ژن درمانی چیست؟ – کاربرد و نحوه انجام به زبان ساده
ژنها از DNA تشکیل شدهاند، و طرحهایی برای ساخت پروتئینهایی هستند که بدن را به کار میاندازند. هر فرد معمولاً دو نسخه از هر ژن را از والدین خود دریافت میکند. ژن درمانی انسانی به دنبال اصلاح یا دستکاری بیان ژن یا تغییر خواص بیولوژیکی سلولهای زنده برای استفادههای درمانی است. این ژنها همه چیز را از رنگ مو، قد و ویژگیهای منحصربهفرد کنترل میکنند. اما ژنها همیشه به درستی ساخته نمیشوند. یک تغییر کوچک در آنها، که جهش نامیده میشود، میتواند نحوه بیان (تولید) پروتئینها را تغییر دهد که بر توانایی بدن برای عملکرد صحیح تأثیر میگذارد. در این مطلب به تعریف و بررسی ژندرمانی و اصول ژندرمانی میپردازیم و همچنین انواع روشهای ژندرمانی، آینده ژندرمانی و خطراتی که ممکن است در این علم وجود داشته باشد را مورد بررسی قرار میدهیم.


ژن درمانی چیست؟
ژن درمانی نوعی درمان است که از مواد ژنتیکی با هدف تغییر مسیر بیماری استفاده میکند و رویکردی درمانی است که برای درمان چندین بیماری در حال بررسی است. ژنها میتوانند با جهشهای ارثی (تغییراتی که از والدین منتقل شدهاند)، با افزایش سن، یا با تغییر و آسیب دیدن توسط مواد شیمیایی و تشعشع تغییر کنند. هدف از ژن درمانی، درمان بیماریها در سطح ژنتیکی (منشا) است. امروزه ژن درمانی برای تعدادی از بیماریها از جمله بیماریهای ارثی و سرطانها در حال بررسی است.
بیش از 100 سال است که دانشمندان بدن انسان و اجزای سازنده DNA را مطالعه کردهاند. با هر علامت پیشرفت، درک بهتری از نحوه عملکرد بدن ما در سطح ژنتیکی و اینکه چگونه ممکن است بتوانیم آنها را سالم و عاری از بیماری نگه داریم، به دست میآید. امروزه، ژن درمانی همچنان بر پایه قوی تحقیقات DNA استوار است. الزامات اساسی ژن درمانی عبارتند از موارد زیر هستند:
- کپی کلون شده از ژن نوع وحشی مرتبط با یک اختلال خاص.
- یک سیستم پروموتر که رونویسی ژن (تبدیل ژن به RNA) را در بافت هدف تضمین میکند.
- ناقل: این معمولاً ویروسی است که از عوامل تکثیر شونده و بیماریزا بیبهره است. ناقل ساختار DNA را به داخل سلول حمل میکند.
- میزبانی با یک جهش ژنی یا شرایطی که ممکن است از دریافت ساختار DNA در سلولهای خود بهرهمند شود.
ژن ها چه هستند؟
ژنها حامل اطلاعاتی هستند که صفات ما را تعیین میکنند، ویژگیها یا مواردی مانند رنگ چشم، قد، رنگ و بافت موهایمان هستند که از والدین خود به ارث بردهایم. ژنها از دی اکسی ریبونوکلئیک اسید (DNA) ساخته شدهاند و به صورت جفت و از هر دو والدین به ارث رسیدهاند. آنها همچنین مواردی مانند پسر یا دختر بودن نوزادان، میزان اکسیژن خونی که میتواند حمل کند و احتمال ابتلا به برخی بیماریها را تعیین میکنند. دانشمندان معتقدند هر انسان حدود 20000 تا 25000 ژن دارد. اگر حتی یکی از این ژنها وجود نداشته باشد یا تغییر کرده باشد (جهش یافته)، میتواند باعث بیماری شود. گاهی اوقات یک جهش به ارث میرسد، درست مانند موهای مجعد یا چشمهای قهوهای. برخی دیگر ممکن است بدون هیچ دلیل مشخصی اتفاق بیفتند، بدون اینکه توسط والدین منتقل شوند.
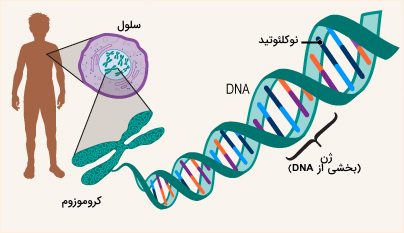
بیماری ژنتیکی چیست؟
برخی از بیماریهای ژنتیکی به دلیل عملکرد نادرست ژن یا از دسترفتن ژن ایجاد میشوند. همانطور که بیان شد ژنها به صورت کد اطلاعات و دستورالعملها ذخیره میکنند، بدن برای ساخت پروتئینها نیاز دارد. تقریباً تمام عملکردهای بدن توسط پروتئینها ممکن میشود. وقتی قطعهای از DNA گم شده یا تغییر میکند، میتواند تولید پروتئین را تغییر دهد. پروتئین ممکن است دیگر نتواند عملکرد طبیعی خود را انجام دهد. بنابراین حتی اگر یک پروتئین واحد از بین رفته باشد، کمبود آن وجود داشته باشد یا اشتباه ساخته شود، تأثیر آن بر بدن میتواند مضر باشد. بیماری ژنتیکی میتواند از یک یا هر دو والدین منتقل شود یا میتواند ناشی از خطاهای تصادفی در ژنهای بدن باشد.
ژن درمانی چگونه کار می کند؟
ژندرمانی شامل تغییر ژنهای درون سلولهای بدن شما در تلاش برای درمان یا توقف بیماری است. ژنها حاوی DNA شما هستند، DNA کدی که بیشتر فرم و عملکرد بدن شما را کنترل میکند، از قد بلندتر شدن گرفته تا تنظیم سیستمهای بدن. ژنهایی که به درستی کار نمیکنند میتوانند باعث بیماری شوند. ژندرمانی جایگزین کردن ژن معیوب یا اضافه کردن ژن جدید در تلاش برای درمان بیماری یا بهبود توانایی بدن شما برای مبارزه با بیماری است.
ژندرمانی برای درمان طیف گستردهای از بیماریها مانند سرطان، فیبروز کیستیک، بیماری قلبی، دیابت، هموفیلی و ایدز نویدبخش است. همانطور که گفته شد ژندرمانی برای اصلاح ژنهای معیوب به منظور درمان بیماری یا کمک به بدن فرد برای مبارزه بهتر با بیماری استفاده میشود. محققان در حال بررسی چندین روش برای انجام این کار هستند که شامل موارد زیر است:
- جایگزینی ژنهای جهشیافته: برخی از سلولها به این دلیل بیمار میشوند که ژنهای خاصی به درستی کار نکرده یا دیگر اصلاً کار نمیکنند. جایگزینی ژنهای معیوب ممکن است به درمان برخی بیماریها کمک کند. به عنوان مثال، ژنی به نام p53 به طور معمول از رشد تومور جلوگیری میکند. چندین نوع سرطان با مشکلات ژن p53 مرتبط است. اگر پزشکان بتوانند ژن معیوب p53 را با نسخه سالم آن جایگزین کنند، ممکن است باعث مرگ سلولهای سرطانی شود.
- آشکارسازی بیشتر سلولهای بیمار برای سیستم ایمنی: در برخی موارد، سیستم ایمنی بدن شما به سلولهای بیمار حمله نمیکند، زیرا آنها را به عنوان مزاحم تشخیص نمیدهد. پزشکان میتوانند از ژندرمانی برای آموزش سیستم ایمنی بدن شما برای تشخیص سلولهایی که تهدیدکننده زندگی هستند استفاده کنند.
- اصلاح ژنهای جهشیافته: ژنهای جهشیافتهای که باعث بیماری میشوند را میتوان خاموش کرد تا دیگر بیماری را ترویج نکنند، یا ژنهای سالمی را که به پیشگیری از بیماری کمک میکنند فعال شوند تا بتوانند بیماری را مهار کنند.

تاریخچه ژن درمانی
ژندرمانی یکی از بزرگترین موفقیتهای قرن بیست و یکم بوده است. طی چند سال اخیر، جریان تقریباً ثابتی از اخبار مثبت در مورد ژندرمانی وجود داشته است، به طوری که امکان درمان پس از تاییدیه نظارتی، موفقیت در آزمایشات، یا جمعآوری مبالغ هنگفت برای ورود به توسعه آن، وجود داشته است و با بیش از 1000 کارآزمایی بالینی که هم اکنون در حال انجام است، ممکن است در نهایت شاهد ورود طولانی مدت انقلاب ژندرمانی باشیم.
در سال 1972 مقالهای با عنوان «ژن درمانی برای بیماری ژنتیکی انسان» توسط دانشمندان آمریکایی تئودور فریدمن و ریچارد رابلین در مجله Science منتشر شد که پتانسیل فوقالعاده ترکیب توالیهای DNA در سلولهای بیماران را برای درمان افراد مبتلا به اختلالات ژنتیکی بیان کردند. با این حال، آنها احتیاط را در توسعه این فناوری توصیه کردند و به چندین گلوگاه کلیدی در درک علمی اشاره کردند که هنوز باید به آنها رسیدگی شود.
اولین موفقیت در ژن درمانی انسانی
پس از 18 سال تحقیق بیشتر، اولین آزمایش ژندرمانی در سال 1990 آغاز شد. دختر چهار سالهای به نام Ashanthi DeSilva تحت یک دوره درمان 12 روزه برای بیماری ژنتیکی نادر به نام نقص ایمنی ترکیبی شدید قرار گرفت. دسیلوا فاقد آنزیم کلیدی به نام آدنوزین دآمیناز (ADA) بود که سیستم ایمنی او را فلج میکرد و او را در معرض خطر دائمی ابتلا به عفونتی قرار میداد که میتوانست او را بکشد.
از ناقل ویروسی برای معرفی کپی عملکردی از ژن کدکننده آنزیم ADA به سلولهای ایمنی DeSilva استفاده شد. این کار باعث بهبود عملکرد سیستم ایمنی بدن او شد و به او اجازه داد تا بدون اجبار به زندگی در شرایط قرنطینه، زندگی عادی داشته باشد. موفقیت پرونده دسیلوا یک نقطه عطف بزرگ بود و آزمایشهای متعدد دیگری با اشتیاق بیشتری در طول دهه 1990 آغاز شد. اما فضای خوشبینی دوام نیاورد. ۹ سال بعد ژن درمانی با شکست ویرانگر (اولین مرگ گزارش شده یک بیمار در طول کارآزمایی بالینی) مواجه شد.
ژن درمانی در اوایل سال ۲۰۰۰ و بعد از آن
در سال 1999، جسی گلسینگر 18 ساله برای آزمایش ژن درمانی تجربی در دانشگاه پنسیلوانیا ثبت نام کرد. او یک بیماری ژنتیکی به نام کمبود اورنیتین ترانس کاربامیلاز داشت. این بیماری که ناشی از یک جهش ژنتیکی است، توانایی کبد او را برای تجزیه آمونیاک سمی که در خونش انباشته شده بود، به خطر انداخت. این کارآزمایی برای معرفی یک نسخه فعال از ژن گمشده به سلولهای کبد او با استفاده از یک آدنوویروس (ویروس سرماخوردگی اصلاح شده) برای انتقال آن طراحی شد. چهار روز پس از معالجه، گلسینگر در اثر یک واکنش ایمنی فاجعه بار به درمان درگذشت. مرگ گلسینگر کل افراد این حوزه را شوکه کرد و توجه رسانهها را به خود جلب کرد.
FDA ایالات متحده از طراحی این کارآزمایی انتقاد کرد، کل برنامه ژندرمانی دانشگاه (یکی از بزرگترینها در جهان در آن زمان) را به حالت تعلیق درآورد و تحقیقاتی را در مورد 69 آزمایش ژندرمانی دیگر در سراسر کشور آغاز کرد. ایمنی ناقلان ویروسی در سطح بالایی مورد بررسی قرار گرفت. مشاهده شد که ژن درمانی خیلی سریع پیش رفته است. رویکرد آهستهتر و محتاطانهتر توصیه شد.
پس از آن چین اولین کشوری بود که در سال 2003 روش ژندرمانی به نام ژندیسین را برای سرطان سر و گردن تایید کرد. به دنبال آن، روسیه Neovasculgen را برای بیماری عروق محیطی در سال 2011 تایید کرد. در سال 2012، کمیسیون اروپا مجوزی برای درمان بیماری بسیار نادر کمبود لیپوپروتئین لیپاز به uniQure's Glybera اعطا کرد. اما با قیمت 1 میلیون یورو، این روش گرانترین درمان در جهان بود. در سال 2017، پس از تجویز برای یک بیمار، این درمان لغو شد.
از زمان موج اول تاییدیههای ژندرمانی بین سالهای 2003 تا 2012، سرعت این روند به سرعت افزایش یافته است. در طول چند سال گذشته، ژندرمانی وارد اتحادیه اروپا شده است که اخیراً Zynteglo برای اختلال خونی بتا تالاسمی است. ایالات متحده رونق مشابهی را تجربه کرده است و FDA انتظار دارد تا سال 2025 هر سال 10 تا 20 درمان سلولی و ژنتیکی تایید شود. بسیاری از موفقیتهای اخیر ژندرمانی را میتوان به پیشرفتهای قابل توجه در فناوریهای ناقل ویروسی که برای ارائه مواد ژنتیکی استفاده میشود نسبت داد.

انواع ژن درمانی
ژن درمانی استراتژی در حال تکامل برای اختلالات ناشی از ژن مفقود یا معیوب است و ممکن است شامل افزودن، مهار، ویرایش یا جایگزینی عملکردی یک ژن باشد. ژندرمانیها میتوانند درمانهای یکباره باشند و برای هدف قرار دادن علت ریشهای ژنتیکی بیماریها طراحی شدهاند. هنگامی که یک ژن تغییر میکند یا از بین میرود، عرضه یک پروتئین مهم میتواند تحت تأثیر قرار گیرد و باعث بیماری شود. در ادامه انواع حالات ژن درمانی را بررسی کردهایم.
ژن درمانی به روش جایگزینی
جایگزینی ژن که از آن به عنوان «روش درمانی جایگزینی ژن» (Gene Replacement Therapy) یاد میشود از یک کپی جدید و فعال از یک ژن برای جایگزینی عملکرد یک ژن نادرست یا از دست رفته استفاده میکند. این ژن جدید میتواند دستورالعملهایی را به بدن برای ساخت پروتئین خاصی که بدن به آن نیاز دارد، بدهد. این ژن در آزمایشگاه ایجاد میشود و سپس در وسیلهای به نام وکتور یا ناقل بستهبندی میشود. این ناقل ژن را به درون هسته سلولهای خاص حمل میکند. بسته به ناقل مورد استفاده، ژن ممکن است بخشی از DNA سلول شود یا ممکن است جدا بماند. در هر صورت، شروع به ساختن پروتئینی میکند که از دست رفته یا کمبود دارد.
ژن درمانی از سال 1990 منطقه مورد مطالعه در انسان بوده است. در اواخر سال 2017، درمان جایگزینی ژن برای اولین بار در ایالات متحده برای درمان یک نوع نادر و ارثی از دست دادن بینایی تایید شد. بسیاری از ژن درمانیها در حال حاضر در آزمایشات بالینی در حال بررسی هستند.
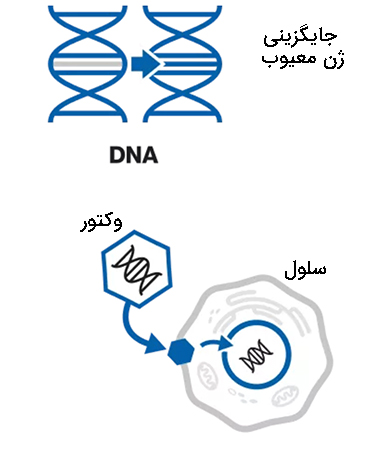
روش ژن درمانی افزودن ژن
در حالی که جایگزینی ژن میتواند برای درمان بیماریهای تکژنی (ناشی از یک ژن مفقود یا ناکارآمد) موثر باشد، هدف قرار دادن یک ژن واحد ممکن است برای اختلالات پیچیده یا بیماریهای عفونی کارساز نباشد. اختلالات پیچیده (مانند سرطان و بیماری قلبی) توسط ژنهای متعدد و همچنین عوامل محیطی ایجاد میشوند و شایع هستند و ممکن است ناتوانکننده باشند.
روش «درمان با افزودن ژن» (Gene Addition Therapy)، بدن را با یک ژن جدید و عملکردی تامین میکند که میتواند به بدن در رفع نقصهای ایجادکننده بیماری و مبارزه با یک یا چند عامل بیماریزا کمک کند. به عنوان مثال، یک عامل رایج در نارسایی قلبی نقص در توانایی سلولهای عضله قلب برای انتقال کلسیم است. افزودن ژنی که به بدن کمک میکند پروتئین بیشتری برای انتقال کلسیم تولید کند، ممکن است عملکرد قلب را بهبود بخشد.
ناقلهای ویروسی نیز ممکن است تغییر کنند تا فقط در سلولهای تومور تکثیر شوند. با استفاده از چنین ناقلهایی، درمان افزودن ژن میتواند ژنهایی را تحویل دهد که میتوانند سیستم ایمنی را تحریک کنند تا فقط به سلولهای سرطانی ناسالم حمله کند. در بیماریهای عفونی، مانند HIV یا آنفولانزا، افزودن یک ژن میتواند به بدن دستور دهد تا آنتیبادیهایی را برای هدف قرار دادن ویروس عامل بیماری تولید کند، که ممکن است به بدن اجازه دهد عفونت را شناسایی و پاک کند.

درمان مهاری ژن
یک ژن نادرست ممکن است پروتئینهای مسمومکننده بیماری تولید کند. فعال شدن بیش از حد برخی از ژنها میتواند رشد سلولی کنترل نشده را تشویق کند و منجر به بیماریهایی مانند سرطان شود. درمان بازدارندگی ژن باعث خاموش شدن این ژنها میشود و آنها را از تولید پروتئینهای سمی باز میدارد. بسته به روش درمانی و نوع رویکرد، این ممکن است شامل قطع کامل ژن یا کاهش قابلیتهای آن باشد که ممکن است باعث شود سلول حاوی ژن معیوب به درستی کار کند.
ژن درمانی به روش ویرایش ژنی
ویرایش ژن رویکردی است که به دانشمندان امکان میدهد تغییرات دقیقی در DNA سلول ایجاد کنند. چندین فناوری به دانشمندان اجازه میدهد تا DNA را در نقاط خاصی مانند قیچی برش دهند تا بتوانند مواد ژنتیکی را در جایی که بریده میشود اضافه، حذف یا تغییر دهند. ویرایش ژن میتواند سلولهای سوماتیک (هر سلولی به استثنای سلولهای تخمک و اسپرم) یا سلولهای زایا (سلولهای تخمک و اسپرم) را هدف قرار دهد. ویرایش سلولهای بدنی فقط بر روی فرد تحت درمان تأثیر میگذارد، در حالی که ویرایشهای سلولهای جنسی ممکن است به نسلهای آینده منتقل شود. ملاحظات اخلاقی در مورد ویرایش سلولهای جنسی وجود دارد زیرا تأثیر آن میتواند فراتر از فرد تحت درمان باشد و در بسیاری از کشورها غیرقانونی است.

برخی از درمانهای ویرایش ژن میتوانند سلولها را در بدن تغییر دهند، در حالی که برخی دیگر شامل استخراج و سپس درمان خارجی سلولها قبل از بازگرداندن آنها به بدن میشوند. یک فناوری نسبتاً شناخته شده ویرایش ژن به نام CRISPR (تکرارهای کوتاه پالیندرومیک خوشهای با فاصله منظم) وجود دارد که در آن دانشمندان ذرات کوچکی به نام نوکلئازها را کدگذاری میکنند تا برشهای کوچکی را در بخشهای دقیق DNA شناسایی کرده و ایجاد کنند. سپس میتوان مواد ژنتیکی را اضافه، حذف یا جایگزین کرد. CRISPR سریعتر، ارزانتر و دقیقتر و کارآمدتر از سایر فناوریهای ویرایش ژن است.
سلول های مختلف در ژن درمانی
همانطور که بیان شد اصل اساسی ژن درمانی، انتقال ماده ژنتیکی به سلولهای خاص بیمار در تلاش برای شروع پاسخ بیولوژیک برای مبارزه یا از بین بردن یک بیماری است. دو نوع سلول هدف وجود دارد، سلولهای سوماتیکی که در تولید مثل کاری نمیکنند و سلولهای زایا که در تولید مثل نقش دارند. اگر سلولهای زایا به طور دائمی تغییر کنند، همه نسلهای آینده تحت تأثیر قرار خواهند گرفت. بسیاری از تحقیقات ژنتیکی کنونی انسان شامل سلولهای سوماتیک میشود، زیرا پیامدهای اخلاقی اصلاح سلولهای زایا هنوز مورد بحث است.
برخی از دانشمندان ابراز نگرانی کردهاند که حتی ژنهای سلولهای سوماتیک تغییر یافته میتوانند راه خود را برای تولید مثل سلولهای زایا پیدا کنند. بر این اساس، مقررات در خصوص تکنیکهای اصلاح ژن سلولهای سوماتیک سختگیرانه است تا این مهاجرت ژن رخ ندهد. در ادامه هر کدام از این دو روش را بیشتر بررسی میکنیم.
ژن درمانی سلول های جنسی
در «ژندرمانی سلولهای جنسی» (Germline Therapy)، سلولهای زایا (سلولهای اسپرم یا تخمک) با وارد کردن ژنهای عملکردی به ژنوم خود اصلاح میشوند. اصلاح یک سلول زایا باعث میشود تمام سلولهای موجودات حاوی ژن اصلاح شده باشند. بنابراین این تغییر ارثی است و به نسل های بعدی منتقل میشود. بنابراین، «ژندرمانی ژرملاین» (GGT) در طول تولیدمثل انجام میشود، جایی که سلولهای گامت اصلاح شده با هم ترکیب میشوند و یک زیگوت تشکیل میدهند. سپس زیگوت، دچار تقسیم سلولی میشود و ژن اصلاح شده را در طول رشد فرزندان به تمام سلولهای دیگر بدن منتقل میکند. به این ترتیب، ژندرمانی سلولهای جنسی ژنوم نسلهای آینده را تغییر میدهد.
اگرچه از نظر تئوری، ژندرمانی سلولهای جنسی میتواند با بیماریهای ارثی مقابله کند، اما در کشورهای مختلف مانند سوئیس، استرالیا و آلمان، استفاده از این روش به دلیل ترس از خطرات ناشناخته این درمان و اینکه آیا اثرات طولانیمدتی در نسلهای آینده ایجاد میکند یا خیر ممنوع هستند. ژندرمانی سلولهای جنسی همچنین بسیار گرانقیمت است که استفاده عملی آن را بیشتر محدود میکند.
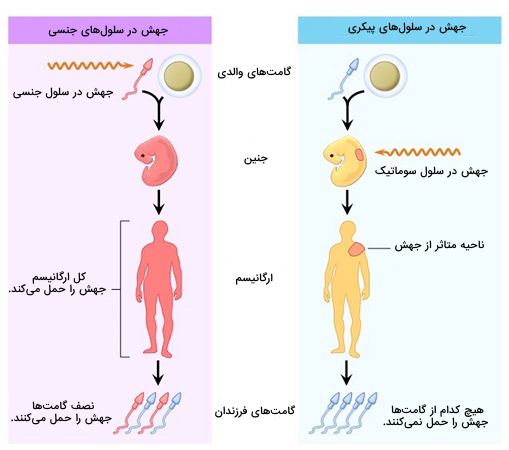
ژن درمانی سلول های پیکری
در «ژن درمانی با سلول سوماتیک» (SCGT)، ژنهای درمانی به هر سلولی غیر از گامت، سلول زایا، گامتوسیت یا سلول بنیادی تمایز نیافته منتقل میشوند. بر خلاف ژندرمانی سلولهای جنسی، ژندرمانی سلولهای پیکری شامل قرار دادن DNA درمانی در سلولهای بدن، به جای سلولهای زایا یا گامتها است. این بدان معنی است که هر گونه اثر درمانی محدود به فرد تحت درمان است و به فرزندان آینده به ارث نمیرسد. زمینه ژن درمانی پیکری در مقایسه با ژن درمانی جنسی با مسائل اخلاقی کمتری احاطه شده است اما با این حال رویکرد درمانی آن در مراحل اولیه توسعه باقی مانده است.
اولین مانع در ژن درمانی سلولهای پیکری، الحاق موفقیتآمیز ژن جدید به ژنوم است. در واقع، ادغام ژن اصلاح شده در قسمت نادرست DNA میتواند به جای پیشگیری از بیماری، باعث ایجاد بیماری شود. علاوه بر نیاز به بیان ژن مورد نظر، بیان ژن جدید باید تنظیم شود تا از بیان بیش از حد که میتواند باعث بیماری نیز شود جلوگیری صورت گیرد.
انواع ناقل های ژنی در ژن درمانی
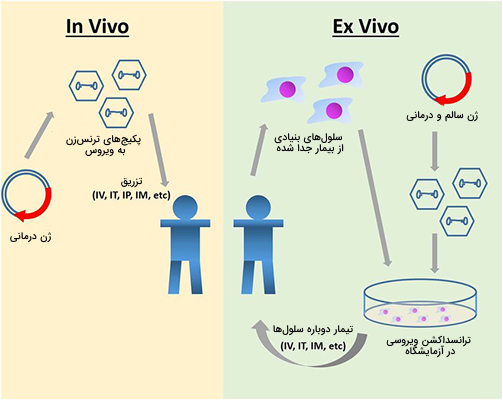
در ژندرمانی سیستمی که برای تحویل مواد ژنتیکی استفاده میشود به عنوان یک ناقل شناخته میشود. یک وکتور را به عنوان کامیون تحویل میکروسکوپی در نظر بگیرید که بستهها (مواد ژنتیکی) را به مکانهای خاص (سلولهای هدف) منتقل میکند. انتقال DNA به سلولها را میتوان با روشهای متعددی انجام داد. دو دسته اصلی ویروسهای نوترکیب (که گاهی اوقات نانوذرات بیولوژیکی یا ناقلهای ویروسی نامیده میشوند) و کمپلکسهای DNA یا DNA برهنه (روشهای غیر ویروسی) هستند. انتقال ژنها به سلولهای هدف معمولاً توسط نوعی ناقل مانند رتروویروسها، آدنوویروسها یا لیپوزومها انجام میشود.
ناقلهای ویروسی به گونهای اصلاح میشوند که ژنهای تولیدمثلی حذف میشوند. ماده ژنتیکی درمانی در ترکیب ژنتیکی ناقل قرار میگیرد که متعاقباً به سلولهای جسمی حمله میکند. این به طور موثر ماده ژنتیکی درمانی را به بافت هدف منتقل میکند. تحویل مواد ژنتیکی میتواند در سه حالت زیر انجام شود.
- «خارج از بدن زنده» «in vitro»
- «دخل بدن زنده» «in vivo»
- «در موقعیت» «in situ»
ناقل های ویروسی
همه ویروسها به میزبان خود متصل میشوند و ماده ژنتیکی خود را به عنوان بخشی از چرخه تکثیر خود وارد سلول میزبان میکنند. این ماده ژنتیکی حاوی دستورالعملهای اساسی در مورد چگونگی تولید نسخههای بیشتر از این ویروسها، هک کردن دستگاههای تولید عادی بدن برای پاسخگویی به نیازهای ویروس است. سلول میزبان این دستورالعملها را انجام میدهد و نسخههای بیشتری از ویروس تولید میکند که منجر به آلوده شدن بیشتر و بیشتر سلولها میشود. برخی از انواع ویروسها ژنوم خود را وارد سیتوپلاسم میزبان میکنند، اما در واقع وارد سلول نمیشوند. برخی دیگر به شکل مولکولهای پروتئینی به غشای پلاسمایی نفوذ کرده و وارد سلول میشوند.
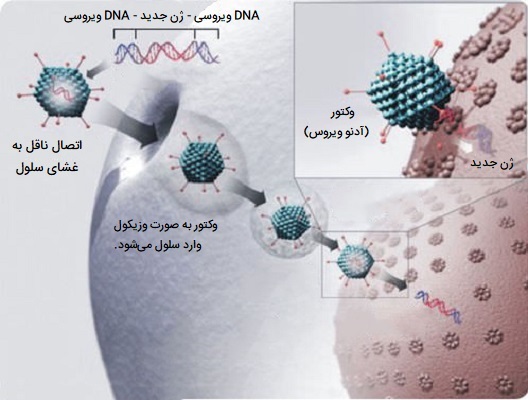
به منظور تکثیر، ویروسها مواد ژنتیکی خود را وارد سلول میزبان میکنند و ماشین سلولی میزبان را فریب میدهند تا از آن به عنوان طرحی برای پروتئینهای ویروسی استفاده کنند. رتروویروسها با کپی کردن مواد ژنتیکی خود در ژنوم سلول میزبان، مرحلهای فراتر میروند. دانشمندان از این موضوع با جایگزینی ماده ژنتیکی یک ویروس با DNA درمانی استفاده میکنند. اصطلاح DNA ممکن است تنها برای سادهسازی باشد، زیرا برخی از ویروسها حاوی RNA هستند و ژندرمانی نیز میتواند این شکل را داشته باشد.
تعدادی از ویروسها برای ژن درمانی انسان استفاده شده است، از جمله رترو ویروسها، آدنوویروسها، هرپس سیمپلکس، واکسینیا و «ویروسهای مرتبط با آدنو» (Adeno-associated virus). مانند ماده ژنتیکی (DNA یا RNA) در ویروسها، DNA درمانی را میتوان طوری طراحی کرد که به سادگی بهعنوان یک طرح اولیه موقتی عمل کند که به طور طبیعی یا (حداقل از نظر تئوری) برای ورود به ژنوم میزبان و تبدیل شدن به بخشی دائمی از DNA میزبان در سلولهای آلوده تخریب میشود.
ناقل های غیر ویروسی
ناقلهای غیرویروسی برای ژندرمانی مزایای خاصی نسبت به روشهای ویروسی دارند، مانند تولید در مقیاس بزرگ و ایمنیزایی پایین میزبان. با این حال، روشهای غیرویروسی در ابتدا سطوح پایینتری از ترانسفکشن و بیان ژن و در نتیجه اثربخشی درمانی کمتری ایجاد کردند. فناوریهای جدیدتر با ظهور افزایش هدفگیری سلولی و کنترل انتقالات درون سلولی، نوید حل این مشکلات را میدهد. روشهای ژندرمانی غیرویروسی شامل تزریق DNA برهنه، «الکتروپوراسیون» (Electroporation)، «تفنگ ژنی» (The gene gun)، «سونوپوراسیون» (Sonoporation)، «مگنتوفکشن» (Magnetofection)، استفاده از الیگونوکلئوتیدها، لیپوپلکسها، دندریمرها و نانوذرات معدنی است.
کاربردهای ژن درمانی چیست؟
برخی از ژندرمانیهای مورد تأیید FDA در حال حاضر برای بیماران مبتلا به بیماریهایی مانند SMA، برخی سرطانهای خون، و بیماریهای ارثی چشم در دسترس هستند. با این حال، اکثر ژندرمانیها در آزمایشهای بالینی هستند. کارآزماییهای بالینی یک فرآیند تحقیقاتی ضروری برای درک نحوه تعامل یک درمان با بدن، و اینکه آیا قبل از اینکه در دسترس عموم قرار گیرد، ایمن و مؤثر است یا خیر است. بسیاری از بیماریهای نادر به علت جهش ساده ژنتیکی آمده از یکی یا هر دو والد فرد ایجاد میشود.
پیشبینی میشود از ژندرمانیهایی که طی پنج سال آینده برای تأیید FDA فرستاده میشوند، 45 درصد روی درمانهای سرطان تمرکز کنند (تقریباً نیمی از آنها) و 38 درصد (تقریباً 4 از 10) به درمان اختلالات ژنتیکی نادر ارثی میپردازند. برخی از این بیماریهای ارثی شامل موارد زیر هستند:
- اختلالات هماتولوژی (خون) مانند بیماری سلول داسیشکل
- اختلالات عصبی که بر مغز و نخاع تأثیر میگذارد.
- بیماریهای اسکلتی عضلانی
- انکولوژی، مانند سرطان خون
در ادامه در مورد برخی از اختلالات و بیماریهایی را که در حال حاضر از طریق ژندرمانی در حال بررسی برای بهبود هستند را بررسی کردهایم.
ژن درمانی مو
یک تکنیک پیشرفته برای حل ریزش موی ارثی در آینده، ژن درمانی است. ژن درمانی فرآیند تغییر ژنهای سلولهای موجود در بدن و در نتیجه تغییر عملکرد سلول است. این درمان پزشکی هنوز در مراحل اولیه است. اما این یک روش بالقوه درمان طاسی در آینده بوده که ارزش بررسی دارد. ژن درمانی مستلزم یادگیری این است که چگونه یک بیماری ارثی در سطح مولکول DNA رخ میدهد و سپس وارد آن شوید و آن را برطرف کنید. با ژن درمانی، فولیکولهای مو با سلولهای حساس به DHT میتوانند به فولیکولهایی با سلولهای مقاوم به DHT تبدیل شوند و فولیکولهای مو تا پایان عمر به رشد موهای جدید ادامه دهند.
مرحله اول این است که بفهمیم کدام یک از دهها هزار ژن روی رشتههای DNA در مشخصهای که باید تغییر داده شود دخیل هستند و مرحله دوم این است که بفهمیم ژنهای هدف دقیقاً چگونه باید تغییر کنند. به طوری که آنها دستورالعملهایی را برای ساخت پروتئینهای کمی متفاوت ارائه میدهند که به اثر مورد نظر میرسد. نه تنها اختلالات ژنتیکی وجود دارد که میتواند منجر به ریزش موی زودرس شود، بلکه تعداد زیادی از عوامل شیمیدرمانی وجود دارد که این بیماری را در میان عوارض جانبی شدیدتر فهرست میکند.
دو دلیل عمده برای وارد کردن ژن به فولیکولهای مو برای اهداف درمانی وجود دارد. اولین مورد، درمان جهشهای تکژنی است که بر رشد ساقه مو تأثیر میگذارد. مورد دوم درمان اختلالات پلیژنیک چرخه فولیکول مو است که منجر به ریزش مو میشود. برای جهشهای تکژنی، پیشرفت قابل توجهی در سالهای اخیر در شناسایی ژنهای مسئول فنوتیپهای غیرطبیعی مو در ژنودرماتوزهای مختلف صورت گرفته است. مبنای ژنتیکی برای تعداد فزایندهای از شرایط، از جمله دیسپلازی اکتودرمی، مونیلیتریکس، سندرم نترتون و بیماری منکس، تعریف شده است.
اصلاح فنوتیپی موثر اختلالات فولیکول مو به دلیل نقصهای تکژنی نه تنها به بیان طولانی مدت ژن لازم بلکه به بیان ژن در درصد بالایی از فولیکولهای مو نیز نیاز دارد. علاوه بر این، بازگرداندن یک فنوتیپ موی طبیعی به بیان ژن طبیعی در درصد بالایی از کراتینوسیتهای هر فولیکول مو نیاز دارد. دستیابی به این اهداف مستلزم انتقال موثر و پایدار ژنهای مورد نظر به سلولهای بنیادی کراتینوسیت است که در ناحیه برآمدگی فولیکولهای مو و سلولهای پیشساز را برای دودمان سلولی مختلف که فولیکول مو را تشکیل میدهند، فراهم میکند. از آنجایی که سلولهای بنیادی برآمده به طور بالقوه باعث ایجاد اپیدرم و غدد چربی میشوند، بیان ژن پایدار در آن سلولها ممکن است ما را قادر به دستکاری فنوتیپها در آن بافتها کند.
ژن درمانی سرطان
یکی از چالشبرانگیزترین جنبههای ژندرمانی، قرار دادن ژن در سلولهای سرطانی است. بنابراین، متخصصان در تلاش هستند تا تکنیکهای جدید و بهبودیافته را برای دستیابی به این امر بیابند. یکی از راههای اصلی درج ژن، استفاده از یک ناقل است که ژن را به سلول سرطانی منتقل میکند. از آنجایی که ویروسها برای هدف قرار دادن و ورود به سلولها ساخته شدهاند، ناقلهای ویروسی اغلب برای رساندن مواد ژنتیکی به سلولهای سرطانی در ژندرمانی استفاده میشوند. دانشمندان راههایی برای تغییر این ویروسها پیدا کردهاند تا اطمینان حاصل کنند که ناقلها تنها ژنها را به سلولهای سرطانی میرسانند تا سلولهای سالم. علاوه بر ویروسها، ناقلهای دیگری نیز در حال آزمایش هستند که شامل باکتریهای غیرفعال میشوند.
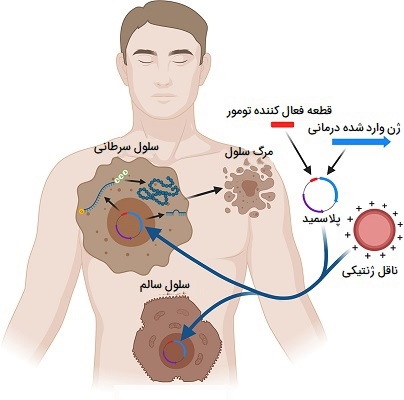
چندین تکنیک ژندرمانی مختلف برای درمان سرطان مورد بررسی قرار گرفته است، که از جمله آن، مواردی هستند که پاسخ ایمنی را مهار میکنند، همچنین شامل مواردی مانند تقویت روشهای درمان سرطان، جلوگیری از محافظت از سلولهای سرطانی در برابر مرگ سلولی و تبدیل داروهای غیرفعال به داروهای فعال هستند. هر کدام از این موارد را بیشتر بررسی میکنیم.
- مهار پاسخ ایمنی: برخی از اشکال ژندرمانی برای تقویت توانایی موجود بدن برای هدف قرار دادن و کشتن سلولهای سرطانی طراحی شدهاند. نقش برخی از سلولهای سیستم ایمنی، شناسایی و از بین بردن این سلولها است. بنابراین، افزودن ژنهای خاصی به سلولهای ایمنی بیمار برای بهبود توانایی آنها در یافتن یا کشتن انواع خاصی از سرطان فرض شده است.
- ژن درمانی برای تقویت درمان سرطان: برخی از تکنیکهای ژندرمانی شامل قرار دادن ژنها در سلولهای سرطانی به منظور آسیبپذیری بیشتر سلولهای سرطانی در برابر پرتودرمانی یا شیمیدرمانی است و در نتیجه اثربخشی این درمانها را بهبود میبخشد.
- جلوگیری از محافظت از سلولهای سرطانی: ژندرمانی میتواند برای جلوگیری از فرآیندهای مختلف بقای مورد استفاده توسط سلولهای سرطانی استفاده شود. یکی از نمونههای آن شامل آپوپتوز است، این فرایند به مرگ برنامهریزیشده سلولی اشاره دارد که در صورت داشتن DNA آسیبدیده و غیرقابل ترمیم یک سلول متحمل میشود. در سلولهای سرطانی، آپوپتوز متوقف میشود و سلولها به تقسیم خود ادامه میدهند، بنابراین سلولهای جدیدی تشکیل میشوند که حاوی DNA آسیبدیده نیز هستند. برخی از تکنیکهای ژندرمانی برای جلوگیری از این مهار آپوپتوز طراحی شدهاند تا اطمینان حاصل شود که سلولهای سرطانی به جای ادامه حیات و تکثیر میمیرند.
- ژن درمانی Pro-drug: برخی از تکنیکهای ژن درمانی شامل قرار دادن ژنهای خاصی در سلولهای سرطانی است تا امکان تبدیل یک داروی غیرفعال به نام پرودارو به شکل فعال را فراهم کند. ژن تبدیلکننده به شکل قرص یا کپسول داده شده و سپس داروی جانبی تجویز میشود. این دارو به سلولهای طبیعی آسیب نمیرساند و فقط به سلولهای سرطانی میرسد و در آنجا توسط ژن فعال میشود تا به مخرب تبدیل شود.
ژن درمانی عصب بینایی
از زمان تصویب اولین ژن درمانی برای نابینایی، بسیاری از شرکتها وجود داشته است که روشهای ژنی را با پتانسیل درمان انواع مختلف نابینایی ژنتیکی توسعه دادهاند. Luxturna اولین ژن درمانی برای نابینایی ارثی بود که در سال 2017 تأییدیه FDA را دریافت کرد. حدود یک سال بعد، این درمان در اروپا تأیید شد. این یک نقطه عطف مهم برای نوآوری در درمان نابینایی و همچنین برای ژن درمانی بود، زیرا Luxturna همچنین اولین ژن درمانی in vivo بود. یعنی روش درمانی که بهجای استخراج و اصلاح سلولها قبل از تزریق مجدد، مستقیماً به سلولهای بیمار ارائه میشود.

Luxturna توسط شرکت آمریکایی Spark Therapeutics ساخته شده است که توسط Roche در سال 2019 خریداری شد. این درمان برای درمان بیماران مبتلا به جهش در ژنی به نام RPE65 طراحی شده است که پروتئین شبکیه را رمزگذاری میکند که برای پاسخگویی چشم به نور ضروری است. درمان شامل تزریق یک نسخه سالم از ژن برای بازیابی پروتئین از دست رفته است. نشان داده است که یک تزریق در هر چشم برای بهبود بینایی حداقل برای سه سال کافی است.
نحوه عملکرد ژن درمانی برای نابینایی
ژن درمانی شامل ارائه یک نسخه عملکردی از ژنی است که از بین رفته یا جهش یافته است.در مورد Luxturna، یک کپی از ژن RPE65 با استفاده از یک ناقل ویروسی به چشم بیمار تحویل داده میشود. این ویروسِ اصلاح شده، برای از بین بردن ظرفیت خود برای عفونت استفاده میشود.
در رابطه با ژندرمانی چشم باید گفت که، چشم ناحیهای از بدن است که دارای امتیاز داشتن ایمنی کافی است که سیستم ایمنی دسترسی به آن را محدود کرده است. این از واکنشهای ایمنی در برابر ناقل ویروسی که برای ارائه درمان استفاده میشود جلوگیری میکند. علاوه بر این، سلولهای شبکیه میتوانند این DNA را برای مدت طولانیتری نسبت به سایر سلولهای بدن حفظ کنند. این بدان معناست که تزریق یک دوز به هر چشم میتواند برای بازگرداندن بینایی در دراز مدت کافی باشد.
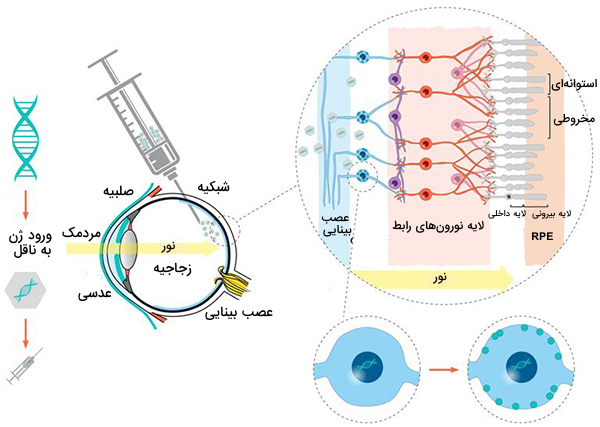
ژن درمانی مربوط به اختلالات شبکیه در مراحل ابتدایی است، درمان تایید شده برای «آموروز مادرزادی لبر» (LCA) در راه است. LCA نوع نادری از اختلال ارثی چشم است که باعث از دست دادن شدید بینایی در بدو تولد میشود. داشتن یک درمان یکروزه که به طور بالقوه میتواند نابینایی را در بیماریهایی که امروزه عملا قابل درمان نیست، ریشه کن کند، دستاوردی اساسی خواهد بود.
ژن درمانی بیماری های خونی
تا کنون، اکثر آزمایشات بالینی در زمینه ژن درمانی بر انتقال ژن به سلولهای خونساز (سلولهای خونی) و سرطان متمرکز شدهاند. همه سلولهای خونساز از یک نوع سلول منفرد به نام «سلولهای بنیادی خونساز پرتوان» (PHSCs) به وجود میآیند. بنابراین، ژن درمانی موفق با سلولهای بنیادی را میتوان برای انواع زیادی از بیماریهای سلولی مادرزادی و اکتسابی به کار برد. در چند سال اخیر، بخش سلولی شامل این PHSCها با استفاده از مولکولهایی که در سطح سلول وجود دارند شناسایی شده است.
مشخص شده است که PHSCها حامل آنتیژن CD34 مثبت (اینآنتی ژن تقریباً در 1٪ از سلولهای مغز استخوان وجود دارد) اما برای نشانگرهای دیگر منفی هستند و lin منفی (که تقریباً در 1٪ از سلول های CD34 + وجود دارد). با تکنیکهای جداسازی سلولی، سلولهای CD34 مثبت و lin منفی را میتوان جدا کرد و برای مطالعات انتقال ژن استفاده کرد. در این مطالعات انتقال ژن سلولهای بنیادی، سلولها از بیمار برداشت میشوند، انتقال ژن خارج از بدن انجام میشود و سلولهای دستکاری شده متعاقباً مجدداً به بیماران تزریق میشوند.
اکثر مطالعات از وکتورهای رتروویروسی به عنوان وسیلهای برای واسطه انتقال ژن استفاده میکنند. کارآزماییهای اولیه با هدف انتقال ژن به سلولهای خونساز با تمرکز بر انتقال ژن کدکننده «آدنوزین دآمیناز» (ADA) صورت گرفته است. کمبود ADA منجر به نقص سلول T میشود که منجر به بیماری به نام کمبود شدید سیستم ایمنی میشود. بیماران مبتلا به این بیماری ژنتیکی به طور کلی در سالهای اول زندگی به دلیل عفونتهای شدید جان خود را از دست میدهند.
مزایای ژن درمانی
مزایای ژن درمانی نسبت به معایب آن سنگینی میکند. این تکنیک به افرادی که با یک بیماری ژنتیکی متولد شده یا مبتلا به سرطان هستند، شانس زندگی عادی را میدهد. دادن فرصتی برای یک زندگی عادی برای بسیاری از افرادی که با این روش مخالف هستند کافی است تا نظر خود را تغییر دهند. دلیل ترس مردم این است که تکنیک را درک نمیکنند. اگر دانشمندان جامعه را آموزش دهند، بسیاری از مردم نظر خود را تغییر خواهند داد. در ادامه مهمترین مزایایی ژندرمانی را بررسی کردهایم.
امکان ارائه نتایج مثبت پزشکی
حدود 3 درصد از تولدها شامل شرایطی است که به طور بالقوه با استفاده از تکنیکهای ژن درمانی قابل درمان است. بسیاری از کودکانی که در این جمعیت به دنیا میآیند، بهدلیل تأثیرات مخرب شرایط خود، بلافاصله پس از تولد میمیرند. نقایص مادرزادی نیز به طور بالقوه با این گزینه قابل پیشگیری هستند که هر ساله حدود 20 درصد از خانوادهها را تحت تأثیر قرار میدهد. پزشکان و دانشمندان بهجای پرداخت هزینه برای مراقبت از آسایشگاه یا مجبور به خداحافظی فوری، با توجه به در دسترس بودن این فناوری به والدین امید بیشتری برای آیندهای روشنتر میدهند.
همیشه معیاری از ناشناختهها وجود دارد که بیماران در دنیای پزشکی تجربه میکنند. بدنهای فردی به یک گزینه درمانی متفاوت واکنش نشان میدهند. آنچه در مورد ژن درمانی میدانیم این است که کارآزماییهای بالینی این مداخله در درمان برخی از بیماریهای خاص موفقیتهایی را نشان داده است. اگر با هموفیلی، لوسمی، نابینایی ناشی از رتینیت پیگمانتوزیس یا یک مشکل کمبود شدید ایمنی ترکیبی سر و کار دارید، ممکن است کاندیدای مناسبی برای این گزینه درمانی باشید.
بهبود زندگی افراد
تمرکز تحقیقات ژن درمانی ایجاد داروها و رویکردهای درمانی جدید است که می تواند رنج را کاهش دهد. این که آیا این یک راه حل درمانی است یا نه، از تغییرات مثبت رخ داده که برای افرادی که به این کمک نیاز دارند، اهمیت کمتری دارد. وقتی فرآیندهای مفیدی را از طریق این کار کشف میکنیم، ممکن است بتوانیم آن را در کشاورزی، مشکلات زیست محیطی، سلامت حیوانات خانگی و حمل و نقل غذا به کار ببریم تا اطمینان حاصل کنیم که همه ما به بهترین زندگی ممکن دسترسی داریم. تغییرات ساده تقریباً در هر صنعتی میتواند نتایج عمیقی ایجاد کند.
امکان درمان خارج از بدن
اگر پزشک، ژن درمانی خارج از بدن را توصیه کند، محققان یا تکنسینها مغز استخوان یا خون را برای شروع جداسازی سلولهای نابالغ از نمونه میگیرند. سپس آنها قبل از تزریق مجدد سلولها به جریان خون، ژن لازم را به آنها اضافه میکنند. پس از بازگشت به بدن، سلولهای نابالغ به مغز استخوان میروند، شروع به بلوغ میکنند و در نهایت تکثیر میشوند تا جایگزین همه سلولهای معیوب شوند. به نظر میرسد این تکنیک به ویژه برای افرادی که از بیماری سلول داسی شکل یا مشابه آن رنج میبرند مفید باشد.
ایجاد نتایج دائمی درمان
هنگامی که ژنتیک معیوب با ژنهای صحیح جایگزین میشود، این رویکرد درمانی مزیتی را به دست میآورد که یک نتیجه طولانی مدت و گاهی دائمی دارد. اگرچه این مزیت در هر شرایطی صدق نمیکند، بسیاری از بیماران میتوانند علائم آزاردهنده خود را در مدت زمان کوتاهی با رویکرد درون بدن یا خارج از بدن معکوس کنند. حتی این احتمال وجود دارد که برخی از تغییرات میتواند برای نسل بعدی به ارث برسد، که خطر ابتلای آنها به آینده مشابه را کاهش میدهد.
امکان ترکیب با تکنیک های سلول درمانی
ژن درمانی شامل انتقال مواد ژنتیکی است. سلول درمانی فرآیند انتقال سلولهایی دارای عملکرد مرتبط با بیمار است، زمانی که آن ماده ژنتیکی در وهله اول وجود نداشته باشد. برخی از پروتکلها از هر دو استفاده میکنند، که میتواند راهی قدرتمند برای بهبود شرایط پزشکی خود به بیماران بدهد. سلولهای بنیادی را میتوان از بیمار جدا کرد و سپس در کشت بافت اصلاح ژنتیکی کرد تا بیان یک ژن جدید آغاز شود. هنگامی که درمان به تعداد مناسب گسترش یافت، بیمار درمان را به عنوان بخشی از مراقبت کلی دریافت میکند.
معایب و خطرات ژن درمانی
مزایا و معایب ژن درمانی نشان میدهد که این گزینه درمانی امیدوار کننده به طور بالقوه برای برخی از اختلالات ارثی، سرطانها و عفونتهای ویروسی مفید است. همچنین تکنیکی است که نسبت به روشهای مرسوم با مجموعه ریسکهای مهمتری همراه است. محققان هنوز در حال مطالعه این رویکرد هستند تا مشخص کنند که آیا این روش برای استفاده منظم با هدف قرار دادن بیماریهایی که هیچ درمان دیگری ندارند، ایمن و موثر است یا خیر. در ادامه ریسکها، معایب و خطرات ژن درمانی را بررسی کردهایم.
احتمال ایجاد واکنش های ناخواسته سیستم ایمنی
سیستم ایمنی بدن ممکن است ویروسهای مختلفی را (که ما برای جایگزینی ژنهای ناخواسته از آنها استفاده میکنیم) ببیند و آنها را به عنوان مهاجمانی که باید قبل از ایجاد آسیب، خاموش شوند قلمداد کند. وقتی گلبولهای سفید به مواد ژنتیکی تازه معرفیشده حمله میکنند، تجربه مشکلات سلامتی مانند التهاب، سرگیجه و سردرد برای بیمار غیرعادی نیست. در واکنشهای شدید، حتی ممکن است پاسخ ایمنی، اندامهای بدن را هدف قرار دهد و باعث از کار افتادن آنها شود. به همین دلیل است که گزینههای درمانی شامل یک سرکوبکننده سیستم ایمنی است، اما این دارو میتواند فرد را مستعد ابتلا به عفونتها و بیماری کند.
مورد هدف قرار گرفتن سلول های اشتباه
ویروسها این قابلیت را دارند که بر بیش از یک نوع سلول در بدن انسان در طول درمان ژن درمانی تأثیر بگذارند. ممکن است ویروسهای تغییر یافته که اطلاعات را به سلولها میرسانند، ویروسهای دیگری را نیز آلوده کنند نه فقط ویروسهایی که حاوی ژنهای جهشیافته یا گمشده هستند. هنگامی که این عیب رخ میدهد، سلولهای سالم ممکن است آسیب ببینند که ممکن است نتایج غیر قابل پیشبینی داشته باشد. این احتمال وجود دارد که نتیجه آن شامل ایجاد بیماری، حساسیت به بیماری یا حتی سرطان باشد.

امکان بیماری زایی ویروس های استفاده شده
ویروسهای خاصی برای ایجاد نتایج در طول ژن درمانی استفاده میشود. حاملی که از آن به عنوان ناقل یا وکتور یاد میشود، تکنیکهای مهندسی ژنتیک را دریافت میکند تا بتواند کار خود را انجام دهد. آنها را میتوان به صورت داخل وریدی یا به بافتهای خاص بدن که نیاز به کمک اضافی دارند تزریق کرد. این امکان وجود دارد که عفونت اولیه پس از ورود به بدن ایجاد شود که میتواند برای انتقال اطلاعات مشکلاتی ایجاد کند. اگرچه دانشمندان از ویروسهای تهدیدکننده حیات برای این فرآیند استفاده نمیکنند، اما خطر ابتلا به بیماریهای دیگر به جز نگرانیهای ژنتیکی که پزشکان در تلاش برای درمان هستند، وجود دارد. محققان در حال حاضر از ویروسهای مرتبط با آدنو برای ارائه اطلاعات ژنتیکی استفاده میکنند. اگرچه مشخص نیست که این موارد در انسان ایجاد بیماری کنند، اما میتوانند مربوط به بیماریهایی باشند که میتواند باعث سرماخوردگی شود.
عدم وجود تضمین صد در صد
اکثر گزینههای ژن درمانی هنوز در مرحله توسعه یا آزمایش هستند. تعدادی از مطالعات بالینی موجود بر اساس تحقیقات حیوانی به جای افراد انسانی بوده است. در حال حاضر شکستهای متعددی در داروهای امیدوارکننده وجود داشته است زیرا نتایجی که حیوانات تجربه کردند در طول بخش بالینی فرآیند تأیید به انسان منتقل نشد. وقتی ژن درمانی انجام میگیرد، هر اتفاقی ممکن است رخ دهد. ممکن است که درمان کاملاً شکست بخورد. برخی از بیماران ممکن است محدودیتی در تواناییهای خود برای انجام فعالیتهای روزمره ببینند. حتی میتواند سلامت آنها را بدتر کند.
احتمال ایجاد تومور
اگر اطلاعات ژنتیکی جدید از یک ویروس در نقطه اشتباهی در بدن شما وارد شود، این خطر وجود دارد که روند درمان منجر به تشکیل تومور شود و حتی خطر بدخیمی نیز با این مشکل وجود دارد. این عیب حتی زمانی رخ میدهد که از ناقلها برای ارائه اطلاعات به سلولها استفاده نمیشود. دانشمندان میتوانند از سلولهای بنیادی با ایجاد ذرات چربی به نام لیپوزوم برای ژن درمانی استفاده کنند.
تجربه مشکلات ناسازگاری در بیماران
شباهتهای زیادی در DNA ما وجود دارد که ژنتیک درمانی را امکانپذیر میکند. هر فرد همچنین دارای حدود 300000 نقطه منحصر به فرد در پروفایل سلولی خود است که پس از آن به یک فرد کاملا منحصر به فرد تبدیل میشود. حتی زمانی که یک جلسه ژن درمانی نتایج مثبتی را برای دیگران به همراه دارد، هیچ تضمینی وجود ندارد که فردی که این گزینه را دریافت میکند، نتیجه مشابهی را با سایرین تجربه کند. پزشکان میتوانند یک ویروس را با مواد ژنتیکی تزریق کنند و ممکن است هیچ اتفاقی نیفتد.
وجود عملکرد در جهش های تک ژنی
برخی از بیماریها هستند که زمینه ارثی برای آنها وجود دارد. آلزایمر، پارکینسون و برخی سرطانها نمونههایی از این ویژگی هستند. علت آنها ممکن است به دلیل چندین جهش یا تغییراتی باشد که در چندین ژن مختلف رخ میدهد. برخی از افراد ممکن است تحت تأثیر عوامل محیطی نیز قرار بگیرند. در این برهه از زمان، گزینههای درمانی برای این موقعیتهای پیچیده به اندازه کسانی که یک نقص ژنی دارند، اصلاح نشده است. برخی از بیماریها، مانند فیبروز کیستیک، ممکن است به طور همزمان نواحی مختلف بدن را نیز تحت تأثیر قرار دهند. این بدان معناست که برای شروع کار بهبودی، لازم است درمان به همه انواع بافت ارائه شود.
امکان ایجاد مقاومت در برابر ژن درمانی
مزایای ژن درمانی ممکن است کوتاه مدت باشد. ما قبلاً دیدهایم که چگونه مقاومت آنتیبیوتیکی رویکرد ما به پزشکی را تغییر میدهد. این گزینه درمانی ممکن است در حال حاضر موثر باشد زیرا بسیار جدید است. با کشف مزایای آن و دریافت IV یا شاتهایی که ژنهای به روز شده را دریافت میکنند، بدن انسان میتواند در برابر انتقال اطلاعات مقاومت کند. برخی از بیماران حتی اگر سیستم ایمنی آنها به ژنهای جدید حمله نکند، ممکن است نتیجه مثبتی را تجربه نکنند. این مشکل به این معنی است که ما ممکن است بتوانیم اختلالات امروزی را به طور موثر درمان کنیم، اما نسل بعدی ممکن است نتواند همان مزیت را تجربه کند.
هزینه های بالای ژن درمانی
هزینههای ژن درمانی در کشورهای غربی به راحتی میتواند بیش از یک میلیون دلار باشد. حتی اگر رقابت بتواند این هزینهها را در طول زمان محدود کند، تأثیر این هزینه به این معنی است که برخی از افراد ممکن است این گزینه درمانی را در نظر نگیرند، حتی اگر بهترین راه حل برای نیازهای آنها باشد. اگر قیمت کاهش نیابد، افراد بسیار کمی قادر به استفاده از این روش درمانی خواهند بود.
وجود نگرانی های اخلاقی در ژن درمانی
اکثر مردم میگویند که معرفی ژن درمانی مزایای متعددی را ارائه میدهد که ارزش توجه به آنها را دارد. برخی نیز وجود دارند که نگرانیهای اخلاقی در مورد استفاده از این فناوری برای رفع بیماری یا بیماری دارند. با تغییر ماهیت مشخصات ژنتیکی یک فرد، حتی اگر برای بهتر شدن باشد، تغییرات طبیعی که در نسل بشر رخ میدهد را از بین میبرد. ممکن است تا زمانی که درباره تأثیرات بلندمدت ژن درمانی بیشتر بدانیم، پاسخی برای برخی از سؤالات اخلاقی مرتبط با ژن درمانی نداشته باشیم.
آینده ژن درمانی
امروزه بیش از 600 ژن درمانی بالقوه و سلولدرمانی برای شرایط مختلف در حال تحقیق و توسعه هستند. همانطور که ژندرمانی بیشتر به سمت تجاریسازی پیش میرود، انتظار داریم که شاهد حضور گسترده آن برای درمان سرطانها، اختلالات خونریزی و بیماریهای نادر باشیم. برخی از این درمانها اولین درمانهایی هستند که اختلال هدفمند را درمان میکنند، برخی جایگزین درمانهای پرهزینه موجود میشوند، و برخی برای استفاده در زمانی که گزینههای دیگر تمام شد، رزرو میشوند. بسیاری از آنها درمانهای یکباره یا نادر خواهند بود.

بسیاری از ژندرمانیها نیاز به رسیدگی تخصصی مانند حمل و نقل و نگهداری در دمای بسیار سرد دارند. برخی نیاز به دسترسی تحت یک جدول زمانی فشرده دارند و برخی دیگر باید تحت شرایط خاص اداره شوند. این داروها نشاندهنده پیشرفتهای درمانی قابل توجهی برای بیمارانی است که هیچ گزینهای ندارند یا امروزه به درمانهای پیچیده منظم نیاز دارند. حتی زمانی که جایگزینهای سنتی وجود داشته باشد، ژن درمانی ممکن است از نظر بالینی و مالی در دراز مدت بهتر باشد. به عنوان مثال، تعدادی از تولیدکنندگان در حال کار بر روی درمانهای ژندرمانی برای هموفیلی هستند، یک اختلال خونریزی که افراد زیادی را تحت تاثیر قرار میدهد.
امروزه افراد تحت درمان طولانی مدت ممکن است بیش از 150 تزریق فاکتور در سال برای جلوگیری یا توقف خونریزی کنترل نشده دریافت کنند. هزینه آن درمان ممکن است بسیار متفاوت باشد. متحمل شدن هزینههای 600000 دلار در سال غیر معمول نیست، به خصوص زمانی که خونریزیهای اولیه درمان میشوند. در حالی که هزینه یک ژندرمانی جدید هنوز مشخص نیست، تخمین زده میشود که آن را 2٫5 میلیون دلار برای دوز یک بار مصرف تخمین زده است.
در سالهای آینده، ممکن است شاهد درمانهای ژنتیکی برای بیماریهای رایج و نادر باشیم. همانطور که بیولوژی در دهه گذشته تکامل یافته است، ژن درمانی نیز تکامل یافته است. برخی از این درمانها ممکن است گزینههایی را برای بیمارانی که امروزه فاقد درمانهای جایگزین هستند، ارائه دهد. برای سایر بیماران، این درمانها ممکن است بهبود قابل توجهی در شیوه زندگی را که در حال حاضر به دلیل شرایط یا رژیم درمانی آنها محدود شده است، ممکن کند.













واقعا روش خوبیه ، باید البته بگیم تغییر نه درمان کاش برای بحث های دیگه مثل پوست و…. هم میشد
ایا برای تغییر رنگ پوست انجام میشه یا تحقیقی صورت گرفته؟