پتانسیل سلول — به زبان ساده
پتانسیل سلول که آن را با $$E_{cell}$$ نشان میدهند، معیاری برای اندازهگیری اختلاف پتانسیل بین دو نیمسلول در یک سلول الکتروشیمیایی است. این اختلاف پتانسیل به دلیل جریان الکترونها از یک نیمسلول به دیگری اتفاق میافتد. علت چنین جریانی از الکترونها، وجود واکنشهای شیمیایی از نوع ردوکس ذکر میشود. یک واکنش اکسایش کاهش (ردوکس) زمانی اتفاق میافتد که در طول واکنش، یک ماده اکسید شود و دیگری کاهش پیدا کند. در طول اکسیداسیون، ماده مورد نظر، یک یا چند الکترون از دست میدهد. در مقابل، به هنگام واکنش کاهش، ماده مورد نظر، با گرفتن الکترون، باردار میشود.
چنین واکنشهای اکسایش و کاهشی سبب اندازهگیری پتانسیل سلول میشوند چراکه اختلاف پتانسیل بین عامل کاهنده برای اکسید شدن و عامل اکسنده برای کاهش، پتانسیل سلول را تعیین میکند.
سلول الکتروشیمیایی
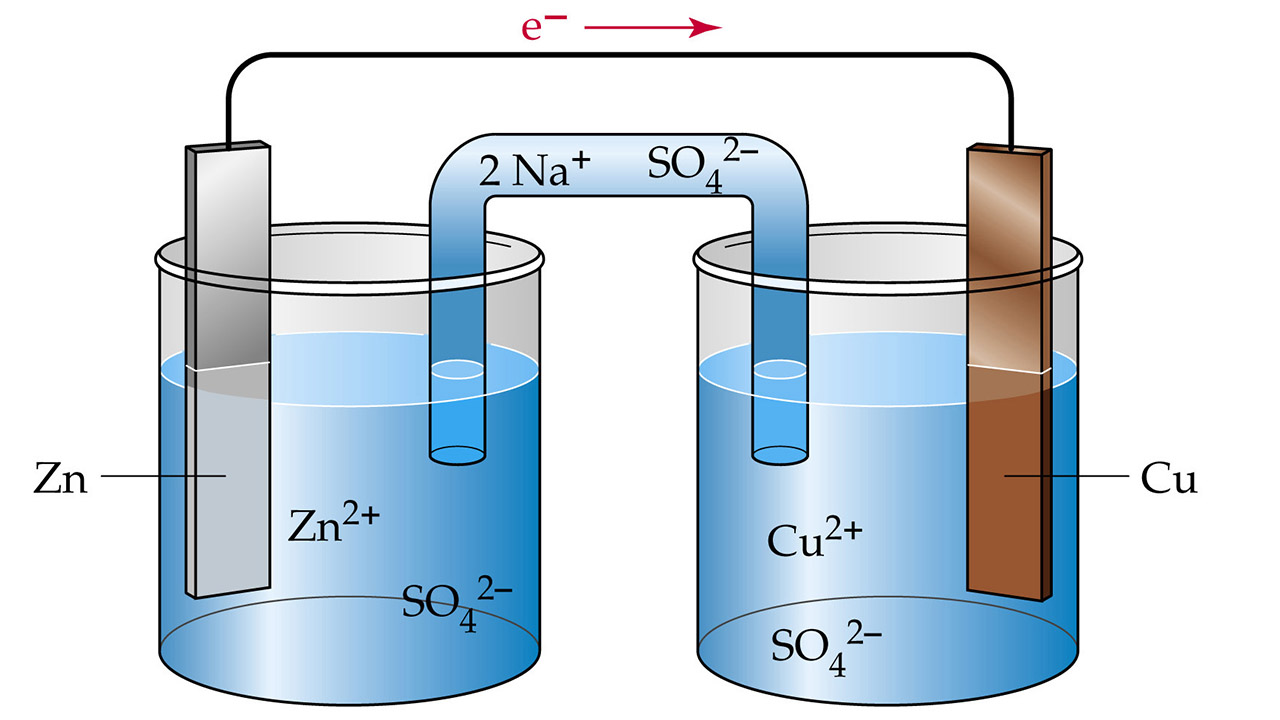
یک سلول الکتروشیمیایی از دو نیمسلول تشکیل شده است. در یکی از این نیمسلولها، اکسیداسیون الکترود فلزی رخ میدهد و در دیگری، یونهای فلزی در محلول، دچار کاهش میشوند. یک نیمسلول، به طور معمول شامل یک الکترود از نوع فلزی خاص است که در محلولی از یون همان فلز غوطهور شده باشد. این الکترود، به الکترود غوطهور در محلول یونی دیگری متصل میشود.
اولین نیمسلول را آند مینامیم. در نیمسلول آند، اتمهای فلزی الکترود اکسید میشوند و به سایر یونهای فلزی در محلول میپیوندند. الکترود مسی، نمونهای از این نیمسلول است که در آن، اتمهای $$Cu$$ در الکترود با از دست دادن ۲ الکترون به $$Cu ^ {2+}$$ تبدیل میشوند.
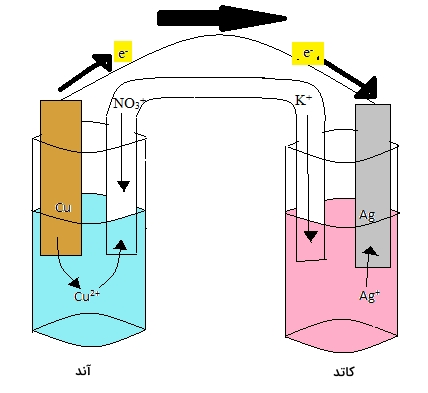
یونهای $$Cu ^ {2+}$$ به محلولی ملحق میشوند که غلظت معینی از این یون را دارد. در ادامه، الکترونهایی که توسط اتم مس از دست رفتهاند، به نیمسلول دیگر منتقل خواهند شد که به این نیمسلول، کاتد میگوییم. در این مثال، فرض میکنیم که نیمسلول دوم، شامل الکترود نقره، غوطهور در محلول یونهای نقره است. زمانی که الکترونها به الکترود $$Ag$$ میرسند، یونهای $$Ag^ +$$ در محلول، کاهش مییابند و به اتم $$Ag$$ بر روی الکترود نقره تبدیل میشوند.
به منظور برقراری تعادل بین بارها در دو طرف سلول، نیمسلولها از طریق یک «پل نمکی» (Salt Bridge) به یکدیگر متصل میشوند. زمانی که میزان یونهای $$Cu ^ {2+}$$ در نیمسلول آند افزایش پیدا کند، آنیونهای منفی در پل نمکی برای ایجاد تعادل، به محلول وارد میشوند. در طرف کاتد نیز به همین صورت، با افزایش مقدار بار منفی محلول، ورود کاتیونهای پل نمکی به محلول، موجب موازنه بار خواهند شد.
اجزای سلول الکتروشیمیایی
اجزای یک سلول الکتروشیمیایی در زیر آورده شده است:
- دو نیمسلول
- دو الکترود فلزی
- ولتمتر
- پل نمکی
- محلول آبی در هر نیمسلول
ارتباط با پتانسیل سلول
برای حرکت الکترودها از آند به سمت کاتد، منبعی از انرژی پتانسیل مورد نیاز است. این انرژی پتانسیل، واکنشهای ردوکس را در سلول الکتروشیمیایی تامین میکند. در اثر این واکنشها، آند، اکسید میشود و کاتد کاهش پیدا میکند. الکترونهایی که در این سلول قرار دارند، از آند به سمت کاتد میروند. دلیل این جریان، پتانسیل بیشتر آند نسبت به کاتد برای اکسید شدن است. برای درک سادهتر، سقوط سنگ از بالای پرتگاه را در نظر بگیرید. سنگها از محلی با انرژی پتانسیل بیشتر، به محلی با انرژی پتانسیل کمتر سقوط میکنند.
تعریف دقیقتر پتانسیل سلول
اختلاف بین پتانسیلهای آند و کاتد برای کاهش را پتانسیل سلول مینامند که رابطه آن به صورت زیر است:
$$E^o_{Cell}= E^o_{Red,Cathode} - E^o_{Red,Anode}$$
توجه داشته باشید که پتانسیلهایی که در این معادله استفاده شدهاند، هر دو پتانسیل استاندارد کاهش هستند و مقدار آنها معمولا در جداول موجود است. اما، واکنش در آند نوعی واکنش اکسایش، یعنی عکس واکنس کاهش است. به همین دلیل در معادله بالا، علامت منفی ظاهر میشود. در نتیجه به جای استفاده از علامت منفی، با قراردادن پتانسیل اکسایش در آند $$(E^o_{Ox,Anode})$$، میتوانیم از علامت مثبت استفاده کنیم.
در معادله بالا، علامت $$E^o$$ نشان میدهد که این پتانسیلها، تنها در غلظت ۱ مولار و فشار ۱ بار صحیح هستند. در صورتیکه شرایط دیگری به غیر از شرایط استاندارد داشته باشیم، از «رابطه نرنست» (Nernst Equation) استفاده میکنیم.
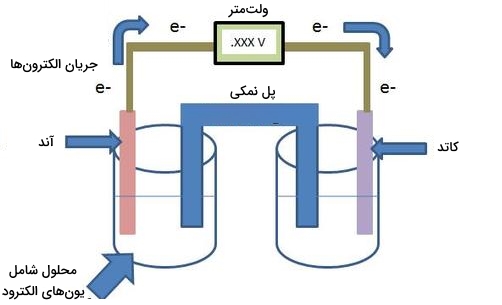
نحوه اندازهگیری پتانسیل سلول
تصویر زیر یک سلول الکتروشیمیایی را نشان میدهد. ولتمتر، مقدار ولتاژ سلول یا به عبارت دیگر، مقدار انرژی تولیدی در الکترودها را اندازهگیری میکند. به ولتاژ خوانده شده، ولتاژ سلول الکتروشیمیایی یا اختلاف پتانسیل در نیمسلولها $$(E _ {cell})$$ میگویند. در حقیقت، ولتاژ، عامل حرکت الکترونها به شمار میآید. ولتاژ زیاد، به معنی حرکت بیشتر الکترونها است.
دیاگرام سلول
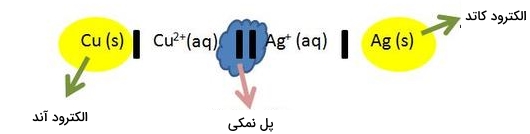
تصویر زیر به دیاگرام سلول معروف و نشاندهنده واکنش کلی در سلول الکتروشیمیایی است. مواد شیمیایی که در دیاگرام سلول حضور دارند، مواد واکنشدهنده در طول واکنشهای ردوکس هستند و از نمایش یونهای تماشاچی صرفنظر میشود. در این دیاگرام، نیمسلول آند را همواره در سمت چپ و نیمسلول کاتد را همواره در سمت راست نشان میدهیم. همانطور که در بخش آبی نشان داده شده است، آند و کاتد را با دو خط موازی از یکدیگر جدا میکنیم. همچنین، با یک خط عمودی، الکترودهای آند و کاتد جدا میشوند.
زمانی که مواد شیمیایی بیشتری در محلول داشته باشیم، به کمک ویرگول آنها را از یکدیگر جدا میکنیم. به طور مثال، در تصویر زیر، اگر مس به تنهایی اکسید نمیشد و مادهای دیگر همچون $$K$$ وجود داشت، بخش آند به صورت $$(Cu, K)$$ نوشته میشد. دیاگرام سلول به ما کمک میکند تا به سادگی مواد اکسید شده و کاهش یافته در یک سلول الکتروشیمیایی را پیدا کنیم. در حقیقت، فهم واکنشهای تشکیل دهنده پتانسیل سلول به کمک این دیاگرام سادهتر میشود.
پتانسیل استاندارد سلول
پتانسیل استاندارد سلول $$(E^ \circ _ {cell})$$، به پتانسیل سلول تحت شرایط استاندارد میگویند که این شرایط عبارتست از غلظت ۱ مولار و فشار ۱ اتمسفر در دمای ۲۵ درجه سانتیگراد. از رابطه زیر برای محاسبه پتانسیل استاندارد سلول استفاده میکنیم:
$$E^o_{Cell}= E^o_{Red,Cathode} - E^o_{Red,Anode}$$
- $$E^o_{Cell}$$: پتانسیل استاندارد سلول
- $$E^o_{Red,Cathode}$$: پتانسیل استاندارد کاهش برای نیمواکنش کاهش در کاتد
- $$E^o_{Red,Anode}$$: پتانسیل استاندارد کاهش برای نیمواکنش اکسایش در آند
واحد پتانسیل معمولا بر حسب ولت ذکر میشود. توجه داشته باشید که این رابطه را به صورت زیر نیز میتوان نشان داد:
$$E^o_{Cell}= E^o_{Red,Cathode} + E^o_{Ox,Anode}$$
مثالهایی از پتانسیل استاندارد سلول
دیاگرام سلول قبل را در نظر بگیرید. نیمسلول اکسایش در معادله واکنش اکسایش کاهش به صورت زیر خواهد بود:
$$\mathrm{Cu}(\mathrm{s}) \rightarrow \mathrm{Cu}^{2+}(\mathrm{aq})+2 \mathrm{e}^{-}\ \ \mathrm{E}_{\mathrm{Ox}}^{\circ}=-0.340 \mathrm{V}$$
نیمواکنش اکسایش نیز به شکل زیر است:
$$\left(\mathrm{Ag}^{+}+\mathrm{e}^{-} \rightarrow \mathrm{Ag}(\mathrm{s})\right) \times 2\ \ \mathrm{E}_{\mathrm{Red}}^{\circ}=0.800 \mathrm{V}$$
واکنش بالا را برای موازنه الکترونها در ۲ ضرب کردیم. اما توجه داشته باشید که پتانسیل استاندارد کاهش را دو برابر نمیکنیم زیرا مقادیر پتانسیل بر حسب ولت بیان میشود. ولتاژ به تعریف ساده عبارتست از تغییرات انرژی بر حسب بار و در نتیجه، مولفه آن را بر حسب واکنش اندازهگیری نمیکنند. بنابراین، نیازی به دخیل کردن آن در موازنه بار نیست. مجموع نیمواکنشها به صورت زیر خواهد بود:
$$\mathrm{Cu}(\mathrm{s})+2 \mathrm{Ag}^{+}+2 \mathrm{e}^{-} \rightarrow \mathrm{Cu}^{2+}(\mathrm{aq})+2 \mathrm{Ag}(\mathrm{s})+2 \mathrm{e}^{-}$$
مجموع پتانسیلهای سلول برابر خواهد بود با:
$$E ^ \circ_{cell} = 0.800 V + (-0.340 V) = 0.460 V$$
با توجه به اینکه $$E^o_{Red}=-E^o_{Ox}$$، میتوانیم از رابطه دیگر نیز برای محاسبه پتانسیل استاندارد سلول استفاده کنیم که رابطه آن به شکل زیر تغییر خواهد کرد:
$$E^o_{cell}=E^o_{Red, Cathode} - E^o_{Red, Anode} \\
E^o_{cell} = 0.800 V - 0.340 V \\
E^o_{cell} = 0.460 V$$
پتانسیلهای الکترود استاندارد کاهش پرکاربرد
در جدول زیر، فهرستی از پتانسیلهای الکترود استاندارد کاهش، در محلولهای اسیدی و بازی آورده شده است. با معکوس کردن جهت واکنش و علامت پتانسیل، حالات اکسایش نیز قابل محاسبه خواهد بود.
جدول پتانسیلهای کاهش در محلول اسیدی:
| پتانسیل استاندارد | نیمواکنش |
| $$+2.866$$ | $$\mathrm{F}_{2}(\mathrm{g})+2 \mathrm{e}^{-} \rightarrow 2 \mathrm{F}(\mathrm{aq})$$ |
| $$+2.075$$ | $$\mathrm{O}_{3}(\mathrm{g})+2 \mathrm{H}^{+}(\mathrm{aq})+2 \mathrm{e}^{-} \rightarrow \mathrm{O}_{2}(\mathrm{g})+\mathrm{H}_{2} \mathrm{O}(\mathrm{l})$$ |
| $$+2.01$$ | $$\mathrm{S}_{2} \mathrm{O}_{8}^{2-}(\mathrm{aq})+2 \mathrm{e}^{-} \rightarrow 2 \mathrm{SO}_{4}^{2-}(\mathrm{aq})$$ |
| $$+1.763$$ | $$\mathrm{H}_{2} \mathrm{O}_{2}(\mathrm{aq})+2 \mathrm{H}^{+}(\mathrm{aq})+2 \mathrm{e}^{-} \rightarrow 2 \mathrm{H}_{2} \mathrm{O}(\mathrm{l})$$ |
| $$+1.51$$ | $$\mathrm{MnO}_{4}^{-}(\mathrm{aq})+8 \mathrm{H}^{+}(\mathrm{aq})+5 \mathrm{e}^{-} \rightarrow \mathrm{Mn}^{2+}(\mathrm{aq})+4 \mathrm{H}_{2} \mathrm{O}(\mathrm{I})$$ |
| $$+1.455$$ | $$\mathrm{PbO}_{2}(\mathrm{s})+4 \mathrm{H}^{+}(\mathrm{aq})+2 \mathrm{e}^{-} \rightarrow \mathrm{Pb}^{2+}(\mathrm{aq})+4 \mathrm{H}_{2} \mathrm{O}(\mathrm{I})$$ |
| $$+1.358$$ | $$\mathrm{Cl}_{2}(\mathrm{g})+2 \mathrm{e}^{-} \rightarrow 2 \mathrm{Cl}^{-}(\mathrm{aq})$$ |
| $$+1.33$$ | $$\mathrm{Cr}_{2} \mathrm{O}_{7}^{2-}(\mathrm{aq})+14 \mathrm{H}^{+}(\mathrm{aq})+6 \mathrm{e}^{-} \rightarrow 2 \mathrm{Cr}^{3+}(\mathrm{aq})+7 H _ 2 O$$ |
| $$+1.23$$ | $$\mathrm{MnO}_{2}(\mathrm{s})+4 \mathrm{H}^{+}(\mathrm{aq})+2 \mathrm{e}^{-} \rightarrow \mathrm{Mn}^{2+}(\mathrm{aq})+2 \mathrm{H}_{2} \mathrm{O}(\mathrm{l})$$ |
| $$+1.229$$ | $$\mathrm{O}_{2}(\mathrm{g})+4 \mathrm{H}^{+}(\mathrm{aq})+4 \mathrm{e}^{-} \rightarrow 2 \mathrm{H}_{2} \mathrm{O}(\mathrm{l})$$ |
| $$+1.2$$ | $$2 \mathrm{IO}_{3}^{-}(\mathrm{aq})+12 \mathrm{H}^{+}(\mathrm{aq})+10 \mathrm{e}^{-} \rightarrow \mathrm{I}_{2}(\mathrm{s})+6 \mathrm{H}_{2} \mathrm{O}(\mathrm{I})$$ |
| $$+1.065$$ | $$\mathrm{Br}_{2}(\mathrm{l})+2 \mathrm{e}^{-} \rightarrow 2 \mathrm{Br}^{-}(\mathrm{aq})$$ |
| $$+0.956$$ | $$\mathrm{NO}_{3}^{-}(\mathrm{aq})+4 \mathrm{H}^{+}(\mathrm{aq})+3 \mathrm{e}^{-} \rightarrow \mathrm{NO}(\mathrm{g})+2 \mathrm{H}_{2} \mathrm{O}(\mathrm{l})$$ |
| $$+0.800$$ | $$\mathrm{Ag}^{+}(\mathrm{aq})+\mathrm{e}^{-} \rightarrow \mathrm{Ag}(\mathrm{s})$$ |
| $$+0.771$$ | $$\mathrm{Fe}^{3+}(\mathrm{aq})+\mathrm{e}^{-} \rightarrow \mathrm{Fe}^{2+}(\mathrm{aq})$$ |
| $$+0.695$$ | $$\mathrm{O}_{2}(\mathrm{g})+2 \mathrm{H}^{+}(\mathrm{ag})+2 \mathrm{e}^{-} \rightarrow \mathrm{H}_{2} \mathrm{O}_{2}(\mathrm{aq})$$ |
| $$+0.535$$ | $$\mathrm{I}_{2}(\mathrm{s})+2 \mathrm{e}^{-} \rightarrow 2 \mathrm{I}^{-}(\mathrm{aq})$$ |
| $$+0.340$$ | $$\mathrm{Cu}^{2+}(\mathrm{aq})+2 \mathrm{e}^{-} \rightarrow \mathrm{Cu}(\mathrm{s})$$ |
| $$+0.17$$ | $$\mathrm{SO}_{4}^{2-}(\mathrm{aq})+4 \mathrm{H}^{+}(\mathrm{aq})+2 \mathrm{e}^{-} \rightarrow 2 \mathrm{H}_{2} \mathrm{O}(\mathrm{I})+\mathrm{SO}_{2}(\mathrm{g})$$ |
| $$+0.154$$ | $$\mathrm{Sn}^{4+}(\mathrm{aq})+2 \mathrm{e}^{-} \rightarrow \mathrm{Sn}^{2+}(\mathrm{aq})$$ |
| $$+0.14$$ | $$S(s)+2 H^{+}(a q)+2 e^{-} \rightarrow H_{2} S(g)$$ |
| $$0$$ | $$2 \mathrm{H}^{+}(\mathrm{aq})+2 \mathrm{e}^{-} \rightarrow \mathrm{H}_{2}(\mathrm{g})$$ |
| $$-0.125$$ | $$\mathrm{Pb}^{2+}(\mathrm{aq})+2 \mathrm{e}^{-} \rightarrow \mathrm{Pb}$$ |
| $$-0.137$$ | $$\mathrm{Sn}^{2+}(\mathrm{aq})+2 \mathrm{e}^{-} \rightarrow \mathrm{Sn}(\mathrm{s})$$ |
| $$-0.440$$ | $$\mathrm{Fe}^{2+}(\mathrm{aq})+2 \mathrm{e}^{-} \rightarrow \mathrm{Fe}(\mathrm{s})$$ |
| $$-0.763$$ | $$\mathrm{Zn}^{2+}+2 \mathrm{e}^{-} \rightarrow \mathrm{Zn}(\mathrm{s})$$ |
| $$-1.676$$ | $$\mathrm{Al}^{3+}(\mathrm{aq})+3 \mathrm{e}^{-} \rightarrow \mathrm{Al}(\mathrm{s})$$ |
| $$-2.356$$ | $$\mathrm{Mg}^{2+}(\mathrm{aq})+2 \mathrm{e}^{-} \rightarrow \mathrm{Mg}(\mathrm{s})$$ |
| $$-2.713$$ | $$\mathrm{Na}^{+}(\mathrm{aq})+\mathrm{e}^{-} \rightarrow \mathrm{Na}(\mathrm{s})$$ |
| $$-2.84$$ | $$\mathrm{Ca}^{2+}(\mathrm{aq})+2 \mathrm{e}^{-} \rightarrow \mathrm{Ca}(\mathrm{s})$$ |
| $$-2.924$$ | $$\mathrm{K}^{+}(\mathrm{aq})++\mathrm{e}^{-} \rightarrow \mathrm{K}(\mathrm{s})$$ |
| $$-3.040$$ | $$\mathrm{Li}^{+}(\mathrm{aq})+\mathrm{e}^{-} \rightarrow \mathrm{Li}(\mathrm{s})$$ |
جدول پتانسیلهای کاهش در محلولهای بازی:
| پتانسیل استاندارد | نیمواکنش |
| $$+1.246$$ | $$\mathrm{O}_{3}(\mathrm{aq})+\mathrm{H}_{2} \mathrm{O}(\mathrm{l})+2 \mathrm{e}^{-} \rightarrow \mathrm{O}_{2}(\mathrm{g})+2 \mathrm{OH}^{-}(\mathrm{aq})$$ |
| $$+0.890$$ | $$\mathrm{OCl}(\mathrm{aq})+\mathrm{H}_{2} \mathrm{O}(\mathrm{I})+2 \mathrm{e}^{-} \rightarrow \mathrm{Cl}(\mathrm{aq})+2 \mathrm{OH}^{-}(\mathrm{aq})$$ |
| $$+0.401$$ | $$\mathrm{O}_{2}(\mathrm{g})+2 \mathrm{H}_{2} \mathrm{O}(\mathrm{I})+4 \mathrm{e}^{-} \rightarrow 4 \mathrm{OH}^{-}(\mathrm{aq})$$ |
| $$-0.0828$$ | $$2 \mathrm{H}_{2} \mathrm{O}(\mathrm{I})++2 \mathrm{e}^{-} \rightarrow \mathrm{H}_{2}(\mathrm{aq})+2 \mathrm{OH}^{-}(\mathrm{aq})$$ |
مثال
پتانسیل استاندارد سلول برای واکنش زیر برابر با 2/71 ولت است:
$$4Al(s) + 3O_2(g) + 6H_2O(l) + 4OH^-(aq) \rightarrow 4[Al(OH)_4]^-(aq)$$
اگر کاهش $$O_2$$ در $$OH^-$$ برابر با $$+0.401 V$$ باشد، پتانسیل کاهش برای نیمواکنش زیر را حساب کنید:
$$[Al(OH)_4]^-(aq) + 3e^- \rightarrow Al(s) + 4OH^-$$
حل: معادله واکنش سلول را به دو نیمواکنش تفکیک میکنیم:
نیمواکنش اکسایش:
$${Al(s) + 4OH^-(aq) → [Al(OH4)]^-(aq) + 3e^-} \times4\\ -E^o= ?$$
نیمواکنش کاهش:
$${O2(g) + 2H2O(l) + 4e^- → 4OH^-(aq)} \times3 \\ E^o= +0.401V$$
واکنش کلی:
$$4 \mathrm{Al}(\mathrm{s})+3 \mathrm{O}_{2}(\mathrm{g})+6 \mathrm{H}_{2} \mathrm{O}(\mathrm{l})+4 \mathrm{OH}^{-}(\mathrm{aq}) \rightarrow 4\left[\mathrm{Al}(\mathrm{OH})_{4}\right]^{-}(\mathrm{aq})\ \mathrm{E}_{\text {cell }}^{\circ}=2.71 \mathrm{V}$$
$$E^\circ{cell}= 2.71V= +0.401V - E^o{Al(OH)4]^-(aq)/Al(s)}$$
$$E^o{[Al(OH)4]^-(aq)/Al(s)} = 0.401V - 2.71V = -2.31V$$
اگر این مطلب برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای مهندسی شیمی
- آموزش پیلهای سوختی – مفاهیم و ساختار
- الکترولیت و هدایت الکتریکی — از صفر تا صد
- پیل سوختی چیست؟ — به زبان ساده
^^











سلام
اگه چند تا کاتد داشته باشیم E cell رو چجوری بدست می اوریم