عدد کوانتومی اصلی و فرعی – در شیمی و به زبان ساده
عدد کوانتومی اصلی و فرعی برای نشان دادن لایه الکترونی و شکل اوربیتالی که الکترون در آن قرار دارد استفاده میشوند. اعداد کوانتومی اعدادی هستند که برای توصیف کامل مکان، حرکت و مسیر چرخش الکترونها در یک اتم به کار میروند. برای هر اتم، ۴ عدد کوانتومی بیان میشود. این ۴ عدد کوانتومی، عدد کوانتومی اصلی و فرعی، عدد کوانتومی مغناطیسی و عدد کوانتومی اسپینی هستند. اعداد کوانتومی بسیار مهم هستند زیرا با استفاده از آنها میتوان آرایش الکترونی اتم و مکان تقریبی الکترونهای اتم را به دست آورد. اعداد کوانتومی همچنین برای درک بهتر سایر ویژگیهای اتم مانند انرژی یونش و شعاع اتمی به کار میروند. در این مطلب از مجله فرادرس به توضیح کامل عدد کوانتومی اصلی و فرعی میپردازیم و رابطه آنها را با سایر اعداد کوانتومی بیان میکنیم.
- یاد میگیرید نقش اعداد کوانتومی در ساختار اتم چیست.
- میآموزید چگونه با توجه به n و l آرایش الکترونی را بنویسید.
- تاثیر اعداد کوانتومی بر ویژگیهایی مثل شعاع اتم و انرژی یونش را متوجه میشوید.
- با نحوه تعیین تعداد اوربیتالها و جهتگیری آنها آشنا میشوید.
- ارتباط n و l با جدول تناوبی و بلوکهای spdf را یاد میگیرید.
- برای پیشبینی خواص مغناطیسی عنصرها از ترکیب اعداد کوانتومی استفاده میکنید.


در ابتدای این مطلب میآموزیم عدد کوانتومی اصلی و فرعی چیست. سپس هریک را به صورت کاملتر و جداگانه توضیح میدهیم. برای درک بهتر این دو عدد کوانتومی و ساختار اتم، با اعداد کوانتومی مغناطیسی و اسپینی نیز آشنا میشویم. در ادامه این مطلب، برای درک بهتر مفهوم اعداد کوانتومی، با ساختار لایهها، زیرلایهها و اوربیتالها در اتم آشنا میشویم. سپس روند تغییر عدد کوانتومی اصلی و فرعی را در جدول تناوبی عناصر بررسی میکنیم. برای درک کاربرد اعداد کوانتومی، آرایش الکترونی عناصر را میآموزیم و مثال آن را برای چند عنصر بررسی میکنیم. سپس لایه ظرفیت عناصر و اهمیت آن را در واکنشها و فرآیندهای شیمیایی توضیح میدهیم. در نهایت، اهمیت و کاربرد عدد کوانتومی اصلی و فرعی را میآموزیم. با مطالعه این مطلب تا انتها، میتوانید با این اعداد مهم و تعیین کننده در ساختار اتم به شکلی کامل و کاربردی آشنا شوید.
عدد کوانتومی اصلی و فرعی چیست؟
عدد کوانتومی اصلی میزان انرژی اتم و بیشترین فاصله ممکن الکترون از هسته اتم را نشان می دهد. در برخی از متون از عبارت «لایه الکترونی» برای بیان سطوح مختلف انرژی که بر اساس عدد کوانتومی اصلی به دست آمده است، استفاده میشود. به بیان دیگر، عدد کوانتومی اصلی به اندازه اوربیتال و بزرگی شعاع لایه الکترونی و سطح انرژی که الکترون در آن واقع شده است، اشاره دارد.
عدد کوانتومی فرعی «l»، تعداد زیرلایههای هر لایه را مشخص میکند. این عدد کوانتومی همچنین شکل اوربیتال الکترونی را نیز مشخص میکند. علاوه بر این، عدد کوانتومی فرعی، نقاطی که الکترون ممکن نیست در آنها وجود داشته باشد را نیز به وسیله شکل اوربیتال مشخص میکند. به این نقاط، گره اوربیتال گفته میشود.
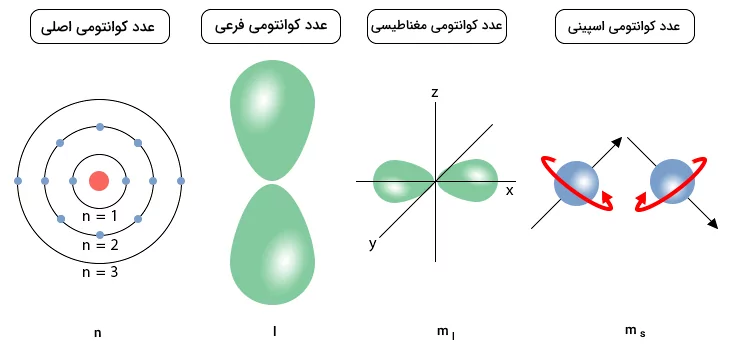
عدد کوانتومی اصلی و فرعی محل و شکل اوربیتال الکترون را مشخص میکنند. ترکیب هر ۴ عدد کوانتومی، با تابع موجی بیان میشود که از معادله شرودینگر تبعیت میکند. هر الکترون در ساختار اتم یک مجموعه منحصر به فرد از اعداد کوانتومی دارد. بنابر اصل طرد پائولی، هیچ دو الکترونی در یک اتم، اعداد کوانتومی کاملا یکسانی ندارند. هر اتم ۴ عدد کوانتومی دارد که برای هر اتم مجموعه آنها منحصر به فرد است. این اعداد کوانتومی، عدد کوانتومی اصلی «n»، عدد کوانتومی فرعی «l»، عدد کوانتومی مغناطیسی «» و عدد کوانتومی اسپین الکترونی«» هستند.
یادگیری شیمی دهم با فرادرس
یادگیری عدد کوانتومی اصلی و فرعی نیازمند شناخت و یادگیری ساختار اتم است. اتم از هسته ای کوچک تشکیل شده است که در آن نوترونهای خنثی و پروتونها با بار مثبت قرار گرفتهاند. در اطراف هسته اتم، الکترونها با بار منفی در لایههایی به صورت ابری در حال حرکت هستند. شناخت ساختار اتم به یادگیری مفاهیمی مانند آرایش آفبا، تبدیل اتمها به یونها و پیوندهای شیمیایی کمک میکند. این مفاهیم در کتاب شیمی پایه دهم متوسطه مطرح شدهاند. پیشنهاد میکنیم برای یادگیری بهتر این مفاهیم به مجموعه فیلم آموزش دروس پایه دهم، بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مسائل و مفاهیم میپردازد.
همچنین با مراجعه به فیلمهای آموزش فرادرس که لینک آنها در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه عدد کوانتومی اصلی و فرعی دسترسی داشته باشید.
- فیلم مجموعه آموزش ریاضی و فیزیک دوره متوسطه
- فیلم آموزش علوم تجربی پایه هشتم بخش شیمی
- فیلم آموزش شیمی ۳ پایه دوازدهم
تعریف عدد کوانتومی اصلی
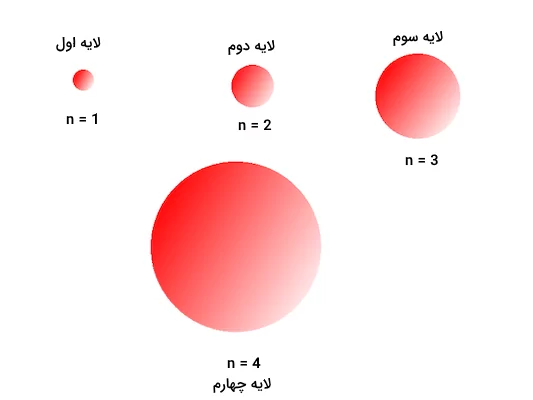
عدد کوانتومی اصلی، لایههای الکترونی اصلی را تعیین میکند. این پدیده به این علت است که «n» مقدار بیشترین فاصله محتمل الکترون از هسته اتم را مشخص میکند. هر چه مقداد عدد کوانتومی اصلی بیشتر باشد، اندازه اوربیتالهای مربوط به آن بزرگتر خواهد بود. مقدار مجاز عددی «n» میتواند اعداد صحیح و مثبت مساوی و بزرگتر از ۱ باشد. مقدار عدد کوانتومی اصلی n = 1 اولین و داخلیترین لایه الکترونی را نشان میدهد.
این لایه الکترونی با نام حالت پایه یا کمترین سطح انرژی یا پایینترین سطح انرژی نیز شناخته میشود. این مسئله به خوبی بیان میکند که چرا عدد کوانتومی اصلی نمیتواند مقادیر کمتر از ۱ داشته باشد. این پدیده به این علت است که الکترونها نمیتوانند بدون انرژی یا با انرژی منفی وجود داشته باشند. هنگامی که یک الکترون در حالت برانگیخته است یا انرژی دریافت میکند، ممکن است به لایه الکترونی دوم (سطح انرژی دوم n = 2) برود. این فرآیند با نام فرآیند جذب شناخته میشود زیرا الکترون انرژی یا فوتون را جذب کرده و به لایه الکترونی بالاتر میرود. همچنین، الکترونها میتوانند با نشر انرژی دریافت شده به حالت پایه و لایه الکترونی اول بازگردند که به آن فرآیند، فرآیند نشر گفته میشود.
با افزایش انرژی الکترونها، عدد کوانتومی اصلی نیز به مرور افزایش مییابد. n = 3 نشاندهنده لایه الکترونی سوم، n = 4 نشاندهنده لایه الکترونی چهارم و به همین ترتیب است.
عدد کوانتومی اصلی، با افزایش دورههای جدول تناوبی افزایش مییابد. برای مثال، هیدروژن و هلیوم تنها ۱ لایه الکترونی دارند و عناصر ردیف دوم، دو لایه الکترونی دارند. برای مثال در تصویر زیر دو لایه الکترون نئون را با ده الکترون تماشا میکنید.
تعریف عدد کوانتومی فرعی
عدد کوانتومی فرعی نمایانگر نوع و شکل زیرلایههای موجود در هر لایه الکترونی است. در قسمت قبل آموختیم عدد کوانتومی اصلی نمایانگر لایههای الکترونی است که الکترون میتواند در آنها وجود داشته باشد. هریک از این لایهها از زیرلایههایی تشکیل شدهاند و هریک از زیرلایهها نیز اوربیتالهایی با شکلهایی به خصوص در خود دارند.
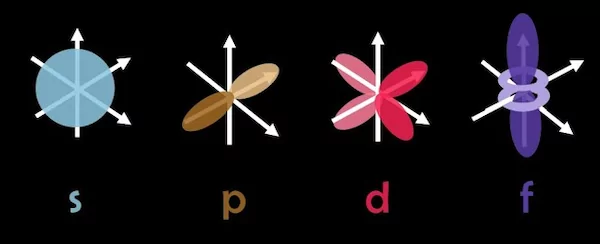
عدد کوانتومی فرعی «l» که با نام عدد کوانتومی تکانه زاویهای مداری نیز شناخته میشود، نشاندهنده شکل اوربیتالها و جهتگیری آنها در فضا است. تعداد گرههایی که شکل اوربیتالها در فضا تشکیل می دهد، برابر با عدد کوانتومی فرعی است. هریک از اعداد کوانتومی فرعی نشانگر یکی از زیرلایههای s، p، d، f و ... هستند. برخلاف عدد کوانتومی اصلی، عدد کوانتومی فرعی میتواند مقدار برابر با صفر داشته باشد اما مقدار آن همواره یک عدد کمتر از عدد کوانتومی اصلی است. برای مثال اگر عدد کوانتومی اصلی برابر با n = 3 باشد، عدد کوانتومی فرعی میتواند مقادیر ۰، ۱ و ۲ را داشته باشد.
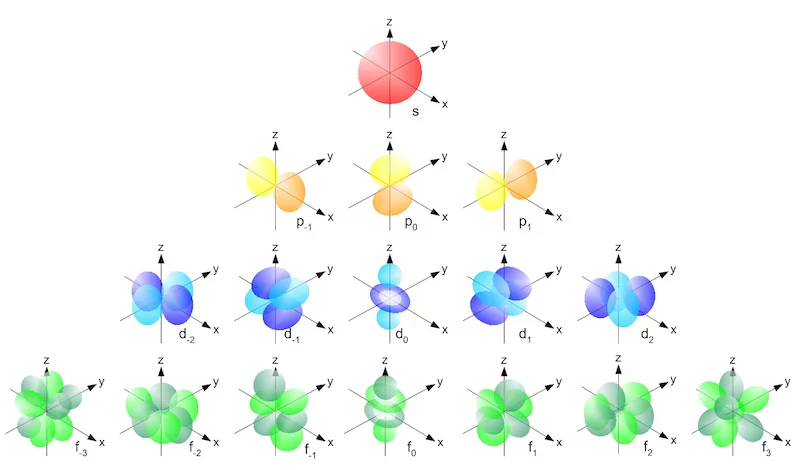
عدد کوانتومی فرعی تاثیر چندانی بر انرژی الکترون ندارد اما شکل اوربیتالها و محل قرارگیری الکترونها را در فضای سهبعدی تعیین میکند. در شکل زیر، نمایی کلی از شکل اوربیتالهای مختلف را مشاهده میکنید.
سایر اعداد کوانتومی
در ابتدای این مطلب توضیح دادیم که هر الکترون با ۴ عدد کوانتومی مشخص میشود و مجموعه این اعداد کوانتومی، برای هر الکترون منحصر به فرد است. در ادامه دو عدد کوانتومی دیگر را بررسی خواهیم کرد.
عدد کوانتومی مغناطیسی
عدد کوانتومی مغناطیسی «» تعداد اوربیتالها و نحوه قرارگیری آنها را در زیرلایهها مشخص میکند. به همین ترتیب، مقادیر این عدد کوانتومی وابسته به عدد کوانتومی فرعی «l» است. عدد کوانتومی مغناطیسی میتواند مقادیری بین l- تا l+ داشته باشد. پس با داشتن مقدار عدد کوانتومی فرعی، میتوان مقدار عدد کوانتومی مغناطیسی را به دست آورد. عدد کوانتومی مغناطیسی میتواند مقادیر مثبت، منفی یا صفر داشته باشد.
مثال
اگر n = 3 و l = 2 باشد، مقادیر عدد کوانتومی مغناطیسی را به دست آورید.
پاسخ
چون مقدار عدد کوانتومی فرعی برابر با ۲ است، عدد کوانتومی مغناطیسی میتواند بین ۲+ تا ۲- باشد.
۲- ، ۱-، ۰، ۱+، ۲+
عدد کوانتومی اسپین الکترون
عدد کوانتومی اسپین الکترون «» جهت چرخش الکترونها را در هر اوربیتال مشخص میکند. برخلاف سه عدد کوانتومی بیان شده در قسمتهای قبل، مقدار این پارامتر به هیچیک از آن سه عدد کوانتومی وابسته نیست. تنها میتواند دو مقدار و را داشته باشد. عدد کوانتومی اسپین الکترون ۱/۲+ با علامت و عدد کوانتومی اسپین الکترون ۱/۲- با علامت مشخص میشود.
اهمیت این عدد کوانتومی در تعیین این موضوع است که الکترون میتواند میدان مغناطیسی تولید کند یا خیر.
تصویر زیر نمایشی از اعداد کوانتومی و کمیتهای مربوط به آنها است.
لایهها، زیرلایهها و اوربیتالها
عدد کوانتومی اصلی و فرعی نقشی اساسی در تعیین لایهها و زیرلایههای اتمها را دارند. الکترونها تنها میتوانند در مقادیر مشخصی فاصله با هسته اتم و در زیرلایهها و اوربیتالهای مشخصی وجود داشته باشند. در ادامه هریک از لایهها، زیرلایهها و اوربیتالهای الکترونی را بیشتر بررسی خواهیم کرد.
لایههای الکترونی
مقدار عدد کوانتومی اصلی n سطح لایههای الکترونی اصلی را مشخص میکند. تمامی اوربیتالها، با مقادیر یکسان n در یک لایه الکترونی وجود دارند.
برای مثال، تمامی اوربیتالها در لایه الکترونی دوم، عدد کوانتومی اصلی n=2 دارند. هنگامی که مقدار n افزایش مییابد، عدد لایه الکترونی نیز بیشتر میشود. این پدیده باعث به وجود آمدن فاصله بیشتر الکترون از هسته اتم خواهد شد. در نتیجه، اندازه اتم نیز با افزایش عدد کوانتومی اصلی و به دنبال آن، مقدار شعاع اتمی افزایش مییابد. تصویر زیر نمایانگر شکل و اندازه زیرلایه s در هریک از لایههای الکترونی ۱ تا ۴ است.
با افزایش عدد کوانتومی اصلی، شعاع اتمی افزایش یافته و فاصله الکترون تا هسته اتم افزایش مییابد. در نتیجه، الکترون راحتتر از مدار جاذبه هسته اتم خارج شده و انرژی یونیزاسیون افزایش مییابد.
زیرلایه ها
عدد کوانتومی اصلی و فرعی همچنین میتوانند برای تعیین تعداد زیرلایهها نیز به کار روند. در واقع، تعداد مقادیر عدد کوانتومی اصلی، تعداد لایهها و تعداد لایهها، تعداد زیرلایهها را در هر لایه الکترونی مشخص میکند. برای مثال به مقادیر زیر توجه کنید.
- هنگامی که عدد کوانتومی اصلی برابر با ۱ باشد، l برابر با ۰ خواهد بود و در این لایه تنها ۱ زیرلایه وجود خواهد داشت.
- هنگامی که عدد کوانتومی اصلی برابر با ۲ باشد، l برابر با ۰ و ۱ خواهد بود و در این لایه، ۲ زیرلایه وجود خواهد داشت.
- هنگامی که عدد کوانتومی اصلی برابر با ۳ باشد، l برابر با ۰، ۱ و ۲ خواهد بود و در این لایه، ۳ زیرلایه وجود خواهد داشت.
هریک از اعداد کوانتمی فرعی، یک نوع زیرلایه را مشخص میکنند. این زیرلایهها و اعداد کوانتومی مربوط به آنها در جدول زیر مشخص شدهاند.
| نام زیرلایه | مقدار عدد کوانتومی فرعی |
| s | ۰ |
| p | ۱ |
| d | ۲ |
| f | ۳ |
در نتیجه از هر عدد کوانتومی اصلی و فرعی میتوان نتایج زیر را برداشت کرد.
- لایه الکترونی اصلی اول با عدد کوانتومی n = ۱، یک زیرلایه s دارد.
- لایه الکترونی اصلی دوم با عدد کوانتومی n = ۲، یک زیرلایه s و یک زیرلایه p دارد.
- لایه الکترونی اصلی سوم با عدد کوانتومی n = ۳، یک زیرلایه s، یک زیرلایه p و یک زیرلایه d دارد.
اوربیتال ها
تعداد اوربیتالهای درون یک زیرلایه برابر با تعداد مقادیر عدد کوانتومی مغناطیسی در هر زیرلایه است. یک معادله کاربردی برای تعیین تعداد اوربیتالهای هر زیرلایه به صورت زیر است.
تعداد اوربیتالهای هر زیرلایه =
این معادله مقادیر عدد کوانتومی مغناطیسی را به شکلی مستقیم تعیین نمیکند اما مقادیر ممکن عدد کوانتومی مغناطیسی را از مقادیر l میتوان به دست آورد. برای مثال اگر l = 1 باشد، مقادیر عدد کوانتومی مغناطیسی همانطور که در قسمتهای قبل توضیح داده شد، مقادیر ۱-، ۰ و ۱+ را خواهد داشت. مقدار 2l + 1 برای این زیرلایه برابر با ۳ خواهد بود درنتیجه این زیرلایه ۳ اوربیتال خواهد داشت. نام اوربیتالها بنابر نام زیرلایه آنها تعیین میشود. مقادیر عدد کوانتومی فرعی، عدد کوانتومی مغناطیسی و نام و تعداد اوربیتالها برای هر ۴ نوع زیرلایه در جدول زیر مشخص شده است.
| عدد کوانتومی فرعی «l» | عدد کوانتومی مغناطیسی «» | تعداد اوربیتالهای زیرلایه |
| ۰ (زیرلایه s) | ۰ | ۱ |
| ۱ (زیرلایه p) | ۱، ۰، ۱- | ۳ |
| ۲ (زیرلایه d) | ۲، ۱، ۰، ۱-، ۲- | ۵ |
| ۳ (زیرلایه f) | ۳، ۲، ۱، ۰، ۱-، ۲-، ۳- | ۷ |
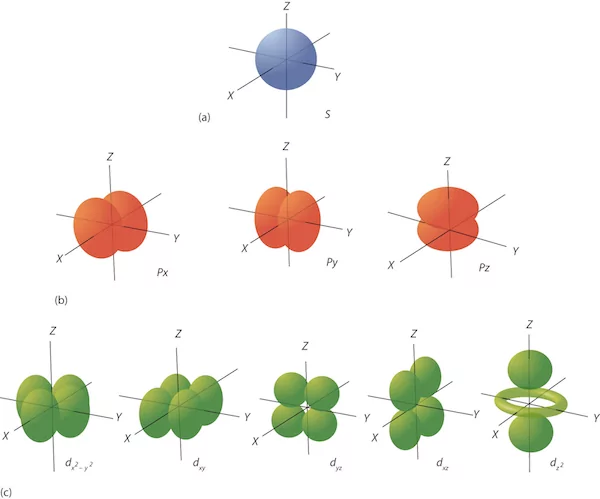
در شکل زیر، تصویر دو اوربیتال p (آبی) و s (قرمز) را مشاهده میکنید. اوربیتال s رسم شده مربوط به لایه اول الکترونی n=1 است. برای تصور اوربیتال 2s یک لایه کروی مشابه با همین شکل رسم شده با شعاع بیشتر را در نظر بگیرید که این کره را در بر گرفته است. اوربیتال 3s نیز کرهای خواهد بود که این دو کره را با شعاع بزرگتر در بر میگیرد. اوربیتال p مانند شکل یک دمبل است که جهت گیری آن در محورهای مختصات با مrدار عدد کوانتومی مغناطیسی مشخص میشود.
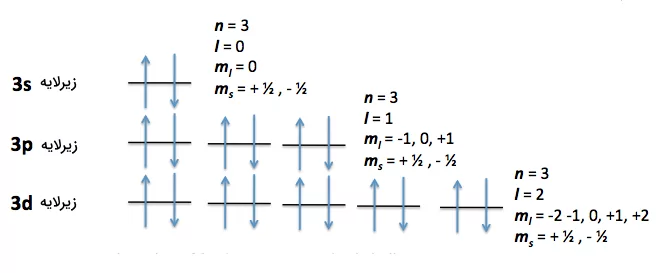
یک روش بررسی اوربیتالها و زیرلایههای الکترونی، استفاده از رسم نمودار اوربیتال، الکترون است. در این شیوه نمایش، برای نمایش هر اوربیتال زیرلایه یک خط یا مربع رسم شده و الکترونها با اسپینهای مشخص در آنها جای میگیرند. شیوه قرارگیری الکترونها در اوربیتالها از قوانین خاصی پیروی میکند که در قسمتهای بعدی توضیح داده خواهد شد. در تصویر زیر، یک نمونه نمودار اوربیتال الکترون را برای لایه سوم الکترونی مشاهده میکنید.
شکل اوربیتال ها
همانطور که در قسمتهای قبل توضیح داده شد، عدد کوانتومی مغناطیسی، میتواند مقادیری بین l- تا l+ داشته باشد. تعداد مقادیر ممکن عدد کوانتومی مغناطیسی، تعداد اوربیتالهای زیرلایههای s، p، d و f را مشخص میکند. هر اوربیتال ۲ الگترون را در خود جای میدهد. همانطور که در جدول قسمت قبل مشخص شد، زیرلایه s یک اوربیتال ، زیرلایه p سه اوربیتال، زیرلایه d پنج اوربیتال و زیرلایه f هفت اوربیتال دارد. هریک از این اوربیتالها جهتگیری خاص خود را در محورهای مختصات دارند و این جهتگیریها به عنوان زیروند در زیر نام اوربیتال نوشته میشود. تصویر زیر، نشاندهنده شکل و جهتگیری اوربیتالها است.
ساختار اتم و اوربیتال های آن نقشی مهم در تعیین خواص شیمیایی آن و واکنشهای شیمیایی که در آن شرکت میکند دارد. درواقع وجود بسیاری از موکولها مانند آب در طبیعت به ماهیت و ساختار اتمهای سازنده آنها و آرایش الکترونها و اوربیتالهای آنها وابسته است. برای یادگیری بیشتر درباره انواع پیوندهای شیمیایی پیشنهاد میکنیم فیلم آموزش پیوند شیمیایی فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
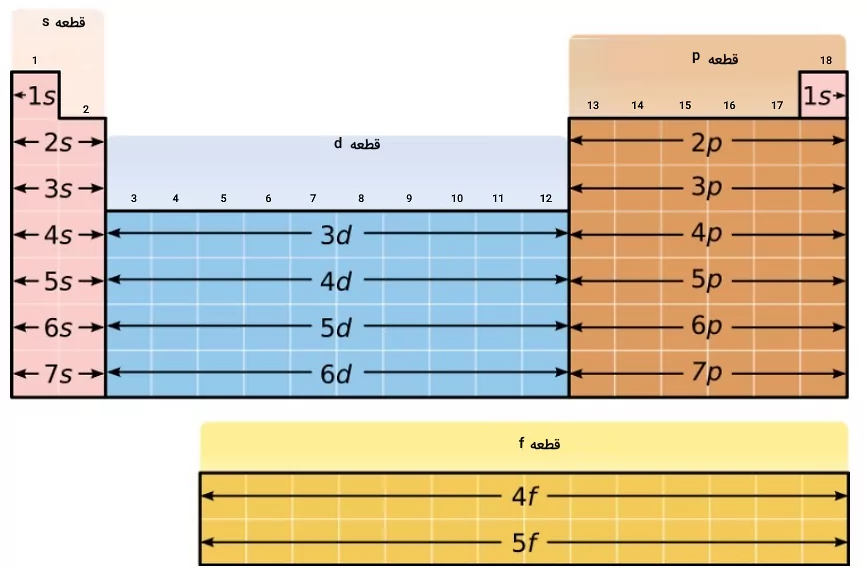
عدد کوانتومی اصلی و فرعی در جدول تناوبی
در جدول تناوبی عناصر، شماره هر ردیف، نمایانگر عدد کوانتومی اصلی آن ردیف است. دوره اول جدول تناوبی ۱ لایه الکترونی، دوره دوم ۲ لایه الکترونی، دوره سوم سه لایه الکترونی .و ... دارند. عدد کوانتومی فرعی در جدول تناوبی نیز از الگویی خاص پیروی کرده و طبق آن الگو تغییر میکند. این الگو به شکل زیر است.
- عدد کوانتومی فرعی l = ۰ که مربوط به زیرلایه s است، در گروه اول و گروه دوم جدول تناوبی پر میشود.
- عدد کوانتومی فرعی l=۱ که مربوط به زیرلایه p است، در گروه ۱۳ تا ۱۸ جدول تناوبی پر می شود.
- عدد کوانتومی فرعی l=۲ که مربوط به زیرلایه d است، در گروههای ۳ تا ۱۲ جدول تناوبی (فلزات واسطه) پر میشود.
- عدد کوانتومی فرعی l=۳ که مربوط به زیرلایه f است، در ردیفهای لانتانیدها و اکتنیدها به ترتیب از چپ به راست، پر میشود.
بسته به این الگوی پر شدن، هریک از این قسمتهای جدول تناوبی با نام قطعه s، p، d و f نامگذاری شدهاند و رفتارهای شیمیایی مشابهی دارند. تصویر زیر، نشاندهنده این الگوها است.
آرایش الکترونی
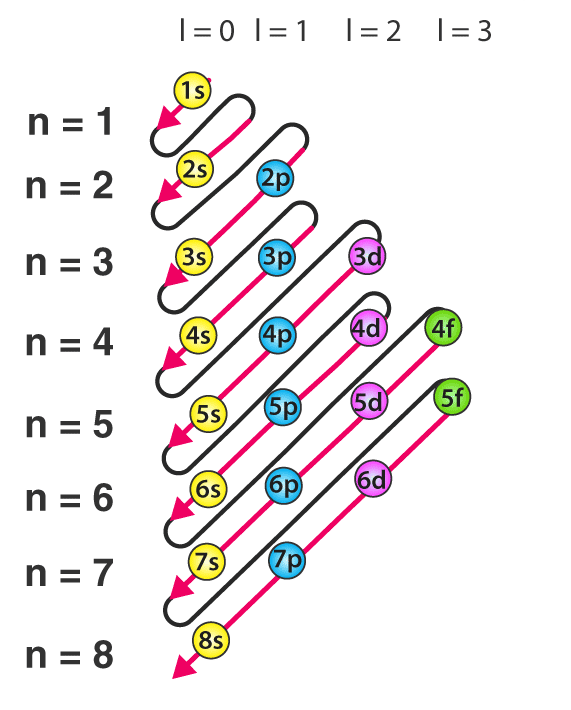
آرایش الکترونی اتمها مجموعهای از اعداد و حروف است که لایهها و زیرلایههای الکترونی اتم را به همراه تعداد الکترون آنها و ترتیب پر شدن آنها نشان میدهد. ترتیب قرارگیری و پرشدن لایهها و زیرلایهها بر اساس سطح انرژی آنها است. در واقع در ترتیب قرارگیری الکترونها در لایهها و زیرلایهها قانونی به نام اصل آفبا برقرار است. اصل آفبا بیان میکند که الکترونها تمایل دارند ابتدا اوربیتالهای لایهها وز یرلایههایی که انرژی کمتری دارند را پر کنند. بنابر اصل آفبا، ترتیب قرارگیری الکترونها در اوربیتالها به شکل زیر است.
در نتیجه با داشتن تعداد الکترونهای اتم و دانشتن تعداد الکترونهایی که در هر زیرلایه قرار میگیرد، میتوان آرایش الکترونی اتمها و عناصر را نوشت. برای مثال، آرایش الکترونی اتم سدیم به شکل زیر است.
ترتیب قرارگیری الکترونها در زیرلایهها طبق اصل آفبا در تصویر زیر مشخص شده است. به جهت حرکت پیکان توجه کنید.
همچنین روش دیگری نیز برای نمایش آرایش الکترونی عناصر وجود دارد که در آن از نماد شیمیایی عناصر گاز نجیب استفاده میشود. به این شیوه نمایش، آرایش الکترونی فشرده گفته میشود. در این آرایش الکترونی، به جای نوشتن قسمتی از آرایش الکترونی که مشابه آرایش الکترونی گاز نجیب عنصر قبل از اتم مورد بررسی است، نماد گاز نجیب در دو براکت نوشته میشود.
برای درک بهتر آرایش الکترونی عناصر باید از جدول تناوبی کمک بگیرید. پیشنهاد میکنیم برای آشنایی بیشتر با نحوه رسم آرایش الکترونی عناصر و همچنین یادگیری آرایش الکترونی عناصر استثنا، مطلب آرایش الکترونی عناصر و نحوه رسم آنها از مجله فرادرس را مطالعه کنید که در آن به توضیح کامل این موارد پرداختهایم.
اگر کل اتم را به یک هتل تشبیه کنیم، عدد کوانتومی اصلی، شماره طبقات و اوربیتالها، اتاقهایی خواهند بود که الکترونها در آنها جای میگیرند. هر اوربیتال، انرژی منحصر به فرد خود را دارد. کم انرژی ترین اوربیتال موجود ابتدا پر میشود و اگر باز هم الکترون باقی مانده بود، باقی اوربیتالها به ترتیب انرژی پر خواهند شد.
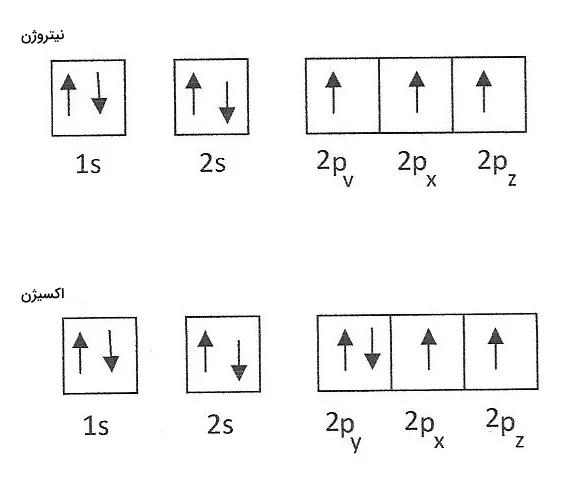
از آنجا که الکترونها بار منفی همسان و هم اندازه دارند، تا جای ممکن از یکدیگر فاصله می گیرند تا تحت اثر دافعه یکدیگر قرار نگیرند. بنابراین، هنگام پر شدن اوربیتالهای هم انرژی در یک زیرلایه، الکترونها ابتدا به صورت تک تک اوربیتالها را پر می کنند و سپس به صورت دوتایی جفت میشوند. به این قاعده، قاعده هوند گفته میشود. برای درک بهتر این قانون، به نمودار اوربیتال الکترون دو اتم نیتروژن و اکسیژن توجه کنید.
عدد کوانتومی اصلی و فرعی در آرایش الکترونی
آرایش الکترونی عناصر یکی از مهمترین ویژگیهایی است که برای هر عنصر بررسی میشود. از روی آرایش الکترونی عناصر میتوان به ویژگیهای شیمیایی و واکنشها و رفتار شیمیایی عناصر پیبرد. همچنین، با توجه به آرایش الکترونی عناصر، میتوان آنها را دسته بندی کرده و شباهتهایی را بین عناصر پیدا کرد.
آرایش الکترونی عناصر بر اساس عدد کوانتومی اصلی و فرعی نوشته میشود عدد کوانتومی اصلی که شماره لایه الکترون را مشخص میکند ابتدا نوشته شده و سپس نام زیرلایه که با توجه به عدد کوانتومی فرعی به دست میآید پس از آن نوشته میشود. در نهایت، تعداد الکترونهای زیرلایه به صورت نمادی در بالای نام زیرلایه قرار میگیرد.
مثال
آرایش الکترونی عناصر نئون و سدیم را بنویسید.
پاسخ
آرایش الکترونی عناصر نئون و سدیم به شکل زیر است.
لایه ظرفیت چیست؟
لایه ظرفیت الکترونی آخرین لایه الکترونی اتم است که در آن الکترون وجود دارد. در واقع لایه ظرفیت اتمهامجموعهای از اوربیتالهای پر انرژی و دورترین اوربیتالها از هسته هستند. الکترونهای لایه ظرفیت اتم ها وظیفه شرکت در واکنشهای شیمیایی و تشکیل پیوند را برعهده دارند. برای عناصر اصلی جدول تناوبی، الکترونهای اوربیتالهای ns و np الکترونهای لایه ظرفیت هستند. برای فلزات واسطه، الکترونهای اوربیتالهای d(n-1) الکترونهای ظرفیت هستند. الکترون های ظرفیت لانتانیدها و اکتنیدها، الکترونهایی هستند که در اوربیتالهای (n-1)d و (n-2)f قرار دارند.
مجموع عدد کوانتومی اصلی و فرعی
مجموع عدد کوانتومی اصلی و فرعی پارامتری است که در مورد الکترونهای ظرفیت عناصر بیان میشود. این پارامتر از طریق فرمول زیر محاسبه میشود.
مجموع عدد کوانتومی اصلی و فرعی لایه ظرفیت = n + l
برای مثال برای اتم سدیم، مجموع عدد کوانتومی اصلی و فرعی لایه ظرفیت به طریق زیر به دست میآید. ابتدا، آرایش الکترونی اتم را مینویسیم.
آخرین لایه الکترون اتم سدیم لایه سوم است و آخرین اوربیتال الکترونی آن 3s است. پس لایه ظرفیت آن لایه سوم است. عدد کوانتومی اصلی این لایه برابر با n = 3 است. عدد کوانتومی فرعی آن به دلیل اینکه زیرلایه آن زیرلایه s است برابر با l = ۰ است. پس مجموع عدد کوانتومی اصلی و فرعی این اتم به شکل زیر است.
n + l = 3 + 0 = 3
برای به دست آوردن تعداد الکترونهای موجود در مجموع اعداد کوانتومی l و n لایه ظرفیت، باید پس از انجام محاسبات بالا، تعداد الکترونها را در این مقادیر ضرب کنیم. از این مطلب در مجموعه سوالات امتحان نهایی و کنکور سوالاتی مطرح شده است. برای تمرین بیشتر، سوالات زیر را حل کنید.
مثال ۱
مجموع اعداد کوانتومی اصلی و فرعی الکترونهای لایه ظرفیت اتم پتاسیم را محاسبه کنید.
پاسخ
برای پاسخ به این گونه سوالات، ابتدا آرایش الکترونی لایه ظرفیت اتم را مینویسیم. آرایش الکترونی اتم پتاسیم به شکل زیر است.
تعداد الکترونهای ظرفیت این اتم ۱ عدد است که در لایه چهارم و در اوربیتال 4s قرار دارد. برای محاسبه مجموع عدد کوانتومی اصلی و فرعی برای این لایه ، n=4 و l=0 را در نظر گرفته و مجموع آن ها را در تعداد الکترون لایه ظرفیت یعنی عدد ۱ ضرب میکنیم.
(۴+۰)×۱=۴
مثال ۲
مجموع اعداد کوانتومی اصلی و فرعی الکترونهای لایه ظرفیت اتم کربن را محاسبه کنید.
پاسخ
برای پاسخ به این گونه سوالات، ابتدا آرایش الکترونی لایه ظرفیت اتم را مینویسیم. آرایش الکترونی اتم کربن به شکل زیر است.
لایه ظرفیت این اتم، لایه دوم است. این لایه از اوربیتالهای 2s و 2p تشکیل شده است. برای محاسبه مجموع عدد کوانتومی اصلی و فرعی برای این لایه، n=2 و l=0 و n=2 و l=1 را در نظر گرفته و در تعداد الکترونها ضرب میکنیم.
۱۰=(۲+۱)×۲+(۲+۰)×۲
اهمیت عدد کوانتومی اصلی و فرعی
عدد کوانتومی اصلی و فرعی در تعیین مکان حضور الکترون بسیار حائز اهمیت هستندو با استفاده از این دو عدد کوانتومی میتوان مقدار عدد کوانتومی مغناطیسی را نیز به دست آورد و با داشتن تعداد الکترونها و اوربیتالهای الکترون میتوان اسپین آنها را نیز مشخص کرد. عدد کوانتومی اصلی و فرعی، آرایش الکترونی اتم را مشخص میکنند. این اعداد اطلاعات مفیدی درباره مکان احتمالی حضور الکترون میدهند و به وسیله عدد کوانتومی اصلی و فرعی میتوان به اطلاعات دیگری درباره ویژگیهای اتم مانند شعاع اتمی و انرژی یونیزاسیون نیز دست یافت.
جدول راهنما عدد کوانتومی
در جدول زیر، مقادیر، نامها و علامتهای اعداد کوانتومی مشخص شدهاند.
| عدد کوانتومی | علامت | مقادیر عددی |
| عدد کوانتومی اصلی | n | ۱، ۲، ۳، ۴ و ... |
| عدد کوانتومی فرعی | l | n-1، ۳، ۲، ۱ و ... |
| عدد کوانتومی مغناطیسی | l- تا l+ | |
| عدد کوانتومی اسپین الکترون | ۱/۲+ و ۱/۲- |
یادگیری شیمی کوانتومی با فرادرس
پس از نظریه اتمی بور، شرودینگر و هایزنبرگ نظریه او را توسعه داده و بیشتر روی خواص کوانتومی اتم تحقیق و بررسی کردند. ساختار اتمی که در حال حاضر بررسی میشود و اشکال و خواص اوربیتالها از حل معادله شرودینگر به دست آمده است. در مطالعه شیمی کوانتومی، با مباحثی مانند طبیعت دوگانه موج ذرهای، اصل عدم قطعیت هایزنبرگ و تفاوتهای عمده مکانیک کوانتوم و مکانیک کلاسیک آشنا میشوید. همچنین برای یادگیری ساختار کوانتومی اتم باید با معادله شرودینگر، عملگرها و نظریه اوربیتال مولکولی آشنا شوید. پیشنهاد میکنیم برای یادگیری این مباحث، به مجموعه فیلم آموزش شیمی از دروس دانشگاهی تا کاربردی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مباحث و مفاهیم میپردازد.
همچنین با مشاهده فیلمهای آموزش فرادرس که لینک آنها در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه شیمی کوانتومی دسترسی داشته باشید.
- فیلم آموزش شیمی فیزیک ۳ همراه با مفاهیم کلیدی
- فیلم آموزش محاسبات کوانتومی
- فیلم آموزش شیمی فیزیک ۱، مرور و حل تست کنکور ارشد
کاربرد عدد کوانتومی اصلی و فرعی
برای تعیین مکان تقریبی حضور الکترون در اطراف هسته، از عدد کوانتومی اصلی و فرعی استفاده میشود. ویژگیهای اوربیتالهای اتمی و الکترونهای درون آنها به وسیله اعداد کوانتومی تعیین میشود. در حالت کلی ۴ عدد کوانتومی برای هر الکترون وجود دارد که مجموعه این ۴ عدد کوانتومی برای هر الکترون منحصر به فرد است. این اعداد کوانتومی آرایش الکترونی الکترونها را در اتمها یا یونها تعیین میکنند. این اعداد کوانتومی با قرار گرفتن در معادلهای، میتوانند مکان تقریبی حضور الکترون را به صورت سه بعدی، تعیین کنند. الکترونها ابتدا به تنهایی اوربیتالها را پر کرده و سپس جفت می شوند. در هر اوربیتال تنها دو الکترون جای میگیرد. اسپین یا جهت چرخش هریک از این الکترون ها در هر اوربیتال خلاف جهت الکترون دیگر است. اگر یک الکترون اسپین رو به بالا داشته باشد، دیگری اسپین رو به پایین خواهد داشت.
ترکیب این اعداد کوانتومی میتواند تعیین کند که اتم میتواند میدان مغناطیسی تولید کند یا خیر. اسپین الکترونهای اتم میتواند در این روند مانند یک آهنربای کوچک عمل کند. اگر در یک اتم، تمامی الکترونها در تمامی اوربیتالها به صورت جفتهایی دوتایی با اسپین مخالف وجود داشته باشند، اتم دیامغناطیسی است. این بدان معنی است که مجموع اسپین الکترونهای اتم برایندی برابر با صفر دارد و میدان مغناطیسی را دفع میکند.
اگر اتم شامل الکترون های جفت نشده و تک باشد، در میدان مغناطیسی جذب خواهد شد و به آن اتم پارا مغناطیسی گفته می شود. این خواص در بررسی رفتار شیمیایی مواد نقشی مهم دارند.
جمعبندی
در این مطلب از مجله فرادرس آموختیم عدد کوانتومی اصلی و فرعی اتم نشاندهنده و تعیین کننده انرژی و فاصله الکترون از هسته اتم هستند. عدد کوانتومی اصلی با حرف «n» نمایش داده میشود و نمایانگر لایههای الکترونی است. عدد کوانتومی فرعی با حرف «l» نمایش داده میشود و نمایانگر شکل اوربیتالها و نوع زیرلایهها است. برای هر الکترون دو عدد کوانتومی دیگر نیز بیان میشود که عبارتند از عدد کوانتومی مغناطیسی و عدد کوانتومی اسپینی. این اعداد تعداد اوربیتال زیرلایهها و همچنین جهت چرخش هر الکترون در اوربیتال را مشخص میکنند.
آزمون عدد کوانتومی اصلی و فرعی
۱. کدام ویژگی توسط عدد کوانتومی اصلی (n) برای یک الکترون تعیین میشود؟
جهتگیری فضایی اوربیتال در فضا
شکل زیرلایه و نوع اوربیتال
شماره لایه الکترونی و بیشترین فاصله از هسته
جهت چرخش الکترون در اوربیتال
عدد کوانتومی اصلی یا n مشخص میکند که الکترون در کدام لایه یا پوسته انرژی قرار دارد و بیشترین فاصله محتمل آن از هسته چقدر است. یعنی عامل اصلی در تعیین سطح انرژی و اندازه اوربیتال محسوب میشود. «شماره لایه الکترونی و بیشترین فاصله از هسته» بیانگر همین نقش است. «شکل زیرلایه و نوع اوربیتال» مربوط به عدد کوانتومی فرعی (l)، «جهتگیری فضایی اوربیتال در فضا» مربوط به عدد کوانتومی مغناطیسی، و «جهت چرخش الکترون در اوربیتال» مربوط به عدد کوانتومی اسپینی هستند.
۲. برای لایهای که عدد کوانتومی اصلی (n) آن برابر با ۳ باشد، مقدارهای مجاز عدد کوانتومی فرعی (l) کدام است؟
صفر تا سه برای l مجاز است.
فقط مقدار دو برای l مجاز است.
فقط یک و دو برای l مجاز است.
صفر، یک و دو برای l مجاز است.
برای n برابر با ۳، عدد کوانتومی فرعی (l) میتواند مقادیر صحیح از صفر تا n-1 یعنی صفر، یک و دو را بپذیرد.
۳. ویژگی مشترک اوربیتالهای یک زیرلایه که توسط عدد کوانتومی فرعی (l) تعیین میشود چیست؟
دارای انرژی اصلی یکسان برای تمام الکترونها هستند.
جهتگیری مغناطیسی آنها یکسان است.
اندازه آنها با افزایش n تغییر نمیکند.
همه آنها شکل فضایی مشابهی دارند.
ویژگی مشترک اوربیتالهای یک زیرلایه این است که همه آنها شکل فضایی مشابهی دارند، چون عدد کوانتومی فرعی (l) نوع و شکل اوربیتالها را مشخص میکند. «انرژی اصلی یکسان» توصیف انرژی لایه است که به عدد کوانتومی اصلی (n) مربوط است. «جهتگیری مغناطیسی یکسان» تحت تاثیر عدد کوانتومی مغناطیسی (ml) تعیین میشود. همچنین «اندازه اوربیتال با افزایش n تغییر میکند» و ثابت نیست.
۴. عدد کوانتومی مغناطیسی () چه نقشی در ساختار آرایش الکترونی اتم ایفا میکند؟
مشخص کردن عدد لایه اصلی الکترون را بر عهده دارد
تعیین جهتگیری فضایی اوربیتال در هر زیرلایه را انجام میدهد
نوع و شکل زیرلایه را مشخص میکند
مطابق با مقدار انرژی هر زیرلایه تعیین میشود
عدد کوانتومی مغناطیسی () وظیفه تعیین جهتگیری فضایی اوربیتال در هر زیرلایه را بر عهده دارد و با این عدد مشخص میشود که هر اوربیتال در فضای سهبعدی چگونه قرار میگیرد. عبارت «تعیین جهتگیری فضایی اوربیتال در هر زیرلایه» بهدرستی نقش را بیان میکند. عدد لایه اصلی با n مشخص میشود، انرژی هر زیرلایه به n و l وابسته است، و نوع و شکل زیرلایه توسط عدد کوانتومی فرعی (l) تعیین میشود.
۵. اصل طرد پائولی چگونه با اعداد کوانتومی مرتبط است؟
برای هر اوربیتال همه الکترونها مقدار یکسانی دارند.
هر الکترون باید دستکم یک عدد کوانتومی بین n یا l متفاوت داشته باشد.
هر الکترون در یک اتم مجموعهای منحصر به فرد از اعداد کوانتومی دارد.
تمام الکترونهای یک لایه مجموع n+l یکسانی دارند.
بر اساس اصل طرد پائولی، هیچ دو الکترونی در یک اتم نمیتوانند مجموعه یکسانی از چهار عدد کوانتومی (n، l، ، ) داشته باشند. این یعنی هر الکترون باید مجموعه منحصر به فرد خود از این اعداد را داشته باشد. بنابراین عبارت «هر الکترون در یک اتم مجموعهای منحصر به فرد از اعداد کوانتومی دارد» صحیح است. گزینههایی مانند تفاوت فقط در n یا l، یا برابر بودن مجموع n+l برای یک لایه، یا یکسان بودن برای یک اوربیتال نادرست هستند، زیرا اصل طرد پائولی بر منحصربهفرد بودن کل ترکیب چهار عدد کوانتومی برای هر الکترون تاکید میکند.
۶. عدد کوانتومی اصلی (n) چه ارتباطی با ردیفهای جدول تناوبی عناصر دارد؟
عدد n در هر ردیف جدول تناوبی ثابت نمیماند و برای هر عنصر متفاوت است.
عدد n فقط برای بلوک d جدول تناوبی با شماره ردیف برابر است.
عدد n در هر ردیف جدول تناوبی همان شماره ردیف آن عنصر است.
عدد n تنها برای عناصر گروه s با شماره ردیف منطبق میشود.
در جدول تناوبی، عدد کوانتومی اصلی یا n برای هر عنصر با شماره ردیف آن عنصر منطبق است. این یعنی عناصر هر ردیف دارای عدد n مشابه هستند. عبارت «عدد n در هر ردیف جدول تناوبی همان شماره ردیف آن عنصر است» درست است. عبارتهای «عدد n فقط برای بلوک d» یا «تنها برای عناصر گروه s» صحیح نیستند چون این انطباق برای همه عناصر هر ردیف برقرار است. همچنین، بر خلاف گزینه «عدد n ثابت نمیماند»، همه عناصر یک ردیف جدول تناوبی عدد n برابری دارند.
۷. جهتگیری فضایی یک اوربیتال الکترونی عمدتا با کدام عدد کوانتومی تعیین میشود و این جهتگیری چه تاثیری بر خواص مولکولی دارد؟
عدد کوانتومی اسپینی تعیینکننده جهتگیری بوده و رفتار مغناطیسی مولکول را تعیین میکند.
عدد کوانتومی اصلی تعیینکننده جهتگیری اوربیتال بوده و در انرژی سطحی نقش دارد.
عدد کوانتومی فرعی جهتگیری را مشخص میکند و فقط بر شکل اوربیتال اثر میگذارد.
عدد کوانتومی مغناطیسی جهتگیری فضایی را تعیین میکند و خواص مولکولی را از این راه تحت تاثیر قرار میدهد.
ویژگی جهتگیری فضایی اوربیتال توسط عدد کوانتومی مغناطیسی تعیین میشود. این عدد مشخص میکند که اوربیتال در فضا به چه جهتی قرار میگیرد و این موضوع به طور مستقیم بر چگونگی برخورد، پیوند و خواص مولکولی تاثیر میگذارد. عبارت «عدد کوانتومی اصلی» مربوط به انرژی و اندازه اوربیتال است و «عدد کوانتومی فرعی» بیشتر به شکل اوربیتال اشاره دارد.
۸. در فرآیند تعیین آرایش الکترونی، اگر n=2 و l=1 باشد، چه نوع اوربیتالی باید پر شود و این ترتیب پر شدن بر اساس کدام اصل انتخاب میشود؟
اوربیتال p پر میشود و این ترتیب تابع اصل آفبا است.
اوربیتال s پر میشود و این ترتیب تابع اصل طرد پائولی است.
اوربیتال d پر میشود و این ترتیب تابع قاعده هوند است.
اوربیتال f پر میشود و این ترتیب تابع اصل آفبا است.
وقتی n برابر با ۲ و l برابر با ۱ باشد، نوع زیرلایه به صورت p (پی) مشخص میشود. طبق اصل آفبا، اوربیتالهایی که انرژی کمتری دارند ابتدا پر میشوند. پرشدن اوربیتال d، s یا f با این تنظیمات ممکن نیست، چون l=1 فقط به اوربیتال p اختصاص دارد و اصل آفبا ترتیب انرژی را مشخص میکند.
۹. برای پیشبینی آرایش الکترونهای ظرفیت یک عنصر با تعداد مشخص الکترون، استفاده از n و l چه کمکی میکند؟
آرایش دقیق اسپین (Spin) هر الکترون ظرفیت را مشخص میکند.
فقط میتواند مجموع اعداد را برابر تعداد الکترون ظرفیت قرار دهد.
فقط جهتگیری فضایی اوربیتال ظرفیت را تعیین میکند.
تعیین شماره لایه و نوع زیرلایه هر الکترون ظرفیت را ممکن میسازد.
استفاده از n (عدد کوانتومی اصلی) و l (عدد کوانتومی فرعی) کمک میکند تا لایه (n) و زیرلایه یا نوع اوربیتال (l) الکترونهای ظرفیت را بهدرستی شناسایی کنیم. برای مثال، به کمک n محل لایه ظرفیت و با l نوع اوربیتال (مثل s یا p) را میتوان تعیین کرد. اما عبارت «تعیین شماره لایه و نوع زیرلایه هر الکترون ظرفیت» درست است. چون دوتای دیگر یا فقط بر مجموع n+l یا جهتگیری اوربیتال تمرکز دارند، و آرایش دقیق اسپین با تعیین میشود.
۱۰. اگر عدد کوانتومی اصلی (n) افزایش یابد اما عدد کوانتومی فرعی (l) ثابت بماند، چه تغییری در شعاع اتمی و انرژی یونش اتفاق میافتد؟
شعاع اتمی کاهش مییابد و انرژی یونش افزایش مییابد.
هر دو ثابت میمانند چون l تغییر نکرده است.
شعاع اتمی افزایش مییابد و انرژی یونش کاهش مییابد.
هر دو افزایش مییابند چون n بزرگتر شده است.
افزایش n با ثابت بودن l موجب بزرگتر شدن اندازه لایه و دور شدن الکترونها از هسته میشود، بنابراین «شعاع اتمی افزایش مییابد». همچنین با دور شدن الکترونها از هسته، نیروی جاذبه کمتر میشود و جدا کردن الکترون آسانتر خواهد بود، پس «انرژی یونش کاهش مییابد».
۱۱. در مقایسه آرایش الکترونی عناصر با استفاده از مجموع n+l برای لایه ظرفیت، کدام روش به درستی نظم پر شدن زیرلایهها را نشان میدهد؟
زیرلایه با n بیشتر صرفنظر از n+l زودتر پر میشود.
زیرلایهای با n+l کوچکتر همیشه زودتر پر میشود.
زیرلایهای با n کوچکتر و n+l یکسان، ابتدا پر میشود.
زیرلایهای با n+l برابر، اما l بزرگتر، پیشتر پر میشود.
در صورت مساوی بودن مجموع n+l بین دو زیرلایه، بر اساس اصل آفبا ابتدا زیرلایهای که عدد n (عدد کوانتومی اصلی) کوچکتری دارد پر میشود. بنابراین، جمله «زیرلایهای با n کوچکتر و n+l یکسان، ابتدا پر میشود» درست است.