بیوشیمی آنزیم ها – به زبان ساده
در هر ثانیه هزاران واکنش درون بدن ما توسط آنزیمها انجام میشوند. این آنزیمها نه تنها در بدن بلکه در صنعت، پزشکی نیز کاربرد دارند. مطالعه بیوشیمی آنزیم ها به ما کمک میکند با نحوه عملکرد و کنترل آنزیمها آشنا شویم. در ادامه توضیحاتی در رابطه با بیوشیمی آنزیم، تعریف کاتالیزگر زیستی و روشهای کنترل آنزیم داده میشود.
- نقش آنزیمها در تسریع واکنشهای شیمیایی بدن را میآموزید.
- اختصاصی بودن آنزیمها و رابطه آنها با سوبسترا را یاد خواهید گرفت.
- با انواع آنزیمهای پروتئینی و اهمیت آنها آشنا میشوید.
- راهکارهای تنظیم فعالیت آنزیم و تأثیر عوامل محیطی را خواهید آموخت.
بیوشیمی آنزیم چیست ؟
بیوشیمی آنزیم به بررسی واکنشهای آنزیمی انجام شده توسط بدن موجودات میگویند. از بررسی برخی از آنزیمها در خون یا سرم بدن میتوان مشکلات پیش آمده در بدن را متوجه شد. اما برای بررسی این واکنشها لازم است ابتدا آنزیم را بشناسیم. بیشتر آنزیمها از جنس پروتئین هستند (آنزیمهایی از جنس مولکول RNA نیز وجود دارد که به آن ریبوزوم میگویند). هر سلول هزاران آنزیم دارد که واکنشهای آن را سرعت می بخشند.
کاتالیزور چیست؟
واکنشی را تصور کنید که در آن مولکول A به مولکول B میپیوندد و مولکول A-B را به وجود میآورد.اگر تمام شرایط واکنش ثابت باشد (دما، غلظت واکنشدهندههای A و B، فشار اتمسفر)، این واکنش با سرعت ثابتی انجام میشود. مثلا در یک ثانیه 3 مولکول A-B تشکیل میشود.
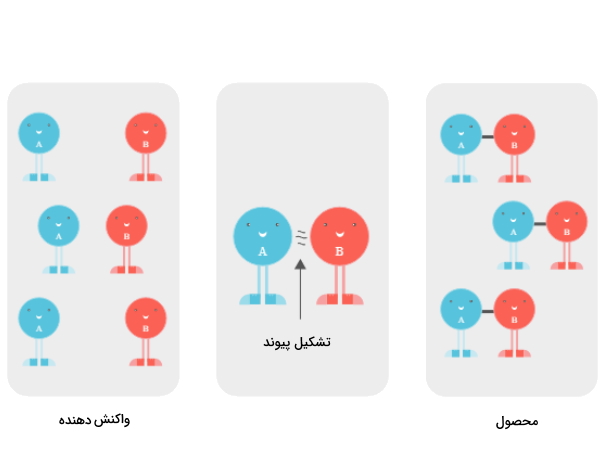
حالا اگر کاتالیزور را به واکنش اضافه کنیم به جای 3 مولکول A-B، دوازده مولکول A-B تولید میشود. همچنین کاتالیزور بدون این که در واکنش مصرف شده باشد، همچنان وجود دارد.

مصرف نشدن کاتالیزور در واکنش یکی از ویژگیهای مهم آن است. برای مثال اگر روی آتش بنزین بریزیم، سرعت واکنش بالا میرود. اما در این واکنش بنزین نقش کاتالیزوری ندارد چون در واکنش مصرف شده است.
یک مثال رایج برای کاتالیزورها آنزیمها هستند که بدون مصرف شدن در واکنشهای درون بدن ما، سرعت واکنش را افزایش میدهند. به همین خاطر بررسی بیوشیمی آنزیم ها و شناخت نحوه عملکرد آنها اهمیت دارد.
کاتالیزور یا آنزیم چگونه کار میکند؟
فرض کنید مولکولهای نیتروژن اکساید را در یک شیشه قرار دادهایم. اگر شیشه را تکان دهیم مولکولها با یکدیگر برخورد میکنند، اما مقدار خیلی کمی از مولکولهای و تولید میشود. علت آن چیست؟ مگر برخورد مولکولها به هم نباید باعث ایجاد واکنش شود؟
اگر تابهحال با آهنربا بازی کرده باشید میدانید که قطبهای یکسان آهنربا را نمیتوان به یکدیگر نزدیک کرد. برقراری پیوند شیمیایی هم همینطور است. اگر اتمها از سمت مناسبی به یکدیگر نزدیک شوند یکدیگر را جذب میکنند.
بیایید آن را سادهتر کنیم. فرض کنیم اتم اکسیژن آهنربای قرمز و اتم نیتروژن آهنربای آبی است. این آهنرباها دو رفتار از خود نشان میدهند.
- آهنربای قرمز آهنربای آبی را جذب میکند.
- ولی آهنرباهای همرنگ قویتر هستند و بیشتر یکدیگر را جذب میکنند.
اگر اتم اکسیژنی که با نیتروژن پیوند دارد مثل شکل زیر به یک مولکول اکسیژن-نیتروژن دیگر نزدیک شود، اتمهای اکسیژن ترجیح میدهند که بجای مولکول نیتروژن به یکدیگر متصل باشند. در نتیجه انقدر محکم به هم برخورد میکنند که پیوندشان با نیتروژن از بین میرود و به هم میپیوندند. از طرفی مولکولهای اکسیژن هم تشکیل مولکول میدهند. ولی این فقط در صورتی است که مولکولها در جهتگیری مناسب خود درست مانند تصویر زیر کنار هم قرار بگیرند.
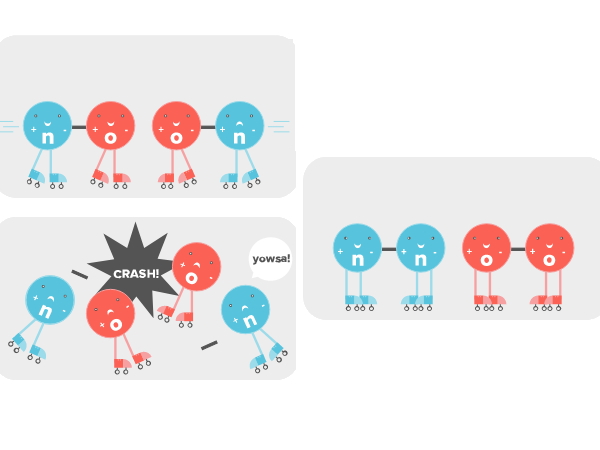
اینجا دقیقا زمانی است که کاتالیزور یا آنزیم وارد میشود. آنزیمها مولکولها را به طور مناسب در کنار هم قرار میدهند که با یکدیگر وارد واکنش شوند. درست مانند تصویر زیر که قرار دادن کاتالیزور همراه سایر مولکولها داخل شیشه آنها را در جهت درست کنار هم قرار میدهد تا واکنش انجام شود.

چرا آنزیمها مهم هستند؟
انرژی سلولی یک منبع بسیار ارزشمند برای بدن ما است. بیایید دوباره به مثال آهنربا برگردیم تا ببینیم آنزیم چگونه به نگهداری انرژی بدن کمک میکند.
تا اینجا دیدیم که اضافه کردن کاتالیزور به محفظه شیشهای سرعت انجام واکنش را زیاد میکند. اما روش دیگری نیز برای انجام واکنش وجود دارد. با تکان دادن شیشه مولکولها حرکت میکنند و در جهتهای مختلف قرار میگیرند. در این حالت، احتمال ایجاد شرایط مناسب برای برقراری پیوند آهنرباهای همرنگ، بالاتر میرود. در نتیجه واکنش انجام میشود.
تکان دادن شیشه انرژی زیادی از ما میگیرد و به زودی دستهایمان خسته میشود. در بدن ما هم روزانه میلیونها واکنش انجام میشود که اگر کاتالیزور یا همان آنزیم وجود نداشت، انرژی زیادی مصرف میشود. به همین دلیل، مطالعه بیوشیمی آنزیم ها به ما کمک میکند سازوکار آنزیم را بهتر درک کنیم و از آنها در بخشهای دیگر مثل صنعت استفاده کنیم.
آنزیم چیست؟
آنزیمها کاتالیزگرهای زیستی هستند که سرعت واکنشهای شیمیایی درون بدن جاندار را افزایش میدهند، بدون آنکه در واکنش مصرف شوند. واکنشدهندهای که در واکنش آنزیمی وجود دارد، سوبسترا نامیده میشود. هر آنزیم برای انجام واکنش سوبسترا خاص خود را دارد. یعنی برای انجام هر واکنش آنزیمی به یک آنزیم خاص نیاز داریم.
اکثر آنزیمها از جنس پروتئین هستند. برخی از آنها برای انجام واکنش به بخش غیرپروتئینی به نام «کوفاکتور» (Cofactor) نیاز دارند. در این حالت آنزیمی که کوفاکتور آن در محیط نباشد غیرفعال میشود که به آن «آپوآنزیم» (Apoenzyme) میگوییم و وقتی کوفاکتور به آن متصل شود به آنزیم فعال یا «هولوآنزیم» (Holoenzyme) تبدیل میشود.
کوفاکتورها میتوانند از جنس مولکولهای آلی باشند که در این حالت «کوآنزیم» (ٰCoenzyme) شناخته میشوند یا اینکه از جنس یونهای فلزی باشند. گاهی اوقات کوفاکتور بسیار محکم به آنزیم متصل میشود و نمیتوان آن را بدون تخریب آنزیم از بین برد، در این حالت به آن «گروه پروستتیک» (Prosthetic Group) میگوییم.
ساختار آنزیم
آنزیمهای پروتئینی از اسیدهایآمینه ساخته شدهاند و همچون پروتئینها ساختار اول، دوم و سوم دارند.
ساختار اول: اسیدهایآمینه به شکل زنجیره با پیوند پپتیدی به یکدیگر متصل میشوند و ساختار اولیه آنزیم را تشکیل میدهند. به این زنجیره پلیپپتید میگویند که نحوه اتصال آمینواسیدهای آن توسط DNA کدگذاری شده است.
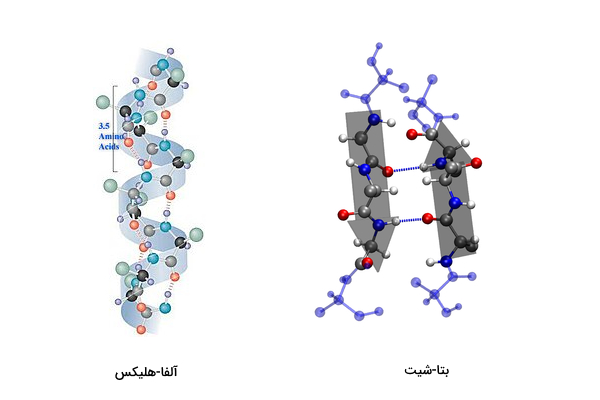
ساختار دوم: اتم هیدروژن در گروه آمین () و اتم اکسیژن گروه کربوکسیل (COOH) هر آمینواسید در ساختار پلیپپتید میتوانند به یکدیگر با پیوند هیدروژنی اتصال یابند. در این حالت پلیپپتید روی خود پیچ میخورد و ساختارهای «α-هلیکس» (α-helix) و «β-شیت» (β-sheet) را ایجاد میکند.
ساختار سوم: پس از اینکه ساختارهای دوم تشکیل شدند، زنجیره پلیپپتیدی بیشتر روی هم پیچ میخورد و ساختار سوم که شکل سه بعدی دارد را ایجاد میکند.
بیوشیمی آنزیم ها و انرژی فعال سازی
آنزیمها انرژی فعالسازی واکنش () را کاهش میدهند. انرژی فعالسازی، انرژی لازم برای شروع کردن واکنش است. آنزیمها با قرار دادن مولکولهای واکنش دهنده در وضعیت مناسب کنار هم این کار را انجام میدهند.
نکته مهم که در رابطه با انرژی فعالسازی و آنزیمها وجود دارد این است که آنزیمها تغییری در انرژی آزاد واکنش (اختلاف بین انرژی آزاد محصول و واکنشدهنده یا همان ) ایجاد نمیکنند. در واکنش آنزیمی انرژی آزاد گیبس ثابت است و فقط انرژی فعالسازی کاهش مییابد. تصویر زیر این مسئله را به خوبی نشان داده است.
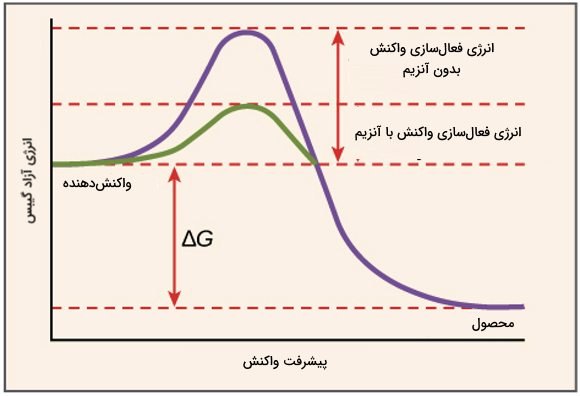
اگر به تصویر دقت کنید واکنشدهندهها برای اینکه وارد واکنش شوند ابتدا به حالت گذار میرسند. حالت گذار وضعیتی است که واکنشدهندهها انرژی زیادی دارند و ناپایدار هستند. رسیدن به حالت گذار برای انجام واکنش ضروری است و برای این کار به انرژی اولیه نیاز است. آنزیمها در این مرحله وارد میشوند و انرژی لازم برای رسیدن به حالت گذار را کاهش می دهند.
بیوشیمی آنزیم ها و جایگاه فعال
به بخشی از آنزیم که واکنشدهنده به آن متصل میشود، جایگاه فعال آنزیم میگویند. واکنشدهندهای که به آنزیم متصل میشود، سوبسترا آنزیم نام دارد.
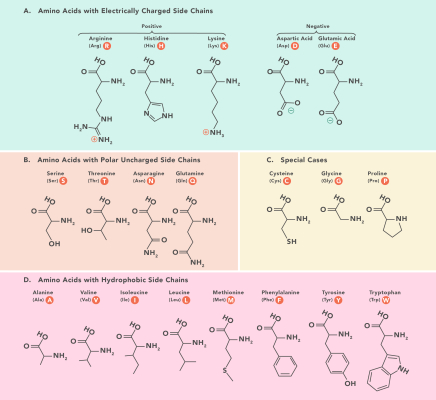
بیشتر آنزیمها پروتئینی هستند و از آمینواسید تشکیل شدهاند. پیچوتاب خوردن این آمینواسیدها شکل سه بعدی منحصربه فردی به آنزیم میدهد. آمینواسیدهایی که در جایگاه فعال آنزیم هستند، عملکرد و شکل جایگاه فعال را مشخص میکنند. برای مثال زنجیره جانبی آمینواسید میتواند اسیدی یا بازی، آبدوست یا آبگریز باشد. سوبسترا میتواند با پیوندهای غیرکووالانسی زیر به جایگاه فعال آنزیم متصل شوند.
- پیوند الکترواستاتیک: آمینواسیدهای موجود در بخش A تصویر زیر میتوانند با سوبسترایی که باز مخالف داشته باشد، پیوند الکترواستاتیک دهند.
- پیوند هیدروژنی: گروه آمید و کربوکسیل آمینواسید میتواند با سوبسترا پیوند هیدروژنی بدهند.
- پیوند واندروالس: آمینواسیدهای موجود در بخش B تصویر زیر میتوانند با سوبسترا پیوند واندروالسی میدهند.
- پیوند هیدروفوب یا آبگریز: آمینواسیدهای موجود در بخش D تصویر زیر میتوانند با سوبسترا پیوند هیدروفوب بدهند.
تقسیم بندی بر اساس بیوشیمی آنزیم ها
به طور سنتی برای نامگذاری آنزیمها از روشهای مختلفی استفاده میکنند. یکی از این روش ها استفاده از اسم سوبسترای آنزیم بهعلاوه آز (ase) در انتهای کلمه است. برای مثال فوماراز آنزیمی است که فومارات را به مالات کاتالیز میکند. روش دیگر استفاده از ماهیت آنزیمها برای نامگذاری است. برای مثال کاتالاز تجزیه هیدروژن پراکسید را انجام میدهد و اسم آن ربطی به سوبسترایش ندارد. البته استثناهایی هم وجود دارد برای مثال تریپسین آنزیمی است که نوعی پروتئین را تجزیه میکند.
با توجه به این که روش یکسانی برای نامگذاری آنزیمها وجود نداشت، دانشمندان در سال 1964 میلادی، سیستمی برای طبقه بندی آنزیمها ابداع کردند. این سیستم «عدد کمیسیون آنزیمها» (The Enzyme Commission Number | EC Number) نام دارد که به هر آنزیم یک کد چهار رقمی اختصاص میدهد. برای مثال آنزیمی با عدد EC 3.4.11.4 به صورت زیر تعریف میشود.
- عدد اول که در اینجا 3 است، کلاس اصلی آنزیم که «هیدرولاز» (Hydrolase) است را نشان میدهد.
- عدد دوم زیرگروه آنزیم را نشان میدهد. که در اینجا 4 به معنی پیوند پپتیدی است. یعنی آنزیم پپیوند پپتیدی را هیدرولیز میکند.
- عدد سوم زیر-زیرگروه را نشان میدهد. که در اینجا 11، محل برش آنزیم که پایانه N آمینواسید است را نشان میدهد.
- عدد چهارم نیز شماره سریال است. که در اینجا 4 به معنی برش دادن پایانه N آمینواسید از تریپپتید است.
همان طور که در مثال دیدیم، بر اساس این کد میتوان شیوه عملکرد یا بیوشیمی آنزیم ها را متوجه شد. بر اساس این سیستم آنزیمها به 7 کلاس اصلی تقسیم میشوند که در جدول زیر نشان داده شده است.
| EC.1 | اکسیدوردکتاز (Oxidoreductases) |
| EC.2 | ترنسفراز (Transferases) |
| EC.3 | هیدرولاز (Hydrolases) |
| EC.4 | لیاز (lyase) |
| EC.5 | ایزومراز (Isomerases) |
| EC.6 | لیگاز (ligases) |
| EC.7 | ترنسلوکاز (Translocase) |
تنظیم آنزیم
سلولهای بدن ما توانایی ساخت تعداد زیاد و متفاوتی از آنزیم را دارند. اما همه این آنزیمها همزمان با هم کار نمیکنند. سلول از مکانیسمهای متفاوتی برای تنظیم عملکرد آنزیمها استفاده میکند.
- مولکولهای تنظیم کننده (Regulatory Molecules): سلول مولکولهای مهارکننده و فعالکنندهای تولید میکند که با آن فعالیت آنزیم تنظیم میشود.
- کوفاکتور (Cofactors): بسیاری از آنزیمها فقط زمانی فعال میشوند که مولکولی غیر پروتئینی به نام کوفاکتور به آنها متصل شود. مثالی از این مولکولها یون روی، پتاسم و مس هستند.
- بستهبندی کردن (Compartmentalization): سلول برخی آنزیمها را تولید میکند و آنها را داخل بستهبندی نگهداری میکند. برای مثال، آنزیمهای لیزوزومی در اندامک لیزوزوم بستهبندی شدهاند که وارد سیتوپلاسم نشوند و سلول را هضم نکنند.
- مهار بازخوردی (Feedback inhibition): در این فرایند، محصول واکنش به عنوان مهار کننده عمل میکند و جلوی فعالیت آنزیم را میگیرد. برای مثال وقتی تعداد زیادی ATP در سلول وجود داشته باشد، آنزیمی که در تولید خود (ATP) نقش دارد را مهار میکند تا دیگر ATP تولید نشود.
دما (Temperature): دما میزان فعالیت آنزیمی را بالا میبرد. البته هر آنزیمی دمای خاصی را تحمل میکند و در آن بهترین عملکرد را دارد (دمای بهینه). دمای بالاتر از دمای بهینه شکل آنزیم را تغییر میدهد و سوبسترا نمیتواند به جایگاه فعال متصل شود. در فعالیت آنزیم کاهش مییابد و واکنش انجام نمیشود. - pH: زنجیره جانبی اسیدآمینههای موجود در جایگاه فعال میتوانند اسیدی، بازی یا خنثی باشند. اگر pH محیط آنها تغییر کند، این زنجیرهها هم تغییر میکنند و فعالیت آنزیم کم میشود.
مدلهای فعالیت آنزیم
تا اینجا فهمیدیم که آنزیمها با کاهش انرژی فعالسازی، سرعت واکنش شیمیایی را افزایش میدهند. اما آنزیمها با چه روشی این کار را میکنند؟ دانشمندان چندین مدل مختلف برای توضیح عملکرد آنزیمها ارائه کردهاند. دو مدل معروف در ادامه توضیح داده میشوند.
مدل قفل و کلید چیست؟
در سال 1894 میلادی، «امیل فیشر» (Emil Fischer) مدل قفل و کلید (lock and key) را ارائه داد. این مدل به شکل آنزیم و سوبسترا اشاره میکند و طبق آن آنزیم را قفل و سوبسترا را کلید در نظر میگیرد. به این معنی که شکل ساختاری سوبسترا مکمل شکل جایگاه فعال آنزیم است و با قرار گرفتن سوبسترا در جایگاه فعال آنزیم، بدون اینکه تغییری در شکل آنزیم یا سوبسترا ایجاد شود، سوبسترا تثبیت میشود.
یکی از مشکلاتی که این مدل دارد، در نظر نگرفتن حالت گذر سوبسترا است. در حالت گذر سوبسترا نه به واکنشدهنده و نه به محصول شباهت دارد. همچنین شکل آن نیز تغییر میکند. این نظریه تا 60 سال پذیرفته شده بود تا اینکه «دانیل کوشلند» (Dan Koshland) نظریه تناسب القایی را ارائه کرد.
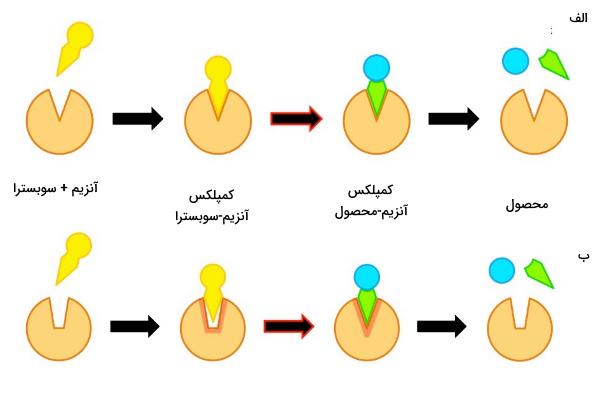
مدل تناسب القایی چیست؟
نظریه «تناسب القایی» (Induced Fit) آنزیم و سوبسترا را ساختاری انعطافپذیر در نظر میگیرد. این نظریه به این دلیل ارائه شد که شکل جایگاه فعال وقتی سوبسترا به آن متصل بود با وقتی که آنزیم فاقد سوبسترا بود، متفاوت بود. در این نظریه آنزیم را به دستکش (که نسبتا انعطاف پذیر است) و سوبسترا را به دست (انعطافپذیر) تشبیه میکنند که وقتی سوبسترا به آنزیم نزدیک شد شکل جایگاه فعال تغییر کند و مکمل سوبسترا شود. سه نکته مهم در رابطه با مدل تناسب القایی توسط کوشلند ارائه شد.
- برای فعالیت آنزیم، گروههای کاتالیکی باید در جهت درست قرار داشته باشند.
- تغییرات شکل سهبعدی بین آنزیم و سوبسترا ممکن است به دلیل سوبسترا به وجود آمده باشد.
- این تغییرات را فقط سوبسترای مکمل انجام میدهد و سوبسترای غیرمکمل نمیتواند این تغییر شکل را ایجاد کند.
جمعبندی
در این مقاله به تعریف بیوشیمی آنزیم ها و اهمیت آن پرداختیم. نقش آنزیم در واکنش را توضیح دادیم و متوجه شدیم که آنزیمها براساس عملکرد و نحوه اثر خود با 4 عدد نامگذاری میشوند. همچنین مدل تناسب القایی و قفل و کلید را که وضعیت آنزیم و سوبسترا در واکنش را مشخص میکنند، توضیح داده شد.












