نکات جدول تناوبی که باید بدانید؟ – به زبان ساده
جدول تناوبی عناصر، که بر روی برخی دیوارهای آزمایشگاهها، اتاقهای کنفرانس و کتابخانهها در سراسر جهان نمایان است و به عنوان ابزاری تسهیلگر در دنیای شیمی به کار میرود، چیدمان جدولیشکلی متشکل از ۱۱۸ عنصر شیمیایی شناسایی شده است که از بالا به پایین به صورت عمودی (ستون که در اصطلاح مربوط به جدول تناوبی گروه نامیده میشود) و از چپ به راست به صورت افقی (ردیف که در اصطلاح مربوط به جدول تناوبی دوره نامیده میشود)، حسب یک سری شاخصها در خانههای آن قرار داده شدهاند. داشتن تسلط علمی و عملی به نکات جدول تناوبی و به کارگیری اصولی آنها، ضمن ارائه مجموعه گستردهای از دادههای حیاتی پیرامون عناصر موجود در طبیعت، پیشبینی و تشخیصِ با سرعت و دقت قابل قبول خواص فیزیکی و شیمیایی آنها را تسهیل میکند. در مقاله حاضر از مجله فرادرس نگاهی اجمالی خواهیم داشت به نکات جدول تناوبی، از مسیر تکامل تا نحوه استفاده از آن در تعیین ویژگیهای عناصر.
- خواهید آموخت که گروهها و دورههای جدول تناوبی چگونه تعریف میشوند.
- نحوه دستهبندی عناصر بر اساس خواص فیزیکی و شیمیایی را میآموزید.
- یاد میگیرید اطلاعات جدول تناوبی را برای پیشبینی واکنشپذیری عناصر به کار ببرید.
- با نقش تعداد الکترونهای ظرفیت در رفتار شیمیایی و ترکیبی عناصر آشنا میشوید.
- میآموزید هر گروه اصلی چه ویژگیها و تفاوتهای مهمی دارند.
- نحوه شکلگیری روندهای دورهای مانند شعاع اتمی و انرژی یونش را یاد میگیرید.


مروری بر نکات جدول تناوبی عناصر
با علم بر لزوم یادگیری جدول تناوبی، میخواهیم مرور و بعضا تاملی داشته باشیم در جنبههای مختلف آن.
سازماندهی اساسی عناصر در جدول تناوبی
عناصر در جدول تناوبی بر مبنای معیارهای زیر طبقهبندی شدهاند:
- ساختار اتمی
- عدد اتمی
- خواص شیمیایی و فیزیکی
بر اساس معیارهای بالا، عناصر را به سه دسته اصلی که نماینده تمامی عناصر هستند، تقسیم میکنیم.
- فلزات
- نافلزات
- شبهفلزات
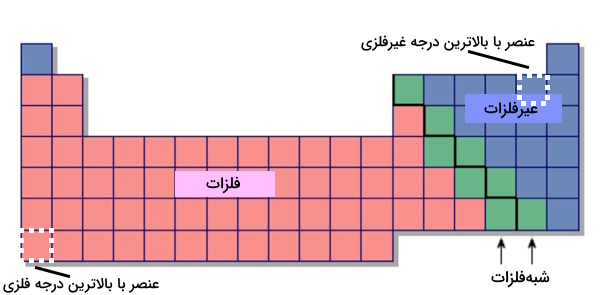
کاربرد جدول تناوبی عناصر
برای برجستهسازی نکات جدول تناوبی، به برخی از کاربردهای آن اشارهای داریم.
پیشبینی ویژگیهای عناصر
از جمله کاربردهای جدول تناوبی عناصر، پیشبینی برخی از ویژگیهای عناصر است از قبیل:
- رفتار شیمیایی عناصر
- روندها
- ویژگیهای عناصر
بررسی ساختار اتمی
از دیگر کاربردهای جدول تناوبی عناصر بررسی ساختار اتمی عناصر مختلف است، به این صورت که:
- اتمها از پروتون، الکترون و نوترون ساخته شدهاند.
- عناصر تنها اتمهای یک نوع هستند.
- عناصر با عدد اتمی (پروتون در هسته) شناسایی میشوند.
بررسی سطوح یا ترازهای انرژی
بررسی ترازهای انرژی، از دیگر کاربردهای جدول تناوبی محسوب میشود. الکترونها در ناحیهای در اطراف هسته قرار گرفتهاند که «ابر الکترونی» نامیده میشود، سطوح انرژی درون این ابر قرار دارند. بین ۱ تا ۷ سطح انرژی در اتمها وجود دارد. سطوح انرژی مقادیر خاصی از الکترونها را در خود نگه میدارد، به عنوان مثال سطح یک تا ۲، سطح دو تا ۸ الکترون و... .
شناسایی الکترونهای ظرفیت
الکترونهای بیرونیترین سطح را الکترونهای ظرفیتی مینامیم. الکترونهای ظرفیت، یکی از مهمترین نکات در جدول تناوبی و به دنبال آن در مبحث عناصر هستند، چراکه در تعیین انواع ویژگیهای عناصر نقشآفرینی میکنند. این الکترونها میزان واکنشپذیری را تعیین میکنند، این که چگونه عنصری با دیگر عناصر واکنش داده و تشکیل ترکیب میدهد. در بیشتر حالات، بیرونیترین سطح الکترونی به طور کامل با الکترون پر نمیشود، یعنی حالت نیمهپر دارد.
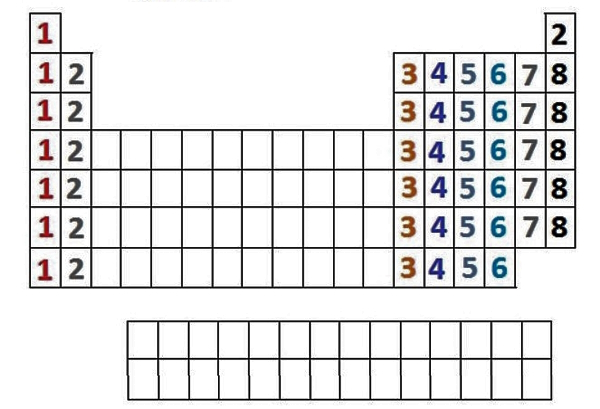
از طرف دیگر به دلیل داشتن ویژگیهای مشابه، در ستونهای عمودی گروهبندی میشوند که به آنها گروه یا خانواده میگوییم و ۱۸ گروه داریم که در قسمتهای بعدی بیشتر با آنها آشنا خواهیم شد، حال شماره گروهها میتوانند به ما در تعیین تعداد الکترونهای ظرفیت کمک کند، به این صورت که:
- گروه ۱: دارای ۱ الکترون ظرفیت
- گروه ۲: دارای ۲ الکترون ظرفیت
- گروههای ۳-۱۲: دارای ۱ یا ۲ الکترون ظرفیت
- گروههای ۱۳ تا ۱۸: ۱۰ عدد کمتر از تعداد گروه، الکترون ظرفیت دارند، به عنوان مثال: گروه ۱۳ دارای ۳ الکترون ظرفیتی، گروه ۱۵ دارای ۵ الکترون ظرفیت، گروه ۱۸، به جز He، دارای ۸ الکترون ظرفیتی است و... .
عناصر و واکنشپذیری
واکنشپذیری یک ویژگی شیمیایی است که تعیین میکند عنصری چگونه با دیگر عناصر واکنش نشان میدهد. حال میخواهیم بدانیم چه چیزی عنصری را واکنشپذیر میکند؟ از جمله نکات جدول تناوبی در راستای تعیین واکنشپذیری عناصر که لازم است به آنها توجه داشته باشیم، عبارتند از:
- تعداد الکترونهای ظرفیت هر اتم، به این صورت که وقتی سطوح بیرونی پر هستند، اتمها پایدار هستند، اما وقتی پر نیستند، واکنش نشان میدهند، به عنوان مثال ۱ یا ۲ الکترون به دست آورده، از دست داده یا به اشتراک میگذارند.
- واکنشپذیرترین فلزات عناصر گروه ۱ و ۲ هستند.
- گروههای ۱ و ۲ به راحتی الکترونهای ظرفیت خود را از دست میدهند تا یک ترکیب بسازند.
- عناصر گروه ۱ به طور معمول یک الکترون از دست میدهند، بنابراین بیرونیترین سطح انرژی آنها خالی است.
- عناصر گروه ۲ معمولا دو الکترون از دست میدهند، بنابراین سطح انرژی بیرونی آنها خالی است.
- واکنشپذیرترین نافلزات عناصر گروه ۱۶ و ۱۷ هستند.
- گروههای ۱۶ و ۱۷، برای تشکیل ترکیب، الکترون میگیرند.
- عناصر گروه ۱۶ برای پر کردن سطح انرژی بیرونی خود به دو الکترون دیگر نیاز دارند.
- عناصر گروه ۱۷ برای پر کردن سطح انرژی بیرونی خود به یک الکترون دیگر نیاز دارند.
گروههای جدول تناوبی
ستونهایی که در جدول تناوبی عناصر به صورت عمودی ،از بالا به پایین، حرکت میکنند، «گروه» نامیده میشوند. همانطور که پیشتر اشاره کردیم، عناصر در ۱۸ ستونِ عمودی مرتب شدهاند که نمایش بصری آنها را در تصویر زیر میبینیم.
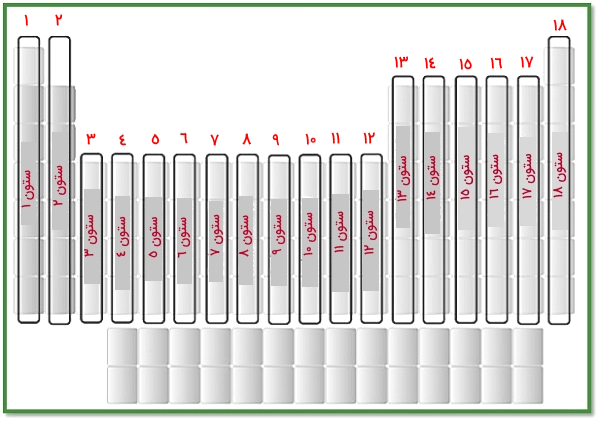
در جدول زیر گروههای موجود در جدول تناوبی عناصر را به همراه نامهای رایج و نام خانوادههای برخی از آنها میآوریم.
| شماره گروه / نام آیوپاک | نام متداول/ نام خانواده |
| گروه ۱ /IA | فلزات قلیایی / خانواده لیتیم |
| گروه ۲ / IIA | فلزات قلیایی خاکی/ خانواده بریلیم |
| گروههای ۳ تا ۱۲ - فلزات واسطه | |
| گروه ۳ / IIIB | خانواده اسکاندیم |
| گروه ۴ / IVB | خانواده تیتانیوم |
| گروه ۵ / VB | خانواده وانادیوم |
| گروه ۶ / VIB | خانواده کروم |
| گروه ۷ / VIIB | خانواده منگنز |
| گروه ۸ / VIIIB | خانواده آهن |
| گروه ۹ / VIIIB | خانواده کبالت |
| گروه ۱۰ / VIIIB | خانواده نیکل |
| گروه ۱۱ / IB | فلزات مسکوک (Coinage Metals)/ خانواده مس |
| گروه ۱۲ / IIB | فلزات فرار / خانواده روی |
| گروه ۱۳ / IIIA | فلزات خاکی/ خانواده بور |
| گروه ۱۴ / IVA |
تترل یا کریستالوژن (Tetrels Or Crystallogens) / خانواده کربن |
| گروه ۱۵ / VA |
پنتلها یا پنکتوژنها (Pentels Or Pnictogens) / خانواده نیتروژن |
| گروه ۱۶ / VIA | کالکوژنها / خانواده اکسیژن |
| گروه ۱۷ / VIIA | هالوژنها / خانواده فلوئور |
| گروه ۱۸ / VIIIA | گازهای نجیب (Noble gases)/ خانواده هلیوم، خانواده نئون |
در تصویر زیر نیز برخی از گروههای مهم با نام متداول آنها نمایش داده شده است.
ویژگیهای مشترک عناصر در گروهها
از جمله نکات جدول تناوبی در حیطه گروههای آن عبارتند از:
- گروهها در جدول تناوبی به صورت عمودی اجرا میشوند.
- گروهها از ۱ تا ۱۸ شمارهگذاری میشوند.
- عناصر در گروههای یکسان، دارای تعداد الکترونهای ظرفیت یکسانی هستند.
- عناصر در گروههای یکسان، رفتار شیمیایی مشابهی دارند.
گروه ۱: فلزات قلیایی
نخستین گروه جدول تناوبی، گروه فلزات قلیایی است که عناصر جایگرفته در این گروه را در تصویر میبینیم.
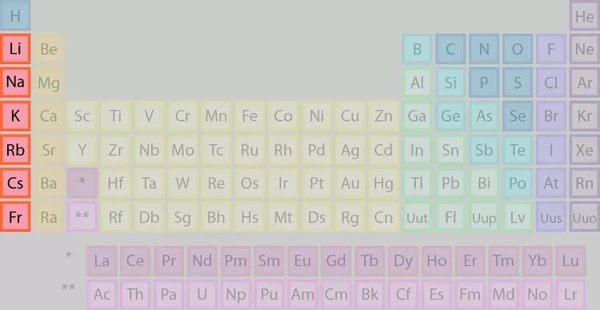
برخی از ویژگیهای عناصر گروه اول عبارتند از:
- عناصر فلزی
- مواد جامد نرم
- دارای ظاهر براق
- با چگالی کم
- دارای یک الکترون ظرفیت
- تمایل به از دستدادن الکترون ظرفیت
- بسیار واکنشپذیر، واکنشپذیرترین گروه در جدول تناوبی
- به راحتی با هالوژنها ترکیب میشوند.
گروه ۲: فلزات قلیایی خاکی
گروه دوم، گروه فلزات قلیایی خاکی است که عناصر جایگرفته در این گروه را در تصویر زیر میبینیم.
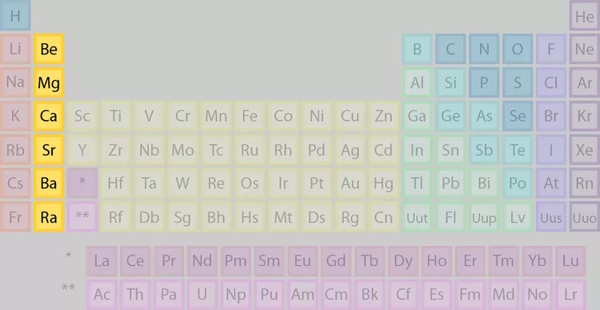
برخی از ویژگیهای عناصر گروه دوم عبارتند از:
- عناصر فلزی فراوان در کره زمین
- جامد
- نقرهای رنگ
- چگالتر از فلزات قلیایی
- دارای دو الکترون ظرفیت
- بسیار واکنشپذیر، اما دارای واکنشپذیری کمتر از فلزات قلیایی (گروه ۱).
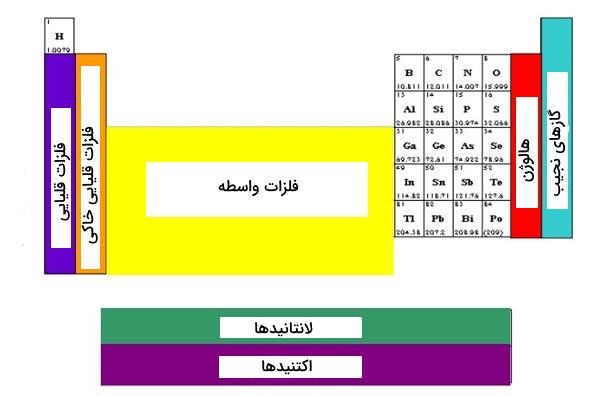
گروههای ۳-۱۲ فلزات واسطه
عناصر گروههای ۳ تا ۱۲ را با نام عناصر واسطه نیز میشناسیم. این طیف عناصر در تصویر نشان میبینیم.
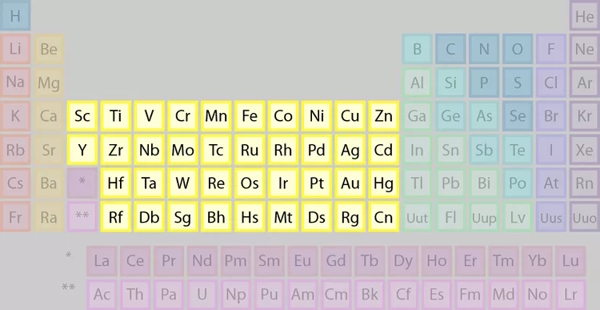
برخی از ویژگیهای عناصر واسطه عبارتند از:
- عناصری فلزی
- تراکم و چگالی بالاتر
- رسانای خوب گرما و الکتریسیته
- دارای یک یا دو الکترون ظرفیت
- واکنشپذیری کمتر نسبت به فلزات قلیایی و قلیایی خاکی
- برای موجودات زنده مهم هستند (به عنوان مثال مواد معدنی، آهن، روی، منگنز).
لانتانیدها و اکتینیدها - زیر جدول اصلی
در ادامه بررسی فلزات واسطه، ادامه آنها را که در زیر جدول اصلی، برای حفظ ظاهر جدول، قرار گرفتهاند، بررسی میکنیم.

برخی از ویژگیهای عناصر این گروهها عبارتند از:
- شامل لانتانیدها و اکتینیدها
- برای حفظ ظاهر بهتر جدول در این قسمت قرار داده شدهاند.
- لانتانیدها دارای اعداد اتمی ۵۷-۷۰ هستند.
- اکتینیدها دارای اعداد اتمی ۸۹-۱۰۲ هستند.
لانتانیدها
اگر به طور مشخص به لانتانیدها اشاره کنیم، عناصر ردیف بالا از دو ردیف مذکور را خواهیم داشت.
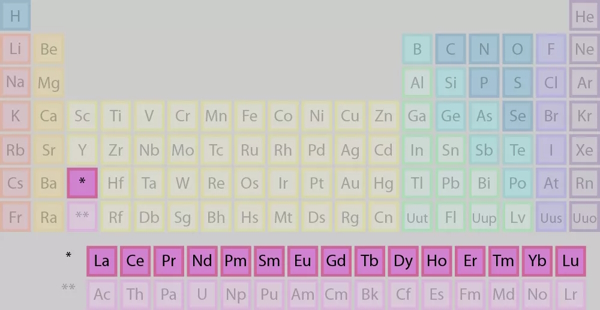
برخی از نکات مهم لانتانیدها عبارتند از:
- از عدد اتمی فلز واسطه لانتانیم، ۵۷، در دوره ۶ پیروی میکنند.
- دارای ۳ الکترون ظرفیت
- فلزات نقرهای نرم
- درخشندگی زیاد، اما به راحتی کدر میشود.
- رسانایی بالا برای الکتریسیته
- بسیار واکنشپذیر
اکتینیدها
در صحبت از اکتنیدها به طور مستقل، به عناصر ردیف پایین از دو ردیف اشاره میکنیم که در تصویر هم نشان دادهایم.
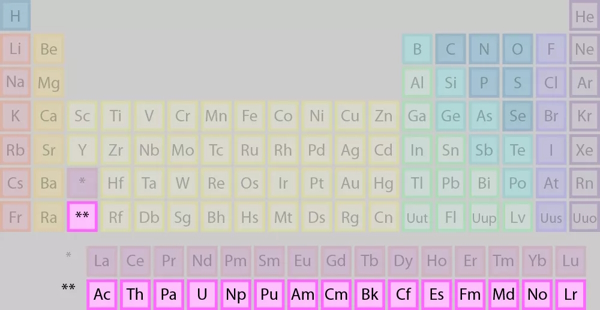
برخی از نکات اکتنیدها نیز عبارتند از:
- اکتینیدها از فلز واسطه اکتینیم با عدد اتمی ۸۹ در دوره ۷ پیروی میکنند.
- عناصری رادیواکتیو
- دارای ۳ تا ۶ الکترون ظرفیت
- ناپایدار به لحاظ واکنشپذیری
- بیشتر در آزمایشگاه ساخته میشود.
گروه ۱۳: گروه بور
عناصر گروه بور را که در تصویر میبینیم، شامل ترکیبی از فلزات و یک نافلز در صدر گروه است.
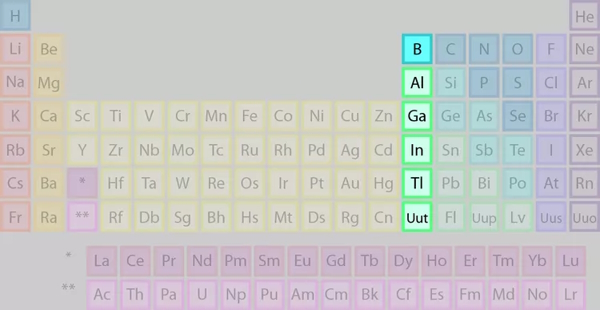
برخی از ویژگیهای عناصر این گروه عبارتند از:
- شامل ۱ شبهفلز و ۴ فلز
- جامد در دمای اتاق
- دارای ۳ الکترون ظرفیت
- واکنشپذیر
گروه ۱۴: گروه کربن
عناصر گروه چهاردهم را که با نام خانواده یا گروه کربن هم میشناسیم در تصویر میبینیم.
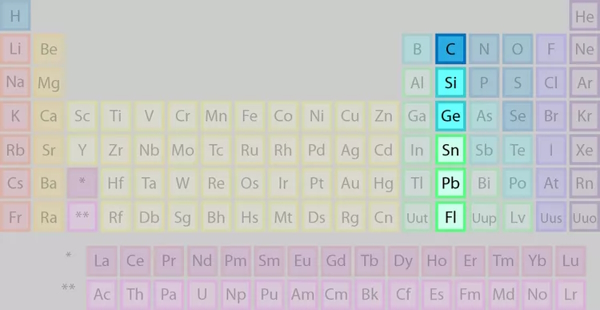
برخی از نکات عناصر گروه ۱۴ جدول تناوبی عبارتند از:
- شامل ۱ غیر فلز، ۲ شبهفلز و ۲ فلز
- جامد در دمای اتاق
- دارای ۴ الکترون ظرفیت
- به لحاظ واکنشپذیری متغیر
گروه ۱۵: گروه نیتروژن
در این قسمت میخواهیم به برخی از ویژگیهای عناصر گروه ۱۵ اشارهای داشته باشیم.
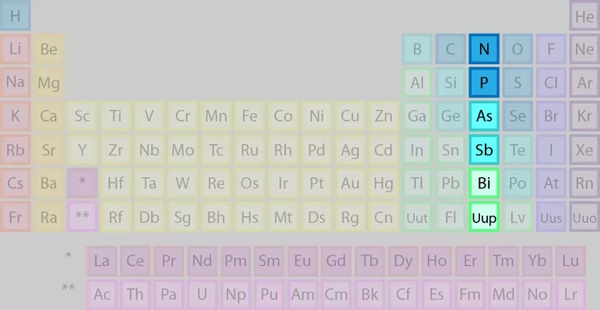
برخی از نکات جدول تناوبی در حیطه عناصر گروه ۱۵ عبارتند از:
- شامل ۲ غیرفلز، ۲ شبهفلز و ۱ فلز
- به جز N، بقیه در دمای اتاق جامد هستند.
- دارای ۵ الکترون ظرفیت
- به لحاظ واکنشپذیری متغیر
گروه ۱۶: گروه اکسیژن
گروه ۱۶ را با نام خانواده یا گروه اکسیژن میشناسیم. این گروه شامل سه طیف عناصر، فلز، غیرفلز، شبهفلز، میشود.
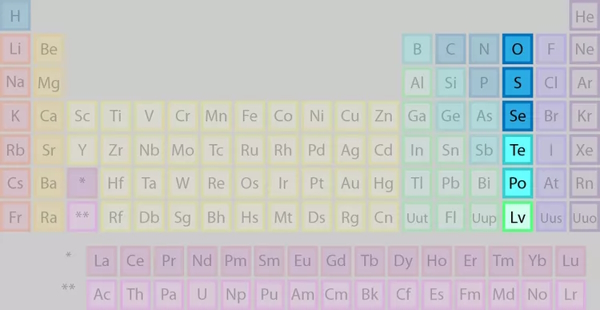
برخی از نکات برجسته جدول تناوبی در محدوده عناصر گروه ۱۶ عبارتند از:
- شامل ۳ غیر از، ۲ شبهفلز و یک فلز
- به جز O، بقیه در دمای اتاق جامد هستند.
- دارای ۶ الکترون ظرفیت
- واکنشپذیر
گروه ۱۷: هالوژنها
این گروه که معروف به هالوژنها هستند، شامل شش عنصر غیرفلزی به شرح تصویر زیر هستند.
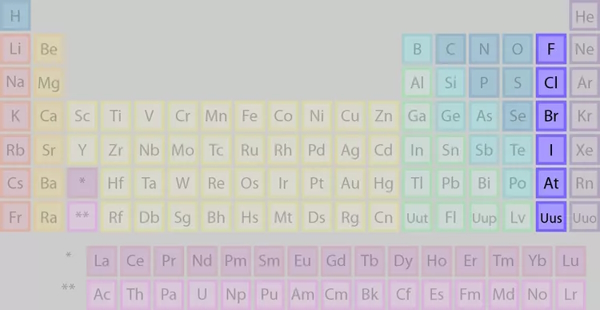
برخی از ویژگیهای عناصر گروه ۱۷ عبارتند از:
- عناصر غیرفلزی
- در طبیعت به فرم آزاد، ترکیب نشده، یافت نشدهاند.
- رسانای ضعیف جریان الکتریکی
- دارای ۷ الکترون ظرفیت
- بسیار واکنشپذیر
- نمکساز، واکنش شدید با فلزات قلیایی برای تشکیل نمک با پیوندهای یونی
گروه ۱۸: گازهای نجیب
عناصر این گروه که نام آنها معرف ماهیت آنها است را در تصویر میبینیم.
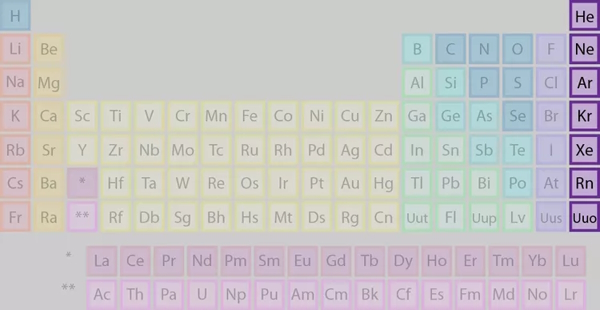
برخی از ویژگیهای عناصر گروه ۱۸ عبارتند از:
- عناصر غیرفلزی
- به فرم گاز در دمای اتاق
- همه آنها در اتمسفر یافت میشوند
- گازهای بی رنگ و بی بو در دمای اتاق
- دارای ۸ الکترون ظرفیت (۲ برای He)
- بیرونیترین سطح انرژی آنها پر است
- واکنشپذیری کم (به نسبت بیاثر یا غیرواکنشی)
- دارای کمترین واکنشپذیری در گروها
هیدروژن
جدا ایستادن عنصر معروف هیدروژن از سایر عناصر و گروههای جدول تناوبی به این علت است که ویژگیهای آن با هیچیک از گروهها مطابقت ندارد. از جمله ویژگیهای این عنصر میتوان به موارد زیر اشاره داشت:
- دارای ۱ الکترون ظرفیت
- بسیار واکنشپذیر، ۱ الکترون را به راحتی از دست میدهد.
- بیشتر شبیه به غیرفلزات تا فلزات.
دورههای جدول تناوبی
ردیفهایی که در جدول تناوبی عناصر بهصورت افقی قرار دارند دوره نامیده میشوند.
عناصر در هفت دوره در جدول تناوبی سازماندهی شدهاند. در تصویر زیر ردیفهای جدول تناوبی عناصر را میبینیم.

جدول زیر دورههای افقی موجود در جدول تناوبی عناصر را به همراه نمادهای عناصر شیمیایی و ویژگی مشترک در آنها نشان میدهد.
| دوره | عناصر |
| دوره ۱ | از قوانین دوتایی پیروی میکند. |
| دوره ۲ | دارای الکترون در هر دو اوربیتال s و p هستند. |
| دوره ۳ | دارای یک ایزوتوپ پایدار هستند. |
| دوره ۴ | عناصر بلوک d هستند. |
| دوره ۵ | همگی دارای ساختار کلی یکسان بوده و عنصر رادیواکتیو Tc نیز در این دوره قرار دارد. |
| دوره ۶ | عناصر بلوک f و عناصر واسطه داخلی. |
| دوره ۷ | همگی عناصر رادیواکتیو طبیعی هستند. |
ویژگیهای عناصر در دورههای جدول تناوبی
در اشاره به نکاتی از جدول تناوبی بر مبنای دورهها، میتوانیم به نکات زیر اشارهای داشته باشیم.
- دورهها به صورت افقی در سراسر جدول تناوبی اجرا میشوند.
- دورهها را در شمارههای ۱-۷ شمارهگذاری میکنیم.
- در بررسی خواص عناصر در دورهها، معیار حرکت را به طور معمول از چپ به راست در نظر میگیریم.
- هنگامیکه از دوره ۱ به دوره ۷ در جدول تناوبی حرکت میکنیم، متوجه افزایش قابل توجهی در تعداد اوربیتالها میشویم.
- عناصر موجود در یک دوره مشابه تعداد اوربیتالهای اتمی یکسانی دارند.
- همه عناصر در یک دوره دارای تعداد یکسانی سطوح انرژی یا همان لایههای الکترونی هستند، به عنوان مثال: دوره ۱ دارای ۱ سطح انرژی، دوره ۲ دارای ۲ سطح انرژی و دوره ۵ اتم دارای ۵ سطح انرژی است.
بلوکها یا دستههای عناصر در جدول تناوبی
تمامی عناصر شیمیایی جدول تناوبی عناصر، در چهار بلوک خاص طبقهبندی شدهاند که موقعیت بیرونیترین الکترون عنصر را در یک اوربیتال خاص توصیف میکنند و بر این اساس در چهار بلوک دستهبندی میشوند که به هریک از آنها میپردازیم.
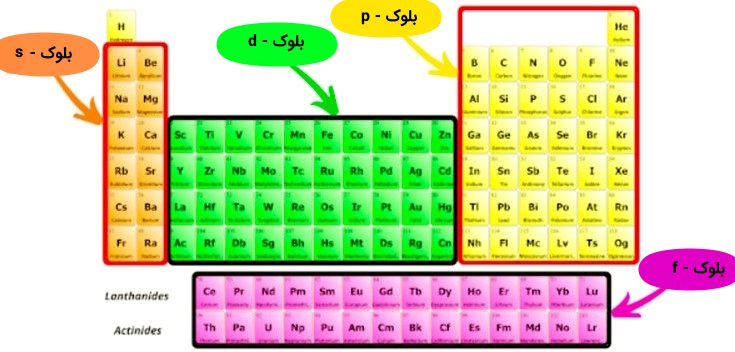
عناصر بلوک s
عناصر بلوک s، آن دسته از عناصری هستند که بیرونیترین الکترونهای آنها در اوربیتالهای s دارند. این عناصر نقطه ذوب پایینی دارند، الکترومثبتتر بوده و از نظر شیمیایی فعال و نرم هستند، مانند: فلزات قلیایی و فلزات قلیایی خاکی.
عناصر بلوک p
عناصر بلوک p آن دسته از عناصری هستند که بیرونیترین الکترونهای آنها در اوربیتالهای p دارند. این عناصر با اشتراک الکترونها، پیوندهای کووالانسی را تشکیل میدهند، مانند: کربن، اکسیژن و گوگرد.
عناصر بلوک d
عناصر بلوک d آن دسته از عناصری هستند که بیرونیترین الکترونهای آنها در اوربیتالهای d دارند. این عناصر تشکیل نمکهای رنگی میدهند و نقطه ذوب و جوش بالایی دارند، مانند: عناصر واسطه.
عناصر بلوک f
عناصر بلوک f آن دسته از عناصری هستند که بیرونیترین الکترونهای آنها در اوربیتالهای f دارند. این عناصر فلزاتی با نقطه ذوب بالا بوده و دارای چندین حالت اکسیداسیون هستند، مانند: لانتانیدها و اکتینیدها
روندهای دورهای عناصر جدول تناوبی
روندهای دورهای، الگوهای خاصی در جدول تناوبی هستند که جنبههای مختلف یک عنصر خاص را نشان میدهند. این روندها توسط شیمیدان روسی، دیمیتری مندلیف در سال ۱۸۶۳ کشف شدند. روندهای دورهای از تعیینکنندهترین نکات در جدول تناوبی در پیشبینی ویژگیهای عناصر هستند.
روندهای تناوبی اصلی که توسط عناصر در جدول تناوبی عناصر دنبال میشود بر اساس برخی از خواص عناصر شیمیایی است که در زیر مورد بحث قرار میگیرد.
- شعاع اتمی
- شعاع یونی
- الکترونخواهی
- انرژی یونیزاسیون
- الکترونگاتیوی
- ظرفیت
- ویژگیهای فلزی عناصر
- ویژگیهای غیرفلزی عناصر
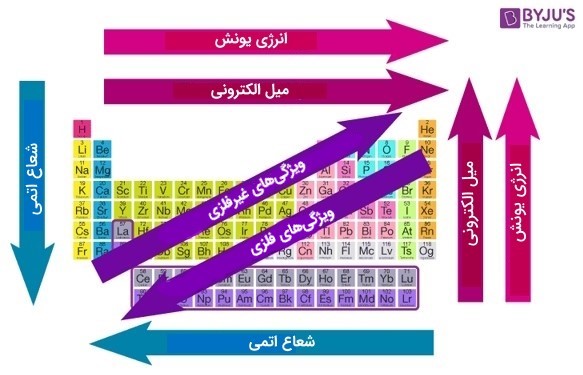
جدول زیر خلاصه ای از روندهای مهم دورهای در خواص عناصر مختلف است.
| ویژگی | در طول دوره - از چپ به راست | در گروه - از بالا به پایین |
| شعاع اتمی | کاهش | افزایش |
| تعداد الکترونهای ظرفیت | افزایش | ثابت میماند |
| ظرفیت | ابتدا افزایش، سپس کاهش | ثابت میماند |
| ویژگیهای فلزی | کاهش | افزایش |
| ویژگیهای غیرفلزی | افزایش | کاهش |
| واکنشپذیری | کاهش | افزایش بعد از گروه ۱۳ |
| نقطه ذوب | متغیر (روند کلی در فلزات: کاهش) | متغیر (روند کلی در فلزات: افزایش) |
| نقطه جوش | متغیر (روند کلی در فلزات: کاهش) | متغیر (روند کلی در فلزات: افزایش) |
| انرژی یونش | افزایش | کاهش |
| Electron Gain Enthalpy | افزایش | کاهش |
این روندها به دلیل آرایش الکترونیکی یکسان عناصر در گروهها یا دورههای مربوطه و به دلیل ماهیت دورهای عناصر وجود دارد، در واقع این روندها یک ارزیابی کیفی از خواص هر عنصر را ارائه میدهند. حال بیایید با جزئیات به آنها نگاه کنیم.
شعاع اتمی
فاصله بین مرکز هسته اتم و لایه ظرفیتی آن را شعاع اتمی میگویند.
روند شعاع اتمی در گروه
شعاع اتمی هنگامی که در یک گروه از بالا به پایین حرکت میکنیم افزایش مییابد.
علت: دو دلیل برای افزایش شعاع اتمی در سراسر گروه وجود دارد:
- افزایش تعداد پوستهها، الکترونها به سطوح انرژی بالاتری اضافه شده و از هسته دورتر میشوند که موجب افزایش شعاع اتمی میشود.
- افزایش بار هستهای
روند شعاع اتمی در دوره
با حرکت از چپ به راست در یک دوره، شعاع اتمی در جدول تناوبی به تدریج کاهش مییابد.
علت: با افزایش تعداد پروتونها در هسته، بار مثبت هستهای افزایش مییابد که موجب افزایش کشش الکترونها میشود.
استثنا: گازهای نجیب جزو استثناها در این زمینه است.
شعاع یونی
میدانیم که یون اتم یا گروههایی از اتمهایی است که بار مثبت یا منفی دارند. یک اتم از نظر الکتریکی خنثی است، یونهای مثبت و منفی با انتقال الکترونها بین اتمها تشکیل میشوند.
- اتمهای فلزات تمایل دارند با از دست دادن ۱ الکترون یا بیشتر از لایه ظرفیت خود، یونهای مثبت (کاتیون) تشکیل دهند، مانند اتم سدیم (Na) که تبدیل به یون سدیم (Na^{+}) میشود.
- اتمهای غیرفلزات تمایل دارند با به دست آوردن ۱ الکترون یا بیشتر، یونهای منفی (آنیون) تشکیل دهند، در نتیجه لایه ظرفیت خود را پر میکنند. مانند تبدیل اتم کلر (Cl) به یون کلر (Cl^{-}).
روند شعاع یونی
در رابطه با مقایسه شعاعهای یونی، اندازه یک یون در مقایسه با یون بعدی، همان الگوی شعاع اتمی برقرار است.
نیز لازم است نکات زیر را در حالت در جدول تناوبی کلی در نظر داشته باشیم:
- آنیونها دارای لایه ظرفیت کامل هستند و آنها از اتم خنثی خود بزرگتر هستند.
- کاتیونها دارای پوسته ظرفیت خالی هستند: آنها از اتم خنثی خود کوچکتر هستند.
انرژی یونش
انرژی یونش، انرژی لازم برای حذف الکترونهای بیرونی است که منجر به تشکیل یون مثبت میشود.
روند انرژی یونش در گروهها
انرژی یونیزاسیون با حرکت از بالا به پایین در یک گروه در جدول تناوبی کاهش مییابد.
علت: افزایش شعاع اتمی که موجب دورتر شدن الکترونها از هسته، و کشش مثبت آن، و سهولت حذف آنها میشود.
روند انرژی یونش در دورهها
انرژی یونیزاسیون با حرکت افقی از چپ به راست در یک ردیف افزایش مییابد.
علت: افزایش بار هستهای و کاهش شعاع اتمی که موجب کشش بیشتر در الکترونها و سختتر شدن حذف آنها و نیاز به انرژی بیشتر میشود.
الکترونگاتیویی
نکته مهم دیگری از جدول تناوبی که لازم است به آن اشاره داشته باشیم، الکترونگاتیوی است. الکترونگاتیوی توانایی یک اتم برای جذب جفتالکترونهای ناپیوندی به سمت خود برای تشکیل پیوند شیمیایی با اتم دیگر، به بیان دیگر تمایل یک اتم برای جذب الکترون اتم دیگر.
روند الکترونگاتیوی در گروه
با حرکت از بالا به پایین در یک دوره، الکترونگاتیوی کاهش مییابد.
علت: سطوح انرژی بالاتر به این معنی است که الکترونها از هسته دورتر هستند و فاصله بیشتر به معنی کاهش جاذبه و کاهش الکترونگاتیوی است.
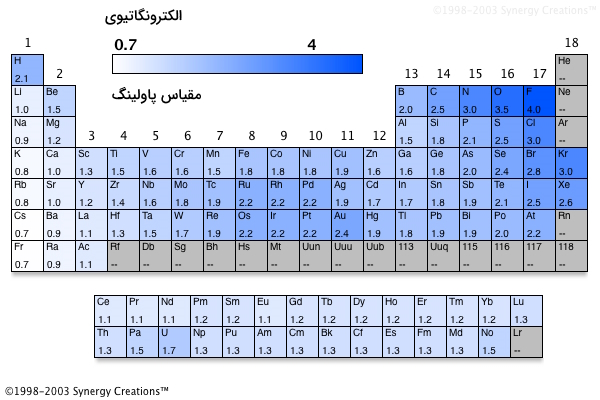
روند الکترونگاتیوی در دوره
با حرکت از چپ به راست در یک دوره، الکترونگاتیوی افزایش مییابد، البته گازهای نجیب از این قاعده مستثنی هستند.
علت: بار هستهای افزایش مییابد و با افزایش بار هستهای، ویژگی «الکتروندوستی» (Electron-Loving Character) افزایش مییابد. شعاع اتمی در حال کاهش و با مقایسه الکترونگاتیوی عناصر مشاهده میکنیم الکترونگاتیوی افزایش مییابد.
الکترونخواهی
به مقدار انرژی لازم برای افزودن یک الکترون به اتم، الکترونخواهی میگوییم. روند الکترونخواهی در گروه و دوره به قرار زیر است:
- با حرکت از بالا به پایین در یک گروه، الکترونخواهی کاهش مییابد.
- با حرکت از چپ به راست در یک دوره، الکترونخواهی افزایش مییابد که علت آن، این است که بار هستهای افزایش اما شعاع اتمی کاهش مییابد.
ویژگی فلزی عناصر
این مورد را در توصیف ویژگیهای منتسب به فلزات مورد استفاده قرار میدهیم و روند آن در دورهها و گروههای جدول به شرح زیر است:
- با حرکت از چپ به راست در طول دوره، ویژگی فلزی عناصر شیمیایی کاهش مییابد.
- با حرکت از بالا به پایین در یک گروه، ویژگی فلزی عناصر شیمیایی افزایش مییابد.
ویژگیهای غیرفلزی عناصر
این مورد را نیز در توصیف ویژگیهای منتسب به غیرفلزات مورد استفاده قرار میدهیم که روند آن در دورهها و گروههای جدول به شرح زیر است:
- با حرکت از بالا به پایین در یک گروه، ویژگی غیرفلزی عناصر شیمیایی کاهش مییابد.
- با حرکت از چپ به راست در طول دوره، ویژگی غیرفلزی عناصر شیمیایی افزایش مییابد.
ظرفیت (Valency)
ظرفیت یک اتم توانایی آن در ترکیب شدن است و روند آن در دورهها و گروههای جدول به شرح زیر است:
- هیچ تغییری در ظرفیت بین اعضای یک گروه وجود ندارد. ظرفیت عناصر از همان گروهها یکسان است.
- با حرکت از چپ به راست در یک دوره در جدول تناوبی، ظرفیت در ابتدا افزایش، سپس کاهش مییابد.
واکنشپذیری عناصر
واکنشپذیری فلزات با ماهیت الکتروپوزیتیوی آنها تعیین میشود، در نتیجه، هرچه یک عنصر فلزیتر باشد، الکتروپوزیتیو تر و واکنشپذیرتر است.
روند دورهها در فلزات و نافلزات
روندهای فلزات و نافلزات را میتوان در فهرست زیر مشخص کرد.
- در محدوده فلزات، همانطور که ویژگی فلزی از چپ به راست کاهش مییابد، واکنشپذیری نیز کاهش مییابد.
- واکنشپذیری نافلزات با حرکت از چپ به راست در طول زمان افزایش مییابد.
در نتیجه، میتوانیم نتیجه بگیریم که:
- تا گروه سیزدهم، با حرکت از چپ به راست در یک دوره، واکنشپذیری عناصر به طور پیوسته کاهش مییابد و از آنجا شروع به افزایش میکند.
نقطه ذوب
نقطه ذوب که به عنوان نقطه شروع تبدیل جامد به مایع تعریف میشود، مقدار انرژی کل لازم برای تبدیل یک جامد به مایع است.
روند تغییرات نقطه ذوب در گروهها
- با حرکت از بالا به پایین در گروهها، نقطه ذوب کاهش مییابد.
علت: چون پیوند بین اتمهای عناصر قوی باشد، برای شکستن پیوند انرژی زیادی لازم است.
- نقطه ذوب در غیرفلزات از بالا به پایین جدول تناوبی افزایش مییابد.
نقطه جوش عناصر
نقطه جوش را نقطهای تعریف میکنیم که فشار بخاز مایع، با فشار خارجی (گاز اطراف) برابر شود. البته پیشتر نیز اطلاعات مناسبی پیرامون «نقطه جوش» در مجله فرادرس ارائه شده است.
روند تغییرات نقطه جوش در گروهها
- نقطه جوش فلزات به تدریج از بالا به پایین در یک گروه کاهش مییابد.
- در حالی که دمای جوش نافلزات از بالا به پایین در یک گروه جدول تناوبی افزایش مییابد.
نگاهی بر تاریخچه جدول تناوبی
بعد از طرح نکاتی از جدول تناوبی از جنبههای علمی، میخواهی نگاهی گذرا بر تاریخچه آن داشته باشیم.
دیمیتری مندلیف (Dmitri Mendeleev)، اواسط دهه ۱۸۰۰، از دو ابزار اساسی برای طبقهبندی عناصر استفاده کرده و موفق شد عناصر شیمیایی را به طور منسجم بر اساس این دو معیار مرتب کند که عبارتند از:
- وزن اتمی نسبی (مقدار پروتون و نوترون همراه با وزن الکترون)،
- تعداد الکترونهای ظرفیت (تعداد الکترونهای موجود در آخرین لایه الکترونی)
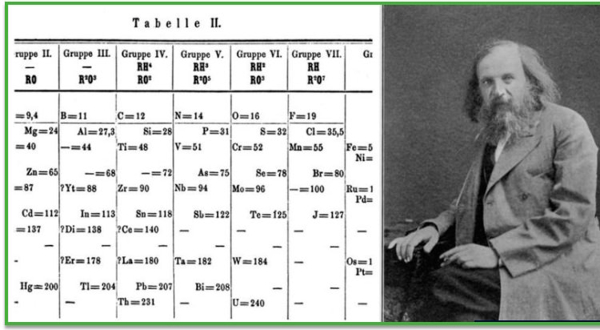
شکاف بین عناصر در جدول تناوبی عناصر مندلیف
دلیل احتمالی تعریف این فضاها، پیشبینی مندلیف درباره عناصر ناشناخته در آن زمان بود. این پیشبینی، پس از پانزده سال، زمانی که سه عنصر جدید کشف شده و در این محلهای بین عناصر در جدول قرار گرفت، به طور شگفتانگیزی درست در آمد.
«سیستم تناوبی مندلیف» را به دلیل چیدمان عناصر شیمیایی در آن به شکل ردیفهای افقی و ستونهای عمودی که در مجموع تشکیل یک جدول را میدهند، «جدول تناوبی عناصر» مینامیم.
تکامل جدول تناوبی عناصر
دانشمندان زیادی علاوه بر آقای مندلیف به عنوان پیشرو، در راستای این جدول و تکامل روال های دورهای آن کار کردهاند، برخی از آنها عبارتند از:
- «آنتوان لاووازیه» (Antoine Lavoisier)، فلزات و غیرفلزات را گروهبندی کرد.
- «یوهان ولفگانگ دوبراینر» (Johann Wolfang Döbereiner)، به شباهت هایی در خواص فیزیکی و شیمیایی عناصر پی برد و اصطلاح «سه گانه» (Triads) را معرفی کرد.
- «جان نیولندز» (John Newlands)، قانون اکتاوها (Introduced law of octaves) را معرفی کرد.
- «هنری موزلی» (Henry Moseley)، از اشعه ایکس برای اندازهگیری طول موج هر عنصر استفاده کرد و عناصر را بر اساس اعداد اتمی بازآرایی کرد.
تصاویری از این دانشمندان فاخر را در تصیر زیر میبینیم.

جدول تناوبی عناصر مدرن
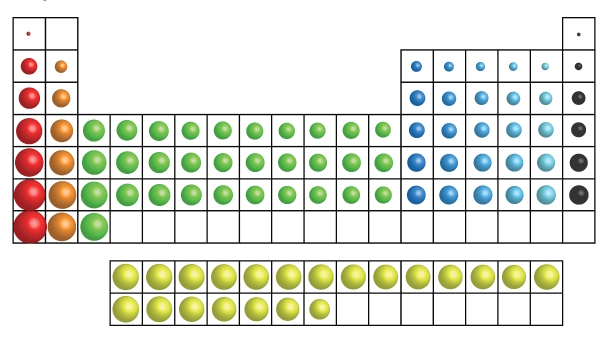
عناصر در جدول تناوبی عناصر مدرن، بر اساس قانون «دورهای یا تناوب» (Periodicity) که نشاندهنده الگوهای تکرارشونده در خواص است و عدد اتمی عناصر مرتب شدهاند.
تفاوتهای جدول تناوبی عناصر قدیمی و مدرن
جدول تناوبی عناصر مدرن دارای ویژگیهای منحصر به فردی است که سیستم تناوبی مندلیف فاقد آنهاست که برخی از آنها عبارتند از:
- در سیستم تناوبی مدرن، عناصر به طور یکنواختی بر اساس افزایش اعداد اتمی مرتب شدهاند. در جدول تناوبی مندلیف، عناصر بر اساس وزن اتمی چیده شده بودند و در بین آنها فواصلی برای عناصر ناشناخته در نظر گرفته شده بود،
- جدول تناوبی عناصر مدرن، بر اساس ۱۱۸ عنصر شیمیایی است، در حالی که جدول تناوبی مندلیف شامل حدود ۷۰ عنصر است،
- از بارزترین پیشرفتهای جدول تناوبی مدرن، تعریف دسته، بلوک یا گروههای جداگانه برای گازهای نجیب و عناصر واسطه است.
نمایش بصری جدول تناوبی مدرن با ۱۱۸ عنصر همراه با عناصر انتقال جداگانه و گروههای گازهای نوبل در زیر نشان داده شده است.
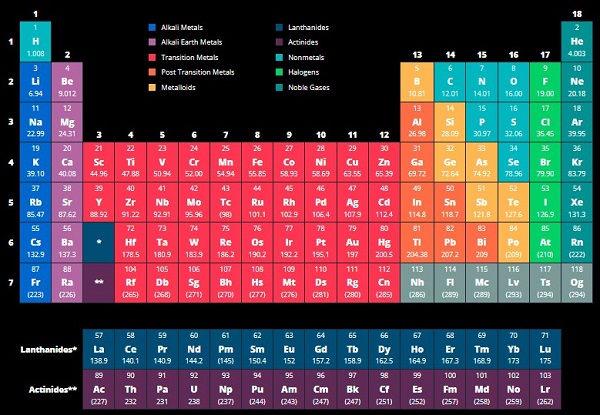
جمعبندی
در این مطلب از مجله فرادرس مروری داشتیم بر برخی از نکات مهم و اساسی در جدول تناوبی عناصر، ازجمله روندهای تناوبی در ویژگیهایی مانند شعاع اتمی، الکترونگاتیوی، واکنشپذیری و ... . در کنار بررسی یک به یک این موارد وارتباط بین آنها، به عنوان مثال ارتباط الکترونهای ظرفیت با واکنشپذیری، شعاع اتمی با الکترونگاتیوی که موجب سهولت در یادگیری عمیقتر و یادآوری دقیقتر موارد میشود، نگاهی به برخی نکات مهم در تاریخچه شکلگیری و تکامل این جدول نیز داشتیم.
آزمون نکات جدول تناوبی
۱. کدام گزینه توصیف مناسبی از نحوه چینش عناصر در جدول تناوبی ارائه میدهد؟
عناصر به ترتیب وزن اتمی کاهشیابنده چیده شدهاند.
عناصر فقط بر اساس نام شیمیایی خود مرتب شدهاند.
عناصر بر اساس خواص فیزیکی به صورت تصادفی قرار گرفتهاند.
عناصر بر اساس عدد اتمی و ویژگی اتمی سازماندهی شدهاند.
در جدول تناوبی عناصر بر اساس عدد اتمی (تعداد پروتون) و ویژگیهای ساختاری، به شکل منظم قرار میگیرند که این ترتیب امکان پیشبینی خواص شیمیایی و فیزیکی را میدهد.
۲. کدام ویژگی باعث تفاوت عناصر در گروهها و دورههای جدول تناوبی میشود و اهمیت آن در چیست؟
نوع پیوندهای شیمیایی که عنصر ایجاد میکند.
تعداد کل ایزوتوپهای پایدار عنصر
تعداد پروتونهای هسته هر عنصر
تعداد الکترونهای ظرفیت عنصر
تفاوت عناصر در گروهها و دورههای جدول تناوبی ناشی از «تعداد الکترونهای ظرفیت عنصر» است، زیرا عناصر داخل یک گروه الکترونهای ظرفیت مشابه دارند و به همین دلیل رفتار شیمیایی مشترک نشان میدهند. عناصر در هر دوره نیز با افزایش تعداد الکترون ظرفیت و ساختار انرژیشان، خواص ویژه خود را پیدا میکنند.
۳. کدام معیارها برای تقسیمبندی عناصر به فلزات، نافلزات و شبهفلزات در جدول تناوبی نقش کلیدی دارند و چه ویژگی، گروه شبهفلزات را از دو گروه دیگر متمایز میکند؟
رنگ ظاهری عنصر. شبهفلزات عموما بیرنگ و بیاثر هستند.
صرفا موقعیت عناصر در گروههای عمودی. شبهفلزات فقط در گروه شانزدهم قرار دارند.
درجه رسانایی حرارتی. نافلزات اساسا نرمالاند و شبهفلزات فقط جامدند.
ترکیب ساختار اتمی، عدد اتمی و خواص شیمیایی. شبهفلزات نقش پل بین فلزات و نافلزات را دارند.
عناصر جدول تناوبی بر اساس ساختار اتمی، عدد اتمی و ویژگیهای شیمیایی و فیزیکی به فلزات، نافلزات و شبهفلزات تقسیم میشوند. شبهفلزات نقش پل میان فلزات و نافلزات دارند و برخی خواص هر دو گروه را نشان میدهند.
۴. عدد اتمی و ساختار اتمی چگونه جایگاه یک عنصر را در جدول تناوبی تعیین میکنند؟
عدد اتمی فقط نام عنصر را مشخص میکند و بر جایگاه تاثیر ندارد.
ساختار اتمی تعیینکننده جایگاه افقی (دوره)، عدد اتمی تعیینکننده جایگاه عمودی (گروه) است.
افزایش عدد اتمی عناصر را به ترتیب خاص در جدول میچیند و ساختار اتمی به همین ترتیب تغییر میکند.
عدد اتمی و ساختار اتمی فقط برای تقسیم عناصر به فلز و نافلز به کار میروند.
در جدول تناوبی، جایگاه عناصر بر اساس افزایش عدد اتمی آنها تعیین میشود و ساختار اتمی نیز به تناسب عدد اتمی تغییر میکند. یعنی هر عنصر با عدد اتمی منحصر به خود، در جایگاه مشخصی قرار میگیرد و ساختار اتمی (تعداد پروتون، نوترون و الکترون) متناسب با این جایگاه است.
۵. برای اینکه بتوانیم واکنشپذیری یک عنصر را با توجه به تعداد الکترونهای ظرفیت و جایگاهش در جدول تناوبی پیشبینی کنیم، باید کدام معیارها را در نظر بگیریم؟
نوع بلوک عنصر (s یا p یا d یا f) و عدد اتمی
فقط شعاع اتمی عنصر و دوره افقی آن در جدول
تعداد الکترون ظرفیت و گروه عمودی عنصر در جدول تناوبی
مقدار عدد اتمی و جایگاه آن در گروههای فلزات واسطه
پیشبینی نوع واکنشپذیری عناصر به بررسی «تعداد الکترون ظرفیت و گروه عمودی عنصر در جدول تناوبی» وابسته است، زیرا الکترونهای بیرونی و گروه عمودی رابطه مستقیم با رفتار شیمیایی دارند. مواردی مانند «شعاع اتمی و دوره» یا «عدد اتمی و نوع بلوک» نقش اول را ایفا نمیکنند و فقط بر برخی ویژگیهای دیگر تاثیرگذارند. تنها با توجه به موقعیت عنصر در گروه و تعداد الکترونهای ظرفیت میتوان ویژگی واکنشپذیری را دقیقتر ارزیابی کرد.
۶. عنصری که در گروه ۱۷ جدول تناوبی قرار دارد با توجه به تعداد الکترونهای ظرفیت و جایگاهش نسبت به فلزات گروه ۱، چه نوع رفتاری در واکنش شیمیایی نشان میدهد؟
به کندی و بدون تغییر الکترون واکنش میدهد.
تمایل به از دست دادن سریع الکترون دارد.
در واکنشها تقریبا بیاثر است و ترکیب ایجاد نمیکند.
الکترون بدست میآورد و واکنشپذیری بالایی دارد.
عنصرهای موجود در گروه ۱۷ یا هالوژنها، به دلیل داشتن هفت الکترون ظرفیت و موقعیتشان در جدول، تمایل شدید به جذب یک الکترون دیگر برای تکمیل لایه بیرونی خود دارند و همین ویژگی باعث واکنشپذیری بالای آنها میشود. در مقابل، فلزات گروه ۱ معمولا الکترون از دست میدهند، اما هالوژنها با گرفتن الکترون رفتار میکنند.
۷. برای پیشبینی ویژگیهایی مانند نقطه جوش یا شعاع اتمی یک عنصر در جدول تناوبی، کدام داده یا روند بیشتر اهمیت دارد؟
تنها شمارش پروتون و وزن اتمی عنصر
موقعیت عنصر در دوره یا گروه و روندهای تناوبی
نام شیمیایی عنصر و تاریخ کشف آن
تنها بررسی حالت فیزیکی عنصر در دمای معمول
موقعیت هر عنصر در دوره یا گروه جدول تناوبی و توجه به روندهای تناوبی مانند تغییر شعاع اتمی یا نقطه جوش در طول دورهها و گروهها امکان پیشبینی دقیقتر ویژگیهای آن را فراهم میکند. اطلاعاتی مانند نام عنصر، تاریخ کشف یا صرفا شمارش پروتون و وزن اتمی به تنهایی برای پیشبینی این ویژگیها کافی نیستند. همچنین صرف بررسی حالت فیزیکی در دمای معمول دلیل کافی برای تعیین روند نقطه جوش یا شعاع اتمی نیست.
۸. بلوکهای s، p، d و f جدول تناوبی بر اساس چه معیاری شکل میگیرند و چه ویژگی منحصربهفردی به عناصر هر بلوک میبخشند؟
تقسیمبندی بر پایه آرایش بیرونیترین الکترون و تشخیص خواص فیزیکی خاص
جای موقعیت عنصر در گروه یا دوره و شباهت انرژی یونش
نام خانواده عناصر و قابلیت تشکیل ترکیبات مشابه
ساختار اتمی کلی عناصر و مشارکت در واکنشهای شیمیایی
تقسیمبندی بلوکهای s، p، d و f براساس مکان قرارگیری بیرونیترین الکترون در اوربیتال (orbital) مرتبط است که موجب ایجاد ویژگیهای فیزیکی خاص مانند نرمی، فعالیت شیمیایی یا دمای ذوب بالا نزد هر بلوک میشود.
۹. کدام مورد تفاوت اساسی میان جدول اولیه مندلیف و جدول تناوبی مدرن از نظر مبنای طبقهبندی و جایگاه گروهها و گازهای نجیب است؟
جدول مدرن عناصر را فقط براساس وزن اتمی مرتب میکند و گازهای نجیب گروه ویژه ندارند.
در جدول مدرن، بلورشناسی مهمترین معیار گروهبندی قرار گرفته است.
در جدول مدرن ترتیب عناصر بر پایه عدد اتمی است و گازهای نجیب گروه مستقل دارند.
در جدول مندلیف، عناصر با گروههای افقی دستهبندی شده و گازهای نجیب جدا نیستند.
جدول تناوبی مدرن عناصر را بر اساس عدد اتمی مرتب میکند و برای گازهای نجیب یک گروه مستقل در نظر گرفته شده است، برخلاف جدول اولیه مندلیف که بر پایه وزن اتمی بود و گازهای نجیب را جدا نکرده بود.
۱۰. چرا عناصر یک گروه عمودی جدول تناوبی رفتار شیمیایی مشابهی نشان میدهند؟
چون همه عناصر گروهها فلز یا نافلز هستند.
چون موقعیت نسبی عناصر در دورهها تفاوت ندارد.
زیرا همه عناصر جدول عدد اتمی یکسان دارند.
زیرا تعداد الکترونهای ظرفیت آنها مساوی است.
عناصر یک گروه عمودی در جدول تناوبی به دلیل داشتن تعداد برابر الکترونهای ظرفیت، رفتار شیمیایی مشابه دارند. عدد اتمی، نوع فلز یا نافلز بودن و موقعیت در دورهها علت این شباهت نیست.
۱۱. در جدول تناوبی، هنگام حرکت به راست در یک دوره و پایین آمدن در یک گروه، انرژی یونش و شعاع اتمی چگونه تغییر میکنند و دلیل اصلی این روند چیست؟
انرژی یونش کاهش و شعاع اتمی کاهش مییابد؛ به علت افزایش جاذبه هستهای.
انرژی یونش افزایش و شعاع اتمی کاهش مییابد؛ دلیل آن افزایش بار هستهای و کوچک شدن اندازه اتم است.
انرژی یونش و شعاع اتمی هر دو افزایش مییابند؛ بهخاطر افزایش جاذبه هستهای.
انرژی یونش کاهش و شعاع اتمی افزایش مییابد؛ چون الکترونها به هسته نزدیکتر میشوند.
با حرکت به راست در یک دوره، بار هستهای افزایش مییابد، الکترونها به هسته نزدیکتر میشوند، بنابراین انرژی یونش افزایش و شعاع اتمی کاهش مییابد. این روند ناشی از جاذبه قویتر هسته بر الکترونهاست.













مندلیف از الکترون و پروتونو عدد اتمی و جرم اتمی و لایه های الکترونی اطلاع نداشت
ملاک های او برای تنظیم جدول خود چه بود؟
هیدرژن بر اساس چه ملاک های از طرف او در گروه اول گذاشته شد؟
یادمان باشد الکترون و پروتون بعد از تنظیم جدول مندلیف کشف شدند و اینکه جدول بر اساس عدد اتمی و لایه ای الکترونی تنظیم شده است صحیح نیست.
البته بعدها معلوم شد که تنظیمات او با افزایش عدد اتمی و لایه ای الکترونی مطابقت دارد!
با سلام؛
مندلیف جدول تناوبی را قبل از کشف الکترون، پروتون و عدد اتمی تدوین کرد و عناصر را بر اساس جرم اتمی نسبی و شباهت خواص شیمیایی مرتب نمود. به همین دلیل هیدروژن در گروه اول قرار گرفت، چون رفتار شیمیایی آن تا حدی شبیه فلزات قلیایی بود. اگرچه جدول او بر اساس عدد اتمی نبود، بعدها مشخص شد که ترتیب عناصر با افزایش عدد اتمی و توزیع الکترونی هماهنگ است.
با تشکر از همراهی شما با مجله فرادرس
عالی بود دمتون گرم شب امتحان به دادم رسیدین خدا پشت و پناهتون
با سلام ؛
از همراهی و بازخورد مثبت شما سپاسگزاریم.
مثل همیشه مطالب عالی و به روز…
عنصر استاتین چه حالتی داره؟ تعدادی از منابع گفتن فلزه، تعدادی هم گفتن شبه فلزه. ممنون میشم راهنماییم کنین
سلام و وقت بخیر خدمت شما؛
عنصر استاتین در ستون هالوژنها قرار دارد و به عنوان سنگینترین هالوژن موجود در طبیعت شناخته میشود. این عنصر بسیار پرتوزا است و به همین علت حضور آن به صورت طبیعی بسیار نادر است. با این حال از ویژگیهای فیزیکی این عنصر به رنگ سیاه آن و ظاهری براق اشاره شده که میتواند از ویژگیهای فلزات یا شبه فلزات شناخته شود. رفتار این عنصر از نظر شیمیایی بیشتر شبیه به عنصر ید است.
خواص فلزی و شبه فلزی به دلیل ناپایدار بودن استاتین نمیتواند بررسی شود به همین دلیل نظرات مختلفی درباره خواص فلزی یا شبه فلزی آن وجود دارد.
از همراهی شما با مجله فرادرس سپاسگزاریم.