مکانیسم واکنش شیمیایی – به زبان ساده
در علم شیمی، مکانیسم واکنش شیمیایی به انجام مرحله به مرحله «واکنشهای ابتدایی» (Elementary Reactions) میگویند که در نهایت موجب یک تغییر شیمیایی میشود. مکانیسم واکنش شیمیایی روشی برای توصیف جزییات هر مرحله از یک واکنش شیمیایی به شمار میآید. یک واکنش موازنه شده شیمیایی، مواد واکنشدهنده و فرآورده را به خوبی نشان میدهد اما بیان نمیکند که این واکنش چطور انجام میشود. در حقیقت، مکانیسم واکنش شیمیایی بیانگر مسیر و نحوه انجام یک فرآیند شیمیایی است.


مقدمهای بر مکانسیم واکنش شیمیایی
یک واکنش شیمیایی به طور معمول طی چند مرحله به انجام میرسد. به طور مثال، مکانیسم واکنش شیمیایی در تجزیه اوزون، شامل دو مرحله زیر است:
$$\begin {array} \text{O} _ 3 ( g ) \rightarrow \text { O } _ 2 (g) \; + \; \text {O} \\[0.5em] \text { O } \;+\;\text {O} _ 3(g) \rightarrow 2 \text { O } _ 2(g) \end{array}$$
تعریف واکنش شیمیایی ابتدایی
هر مرحله بالا در یک مکانیسیم واکنش شیمیایی را با عنوان واکنش ابتدایی میشناسیم. در تعریف واکنش ابتدایی باید گفت که این نوع از فرآیندها، به واکنشهایی گفته میشوند که نتوان آنها را به مراحل کوچکتر تقسیم کرد و به همان شکل که رخ میدهند، آنها را مینویسیم.
در نهایت، این نوع از واکنشها با یکدیگر جمع میشوند که در خصوص واکنش تجزیه اوزون، واکنش کلی به صورت زیر خواهد بود:
مواد واسط و نقش آنها در واکنش
توجه داشته باشید که اکسیژن تولیدی در مرحله اول مکانیسم، در مرحله دوم به مصرف میرسد و به همین دلیل، به عنوان فرآورده در واکنش کلی دیده نمیشود. به موادی که در یک مرحله به تولید و در مرحله بعد به مصرف میرسند، مواد «واسط» (Intermediates) میگویند. واکنش کلی در تجزیه اوزون نشان میدهد که دو مولکول اوزون در اثر واکنش، به سه مولکول اکسیژن تبدیل میشوند اما مکانیسم واکنش شیمیایی در تجزیه اوزون، نشاندهنده برخورد و واکنش دو مولکول اوزون نیست. در حقیقت، در این واکنش تجزیه، یک مولکول اوزون، به یک مولکول اکسیژن و یک اتم اکسیژن به صورت ماده واسط تبدیل میشود. در ادامه، این اتم اکسیژن با مولکول دوم از اوزون وارد واکنش میشود تا دو مولکول اکسیژن به تولید برسند.

واکنشهای ابتدایی تک مولکولی
لازم به ذکر است که «مولکولاریته» (Molecularity) در یک واکنش ابتدایی به تعداد ذرات واکنشدهنده (اتم، مولکول یا یون) آن میگویند. به طور مثال، یک واکنش «تکمولکولی» (Unimolecular)، شامل واکنش یک ذره و تبدیل آن به یک یا چند مولکول از فرآورده است. این نوع از واکنش را در زیر مشاهده میکنید:
برای چنین واکنشی، سرعت واکنش را میتوان به شکل زیر تعریف کرد:
یک واکنش تکمولکولی ممکن است شامل یکی از چندین واکنش ابتدایی در یک مکانیسم پیچیده باشد. به طور مثال، واکنش زیر را در نظر بگیرید:
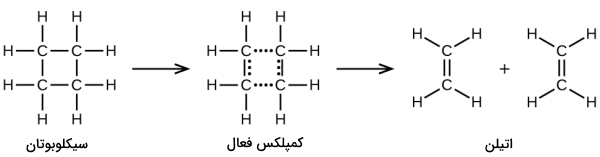
همانطور که پیشتر نیز گفته شد، واکنش بالا بیانگر یک واکنش تکمولکولی و بخشی از یک مکانیسم دو مرحلهای است. البته، برخی از واکنشها میتوانند تنها شامل یک واکنش به عنوان مکانیسم واکنش شیمیایی باشند. به عبارت دیگر، یک واکنش ابتدایی در برخی شرایط میتواند در نقش یک واکنش کلی ظاهر شود. از جمله این واکنشها میتوان به تجزیه سیکلوبوتان به اتیلن اشاره کرد که یک واکنش تکمولکولی و یک مرحلهای است:
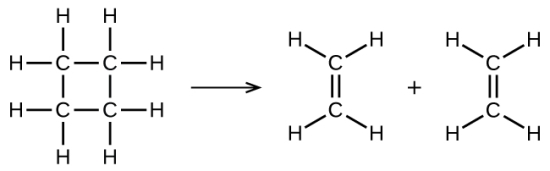
برای اینکه چنین واکنشهایی به انجام برسند، تنها نیاز داریم تا مولکول واکنشدهنده، به فرآورده تقسیم شود. البته پیوندهای شیمیایی در طی یک واکنش، به سادگی از بین نمیروند و این کار نیاز به انرژی دارد. به طور مثال، انرژی اکتیواسیون برای تجزیه ، برابر با 261 کیلوژول به ازای هر مول است. این امر بدان معنی است که برای انجام واکنش هر مول از این مولکولها و تبدیل کمپلکس فعال آنها به فرآورده، به 261 کیلوژول انرژی نیاز داریم.
رابطه سرعت واکنش و غلظت
در یک نمونه سیکلوبوتان، تعداد کمی از مولکولها با یکدیگر برخورد میکنند که موجب جذب انرژی و انجام واکنش برای تولید اتیلن میشوند. در حقیقت، یک برخورد با انرژی مناسب نیاز داریم تا مولکول سیکلوبوتان به یک کمپلکس فعال تبدیل شود اما تنها کسر کوچکی از مولکولهای گاز، با سرعت، انرژی جنبشی و جهت مناسب با یکدیگر برخورد میکنند تا این شرایط فراهم شود. بنابراین، در هر لحظه از زمان، تنها مولکولهای کمی، انرژی لازم برای برخورد را کسب میکنند.
توجه داشته باشید که سرعت تجزیه سیکلو بوتان به طور مستقیم با غلظت آن متناسب است. دو برابر کردن غلظت سیکلوبوتان در یک نمونه، تعداد دو برابر مولکول را در هر لیتر بدست میدهد. با وجود ثبات کسری از مولکولها با برخورد مناسب، تعداد مولکولهای فرآورده نیز دو برابر میشود. در نتیجه، سرعت واکنش نیز به میزان دو برابر افزایش پیدا میکند. سرعت این واکنش را با رابطه زیر نشان میدهند:
مشابه رابطه بالا، برای تمامی واکنشهای ابتدایی تکمولکولی برقرار است. در حقیقت، سرعت واکنش، ارتباط مستقیمی با غلظت واکنشدهندهها دارد و این نوع از واکنشها، رفتاری همچون واکنشهای مرتبه اول دارند.
واکنشهای ابتدایی دو مولکولی
در یک واکنش ابتدایی، برخورد و ترکیب دو مولکول یا اتم برای تشکیل کمپلکس فعال را «واکنش دو مولکولی» (Bimolecular Reaction) میگویند. این واکنشها بر دو نوع و به شکل زیر هستند:
برای واکنش نوع اول که دو مولکول متفاوت در واکنشدهندهها داریم، قانون سرعت برای A و B از مرتبه اول است:
در نوع دوم از واکنش که دو مولکول مشابه با یکدیگر برخورد میکنند، قانون سرعت از مرتبه نوع دوم است و به شکل زیر نوشته میشود:
برخی از واکنشها شامل مکانیسم واکنش شیمیایی به صورت دو مولکولی هستند که نمونهای از آنرا میتوان واکنش دیاکسید نیتروژن با مونو اکسید کربن دانست:
نوع دیگر این واکنش، تجزیه دو مولکول هیدروژن یدید و تولید هیدروژن و ید طبق واکنش زیر است:
در تصویر زیر، مکانسیم واکنش شیمیایی محتمل را برای تفکیک هیدروژن یدید و تولید هیدروژن و ید، مشاهده میکنید:
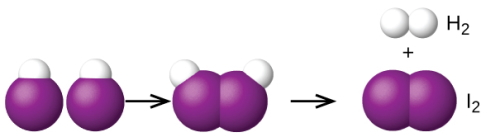
مکانیسم واکنش شیمیایی چند مرحلهای را نیز میتوان در واکنشهای دو مولکولی، به شکل زیر مشاهده کرد:
واکنشهای ابتدایی سه مولکولی
یک واکنش سه مولکولی، شامل برخورد همزمان سه مولکول، اتم یا یون است. این نوع از واکنشها به طور معمول، کمتر اتفاق میافتند چراکه احتمال برخورد سه مولکول همزمان، بسیار کمتر از احتمال برخورد دو مولکول است. به هر حال، واکنشهای ابتدایی سه مولکولی کمی وجود دارند که از آنجمله میتوان به واکنش نیتریک اکسید با اکسیژن اشاره کرد:
به طور مشابه، واکنش نیتریک اکسید با کلر را نیز میتوان از جمله واکنشهای سه مولکولی دانست.
ارتباط مکانیسم واکنش شیمیایی با قانون سرعت
به طور معمول در واکنشهای چندمرحلهای، یکی از مراحل به طور ویژهای سرعت کمتری نسبت به بقیه دارد. با توجه به این مطلب، در مییابیم که مرحلهای که کمترین سرعت را دارد، به عنوان محدود کننده سرعت واکنش شناخته میشود. به این مرحله، مرحله محدود کننده سرعت یا تعیین کننده سرعت میگویند.
برای درک بهتر این مفهوم، میتوان به حرکت گلهای از گاوها در تصویر زیر اشاره کرد. در حقیقت، تا زمانی که اولین حیوان در گله، حرکت نکند، حیوانات دیگر توانایی حرکت نخواهند داشت. به همین دلیل، این حیوان نقش محدود کننده یا تعیین کننده سرعت را دارد.

همانطور که پیشتر نیز اشاره شد، به طور مستقیم میتوان معادله سرعت را در واکنشهای ابتدایی از طریق واکنش شیمیایی بدست آورد. البته این مورد را در بسیاری از واکنشهای معمول شیمیایی نمیتوان در نظر گرفت. به طور معمول، یک واکنش موازنه شده بیانگر تغییر کلی در یک سیستم شیمیایی است که در بیشتر موارد، این تغییر، حاصل مکانیسمهای چندمرحلهای است. در هر واکنش باید معادله کلی سرعت را به کمک دادههای آزمایشگاهی تعیین و به کمک آن و سایر دادهها، مکانیسم واکنش شیمیایی را مشخص کنیم. به عنوان مثال، واکنش دیاکسید نیتروژن و را در نظر بگیرید.
در دمای بالاتر از ۲۲۵ درجه سانتیگراد، معادله سرعت به صورت زیر خواهد بود:
این واکنش از نوع مرتبه اول به شمار میآید. در واکنشهای تک مولکولی یک مرحلهای، چنین مکانیسمی را میتوان محتمل دانست. در دماهای پایینتر از 225 درجه سانتیگراد، واکنش از نوع مرتبه دوم و معادله آن به شکل زیر خواهد بود:
این واکنش از دو مرحله به شکل زیر تشکیل شده است که مرحله اول آن، آهسته و مرحله دوم آن سریع انجام میشود. بنابراین، مرحله اول، تعیینکننده سرعت خواهد بود:
به طور کلی، زمانی که مرحله تعیینکننده سرعت، مرحله اول باشد، معادله سرعت برای واکنش کل، همان معادله سرعت در مرحله اول است. اما در صورتی که مراحل واکنش، شامل واکنش تعادلی نیز باشند، تعیین معادله سرعت برای واکنش کلی، قدری پیچیده خواهد بود.
اگر یک واکنش ابتدایی در هر دو جهت با سرعت یکسان پیشروی کند، در حال تعادل است. واکنش دیمر شدن به را در نظر بگیرید. ثابت سرعت در واکنش رفت با نماد و در واکنش برگشت با نماد نشان داده شده است. اگر سرعت رفت را مساوی با سرعت برگشت در نظر بگیریم، خواهیم داشت:
اگر یک ماده واسط در مکانسیم واکنش شیمیایی باشد، رابطه زیر را میتوان برای بیان غلظت بر اساس معادله کلی سرعت بکار برد.
لازم به ذکر است که مواد واسط را نمیتوان در رابطه سرعت جای داد، گرچه میتوان در واکنش ابتدایی یک مکانیسم، از این روابط استفاده کرد. مثال زیر نشان میدهد که چگونه رابطه کلی سرعت را از مکانیسم واکنش شیمیایی شامل مراحل تعادلی همراه با مرحله تعیینکننده سرعت، محاسبه کرد.
مثال برای تعیین رابطه کلی سرعت
نیتریل کلرید با فرمول طی واکنشی به دیاکسید نیتروژن و گاز کلر تجزیه میشود. مکانیسم واکنش شیمیایی چنین واکنشی در سه مرحله به شکل زیر است. مرحله اول، مرحلهای سریع با ثابت سرعت در مرحله رفت و در واکنش برگشت خواهد بود. مرحله دوم نیز مرحلهای سریع است که ثابتهای سرعت را در آن با و نشان میدهند. مرحله سوم اما سرعت آهسته دارد که ثابت سرعت آن با بیان میشود.
به کمک مکانسیمهای ارائه شده، واکنش کلی را مشخص کنید. همچنین، رابطه سرعت را برای هر واکنش بنویسید. علاوه بر این، مواد واسط را مشخص کنید و معادله کلی سرعت را نشان دهید.
برای اینکه واکنش کلی را مشخص کنید کافی است که هر سه مرحله را با یکدیگر جمع و واسطها را از دو طرف معادلات حذف کنید. بنابراین، واکنش کلی به صورت زیر خواهد بود:
در مرحله بعد، رابطه سرعت را برای هر مرحله بنویسید. توجه داشته باشید که در واکنشهای ابتدایی که بخشی از مکانیسم هستند، رابطه سرعت را میتوان به کمک ضرایب استوکیومتری نوشت:
$$\begin {array} {r @{{} = {}} l } k _ 1 [\text {NO} _ 2 \text { C l } ] _ 2 & k _ { - 1 } [\text {ClO} _ 2 ] [\text { N } _ 2 \text {O} ][\text{ClO}] \\[0.5em] k _ 2 [\text {N} _ 2\text {O} ] [\text {ClO} _ 2 ] & k _ { - 2 } [\text {NO} _ 2 ] [\text {NOCl} ] \\[0.5em] \text {Rate} & k _ 3 [\text {NOCl} ] [ \text {ClO} ] \end{array}$$
مرحله سوم، که سرعت آهستهای دارد، به عنوان مرحله تعیینکننده سرعت شناخته میشود. بنابراین، معادله کلی سرعت را میتوان به صورت زیر نوشت:
البته هر دو ماده و ، ماده واسط به شمار میآیند. برای حذف این مواد واسط میتوان از روابط جبری متناسب با آنها به شکل زیر استفاده کرد. با استفاده از واکنش ابتدایی ۱ خواهیم داشت:
به کمک واکنش ابتدایی ۲ نیز داریم:
حال با جایگذاری این روابط در رابطه اصلی سرعت و سادهسازی آن خواهیم داشت:
توجه داشته باشید که این رابطه بدست آمده، نسبت عکس با غلظت یکی از فرآوردهها دارد. این امر، مطابق با وجود یک مرحله تعادلی در مکانسیم واکنش شیمیایی است.

مثال برای تعیین مواد واسط
اتم کلر در اتمسفر، طبق معادلات زیر با اوزون واکنش میدهد. ثابت سرعت برای این دو واکنش را به ترتیب با و نشان میدهیم. همانند مثال قبل، واکنش کلی و مواد واسط را تعیین کنید و رابطه اصلی سرعت را بنویسید.
روش حل، مانند مثال قبل خواهد بود. واکنش کلی به صورت زیر است:
ماده واسط در این مثال، است. همچنین، رابطه کلی برای سرعت به شکل زیر خواهد بود:
رابطه کلی سرعت
جمعبندی
در این آموزش، در خصوص مکانیسم واکنش شیمیایی صحبت کردیم و دانستیم که توالی مراحل مختلف در یک واکنش یا به عبارت دیگر، انجام واکنشهای ابتدایی به صورت مرحله به مرحله در طول یک واکنش شیمیایی را مکانسیم واکنش شیمیایی میگویند. دانستیم که سرعت کلی واکنش توسط آهستهترین مرحله محدود (تعیین) میشود. یاد گرفتیم که رابطه سرعت برای واکنشهای ابتدایی تک مرحلهای از نوع مرتبه اول است در حالیکه واکنشهای ابتدایی دو مولکولی، رابطه سرعت از نوع مرتبه دوم دارند. میزان محتمل بودن رابطه یا نادرست بودن آن با مقایسه روابط سرعت بدست آمده از مکانیسم واکنش شیمیایی با روابط آزمایشگاهی، بررسی میشود.
اگر این مطلب برای شما مفید بوده است، آموزشها و مطالب زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای مهندسی شیمی
- آموزش شیمی عمومی
- حجم مولی — به زبان ساده
- تبدیل واحد فشار — به زبان ساده
- جدول تناوبی — از صفر تا صد
^^












