ساختار لوویس و نحوه رسم آن – به زبان ساده
مواد یونی به طور کامل توسط پیوندهای یونی در کنار یکدیگر قرار گرفتهاند. بارهای الکتریکی هر یون سبب بروز برهمکنشهای الکترواستاتیک و در نهایت تشکیل یک شبکه بلوری میشوند. نوع آرایش یونها با ساختار مواد مولکولی تفاوت دارد. برای نمایش مولکولهای مختلف میتوان از ساختار لوویس استفاده کرد. همچنین ساختار لوویس در تعیین شکل مولکول با استفاده از نظریه «وسپر» (VSEPR) بسیار موثر است. در این مطلب از مجله فرادرس میآموزیم ساختار لوویس چیست و چگونه پیوندهای شیمیایی را مشخص میکند.
- میآموزید ساختار لوویس چیست و چگونه رسم میشود.
- با پیوندهای کووالانسی یگانه و نمایش آنها آشنا میشوید.
- میتوانید تفاوت پیوندهای دوگانه و سهگانه را تشخیص دهید.
- یاد میگیرید چگونه ساختار لوویس ترکیبات را رسم کنید.
- با ساختارهای جایگزین مواد آشنا میشوید.
- مثالهایی از رسم ساختار لوویس مواد را بررسی میکنید.


ساختار لوویس چیست؟
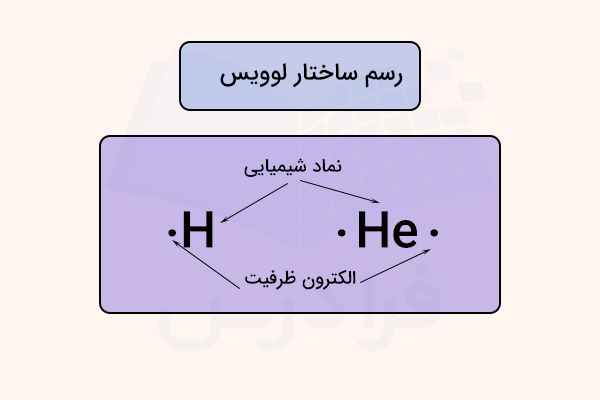
ساختا لوییس (نمایش الکترون - نقطه) نوعی از نمایش اتمها به همراه تعداد الکترونهای ظرفیت آن ها برای بررسی نوع و تعداد پیوندهایی است که می توانند تشکیل دهند. در این ساختمار، نماد شیمیایی ماده نوشته شده و تعداد الکترونهای ظرفیت آن به صورت نقطههایی در ۴ طرف آن (به صورت تکی و جفت نسبت به تعداد) نوشته میشود.
الکترونهایی که یک پیوند کووالانسی را تشکیل میدهند به یک اتم تنها تعلق ندارند بلکه بین دو اتم در یک پیوند به اشتراک گذاشته شدهاند. مفهوم پیوند کووالانسی در سال 1916 توسط شیمیدان آمریکایی، «گیلبرت نیوتون لوویس» (Gilbert Newton Lewis) ارائه شد. او پیشنهاد کرد که اشتراک الکترونها یکی از راههایی است که اتمها به کمک آن میتوانند به آرایش اکتت لایه ظرفیت دست پیدا کنند. این ایده بعدها توسط لاینس پاولینگ توسعه داده شد. این دانشمند علاوه بر کسب جایزه نوبل در سال 1954، مطالعاتی بر روی پیوندهای شیمیایی و همچنین الکترونگاتیوی انجام داده بود.
پیوند کووالانسی یگانه
سادهترین پیوند کووالانسی بین دو اتم هیدروژن به وقوع میپیوندد. هر اتم هیدروژن یک الکترون دارد و با گرفتن یک الکترون دیگر، لایه بیرونی خود را تکمیل میکند. «مولکول هیدروژن» ، شامل دو اتم هیدروژن است که هرکدام الکترون ظرفیت خود را به اشتراک گذاشتهاند.
هیدروژن همچنین میتواند پیوندهای کووالانسی را با دیگر اتمها تشکیل دهد. به طور مثال، هیدروژن و کلر هر کدام برای رسیدن به آرایش گاز نجیب، تنها به یک الکترون نیاز دارند. در نتیجه با به اشتراک گذاشتن الکترون لایه ظرفیت خود، مولکول پایدار را تشکیل میدهند.
نمایش پیوندهای کووالانسی
برای نمایش پیوندهای کووالانسی میتوان از یک شکل ساده موسوم به «ساختار لوویس» (Lewis Structure) استفاده کنیم. این ساختار را با نامهای دیگری همچون «دیاگرام لوویس» (Lewis Diagram) یا «ساختار الکتروننقطهای لوویس» (Lewis Electron dot Structure) هم میشناسند. در ساختار لوویس، هر نقطه بیانگر یک الکترون لایه ظرفیت در ترکیب است. به طور مثال را میتوان به شکل نشان داد.
همانطور که گفته شد، هر نقطه نشاندهنده یک الکترون لایه ظرفیت خواهد بود و به این دلیل در میان دو اتم نوشته میشود چون این الکترونها توسط پیوند کووالانسی، بین دو اتم به اشتراک گذاشته شدهاند. برای مولکولهای بزرگتر، رسم تمامی الکترونهای لایه ظرفیت دشوار خواهد بود. در نتیجه جفت الکترونهای پیوندی را میتوان با یک خط نشان داد. بنابراین، را میتوان به صورت نشان داد. اگر بخواهیم ساختار لوییس مولکول را نشان بدهیم، به صورت زیر خواهد بود:

در این تصویر مشاهده میکنیم که پیوند کووالانسی بین اتم هیدروژن و کلر شامل دو الکترون است. هیدروژن در لایه خارجی خود دارای دو الکترون و کلر در لایه خارجی خود هشت الکترون دارند. به همین صورت میتوان برای پیوندهای کووالانسی هیدروژن با دیگر هالوژنها نیز ساختاری مشابه تصویر بالا رسم کرد. برای سایر مولکولهایی که تشکیل پیوند کووالانسی میدهند، ساختارهای لوییس مشابهی میتوان رسم کرد.
بسیاری از ترکیباتی که شامل اکسیژن، نیتروژن، کربن، گوگرد و فسفر هستند به کمک پیوندهای کووالانسی در کنار یکدیگر نگهداشته شدهاند. به طور کلی تعداد پیوندهایی که یک اتم تشکیل میدهد را میتوان از طریق تعداد الکترون مورد نیاز برای پر کردن لایه ظرفیت آن، پیشبینی کرد. به طور مثال، اکسیژن در لایه ظرفیت خود دارای ۶ الکترون است و تنها به دو الکترون برای پر کردن لایه ظرفیت خود نیاز دارد. در نتیجه، این اتم فقط میتواند تعداد دو پیوند کووالانسی با دیگر اتمها تشکیل دهد. با نگاهی به مولکول آب میتوان این دو پیوند کووالانسی را بهتر نشان داد:
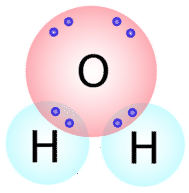
همانطور که مشاهده میکنید، در تصویر بالا تعداد دو جفت الکترون وجود دارند که در تشکیل پیوند کووالانسی نقش ندارند. به این نوع از الکترونها، «جفت الکترون ناپیوندی» (Lone Pairs) میگویند.
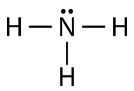
به طور مشابه، نیتروژن برای تکمیل لایه ظرفیت خود به ۳ الکترون نیاز دارد. در نتیجه سه پیوند کووالانسی خواهیم داشت. همچنین ملاحظه میکنید که یک جفت الکترون ناپیوندی هم در این مولکول دیده میشود. در این ساختار، الکترونهای پیوندی با خط و جفت الکترون ناپیوندی به صورت دو نقطه نشان داده شده است:
پیوندهای دوگانه و سهگانه
تا این بخش تنها به پیوندهای یگانه پرداختیم. بسیاری از مولکولها شامل پیوندهای دوگانه و سهگانه هستند که هر اتم، دو یا سه الکترون به ترتیب به اشتراک میگذارد. این نوع از پیوندها را به کمک دو یا سه خط که بین دو اتم کشیده میشوند نشان میدهیم. به طور مثال، پیوند دوگانه کربن-کربن را میتوان به دو شکل یا نشان داد. پیوند سهگانه کربن-کربن را هم میتوان به شکل یا مانند تصویر زیر با سه خط نشان داد.

رسم ساختار لوویس برای ترکیبات مختلف
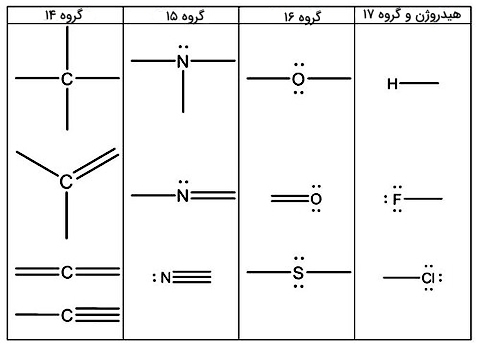
برای رسم ساختار لوویس برخی گروههای جدول تناوبی میتوانید از جدول زیر کمک بگیرید:
همچنین از ساختار لوویس میتوان برای نمایش نحوه تشکیل کاتیونها و آنیونها استفاده کرد:

علاوه بر این، برای نمایش انتقال الکترونها و تشکیل یک ترکیب یونی هم میتوان از ساختار لوییس بهره گرفت:
مثال
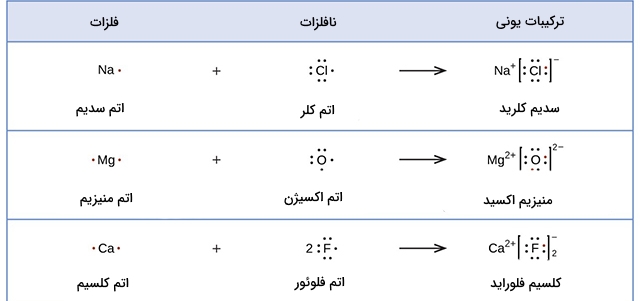
ساختار لوویس یون نیتریت با فرمول را رسم کنید.
حل:
- بین این دو اتم،
- با مقایسه الکترونگاتیوی مشاهده میکنیم الکترونگاتیوی نیتروژن کمتر است و بنابراین به عنوان اتم مرکزی در نظر گرفته میشود.
- در مرحله بعد باید تعداد الکترونهای لایه ظرفیت را شمارش کنید. نیتروژن دارای ۵ الکترون و اکسیژن ۶ الکترون در لایه ظرفیت خود هستند. در نتیجه، تعداد کل الکترونها به صورت زیر محاسبه خواهد شد:
اما این یون دارای بار و نشانگر یک الکترون بیشتر است و بنابراین، تعداد کل الکترونها برابر با ۱۸ است.
- حال، اتمها را با پیوندهای یگانه به یکدیگر وصل کنید. هر اکسیژن را به نیتروژن وصل کنید و با این کار ۴ الکترون را در پیوند شرکت دادهاید.
- جفت الکترونهای ناپیوندی را در محلهای خود قرار دهید. ۱۴ الکترون باقی مانده است و در نتیجه تعداد ۷ جفت الکترون خواهیم داشت. هر اکسیژن در نهایت میتوان ۳ جفت الکترون دریافت کند و لایه ظرفیت خود را با احتساب دو الکترون پیوندی، با ۸ الکترون تکمیل کند. در نهایت، آخرین جفت الکترون به نیتروژن میرسد.
- قاعده اکتت را برای اتمها استفاده کنید. هر دو اتم اکسیژن در حال حاضر دارای ۸ الکترون هستند اما اتم نیتروژن تنها ۶ الکترون در لایه ظرفیت خود دارد. در نتیجه یکی از جفت الکترونهای ناپیوندی باید به صورت یک جفت الکترون پیوندی با نیتروژن پیوند تشکیل دهد. البته میتوان هرکدام از اتمهای اکسیژن را برای این کار انتخاب کرد. به این نوع ساختار، رزونانس میگویند.
- با انجام مراحل بالا، دو ساختار لوییس خواهیم داشت. در هر کدام از این دو ساختار، یک اتم اکسیژن دارای پیوند دوگانه با اتم نیتروژن و اتم دیگر دارای پیوند یگانه است. در نتیجه ساختار لوییس آنها به شکل زیر خواهد بود:
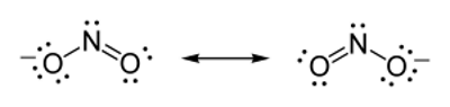
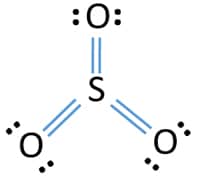
ساختار لوویس SO3
رسم ساختار لوویس سولفور تریاکسید سبب گمراهی برخی از دانشجویان و دانشآموزان میشود. از اینرو، در ادامه، ساختار را برای این مولکول رسم میکنیم. در بیان ساده، گوگرد ۶ الکترون دارد و هر اتم اکسیژن نیز با خود ۶ الکترون همراه میآورد. بنابراین، در مجموع،۲۴ الکترون ظرفیت داریم.
اتم مرکزی (با الکترونگاتیوی کمتر) در مرکز قرار میگیرد. در ادامه، پیوندها را رسم میکنیم تا ۶ الکترون گوگرد لحاظ شود.
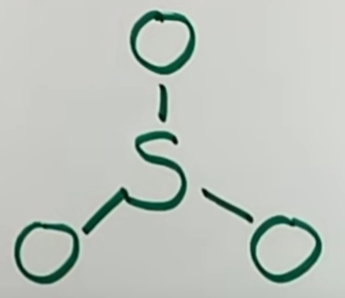
در تصویر بالا، ۶ الکترون از ۲۴ الکترون را مصرف کردهایم. با این وجود، برای تکمیل اوکتت، باقی الکترونها را به صورت نقطهای رسم میکنیم.
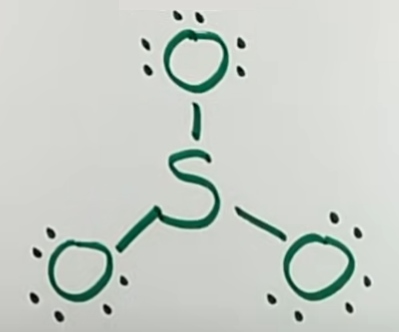
در تصویر بالا، تمامی الکترونهای ظرفیت را استفاده کردهایم. شاید تا اینجا به این نتیجه برسیم که پس تمامی مراحل را انجام دادهایم. اما مبحثی با عنوان «بار قراردادی» را لحاظ نکردهایم. به کمک بار قرارداری میتوان تعیین کرد که نوع پیوندها به چه شکل خواهد بود. مبحث بار قراردادی را گاهی اوقات با «عدد اکسایش» اشتباه میگیرند. فرمول بار قراردادی در مطلب «بار قراردادی چیست؟ — به زبان ساده» بررسی شده است. بار قراردادی هر اتم در تصویر زیر نشان داده شده است.

هدف این است که بار قراردادی در ساختار بالا به حداقل برسد. برای درک بیشتر این موضوع نیز میتوانید به مطالب «رزونانس» و «رسم ساختار رزونانس» مراجعه کنید. اما در اینجا برای سادگی کار، اگر دو الکترون از سمت راست حذف کنیم و به یک پیوند اضافه کنیم، بار قرارداری گوگرد برابر با 2+ و بار قراردادی اکسیژن برابر با صفر خواهد بود.

در اینجاست که بسیاری از دانشآموزان با مشکل مواجه میشوند چراکه با قاعده اکتت همخوانی ندارد. اما درواقع، قاعده اکتت بیشتر در اتمهایی مانند کربن، نیتروژن، اکسیژن و فلوئور کاربرد دارد. گوگرد در اینجا یک استثناء است که میتواند تا ۱۲ الکترون را (به ازای هر اتم) در خود نگه دارد. بنابراین نباید نگران باشیم که دو الکترون دیگر هم از حالت ناپیوندی به پیوندی منتقل کنیم.

با شمارش الکترونهای پیوندی اطراف گوگرد میبینیم که گوگرد، ۱۰ الکترون در اطراف خود دارد و این مورد برخلاف قاعده اکتت است اما همانطور که گفته شد، گوگرد در اینجا از اینجا یک استثناء به شمار میآید. حال اگر دو الکترون دیگر را از حالت ناپیوندی به پیوندی تبدیل کنیم، بار قراردادی در تمام اتمها برابر با صفر خواهد شد.

بنابراین ساختار لوویس در به صورت زیر خواهد بود.
ساختارهای جایگزین
ساختارهای شیمیایی را میتوان در شکلهای فشردهتر نیز نشان داد. این کار در خصوص نمایش مولکولهای آلی بیشتر کاربرد دارد. به هنگام نمایش فرمولهای ساختاری فشرده (تراکمی)، بیشتر پیوندهای کووالانسی را در نظر نمیگیریم. نوع دیگر نمایش ساختاری «فرمول اسکلتی» (Skeletal Formula) نام دارد.
در فرمول اسکلتی، اتمهای کربن را با حرف نمایش نمیدهیم بلکه رئوس خط بیانگر این اتمها هستند. علاوه بر این، اتمهای هیدروژن متصل به کربن نیز نمایش داده نمیشوند.

اگر این مطلب برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای نرمافزارهای مهندسی شیمی
- آموزش شیمی عمومی
- فرمول شیمیایی — به زبان ساده
- قانون هس — به زبان ساده
^^
آزمون ساختار لوییس
۱. کدام عامل زیر باعث تفاوت پیوند کووالانسی با پیوند یونی از نظر آرایش الکترونی میشود؟
تشکیل شبکه بلوری با جاذبه بارهای مخالف
اشتراکگذاری الکترونهای ظرفیت بین اتمها
حضور یونهای مثبت و منفی در ساختار
انتقال کامل الکترون از یک اتم به اتم دیگر
در پیوند کووالانسی، ویژگی «اشتراکگذاری الکترونهای ظرفیت بین اتمها» باعث میشود که اتمها لایه خارجی خود را با هم تقسیم کنند و مولکولهایی بدون بار خالص ایجاد کنند. برعکس، در پیوند یونی انتقال کامل الکترون رخ میدهد، ساختار شبکهای یونها شکل میگیرد و بارهای مخالف کنار هم قرار میگیرند.
۲. ساختار لوویس چه نقشی در تعیین شکل هندسی مولکولها بر اساس نظریه VSEPR دارد؟
تعداد خطوط بین اتمها مستقیما نوع عنصر را بدون توجه به آرایش الکترونی مشخص میکند.
با شمارش تعداد پیوندهای کووالانسی موجود، شکل مولکول به طور دقیق مشخص میشود.
الکترونهای ظرفیت اطراف اتم مرکزی و جفتهای ناپیوندی برای پیشبینی آرایش هندسی بررسی میشوند.
فقط پیوندهای یونی در ساختار لوویس نقش داشته و شکل را تعیین میکنند.
در ساختار لوویس، قرارگیری الکترونهای ظرفیت به صورت جفتهای پیوندی و ناپیوندی پیرامون اتم مرکزی نمایش داده میشود. این چیدمان مبنایی برای نظریه VSEPR فراهم میکند که طبق آن، شکل هندسی مولکول با توجه به دوری جفتهای الکترون (چه پیوندی و چه ناپیوندی) پیشبینی میشود.
۳. در تعیین ساختار لوویس SO₃، بار قراردادی چه نقشی در انتخاب ساختار پایدار دارد و علت امکان گسترش لایه ظرفیت برای گوگرد چیست؟
بار قراردادی ساختار با جابجایی جفتهای ناپیوندی به پیوندی کم میشود و گوگرد میتواند بیش از هشت الکترون در لایه آخر داشته باشد.
ساختار پایدار صرفا با تعداد پیوندهای یگانه تعیین میشود و لایه ظرفیت گوگرد افزایش نمییابد.
بار قراردادی بدون توجه به جفتهای ناپیوندی بررسی میشود و گوگرد فقط تا هشت الکترون ظرفیت دارد.
بار قراردادی در SO₃ اهمیتی ندارد و گوگرد لایه ظرفیت را گسترش نمیدهد.
کاهش بار قراردادی با انتقال جفتهای ناپیوندی گوگرد به پیوندی موجب پایداری ساختار SO₃ میشود. این کار باعث میشود گوگرد بیش از هشت الکترون ظرفیت داشته باشد که استثنایی از قاعده اکتت و مختص عناصری مانند گوگرد است. در مقابل، در روشهایی که به جفتهای ناپیوندی یا قانون اکتت محدود میمانند، ساختار صحیح پیشبینی نمیشود یا پایداری لازم حاصل نمیگردد. بنابراین نقش بار قراردادی و امکان گسترش لایه ظرفیت برای گوگرد در رسیدن به ساختار پایدار SO₃ حیاتی است.













سلام
من پایه دهم هستم و تو شیمی ساختار لوییس رو خوندم و همه معلم های شیمی و آموزش کتاب و کتاب های آموزشی هم ساختار لوویس ( SO3 ) رو به این صورای که شما میگید که بین هر سه اتم اکسیژن و گوگرد بین هر کدونشون دو پیوند قرار داره؛ اینجوری نیست، حتی معلم شیمی من هم اینطوری نمیکشه ساختار لوویس ( SO3 ) رو ! و از معلمای دیگه و چند نفر دیگه هم پرسیدم بازم اوتا هم اینطور مثل شما نمیکشیدن ،
و فقط بین یک اتم اکسیژن و گوگرد پیوند دوگانه قرار داره و بین دو تا اتم اکسیژن دیگه و گوگرد هر کدوم فقط یک پیوند بینشون قرار داره ! اما شما در ساختار لوییس ( SO3 ) بین هر سه اتم اکسیژن و گوگرد بین هرسه شون هرکدم دوتا پیوند و پیوند دوگانه قرار داره !!
من از روش داتیو تین ساختار لوویس رو میکشم و برای ( SO3 ) مثل بالا که گفتم فقط بین یک اکسیژن با گوگرد پیوند دوگانه وجود داره و بین دوتایه دیگه هرکدوم با گوگرد یک پیوند بینشون هست ، معلم ها و دوستانم همین رو گفتن و کشیدن با هرروشی!!!
اما شما بین اتم های اکسیژن و گوگرد بین هر کدوم دوتا پیوند کشیدین !!
میشه بگید دلیلش چیه و چرا این کار رو کردین و آیا روش کشیدن ساختار لوییس ها باهم فرق داره چون روش من داتیو هست،
میشه توضیح بدین از وقتی که این ساختار لویس so3 ی شما رو دیدم کلا ذهنم برای ساختار لوویس دچار مشکل شده و همش برای ساختار لویس ها شک میکنم!!
لطف کنید بگید که چرا ساختار لوویس شما با مال من و معلما و دوستام فرق داره و اینکه روش کشیدن ساختار لوویس تون چیه ؟؟؟
و آیا روش کشیدن ساختار لوویس ها باهم فرق دارن و جوابشون هم فرق داره؟؟؟ مثلا اگه من با روش داتیو ساختار لوویس میکشم و ساختار لوویسم اینطوره (( در بالا گفتم که روش من چطوره ))؛ اگه با یک روش دیگه بکشم همونه یا یک جواب دیگهس و با جواب اون یکی روش فرق داره؟؟؟؟!!
لطف کنید بگید که چرا ساختار لوویس من و معلما و دوستانم با شما فرق داره و آیا مربوط به روش کشیدنش هست و هر روش با جوابش با جواب روش دیگه فرق داره یا نه؟؟ و اینکه الان کدوم ساختار لوییس ( SO3 ) درسته ؟؟! مال من یا مال شما ؟؟ روش من یعنی روش داتیو یعنی اگه فقط بین یکی از اتم اکسیژن ها با گوگرد پیوند دوگانه قرار داشته باشه و بین دو تا اتم اکسیژن دیگه با گوگرد هر کدوم بینشون فقط یک پیوند قرار داشته باشه درسته؟؟؟ یا روش شما یعنی اگه بین هر اتم اکسیژن یعنی بین هر سه تا اتم اکسیژن بین هر کدومشون با گوگرد دو تا پیوند یعنی بین هرکدومشو با گوگرد یه پیوند دو گانه قرار داشته باشه درسته؟؟؟
لطف کنید سوال من رو جواب بدید و این ابهام من رو برطرف کنید، ممنون.
ببخشد خیلی طولانی شد😁.
با سلام؛
از ارائه بازخورد شما سپاسگزاریم. ساختار رسم شده در مطلب کاملا صحیح است. ساختاری که در نظرات به آن اشاره کردهاید، ساختاری با بار منفی است (۲ بارِ منفی).
با تشکر از همراهی شما با مجله فرادرس
سلام، طبق جدول شما گوگرد فقط میتونه دو پیوند یگانه داشته باشه اما تو ساختار لوویس SO3، گوگرد یه پیوند یگانه و دو پیوند دوگانه داره؟ میشه خواهش کنم ابهام من رو برطرف کنید.
ممنون
با سلام؛
پاسخ سوال شما در قالب یک مثال به انتهای مطلب اضافه شد. با مطالعه این بخش، ابهامات به طور کامل برطرف میشوند.
با تشکر از همراهی شما با مجله فرادرس
مگه میشه همچین چیز کامل و جامعی دید و نظر نداد؟
بسیار عالی
عزیز ساختار so4 چجوری شد؟مگر میشه خارج از اکتد بشه عزیز.الان پیوند ۶ گانس کاملا شکل غلطه
با سلام؛
همانطور که در متن نیز توضیح داده شده، قاعده اکتت شامل استثنا هم هست و بیشتر در نیتروژن، اکسیژن و فلوئور کاربرد دارد. ساختار SO3 نیز بر همین اساس، تنظیم شده است.
با تشکر از همراهی شما با مجله فرادرس
با سلام؛
خوشحالیم از اینکه مطالعه این مطلب برای شما مفید بوده است.
با تشکر از همراهی شما با مجله فرادرس
خیلی ممنون، برام واقعا مفید بود
بسیار عالی توضیح دادید.بار قراردادی رسم ساختار لوییس رو خیلی آسون تر میکنه ولی در دبیرستان یاد داده نمی شه متاسفانه.
عالی
خیلی زیاد ممنونم
عالی بود خسته نباشید
فوق العاده بود
سلام عزیز
به شدت عالی بود
نظیرش رو تا حالا ندیده بودم
واااااقعا مرسی
سلام
با تشکر از آموزش عالیتون
واقعا به کامل و بسیار آموزنده
ممنون از شما