رسم ساختار رزونانس – به زبان ساده
هنگامی که نتوانیم به کمک ساختار لوویس، پیوندها در مولکول را توضیح دهیم از ساختار رزونانس استفاده میکنیم. ترکیب ساختارهای رزونانس محتمل را با نام «هیبرید رزونانس» (Resonance Hybrid) تعریف میکنند. در حالت کلی، مولکولهایی با چندین ساختار رزونانس، پایدارتر از مولکول با تعداد ساختار رزونانس کمتر هستند. در این آموزش قصد داریم تا در خصوص رسم ساختار رزونانس به بحث بپردازیم و در قالب حل چند مثال، رسم ساختار رزونانس را یاد بگیریم.


مقدمه
همانطور که در ابتدای متن گفته شد، رزونانس، راهی برای توصیف الکترونهای آزاد در مولکولهایی خاص یا یونهایی چنداتمی است که در آنها نمیتوانیم با رسم ساختار لوویس، پیوندها را توضیح دهیم.
چنین مولکول یا یونی را با چندین ساختار رزونانس نشان میدهند. چارچوب اصلی ساختار لوییس در رسم ساختار رزونانس حفظ میشود و تنها الکترونها تغییر میکنند. به طور مثال، اوزون، آلوتروپی از اکسیژن با ساختار V شکل و زاویه پیوندی 117/5 درجه است. در ادامه قصد داریم تا رسم ساختار رزونانس برای اوزون را شرح دهیم.
- میدانیم که اوزون، ساختاری V شکل دارد و بنابراین، یکی از اتمها را به صورت اتم مرکزی در نظر میگیریم.

- هر اتم اکسیژن، ۶ جفت الکترون ظرفیت دارد و در نتنیجه، تعداد ۱۸ الکترون در لایه ظرفیت خواهیم داشت.
- هر جفتالکترون را به یک پیوند اکسیژن-اکسیژن اختصاص میدهیم. در این حالت،۱۴ الکترون باقی میماند.
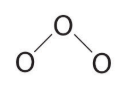
- اگر در دو سر مولکول، سه جفتالکترون قرار دهیم، به شکل زیر میرسیم که در این شکل، همچنان دو جفتالکترون ناپیوندی داریم.
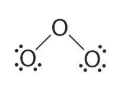
- در این مرحله، با بررسی اتمها درمییابیم که اتمهای دو سر مولکول، هر دو از قاعده اکتت پیروی میکنند، بنابراین، ۲ الکترون باقیمانده را به اتم مرکزی اختصاص میدهیم.
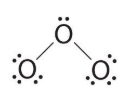
- اتم مرکزی، تنها شش الکترون دارد. در این مرحله باید یکی از جفتالکترونهای ناپیوندی در دو سر مولکول را به جفتالکترون پیوندی تبدیل کنیم. اما کدامیک از این جفتالکترونها را باید انتخاب کنیم؟ بسته به اینکه کدامیک از دو اتم را انتخاب کنیم، به یکی از دو ساختار زیر میرسیم:

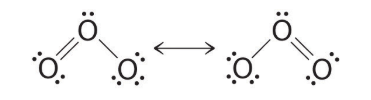
این سوال پیش میآید که کدامیک از دو ساختار بالا صحیح هستند؟ در حقیقت، هیچکدام از ساختارهای بالا صحیح نیستند و هردو، یک پیوند یگانه و یک پیوند دوگانه را برای مولکول، پیشبینی میکنند. همانطور که میدانید، اگر نوع پیوندها (از نظر یگانه، دوگانه و ...) با یکدیگر متفاوت باشند، طول آنها نیز با هم تفاوت دارند. نشان داده میشود که طول هر دو پیوند اکسیژن-اکسیژن با یکدیگر یکسان و برابر با است. طول این پیوند، کوتاهتر از طول پیوند معمول اکسیژن-اکسیژن با مقدار و بلندتر طول پیوند دوگانه اکسیژن-اکسیژن (120.7pm) ذکر میشود.
ساختارهای لوییس همارز در مولکول اوزون را با نام ساختار رزونانس میشناسند. محل اتم به هنگام رسم ساختار رزونانس یک ترکیب، یکسان است اما محل الکترونها تفاوت دارند. از فلشهای دوطرفه برای ارتباط دادن دو ساختار رزونانس استفاده میکنند. این فلشهای دوطرفه نشان میدهند که ساختار الکترونی حقیقی در این مولکولها، متوسطی از ایندو است و مولکول بین این دو حالت نوسان نمیکند. برای توصیف دقیقتر ساختارهای رزونانس باید چندین ساختار رزونانس را به طور همزمان در نظر گرفت.
قوانین رسم ساختار رزونانس
در ادامه قصد داریم تا با قوانین رسم ساختار رزونانس آشنا شویم.
- ساختارهای رزونانس باید تعداد الکترون یکسانی داشته باشند. هیچ الکترونی نباید کم یا اضافه شود.
- رسم ساختار رزونانس باید منطبق بر رسم ساختار لوویس باشد.
- هیبرید شدن ساختار باید بدون تغییر باقی بماند.
- اسکلت ساختار نباید تغییر کند. در حقیقت، تنها الکترونها هستند که تغییر میکنند.
- ساختارهای رزونانس نیز باید همان تعداد جفتالکترون ناپیوندی ساختار لوویس را داشته باشند.
فلشها در شیمی
به هنگام رسم ساختار رزونانس استفاده از فلشها امری اجتناب ناپذیر است اما باید توجه داشت که این فلشها را نمیتوان به جای یکدیگر استفاده کرد. در زیر، این نوع از فلشها آورده شدهاند.
- : از این نوع فلش دو طرفه بین ساختارهای لوویس برای نشان دادن رزونانس استفاده میشود.
- : از این فلش جهت نمایش تعادل در واکنشهای شیمیایی بهره میگیرند.
- : این نوع فلش نشاندهنده حرکت یک الکترون است.
- : این فلش، حرکت دو الکترون را نشان میدهد.
مثال
ساختار رزونانس را برای یون کربنات با فرمول رسم کنید.
با توجه به اینکه کربن، کمترین الکترونگاتیوی را در بین عناصر دارد، آن را در مرکز قرار میدهیم.
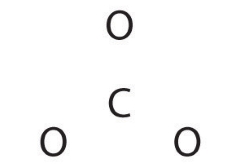
کربن، ۴ الکترون در لایه ظرفیت خود و هر اکسیژن، ۶ الکترون در لایه ظرفیت خود دارد. همچنین، برای بار نیز، ۲ الکترون خواهیم داشت. در نتیجه، تعداد الکترونهای ظرفیت برابر خواهد بود با:
از ۶ الکترون برای تشکیل پیوند بین اتمهای کربن و اکسیژن استفاده میکنیم.
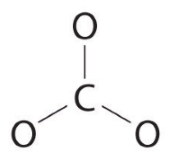
۱۸ الکترون باقیمانده را به طور مساوی بین ۳ اتم اکسیژن تقسیم میکنیم به گونهای که ۳ جفتالکترون ناپیوندی را به اتمها و بار کلی را به کل یون اختصاص میدهیم. و هیچ الکترونی برای اتم مرکزی باقی نخواهد ماند.
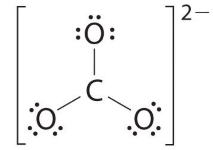
در این مرحله، اتم کربن تنها ۶ الکترون ظرفیت دارد، در نتیجه باید یک جفتالکترون ناپیوندی از اکسیژن را برای تشکیل پیوند دوگانه کربن-کربن بکار ببریم. در این مساله، سه حالت مختلف بوجود میآید:
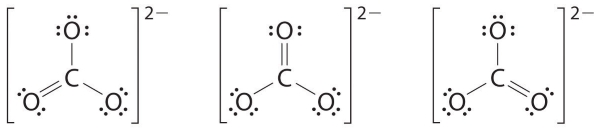
همانند اوزون، هیچکدام از ساختارهای بالا، پیوند را به طور دقیق توضیح نمیدهد. هر کدام، یک پیوند کربن-اکسیژن دوگانه و دو پیوند کربن-اکسیژن یگانه را پیشبینی میکنند. این درحالیست که به صورت آزمایشگاهی نشان داده شده است که هر سه پیوند کربن-اکسیژن، طول یکسانی دارند. در این حالت، میتوان رسم ساختار رزونانس برای یون کربنات به صورت زیر نشان داد:
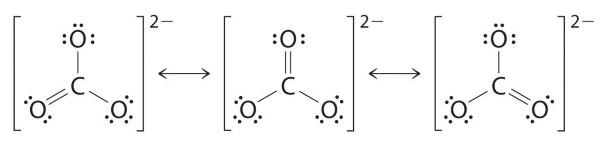
ساختار اصلی، میزان متوسطی از سه ساختار بالا خواهد بود. همانند اوزون، ساختار الکترونی یون کربنات را نمیتوان با یک ساختار لوویس تنها نشان داد.
استفاده از بار قراردادی به منظور تعیین ساختار رزونانس
درحالیکه هر ساختار رزونانس در ساختار الکترونی کلی مولکول دخیل است، اما این شرایط برای همه ساختارها یکسان نخواهد بود. اختصاص دادن «بار قراردادی» (Formal Charges) به اتمهای یک مولکول، مکانیسمی برای شناسایی کارآمد بودن یک ساختار رزونانس و تعیین قدرت نسبی آن در میان سایر ساختارها به شمار میآید. بار قراردادی یک اتم در یک ذره کووالانسی، بار خالصی است که آن اتم میگیرد. اگر الکترونها به طور مساوی در تمامی پیوندهای یک اتم تقسیم شده باشند، به بار خالص آن اتم در ذره کووالانسی، بار قرارداری میگویند. برای تعیین بار قراردادی در اتم، از رابطه زیر استفاده میکنیم:
= بار قراردادی
(تعداد جفتالکترونهای پیوندی) - (تعداد جفتالکترونهای ناپیوندی) - (تعداد الکترون ظرفیت در اوربیتال آزاد)
قوانین تخمین پایداری ساختار رزونانس
در این بخش، قوانین تخمین پایداری برای ساختارهای رزونانس را بررسی میکنیم.
- هر قدر تعداد پیوندهای کووالانسی بیشتر باشد، پایداری بیشتری خواهیم داشت زیرا اتمهای بیشتری به قاعده اکتت میرسند.
- ساختاری با بار قراردادی کمتر، پایداری بیشتری دارد.
- ساختاری که کمترین جدایش بار قراردادی را داشته باشد، پایداری بیشتری دارد.
- ساختاری که بار منفی بر روی اتم الکترونگاتیوتر داشته باشد، پایدارتر است.
- بار مثبت، بر روی اتم با کمترین الکترونگاتیوی، ساختار رزونانس پایدارتری بدست میدهد.
- ساختارهای رزونانس معادل همچون بنزن، تفاوتی در پایداری نخواهند داشت.
مثال
با توجه به قوانین گفته شده، ساختار رزونانس تیوسیانات با فرمول را رسم کنید.
ساختار لوویس مولکول را رسم کنید.
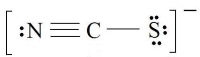
برای اینکه در تمامی عناصر، قاعده اکتت رعایت شده باشد، با حرکت دادن اتمهای دو سر مولکول و پیوندهای آنها، این شرایط را ایجاد میکنیم.
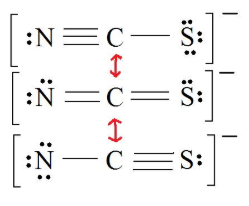
بر اساس رابطه گفته شده، بار قراردادی را تعیین کنید. بار قراردادی به ترتیب برای کربن، نیتروژن و گوگرد را در تصویر زیر مشاهده میکنید.
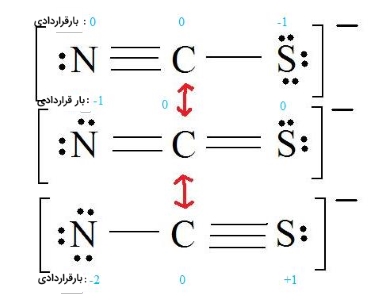
ساختار ایدهآل با توجه به قوانین تخمین پایداری را انتخاب کنید. در تصویر زیر، دو ساختار سمت چپ، هردو ساختارهای ایدهآلی هستند چراکه حداقل میزان بارقراردادی را در آنها میتوان یافت.
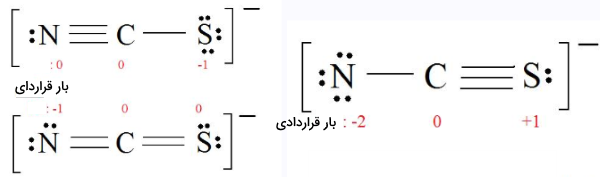
در این مرحله برای تعیین ساختار لوویس مناسب، به الکترونگاتیوی توجه کنیم. به طور معمول، الکترونگاتیوترین اتم، بار قراردادی منفی دارد و اتم با کمترین الکترونگاتیوی، بار قراردادی مثبت دارد. با توجه به موارد مطرح شده، ساختار تصویر زیر، ساختار رزونانس تیوسیانات خواهد بود.
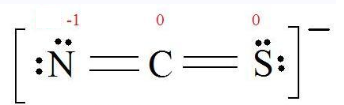
هیبرید رزونانس
به طور معمول میتوانیم ساختارهای رزونانس را با یکدیگر ترکیب کنیم تا به ساختاری واحد، موسوم به هیبرید رزونانس برسیم. روش کلی برای رسیدن به ساختار هیبرید رزونانس در زیر آورده شده است:
- ساختارهای لوویس و رزونانس را برای مولکول رسم کنید.
- در جایی که پیوند دوگانه یا سهگانه دارید، از خطچین برای نشان دادن پیوند استفاده کنید.
- تنها جفتالکترونهایی را رسم کنید که در تمامی ساختارهای رزونانس مشترک هستند و بقیه جفتالکترونها را دخیل نکنید.
مثال
بنزن، حلال آلی است که قبلا در بنزین استفاده میشد اما با توجه به اینکه مادهای سرطانزا محسوب میشود، امروزه کاربردی در بنزین و گازوئیل ندارد. مولکول بنزن، شامل ۶ اتم کربن متصل به اتم هیدروژن است. روشهای رسم ساختار رزونانس را برای مولکول بنزن بکار برید و ساختار آن را رسم کنید.
استراتژی حل مساله:
تعداد الکترونهای لایه ظرفیت را محاسبه و ساختار لوویس را رسم کنید.
عدد بدست آمده را از تعداد کل الکترونهای ظرفیت در بنزن کسر کنید و الکترونهای باقیمانده را به گونهای در ساختار قرار دهید تا اتمها به قاعده اکتت برسند.
در نهایت، با توجه به مسائل گفته شده، ساختار رزونانس را رسم کنید.
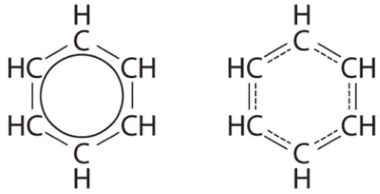
اگر این مطلب برای شما مفید بوده است، آموزشها و مطالب زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای مهندسی شیمی
- آموزش شیمی عمومی
- اوربیتال مولکولی — به زبان ساده
- شیمی فضایی — به زبان ساده
^^













سلام من دانشجوی خارج از ایران هستم و چون خیلی از مطالب رو سره کلاس متوجه نمیشم از اموزش های ایرانی استفاده میکنم لطفا امپزش هارو بیشتر و کامع تر کنید من خیلی نیاز دارم؛ لطفا سیستم ۵ مرحله ای رزونانس با عدد پی رو توضیح بدین
خیلی ممنون از مطلب کاملا مفیدتون فقط من یک سوال داشتم ؟ اونجا که گفتید بین دو حالت نوسان نمیکند و فقط متوسطی از این هاست یکم درکش برام سخته چون قبلا جایی خونده بودم در مولکول اوزون پیوند دو گانه بین o_o دائما به سرعت همان سرعت الکترون بین دو مولکول o و o تغیر میکنه
با سلام؛
خوشحالیم که مطالعه مطلب برای شما مفید بوده است. برای درک بهتر این موضوع، پیشنهاد میکنیم مثال مقدمه مطلب «رزونانس در شیمی — به زبان ساده» را مطالعه کنید.
با تشکر از همراهی شما با مجله فرادرس
با تشکر از همراهی شما با مجله فرادرس
باسلام و احترام،
اقاي مهندس من يك سوال دارم ازتون منظور از M / +M- چيست؟ من چه طور ميتوانم در aromatische Verbindungen مثل بنزول مثبت يا منفي بودن mesomerie Effekt را تشخيص بدهم؟
خيلي ممنون ?