خصلت فلزی چیست؟ – به زبان ساده + رابطه با شعاع اتمی و واکنش پذیری
خصلت فلزی مقدار واکنشپذیری یک فلز و تمایل آن به از دست دادن الکترونهای ظرفیت را مشخص میکند. ساختار اتمی، بهویژه تعداد الکترونهای ظرفیت و شعاع اتمی، نقشی کلیدی در تعیین خصوصیات فلزی عناصر دارد. هرچه شعاع اتمی بزرگتر باشد، الکترونهای ظرفیت از هسته دورتر و ناپایدارترند و خصلت فلزی افزایش مییابد. در این مطلب از مجله فرادرس میآموزیم خصلت فلزی چیست و چگونه شعاع اتمی میتواند بر آن اثر بگذارد.
- میآموزید خصلت فلزی چیست و چه اثری بر واکنشپذیری مواد میگذارد.
- می توانید رابطه بین شعاع اتمی و خصلت فلزی را درک کنید.
- مفهوم شعاع اتمی و انواع مختلف آن را یاد میگیرید.
- میتوانید روند تغییر خصلت فلزی را در جدول تناوبی درک کنید.
- با عوامل اثرگذار بر خصلت فلزی آشنا میشوید.
- تفاوت خصلت فلزی و خصلت نافلزی را میآموزید.


در ابتدای این مطلب میآموزیم خصلت فلزی چیست و چه رابطهای با شعاع اتمی دارد. در ادامه، شعاع اتمی را تعریف کرده و انواع آن را بررسی میکنیم. سپس روند تغییر خصلت فلزی در جدول تناوبی و عوامل تاثیرگذار بر این خاصیت را میآموزیم. در نهایت خصلت فلزی را برای آلیاژها بررسی کرده و تفاوت خصلت فلزی و نافلزی را میآموزیم. با مطالعه این مطلب تا انتها میتوانید به شکلی کامل بیاموزید خصلت فلزی چیست.
خصلت فلزی چیست؟
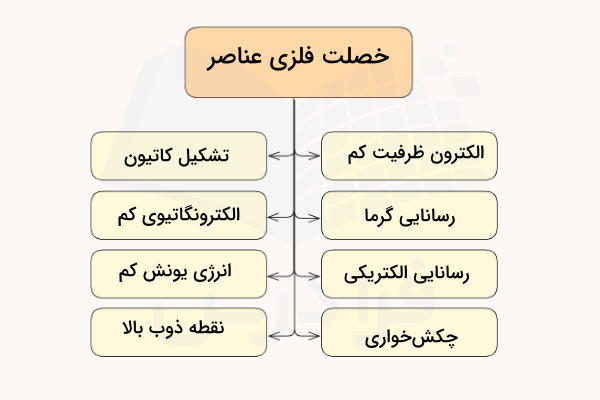
خصلت فلزی به مجموعه ویژگیهایی اطلاق میشود که مربوط به عناصر فلزی است. در این عناصر، الکترونهای ظرفیت، جاذبه کمی را از هسته اتم احساس می کنند و راحتتر جدا میشوند. در مقابل، در عناصر نافلزی، هسته اتم اثر بیشتری بر روی الکترونهای ظرفیت میگذارد زیرا این الکترونها به هسته اتم نزدیکتر هستند و اثر پوششی معمولا در این عناصر زیاد نیست. به همین دلیل است که عناصر فلزی تمایل دارند کاتیون (یون مثبت حاصل از از دست دادن الکترون) و نافلزات تمایل دارند آنیون (یون منفی حاصل از دریافت الکترون) را تشکیل دهند.
خصلت فلزی به میزان واکنشپذیری یک فلز اشاره دارد. فلزها در واکنشهای شیمیایی تمایل دارند الکترون از دست بدهند، که این موضوع با انرژی یونش پایین آنها نشان داده میشود. در ادامه، خواص فلزی عناصر را نام میبریم.
- فلزات دارای رسانایی حرارتی و الکتریکی بالا هستند، زیرا الکترونهای ظرفیت در آنها آزادانه جابهجا میشوند و این تحرک الکترونی ساختار فلزی را شکل میدهد.
- خصلت فلزی بهطور کلی در فلزات قلیایی (گروه ۱) و فلزات قلیایی خاکی (گروه ۲) بیشترین مقدار را دارد و با حرکت از چپ به راست جدول تناوبی کاهش مییابد.
- قدرت پیوند فلزی تحت تاثیر تعداد الکترونهای ظرفیت و شعاع اتمی قرار دارد. اتمهای بزرگتر و با الکترونهای ظرفیت کمتر معمولا خصلت فلزی قویتری نشان میدهند.
- خصلت فلزی ارتباط نزدیکی با تمایل عنصر به تشکیل یون مثبت (کاتیون) دارد، زیرا فلزات بهراحتی الکترونهای ظرفیت خود را از دست میدهند.
- چکشخواری و مفتولپذیری بالا در فلزات نتیجه مستقیم خصلت فلزی آنهاست. اتمها میتوانند بدون شکستن پیوند فلزی از کنار یکدیگر سر بخورند.
- عناصری که الکترونهای ظرفیت کمتری دارند، خصلت فلزی بیشتری نشان میدهند، زیرا تمایل دارند الکترون از دست بدهند تا به آرایش پایدار برسند.
رابطه خصلت فلزی و شعاع اتمی
در قسمت قبل آموختیم خصلت فلزی چیست. خصوصیات فلزی و غیرفلزی یک عنصر عمدتا توسط ساختار اتمی آن، به ویژه تعداد الکترونهای ظرفیت و شعاع اتمی تعیین میشود. الکترونهای ظرفیت، دورترین الکترونها از هسته هستند که کمترین جاذبه را از سمت هسته احساس میکنند. این الکترونها، فاصله آنها از هسته اتم (شعاع اتمی) و تعداد آنها مشخص کننده خواص مختلف اتم مانند خصلت فلزی است. هرچه اتم راحتتر الکترون از دست بدهد، خصلت فلزی آن بیشتر است. پس خصلت فلزی به موارد زیر وابسته است:
- شعاع اتمی بزرگتر
- الکترون ظرفیت کمتر
- ساختار اتمی
- تعداد لایههای الکترونی و تعداد الکترونها
در جدول تناوبی عناصر، با حرکت در هر دوره از چپ به راست، شعاع اتمی کاهش یافته و خصلت فلزی کاهش مییابد. در هر گروه جدول تناوبی، با حرکت از بالا به پایین، شعاع اتمی افزایش و خصلت فلزی افزایش مییابد.
پیشنهاد میکنیم برای آشنایی بیشتر با روند تغییر شعاع اتمی در جدول تناوبی، آموزش تغییرات شعاع اتمی در جدول تناوبی فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
یادگیری شیمی یازدهم با فرادرس
برای درک بهتر اینکه خصلت فلزی چیست، نیاز است با مفاهیمی چون انتقال الکترون، انواع مواد، فلزات و نافلزات، جدول تناوبی عناصر و .... آشنا شویم. پیشنهاد میکنیم برای درک بهتر این مسائل و مفاهیم، به مجموعه فیلم آموزش دروس پایه دوازدهم، بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در مورد خصلت فلزی و شعاع اتمی دسترسی داشته باشید.
- فیلم آموزش شیمی ۱ پایه دهم فرادرس
- فیلم آموزش شیمی ۱ پایه دهم حل سوالات تشریحی امتحانات نهایی فرادرس
- فیلم آموزش شیمی ۳ پایه دوازدهم فرادرس
شعاع اتمی چیست؟
شعاع اتمی فاصله بین هسته اتم و دورترین اوربیتال (لایه) الکترونی را تعیین میکند. به بیان سادهتر، اگر اتم را به شکل یک کره یا دایره در نظر بگیریم که مرکز آن هسته و محیط آن آخرین لایه الکترونی است، شعاع اتمی برابر با شعاع دایره خواهد بود. این فاصله در تصویر زیر نشان داده شده است.
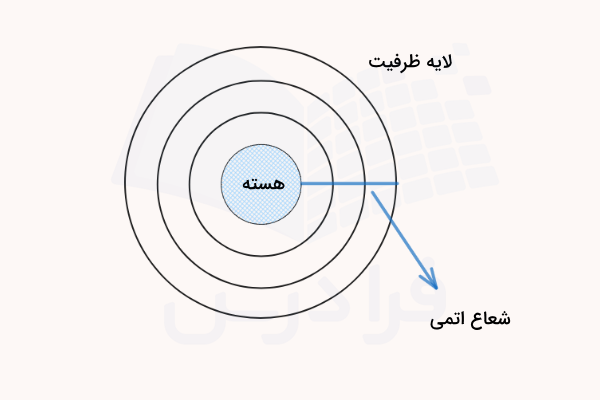
اندازهگیری شعاع اتمی به دلیل نامشخص بودن محل دقیق قرارگیری الکترونها در یک اتم تکی (اصل عدم قطعیت هایزنبرگ) میتواند مشکل باشد. به همین دلیل، مقدار شعاع اتمی بر اساس فاصله دو هسته اتم در یک پیوند شیمیایی تعیین میشود. شعاع اتمی بر این اساس برابر با نصف فاصله بین هستههای دو اتم درگیر در پیوند خواهد بود. در مقابل، هرچه شعاع اتمی کوچکتر باشد، الکترونهای ظرفیت به هسته نزدیکتر و پایدارترند و خصلت نافلزی افزایش مییابد.
شعاع اتمی بسته به پیوندی که اتم تشکیل میدهد، میتواند انواع متفاوتی داشته باشد. برای مثال، شعاع اتمی در پیوندهای کووالانسی، یونی و فلزی مقادیر متفاوتی دارد. اما تعریف شعاع اتمی همواره به صورت فاصله هسته اتم و لایه ظرفیت، ثابت است. در ادامه، انواع شعاع اتمی را تعریف میکنیم.
پیشنهاد میکنیم برای درک بهتر روند تغییر شعاع اتمی و عوامل موثر بر آن، فیلم آموزش تغییرات شعاع اتمی در جدول تناوبی که لینک آن در ادامه آورده شده است را مشاهده کنید.
شعاع کووالانسی
شعاع کووالانسی یک اتم برابر با نصف هستههای دو اتم مشابه است که باهم پیوند کووالانسی تشکیل دادهاند. هنگامی که بین دو اتم، پیوند کووالانسی حاصل از به اشتراکگذاری الکترونها تشکیل میشود، شعاع کووالانسی تعیین میشود. اگر دو اتم درگیر در پیوند کووالانسی مشابه باشند، به دلیل اینکه هر دو اتم به یک اندازه الکترونها را به هسته خود جذب میکنند، شعاع کووالانسی دقیقا برابر با نصف فاصله بین هستههای آنها خواهد بود. شعاع کووالانسی در تصویر زیر مشخص شده است.

شعاع یونی
شعاع یونی را بر اساس فاصله دو هسته اتم درگیر در پیوند یونی میتوان اندازه گرفت. در پیوند یونی، اندازه اتمها متفاوت است زیرا یکی از اتمها کاتیون با اندازه کوچکتر و دیگری آنیون با اندازه بزرگتر است. بنابراین نمیتوان اندازه شعاع یونی را با نصف فاصله بین دو هسته اتم اندازهگیری کرد. شکل زیر نشاندهنده شعاع یونی دو اتم در یک پیوند یونی است.
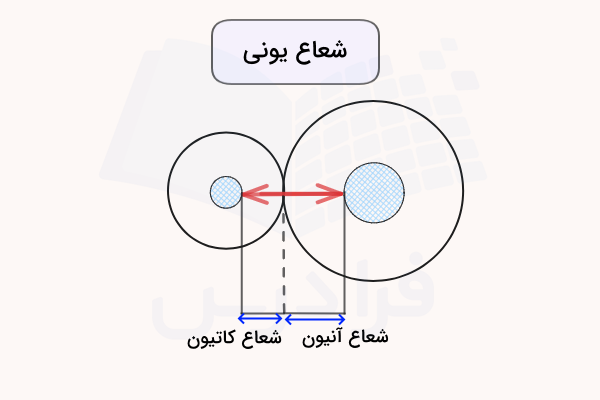
در این نوع پیوند، فاصله بین دو هسته اتم بنابر اندازه شعاع اتمی بین آنها تقسیم میشود. برای مثال، اگر اندازه شعاع اتمی کووالانسی اتم Se برابر با ۱۷۸ پیکومتر باشد و در یک ترکیب یونی CaSe اندازه فاصله بین دو هسته اتم برابر با ۲۷۸ پیوکتر باشد، ۱۷۸ پیکومتر اندازه شعاع یونی Se و ۱۰۰ پیکومتر اندازه شعاع یونی Ca خواهد بود. این روش برای سایر ترکیبات یونی نیز میتواند استفاده شود.
شعاع فلزی
شعاع فلزی، شعاع اتمهایی است که با هم پیوند فلزی برقرار کردهاند. شعاع فلزی نصف فاصله بین هسته های دو اتم مشابه است که پیوند فلزی برقرار کردهاند. در تصویر زیر، این شعاع مشخص شده است. در ادامه میآموزیم نحوه اثر شعاع اتمی بر خصلت فلزی چیست.

روند تغییر شعاع اتمی در جدول تناوبی
شعاع اتمی در هر دوره جدول تناوبی از چپ به راست کاهش و در هر گروه از بالا به پایین افزایش مییابد. این پدیده به این علت است که در هر ردیف جدول تناوبی با حرکت از چپ به راست یک الکترون به الکترونهای هسته افزوده شده و یک پروتون نیز افزایش مییابد و اثر جاذبه هسته اتم بر الکترونهای درونی باقیمانده بیشتر میشود. به بیان دیگر، الکترونهای باقی مانده، اثر پوششی الکترون درونی کمتری را احساس میکنند. بدین ترتیب شعاع اتمی کاهش مییابد.
در مقابل در هر گروه جدول تناوبی با حرکت از بالا به پایین یک لایه الکترونی به لایههای الکترونی اتم افزوده میشود که باعث بزرگتر شدن شعاع اتمی میشود. به همین دلیل است که در هر ردیف جدول تناوبی خصلت فلزی کاهش و در هر گروه خصلت فلزی افزایش مییابد. در این مورد، اتمها اثر پوششی الکترون درونی بیشتری را نسبت به اتمهای بالاتر خود در یک گروه جدول تناوبی تجربه میکنند. تصویر زیر، نشاندهنده روند تغییر شعاع اتمی در حدول تناوبی عناصر است.
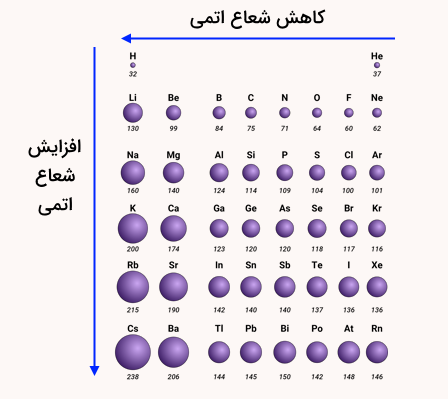
موارد استثنا
باید دقت داشته باشیم که روند تغییر شعاع اتمی برای عناصر فلزات واسه به صورت یکنواخت و با الگوی مشخص تغییر نمیکند. این پدیده به این علت است که الکترونهای اضافه شده به عناصر فلزات واسطه طی حرکت در دوره از چپ به راست، به اوربیتالها و لایههای الکترونی داخلی آنها (3d و 4d و ...) افزوده میشود. در حالی که بیرونیترین لایه الکترونی آنها (4s و 5s و ...) ثابت باقی میماند. به همین علت، هسته اتم، الکترونهای درونی را به خود جذب میکند.
آرایش الکترونی عناصر فلزات واسطه این پدیده را به خوبی توضیح میدهد. به همین دلیل است که در جدول تناوبی، شعاع اتم گالیم Ga با اتم قبل از خود (روی) تقریبا برابر است. جیوه در دمای اتاق بهجای یک جامد سخت، مایع است. همچنین رسانایی الکتریکی کمتری نسبت به دیگر فلزها دارد. بعضی از فلزات نجیب نیز بهجای چکشخواری، شکنندهاند. در عین حال، این فلزها همچنان براق و فلزی به نظر میرسند و توانایی تشکیل کاتیون دارند. آرایش الکترونی اتم روی و گالیم در ادامه اورده شده است.
گالیم:
روی:
روند خصلت فلزی در جدول تناوبی
در جدول تناوبی عناصر، خصلت فلزی از چپ به راست در هر دوره کاهش و در هر گروه از بالا به پایین افزایش مییابد. در مقابل، خصلت نافلزی در هر دوره از چپ به راست افزایش و در هر گروه از بالا به پایین کاهش مییابد. در واقع، میتوان گفت که خصلت فلزی با شعاع اتمی رابطه مستقیم و خصلت نافلزی با شعاع اتمی رابطه عکس دارد. فعالترین فلز، سزیم است که به صورت عنصر آزاد در طبیعت یافت نمیشود. این فلز با آب بهطور انفجاری واکنش میدهد و حتی در هوا بهطور خودبهخود شعلهور میشود. فرانسیم در زیر سزیم در گروه فلزات قلیایی قرار دارد، اما آنقدر کمیاب است که بیشتر خصلتهای آن هرگز مشاهده نشدهاند.
در تصویر زیر، روند تغییر خصلت فلزی در جدول تناوبی نمایش داده شده است.

همچنین، یکی دیگر از عواملی که بر خصلت فلزی و شعاع اتمی اثر گذار است، الکترونگاتیوی عناصر است. الکترونگاتیوی، خصلتی است که تعیین میکند عناصر با چه قدرتی الکترونها را به سمت هسته خود جذب میکنند. در جدول تناوبی، الکترونگاتیوی از چپ به راست افزایش یافته و در هر گروه از بالا به پایین کاهش مییابد. اتمهای الکترونگاتیوتر بیشتر الکترونهای خود را به سمت هسته جذب میکنند و به همین علت شعاع اتمی آنها کاهش مییابد. بدین ترتیب میتوان گفت که الکترونگاتیوی با شعاع اتمی و خصلت فلزی رابطه عکس دارد.
سایر عوامل تاثیرگذار بر خصلت فلزی
در قسمتهای قبل آموختیم روند تغییر شعاع اتمی و خصلت فلزی چیست. علاوه بر شعاع اتمی عواملی دیگر نیز میتوانند بر خصلت فلزی اثر بگذارند. این عوامل تعداد الکترون های ظرفیت، مقدار بار هسته، اثر پوششی الکترون درونی و تعداد لایههای الکترونی هستند. در ادامه این عوامل را بررسی میکنیم. بسیاری از این خواص به شکل دورهای در جدول تناوبی و با الگوی مشخص تغییر میکنند. پیشنهاد میکنیم برای آشنایی بیشتر با این خواص، مطلب قانون دوره ای عناصر مجله فرادرس را مطالعه کنید.
تعداد الکترونهای ظرفیت
عناصری که تعداد کمی الکترون ظرفیت دارند (۱ تا ۳)، بهراحتی آنها را از دست میدهند و بنابراین خصلت فلزی نشان میدهند. بهعنوان مثال، فلزات قلیایی با یک الکترون ظرفیت بسیار فلزی هستند.
مقدار بار هسته
افزایش بار موثر هسته باعث میشود که الکترونهای ظرفیت بیشتر به هسته جذب شوند و از دست دادن آنها دشوارتر شود. این موضوع خصلت فلزی را کاهش میدهد.
اثر پوششی الکترون درونی
الکترونهای داخلی مانند یک سپر عمل میکنند و الکترونهای ظرفیت را از جاذبه کامل هسته محافظت میکنند. هرچه اثر پوششی بیشتر باشد، جذب هسته ضعیفتر شده و از دست دادن الکترون آسانتر میشود، بنابراین خصلت فلزی افزایش مییابد.
تعداد لایههای الکترونی
عناصری که تعداد کمی الکترون ظرفیت دارند (۱ تا ۳)، بهراحتی آنها را از دست میدهند و بنابراین خصلت فلزی نشان میدهند. بهعنوان مثال، فلزات قلیایی با یک الکترون ظرفیت بسیار فلزی هستند. در نتیجه، خصلت فلزی در طول یک گروه افزایش مییابد و خصلت نافلزی کاهش پیدا میکند.
اندازه اتم
با افزایش اندازه اتم (حرکت به سمت پایین یک گروه)، فاصله بین هسته و الکترونهای ظرفیت بیشتر میشود. جاذبه ضعیفتر باعث میشود که الکترونهای بیرونی راحتتر از دست بروند، بنابراین خصلت فلزی افزایش مییابد.
انرژی یونش
انرژی یونش انرژی لازم برای جدا کردن یک الکترون از یک اتم در حالت گازی است. هرچه انرژی یونش کمتر باشد، الکترونها راحتتر از اتم جدا میشوند و خصلت فلزی قویتر است. در جدول تناوبی، انرژی یونش از بالا به پایین کاهش و از چپ به راست افزایش مییابد.
الکترونگاتیوی
الکترونگاتیوی تمایل اتم به جذب الکترون در یک پیوند شیمیایی است. هرچه الکترونگاتیوی کمتر باشد، اتم راحتتر الکترون از دست میدهد و خصلت فلزی بیشتر میشود. در جدول تناوبی، الکترونگاتیوی از بالا به پایین کاهش و از چپ به راست افزایش مییابد.
آلیاژها و خصلت فلزی
اگرچه اصطلاح خصلت فلزی معمولا برای عناصر خالص بهکار میرود، آلیاژها نیز میتوانند این خصلت را نشان دهند. برای مثال، برنز و بیشتر آلیاژهای مس، منیزیم، آلومینیوم و تیتانیوم سطح بالایی از خصلت فلزی دارند. بعضی از آلیاژهای فلزی کاملا از فلز تشکیل شدهاند، اما بیشتر آنها شامل شبهفلزها و نافلزها نیز هستند و همچنان خصلتهای فلزی خود را حفظ میکنند.
تفاوت خصلت فلزی و خصلت نافلزی
در این مطلب از مجله فرادرس آموختیم خصلت فلزی چیست. فلزات دارای خصلت فلزی و نافلزها دارای خصلت نافلزی هستند. تفاوتهای میان فلزات و نافلزها در جدول زیر آورده شده است.
| خصلت فلزی | خصلت نافلزی |
| معمولا جامد در دمای اتاق | جامد، گاز یا مایع در دمای اتاق |
| رسانای برق و گرما | رسانایی ضعیف |
| چکشخوار و انعطافپذیر | نرم و غیر چکش خوار |
| نقطه ذوب و جوش بالا | نقطه ذوب و جوش پایین |
| ظاهر براق | فاقد جلای فلزی |
| الکتروپوزتیو | الکترونگاتیو |
| شعاع اتمی زیاد | شعاع اتمی کم |
| الکترونخواهی کم | الکترونخواهی زیاد |
برخی عناصر خصلتهایی بین فلزات و نافلزها دارند که به آنها شبهفلز (متالوئید) گفته میشود. در کل فقط هفت شبهفلز در جدول تناوبی وجود دارد که عبارتند از بور، سیلیسیم، ژرمانیم، آرسنیک، آنتیموان، تلوریم و پولونیوم. این عناصر جامد، شکننده و نیمهرسانا هستند و در ترکیب با فلزات میتوانند آلیاژ تشکیل دهند.












