اتم برانگیخته چیست و چه ارتباطی با طیف نشری دارد؟ – به زبان ساده
اتم برانگیخته اتمی است که حداقل یکی از الکترونهای آن در حالت برانگیخته باشد. حالت برانگیخته حالتی است که در آن الکترون به وسیله جذب نور یا انرژی، اوربیتال خود را ترک کرده و به اوربیتالی با انرژی بالاتر میرود. این حالت برای الکترون وضعیتی ناپایدار ایجاد میکند و پس از بازه زمانی کوتاهی الکترون با نشر نور و انرژی به حالت پایه و پایدار خود بازمیگردد. در این مطلب از مجله فرادرس میآموزیم اتم برانگیخته چیست و چگونه باعث بوجود آمدن طیف نشری برای اتمها میشود.
- میآموزید اتم برانگیخته چیست و چه تفاوتی با حالت پایه اتم دارد.
- فرآیند برانگیختگی اتم را درک کرده و حالت برانگیختگی اول، دوم و سوم را میآموزید.
- میتوانید ارتباط بین اتم برانگیخته و طیف نشری اتم را درک کنید.
- با انواع نشر انرژی از اتم برانگیخته و مواد فلورسان و فسفرسان آشنا میشوید.
- برخی از روشهای برانگیخته کردن اتم و دریافت طیف نشری آنها را یاد میگیرید.
- میآموزید اهمیت و کاربرد اتم برانگیخته در علوم مختلف چیست.

در ابتدای این مطلب میآموزیم مفهوم اتم برانگیخته چیست و چه تفاوتی با حالت پایه دارد. سپس فرآیند برانگیخته شدن اتم را توضیح داده و انواع حالات برانگیختگی را بررسی میکنیم. در ادامه، ارتباط اتم برانگیخته و طیف نشری را توضیح داده و روشهای برانگیخته کردن اتم را میآموزیم. در نهایت اهمیت و کاربرد اتم برانگیخته را در علوم و فناوریهای مختلف معرفی میکنیم. با مطالعه این مطلب تا انتها میتوانید به شکلی کامل بیاموزید مفهوم اتم برانگیخته چیست.
اتم برانگیخته چیست؟
اتم برانگیخته اتمی است که دارای الکترون (الکترونهای) برانگیخته باشد. در حالت پایدار الکترونی، هر الکترون در اتم، یک سطح انرژی مشخص و کوانتومی دارد. این سطوح انرژی با اصطلاح لایه الکترونی و اوربیتال الکترونی شناخته میشوند. برای مثال الکترونهای اتم سدیم در حالت پایه آرایشی مانند تصویر زیر دارند.
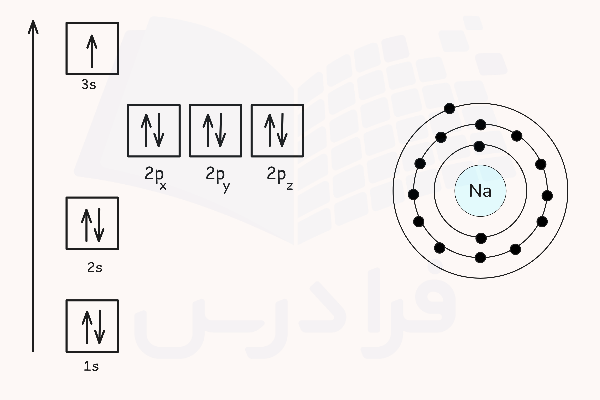
اگر به اتم مقدار مشخصی انرژی بدهیم، الکترونهای آن انرژی را جذب کرده و به لایهها و اوربیتالهایی با انرژی بالاتر میروند و به اصطلاح برانگیخته میشوند. مقدار انرژی که برای برانگیخته کردن یک الکترون اتم نیاز است دقیقا برابر با اختلاف انرژی بین لایههای الکترونی است.
برای مثال، الکترون لایه آخر( ظرفیت) اتم سدیم با دریافت ۲٫۱ الکترون ولت انرژی به اوربیتال p میرود.
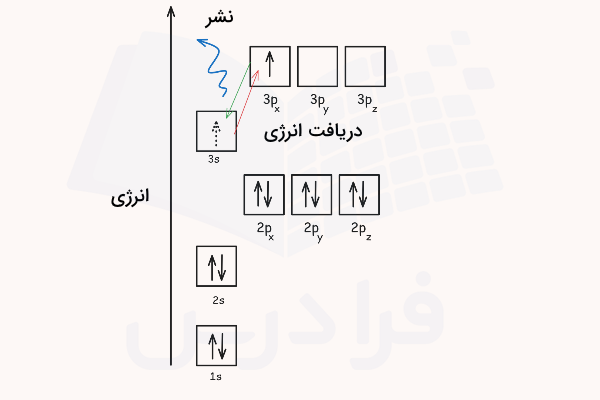
سپس این الکترون با بازنشر دقیقا همان مقدار انرژی به حالت پایه خود باز میگردد. این انرژی آزاد شده از نوع امواج الکترومغناطیسی است و معمولا به صورت امواج نور با طول موج مشخص بازتاب میشود. به دلیل منحصر به فرد بودن سطوح انرژی الکترونی در هر اتم، با برانگیخته کردن و بازنشر انرژی اتم میتوان طول موجهای ساطع شده را شناسایی کرد و یک طیف نشری مشخص برای هر اتم به دست آورد. این طیفهای نشری در واقع حکم اثر انگشت عناصر را دارند و میتوانند برای شناسایی ترکیبات مختلف استفاده شوند.
تفاوت حالت پایه و حالت برانگیخته
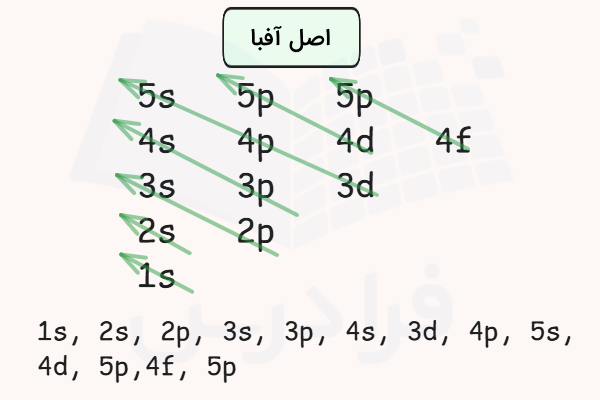
حالت پایه اتم (الکترون) حالتی است که در آن تمامی الکترونهای اتم در پایدارترین سطح انرژی خود قرار دارند. در حالت پایه اتم و الکترونهای آن هیچ انرژیای را جذب یا نشر نمیکنند. در حالت پایه اتم الکترونها طبق اصل آفبا، زیرلایهها و اوربیتالهای الکترونی را پر میکنند و در همان حالت باقی میمانند.
این ترتیب به شکل زیر است.
حالت برانگیخته اتم (الکترون) حالتی است که در آن الکترون اتم مقدار مشخصی انرژی دریافت کرده و به سطوح انرژی بالاتر میرود. این حالت ناپایدار است و اتم با نشر انرژی به صورت فوتون به حالت پایه بازمیگردد. مقدار انرژی جذب شده و نشر شده در حالت براگیخته باهم برابر است و مقداری برابر با اختلاف انرژی سطح پایه و برانگیخته دارد.
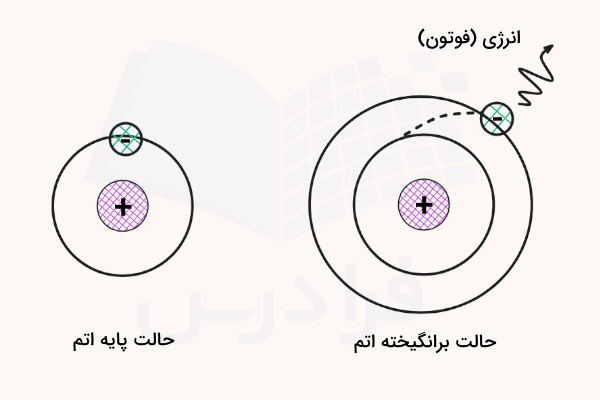
در حالت برانگیخته، بیشترین مقدار انرژی که الکترون میتواند جذب کند باید در حدی باشد که جاذبه هسته بر روی آن اثر بگذارد. به عبارتی اگر الکترون به حدی انرژی جذب کند که از مدار جاذبه هسته خارج شود، دیگر جزو اتم به حساب نمیآید و اتم به اصطلاح «یونیزه» میشود. الکترون اتمها با دریافت انرژی به شکل مستقیم یا بر اثر برخورد با سایر ذرات میتوانند برانگیخته شوند.
لایهها و اوربیتال الکترونی
در هر اتم، الکترونها با سطح انرژی مشخصی وجود دارند. این سطوح انرژی با توجه به فضای احتمالی حضور اتم بر اساس رابطه شرودینگر، به لایهها، زیر لایهها و اوربیتالهای الکترونی تقسیم شدهاند. هر لایه الکترونی تعداد مشخصی الکترون را در زیرلایهها و هر زیرلایه تعداد مشخصی الکترون را در اوربیتالهای دوتایی خود جای میدهد. هر یک از این موارد با یک عدد کوانتومی مشخص میشود. هر الکترون مجموعهای از ۴ عدد کوانتومی اصلی، فرعی، مغناطیسی و اسپینی اختیار میکند و مجموعه این ۴ عدد برای هر الکترون منحصر به فرد است.
به همین دلیل هیچ دو الکترونی در یک اتم نمیتوانند اعداد کوانتومی برابر داشته باشند و با جذب و دفع انرژی توسط اتم برانگیخته، مقدار مشخصی انرژی ساطع میشود. برای درک بهتر لایهها و زیرلایههای الکترونی، به تصویر زیر دقت کنید.
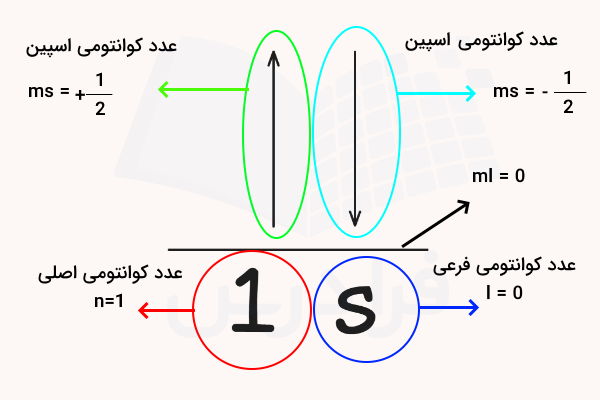
همانطور که در تصویر مشاهده میکنید، اوربیتالها با ۴ عدد کوانتومی توصیف میشود. این اعداد به شرح زیر هستند.
- (n) عدد کوانتومی اصلی: سطح انرژی (لایه الکترونی) الکترون را مشخص میکند و میتواند اعداد صحیح بین ۱ تا ۷ را داشته باشد.
- (l) عدد کوانتومی تکانه زاویهای : شکل اوربیتال را مشخص میکند و میتواند مقادیر (n-1) داشته باشد که اوربیتالهای s، p، d و f را مشخص میکند.
- () عدد کوانتومی مغناطیسی: جهتگیری اوربیتال را در فضا مشخص میکند و میتواند مقادیر (l+ تا l-) را داشته باشد.
- () عدد کوانتومی اسپین الکترون: کمیتی به نام اسپین الکترون را مشخص میکند که میتواند یکی از دو مقادیر و را داشته باشد.
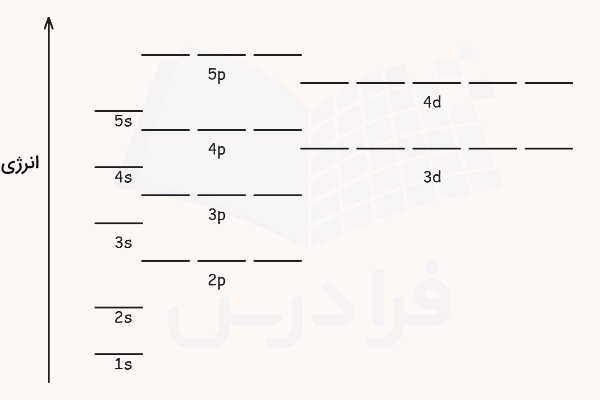
برای توصیف مکان یک الکترون در اتم، ترکیبی از هر چهار عدد کوانتومی لازم است. این اعداد نشاندهنده سطح انرژی الکترون (n)، شکل کلی اوربیتال (l)، جهتگیری فضایی آن () و اسپین الکترون () هستند. در مجموع برای نمایش این اوربیتالها و مقدار انرژی هریک، از نموداری مشابه نمودار زیر استفاده میشود.
یادگیری شیمی دهم با فرادرس
برای درک بهتر اتم برانگیخته و تفاوت آن با حالت پایه، نیاز است ابتدا با مفاهیمی چون ساختار اتم، آرایش آفبا، آرایش الکترونی فشرده و آرایش الکترونی گسترده اتمها آشنا شویم. پیشنهاد میکنیم برای درک بهتر این مفاهیم، به مجموعه فیلم آموزش دروس پایه دهم، بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه اتم برانگیخته دسترسی داشته باشید.
- فیلم آموزش علوم تجربی پایه نهم بخش شیمی فرادرس
- فیلم آموزش شیمی ۲ پایه یازدهم حل سوالات تشریحی امتحانات نهایی فرادرس
- فیلم آموزش شیمی ۲ پایه یازدهم رشته علوم تجربی و ریاضی و فیزیک فرادرس
فرآیند برانگیخته شدن اتم
وقتی یک الکترون در اتم بهوسیلهی یک منبع انرژی (مانند پلاسما یا شعله) برانگیخته میشود، این الکترون از اوربیتال حالت پایه خود به اوربیتال با انرژی بالاتر منتقل میگردد. این وضعیت ناپایدار است، زیرا الکترون تمایل دارد دوباره به حالت پایدارتر (حالت پایه) بازگردد.
هنگامی که الکترون از حالت انرژی بالاتر به حالت پایینتر بازمیگردد، اختلاف انرژی میان این دو حالت بهصورت نور آزاد میشود. این فرآیند، اساس تولید نور در طیفسنجی نشر اتمی است. انرژی نوری که آزاد میشود بهطور مستقیم با اختلاف انرژی بین دو اوربیتال مربوط است و میتوان آن را با معادله زیر بیان کرد:
در این فرمول، E انرژی تابش شده، h ثابت پلانک، و بسامد تابش است. پیشنهاد میکنیم برای درک بهتر این فرمول و کاربرد آن در طیف سنجی، فیلم آموزش طیف سنجی اتمی فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
مثال اتم برانگیخته
برای درک بهتر روش برانگیخته شدن اتم و تابش نور و انرژی توسط آن، به ساختار الکترونی اتم لیتیوم با ۳ الکترون دقت کنید. در حالت پایه اتم لیتیم، یک الکترون آن در اوربیتال 2s و دو الکترون آن در اوربیتال 1s قرار دارند. با جذب انرژی توسط این اتم، تک الکترون لایه ظرفیت این اتم (2s) انرژی دریافت میکند.
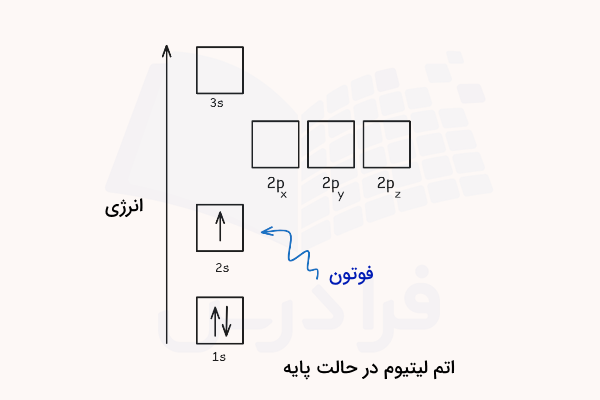
انرژی فوتون برای برانگیختن این الکترون باید دقیقا برابر با اختلاف انرژی اوربیتال 2s و 2p باشد. با استفاده از فرمول اشاره شده، مقدار انرژی این فوتون برای لیتیوم باید برابر با و طول موج ۶۷۰٫۷۸ نانومتر باشد. بدین ترتیب الکترون لیتیوم با اوربیتال 3s میرود. اتم لیتیوم در حالت برانگیخته میتواند با نشر فوتونی با همان انرژیای که قبلا جذب کرده بود، دوباره به حالت پایه بازگردد.
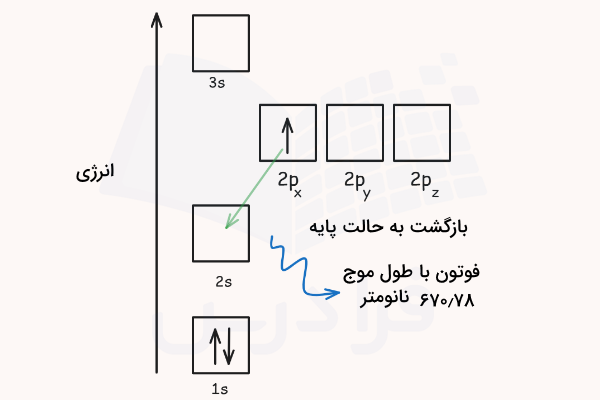
در این وضعیت، زمانی که الکترون از اوربیتال 2p به اوربیتال 2s بازمیگردد، فوتونی با طول موج ۶۷۰٫۷۸ نانومتر تابش میشود که بهصورت نور قرمز قابل مشاهده است. در فیزیک کوانتومی فقط گذارهایی مجاز هستند که در آنها عدد کوانتومی تکانه زاویهای (l) یک واحد تغییر کند. در مثال ما، الکترون از اوربیتال s (با l=۰) به اوربیتال p (با l=۱) رفت. این گذار مجاز است چون مقدار عدد کوانتومی تکانه زاویهای تنها ۱ واحد تغییر کرده است.
یک گذار مجاز دیگر میتواند از 2s به 3p باشد که به انرژی بیشتری نیاز دارد و نور تابیدهشده طول موج کوتاهتری خواهد داشت.
برانگیختگی اتم هیدروژن
اتم هیدروژن به این دلیل داشتن تنها یک الکترون، اتمی است که برای بررسی نشر الکترونی و برانگیختگی اتم توسط نیلز بور بررسی شده است. در حالت پایه، الکترون منفرد اتم هیدروژن در پایینترین اوربیتال ممکن قرار دارد یعنی تابع موج کروی و متقارن «1s» که تاکنون نشان داده شده دارای کمترین اعداد کوانتومی ممکن است. با دادن انرژی اضافی به اتم (برای مثال از طریق جذب یک فوتون با انرژی مناسب)، الکترون به حالت برانگیخته منتقل میشود حالتی که در آن یک یا چند عدد کوانتومی بزرگتر از حداقل مقدار خود هستند.
اگر فوتون انرژی بیشازحد داشته باشد، الکترون دیگر به اتم نخواهد ماند و اتم یونیزه میشود. پس از برانگیختگی، اتم ممکن است با گسیل یک فوتون با انرژی مشخص، به حالت پایه یا به یک حالت برانگیختهی پایینتر بازگردد. نشر فوتونها از اتمها در حالتهای برانگیختهی گوناگون، طیفی الکترومغناطیسی شامل مجموعهای از خطوط گسیل ویژه ایجاد میکند (که در مورد اتم هیدروژن شامل سریهای لایمن، بالمر، پاشن و براکت است).
اتمی که در حالت برانگیختهی بالایی قرار داشته باشد، «اتم ریدبرگ» نامیده میشود. مجموعهای از اتمهای بسیار برانگیخته میتواند حالتی چگال و پایدارتر به نام «مادهی ریدبرگ» را شکل دهد.
ناپایداری اتم برانگیخته
اتم در حالت برانگیخته ناپایدار است زیرا الکترونها در این حالت در سطح انرژی بالاتری نسبت به حالت پایه قرار دارند و این وضعیت انرژی بیشتری دارد. طبیعت به سمت کمینه انرژی تمایل دارد، بنابراین الکترونها تمایل دارند به حالت پایدار و کمانرژیتر یعنی حالت پایه اتم بازگردند.
هنگام بازگشت به حالت پایه، انرژی اضافی که الکترون در حالت برانگیخته دارد، به صورت تابش نور یا فوتون آزاد میشود. به همین دلیل حالت برانگیخته گذرا و ناپایدار است و تنها برای مدت کوتاهی دوام میآورد.

رابطه انرژی الکترون و هسته اتم
رابطه بین انرژی الکترونها و هسته اتم، کلید درک رفتار اتمها و طیفهای نوری آنهاست. الکترونها انرژی منفی دارند و هرچه به هسته نزدیکتر باشند، انرژی آنها کمتر (منفیتر) است و نزدیکترین سطح به هسته حالت پایه محسوب میشود.
سطوح انرژی گسسته هستند و الکترونها فقط در این سطوح مشخص قرار میگیرند. هرچه سطح انرژی بالاتر باشد، الکترون دورتر از هسته است و انرژی آن کمتر منفی یا بالاتر است. هنگام انتقال الکترون از سطح پایین به بالا، انرژی جذب میشود و هنگام بازگشت، انرژی به صورت فوتون آزاد میشود که طول موج آن به اختلاف انرژی بین سطوح بستگی دارد.
انواع حالات برانگیختگی
در قسمتهای قبل آموختیم مفهوم اتم برانگیخته چیست. الکترونها در یک اتم تمایل دارند به گونهای چیده شوند که انرژی اتم حداقل باشد. حالت پایه اتم، پایینترین حالت انرژی اتم است. وقتی به اتمها انرژی داده میشود، الکترونها آن انرژی را جذب کرده و به سطح انرژی بالاتری میروند. الکترونهای هر اتم میتواند بسته به مقدار انرژی دریافت شده، به سطوح الکترونی متفاوتی برود.
یک اتم میتواند چند حالت برانگیختگی داشته باشد زیرا الکترونهای آن میتوانند به سطوح انرژی مختلف و بالاتر از حالت پایه منتقل شوند. هر سطح انرژی بالاتر یک حالت برانگیختگی جداگانه ایجاد میکند و انرژی لازم برای رسیدن به هر سطح با سطحهای دیگر متفاوت است. در ادامه این انواع حالتها را بررسی میکنیم.
حالت برانگیختگی اول
حالت برانگیختگی اول حالتی است که الکترون پس از دریافت کمترین انرژی لازم از حالت پایه به سطح انرژی بالاتر میرود. این حالت نسبتا نزدیک به حالت پایه است و اتم همچنان انرژی کمی دارد اما پایدار نیست و تمایل دارد سریع به حالت پایه بازگردد.
حالت برانگیختگی دوم
حالت برانگیختگی دوم زمانی رخ میدهد که الکترون انرژی بیشتری دریافت کرده و به سطح انرژی بالاتر از حالت اول برود. انرژی پتانسیل اتم در این حالت بیشتر است و بازگشت به حالت پایه یا حالت اول با انتشار انرژی بیشتر همراه خواهد بود.
حالت برانگیختگی سوم
حالت برانگیختگی سوم حالتی است که الکترون حتی انرژی بیشتری جذب کرده و به سطح بالاتری نسبت به دو حالت قبلی میرسد. این حالت بسیار ناپایدار است و معمولا اتم سریعا به سطوح پایینتر بازمیگردد و انرژی اضافی خود را به صورت تابش منتشر میکند.
حالتهای برانگیختگی بالاتر هم وجود دارند. الکترونها میتوانند به هر سطح انرژی مشخص بالاتر از حالت پایه بروند، مشروط بر اینکه انرژی کافی برای رسیدن به آن سطح وجود داشته باشد. هرچه سطح انرژی بالاتر باشد، انرژی و ناپایداری الکترون و تمایل بازگشت ان به حالت پایه بیشتر میشود.
بازگشت الکترون و طیف نشری
وقتی اتم انرژی دریافت میکند، الکترونهای آن از سطحهای انرژی پایین به سطحهای بالاتر میروند. اما این حالت پایدار نیست و الکترونها برای بازگشت به حالت اولیه باید انرژی آزاد کنند. این انرژی به صورت نور منتشر میشود و طیف نشری را بهوجود میآورد. در این روند، تابش الکترومغناطیسی با اتمها و مولکولها برخورد کرده و باعث میشود الکترونها انرژی جذب کنند و به سطح بالاتری بروند. در این وضعیت، تعادل آنها به هم میخورد.
برای بازگشت به تعادل، الکترونها دوباره به سطح انرژی پایینتر برمیگردند و انرژی اضافی خود را به شکل نور آزاد میکنند. به این ترتیب، اتمها و مولکولها در بخشهای مختلفی از طیف الکترومغناطیسی نور نشر میکنند. این نور منتشرشده همان چیزی است که «طیف نشری» نامیده میشود.
طیف نشری چیست؟
طیف نشری یک عنصر یا ترکیب شیمیایی، مجموعهای از بسامدهای نوری است که هنگام بازگشت الکترونها از سطح انرژی بالاتر به سطح پایینتر آزاد میشود. انرژی هر فوتون منتشرشده دقیقا برابر با اختلاف انرژی بین این دو سطح است. هر اتم میتواند گذارهای مختلفی داشته باشد و هر گذار با اختلاف انرژی مشخصی همراه است. همین گذارهای گوناگون باعث تابش طولموجهای متفاوت میشوند و در کنار هم طیف نشری را میسازند.
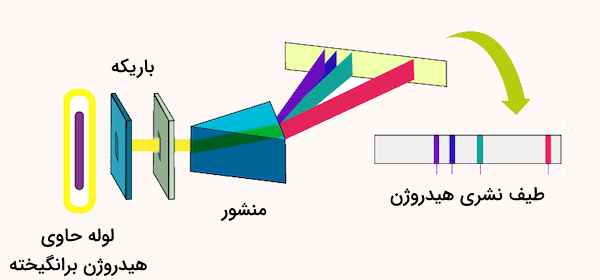
از آنجا که طیف نشری هر عنصر منحصر به فرد است، دانشمندان با استفاده از طیفسنجی میتوانند عناصر موجود در مواد ناشناخته را شناسایی کنند. همچنین طیف نشری مولکولها در بررسی و تحلیل شیمیایی مواد کاربرد فراوان دارد. برای مثال، طیف نشری اتمهای آهن و جیوه در تصویر زیر مشخص شده است. همه نورهای منتشرشده توسط چشم قابل دیدن نیستند، زیرا طیف شامل پرتوهای فرابنفش و مادون قرمز نیز میشود. طیف نشری هنگامی تشکیل میشود که یک گاز برانگیخته مستقیما از طریق طیفسنج مشاهده شود.

مثال طیف نشری اتم برانگیخته
اتم هیدروژن یکی از مثالهای رایج برای بررسی طیف نشری آن است. این اتم که تنها دارای یک الکترون و یک پروتون است میتواند به چندین حالت براگیخته شده و سریهای مختلفی از خطوط طیفی را نشر دهد.
این طیف شامل چند زیرسری است که هرکدام به نام دانشمندانی که آنها را ابتدا مشاهده کردند نامگذاری شدهاند. خطوط موجود در این سریها ناشی از پرش الکترونها بین سطوح انرژی مختلف است. وقتی الکترون از سطح انرژی بالاتر به پایینتر میرود، فوتونی نشری میشود که انرژی آن برابر با اختلاف انرژی دو سطح است. در تصویر زیر انواع این سریها و گذارهای مربوط به آنها را مشاهده میکنید.
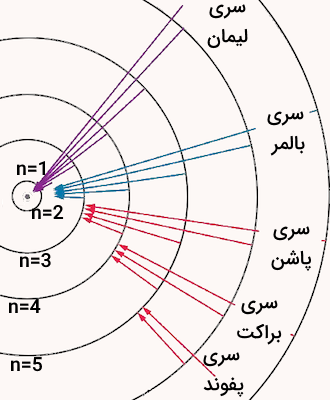
انواع نشر انرژی اتم برانگیخته
وقتی یک الکترون برانگیخته دوباره به حالت پایه بازمیگردد، انرژی خود را به شکل فوتون، گرما یا امواج الکترومغناطیسی خاصی آزاد میکند. فوتون منتشرشده با فوتونی که جذب شده بود متفاوت است، زیرا بخشی از انرژی در اثر ارتعاشات مولکولی از دست میرود.
بازگشت الکترون به حالت پایه میتواند یکمرحلهای یا چندمرحلهای باشد. در یک مخلوط شیمیایی با دو نوع مولکول، اگر حالت برانگیخته مولکول اول نزدیکتر به حالت پایه مولکول دوم باشد، الکترون میتواند به مولکول دوم منتقل شود و فوتونهایی با طول موج بلندتر (انرژی کمتر) تابش کند این پدیده فلورسانس نام دارد.
همچنین، بازگشت حالت سهگانه با چرخش اسپین معکوس فسفرسانس نامیده میشود که نور تابیدهشده طول موجی بلندتر از فلورسانس دارد.
طیف سنجی نشری
طیفسنجی نشری، یک تکنیک طیفسنجی است که طول موجهای فوتونهای ساطعشده توسط اتمها یا مولکولها در هنگام گذار از حالت برانگیخته به حالت انرژی پایینتر را بررسی میکند. هر عنصر مجموعهای مشخص از طول موجهای گسسته را طبق ساختار الکترونی خود منتشر میکند و با مشاهده این طول موجها میتوان ترکیب عنصری نمونه را تعیین کرد. پیشنهاد میکنیم برای درک بهتر این نوع طیف سنجی، مطلب انواع طیف سنجی مجله فرادرس را مطالعه کنید.
در این روش معمولا محلول حاوی آن ماده به داخل مشعل کشیده شده و به صورت افشانهای ریز در شعله پخش میشود. ابتدا حلال تبخیر میشود و ذرات جامد بسیار ریز باقی میمانند که به داغترین قسمت شعله میروند. در این ناحیه، مولکولها شکسته شده و اتمها و یونهای گازی آزاد میشوند. الکترونهای این اتمها برانگیخته شده و هنگام بازگشت به حالت انرژی پایینتر، نور یا فوتون ساطع میکنند. معمولا برای سادهتر شدن تشخیص، از یک تکرنگکننده (مونوکروماتور) استفاده میشود.
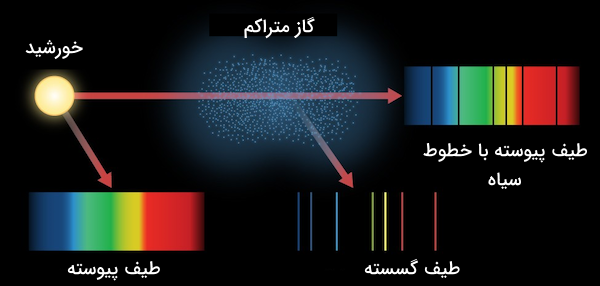
طیف خطی و طیف پیوسته
وقتی نور از یک شکاف کوچک عبور میکند، پراش پیدا میکند و به اطراف منتشر میشود. شبکه پراش (diffraction grating) وسیلهای شفاف با خطوط بسیار نزدیک به هم است که نور را به رنگهای تشکیلدهندهاش تقسیم میکند و الگوی حاصل، اطلاعات دقیقی درباره منبع نور به ما میدهد.
نور خورشید و لامپهای رشتهای طیف پیوسته تولید میکنند. یعنی رنگها بهطور پیوسته و بدون فاصله با هم مخلوط میشوند. دلیل آن این است که در جامدات، سطوح انرژی الکترونها به هم نزدیکند و الکترونها میتوانند فوتون با هر انرژی ساطع کنند. از طرفی در گازها، برای مثال لامپهای فلورسنت طیف خطی ایجاد میکنند. یعنی نور شامل خطوط رنگی مشخص و گسسته است. علت آن این است که الکترونهای بخار داخل این لامپها تنها میتوانند بین سطوح انرژی معین حرکت کنند، بنابراین تنها طول موجهای خاصی از نور تولید میشوند.
در تصویر زیر تفاوت طیف خطی و پیوسته مشخص شده است.
آزمون شعله
در سادهترین حالت، طیف نشری شعله را میتوان با یک شعله و نمونههایی از نمکهای فلزی مشاهده کرد. این روش تحلیل کیفی به «آزمون شعله» معروف است. برای مثال:
- نمکهای سدیم شعلهای زرد تولید میکنند.
- یونهای استرانسیوم شعله را قرمز میکنند.
- سیم مسی شعلهای آبی ایجاد میکند، اما در حضور کلرید، شعله سبز میشود.

در این روش با شناسایی صحیح رنگ ماده در آتش میتوان به نوع اتمهای آن پی برد.
روش برانگیخته کردن اتم
برانگیختگی اتم بیشتر وقتها زمانی رخ میدهد که فوتونی با انرژی دقیقا برابر فاصلهی بین دو مدار جذب شود. در اتمهای بزرگتر این کار با پرتوهای الکترونی یا یونی هم انجام میشود. در این روش ذرات پرسرعت به الکترونهای اتم برخورد کرده و انرژی خود را منتقل میکنند.
برخی مواد مثل نیمهرساناها به دلیل داشتن فاصلهی انرژی خیلی کم، حتی با گرما هم برانگیخته میشوند. در این حالت، ارتعاشات شبکهی بلوری انرژی لازم را به الکترون میدهند تا از حالت پایه به سطح بالاتر برود. بیشتر حالتهای برانگیختهی الکترونی اتمها طولعمر بسیار کوتاهی دارند و تنها چند نانو ثانیه پایدار میمانند. امروزه برای نگه داشتن اتمها در حالت برانگیخته برای مدت طولانیتر، از لیزرهای فوقسریع با پالسهای فمتوثانیه استفاده میشود.
یادگیری شیمی کوانتوم با فرادرس
برای درک بهتر اتم برانگیخته و ویژگیهای آن ابتدا باید با مفاهیمی چون آرایش الکترونی اتم، روش تشکیل پیوند شیمیایی، پرتوزایی، طیف سنجی و ... آشنا شوید. پیشنهاد میکنیم برای درک بهتر این مفاهیم به مجموعه فیلم آموزش شیمی از دروس دانشگاهی تا کاربردی فرادرس مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که در ادامه آورده شده است میتوانید به آموزشهای بیشتری در مورد اتم برانگیخته دسترسی داشته باشید.
- فیلم آموزش شیمی فیزیک جامع و با مفاهیم کلیدی
- فیلم آموزش شیمی فیزیک ۲ مرور و حل تست کنکور ارشد
- فیلم آموزش شیمی فیزیک ۳
اهمیت و کاربرد اتم برانگیخته در علوم مختلف
در این مطلب از مجله فرادرس آموختیم مفهوم اتم برانگیخته و نشر اتمی چیست. مطالعه طیفهای نشری و جذبی مواد برانگیخته یکی از مهم ترین روشها برای شناسایی مواد در نمونههای مجهول است. از ویژگی نشر اتم برانگیخته در بسیاری از فناوریها و علوم استفاده میشود. برای مثال، اخترشناسان با استفاده از خطوط نشری و جذبی خورشید به اجزای سازنده آن مانند هیدروژن، آهن و کربن پیبردهاند.
در ادامه، برخی از کاربردها و اهمیت اتم برانگیخته در علوم مختلف را بررسی میکنیم.
فیزیک و شیمی
از پدیده نشر اتم برانگیخته در علوم فیزیک و شیمی برای مطالعه امواج الکترومغناطیس و شناسایی بسیاری از مواد استفاده میشود. برای مثال، شناسایی انواع اتمها در ترکیبات گوناگون در آزمایشگاه شیمی و تجزیه کیفی و کمی عناصر از کاربردهای این پدیده در شیمی هستند.
همچنین، بررسی و مطالعه انواع لیزرها، پلاسما ، ترکیب ستارگان و ... نیز از کاربردهای مهم اتم برانگیخته در فیزیک هستند.
ساخت لیزر
از پدیده نشر اتم برانگیخته در تولید لیزرها استفاده میشود که خود کاربردها، انواع و استفادههای گسترده ای دارند. در تولید پرتوهای لیزر، تنها یک حالت برانگیخته ایجاد میشود که در نیتجه آن نوری با یک فرکانس واحد تولید میشود.
البته در عمل، لیزرهای تجاری ارزانقیمت نوری با دامنهای بسیار باریک از طول موجها تابش میکنند. لیزرهایی که امروزه در محصولات تجاری استفاده میشوند معمولا دیودهای نیمهرسانای قرمز و کمهزینه هستند.
اخترفیزیک
اخترشناسان از طیفهای نشر و جذب برای تعیین ترکیب ستارگان و مادهی میانستارهای بهره میگیرند.
سایر کاربردها
از قابلیت نشر اتم برانگیخته به ویژه در تولید تابلوهای نئونی و مواد و وسایل فلوئورسانس و فسفرسانس استفاده میشود. در تابلوهای نئونی، یک تخلیهی الکتریکی باعث میشود اتمهای خنثی به حالت برانگیختهی انرژی بالاتر منتقل شوند، و هنگامی که این اتمها به حالت پایه بازمیگردند، نور تابش میشود.

بسیاری از چراغهای خیابانی از لامپهایی استفاده میکنند که حاوی بخار سدیم یا جیوه هستند. به دلیل تفاوت زیاد در طیفهای گسیل این عناصر، آنها نوری با رنگهای متفاوت تولید میکنند. همچنین، از نشر اتم برانگیخته در تولید مواد و وسایل آتشبازی نیز استفاده میشود. در این موارد، از انرژی گرمایی برای برانگیخته کردن اتمها ی مواد مختلفی مانند سدیم، آلومینیوم، گوگرد و پتاسیم استفاده میشود.












