کاتیون و آنیون – به زبان ساده
کاتیون و آنیون هر دو به عنوان یون شناخته میشوند. اگر یک اتم یا تعدادی از اتمها، در هسته خود، تعداد برابری از الکترون و پروتون داشته باشند، بار کلی آن اتم خنثی خواهد بود. اگر این توازن بین الکترون و پروتون برقرار نباشد، بار الکتریکی در اتم ایجاد و یون تشکیل میشود. بسته به مثبت یا منفی بودن این بار الکتریکی، کاتیون یا آنیون خواهیم داشت.


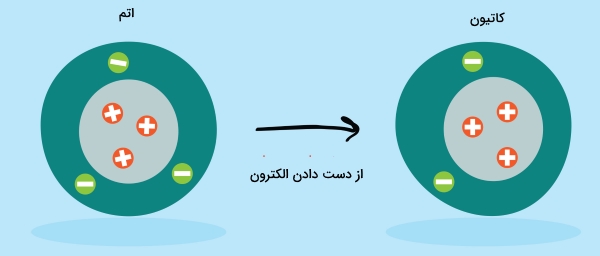
کاتیون چیست؟
اگر پروتون بیشتری نسبت به الکترون داشته باشیم، یک کاتیون تشکیل میشود که بار خالص مثبت دارد. به عبارت دیگر، برای تشکیل کاتیون باید یک یا چند الکترون از دست بدهیم که به طور معمول، این الکترونها توسط اتم دیگری با «الکترونخواهی» (Electron Affinity) بیشتر جذب میشود.
تعداد الکترون از دست رفته و به دنبال آن، بار مثبت ایجاد شده را بعد از نماد شیمیایی عنصر قرار میدهند. به طور مثال، نقره (Ag) با از دست دادن یک الکترون به کاتیون تبدیل میشود درحالیکه روی (Zn)، دو الکترون از دست میدهد و تشکیل خواهد شد.
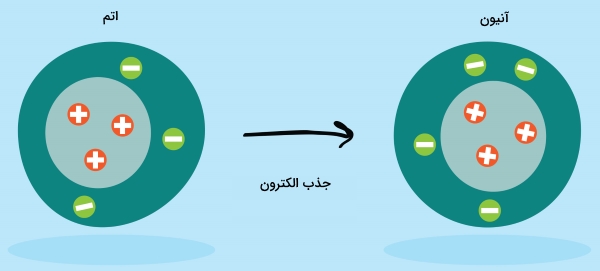
آنیون چیست؟
یک آنیون تعداد الکترون بیشتری نسبت به پروتون دارد و در نتیجه، بار الکتریکی آن منفی خواهد بود. برای تشکیل آنیون باید یک یا چند الکترون توسط اتم جذب شوند. این الکترونها را میتوان از اتمی با الکترونخواهی کمتر بدست آورد. همانند کاتیون نیز در اینجا، تعداد الکترون جذب شده و بار یون را بعد از نماد شیمیایی اتم ذکر میکنند. به طور مثال، اتم کلر با جذب الکترون به یون تبدیل میشود درحالیکه در اتم اکسیژن، با جذب دو الکترون، یون خواهیم داشت.
تفاوت بین کاتیون و آنیون
تفاوتهای اصلی ببین کاتیون و آنیون را در جدول زیر مشاهده میکنید. اتمهای فلزی، برخی از الکترونهای خود را با قدرت کمتری در اطراف خود نگه داشتهاند. در نتیجه، تمایل به از دست دادن الکترون و تشکیل کاتیون دارند. به عکس، بیشتر اتمهای نافلزی، الکترونها را با قدرت بیشتری نسبت به فلزات جذب میکنند و بنابراین، آنیون تشکیل میدهند. در نتیجه، زمانی که دو اتم فلزی و نافلزی با یکدیگر ترکیب شوند، اتم نافلزی تمایل دارد تا یک یا چند الکترون از اتم فلزی را به خود جذب کند تا به این ترتیب، یونهای مثبت و منفی تشکیل شوند.
در ادامه، این یونهای مثبت منفی، با جذب یکدیگر، پیوندی موسوم به پیوند یونی را تشکیل میدهند که ترکیبات حاصل از آنها، دارای بار الکتریکی خنثی هستند. از نمونههای این نوع ترکیبات میتوان به کلسیم کلرید با فرمول ، پتاسیم یدید و منیزم اکسید اشاره کرد.
| کاتیون | آنیون | |
| بار الکتریکی | مثبت | منفی |
| الکترود متصل شده به آن | کاتد (منفی) | آند (مثبت) |
| نحوه تشکیل | توسط اتم فلزی | اتمهای نافلزی |
| مثال | سدیم ، آهن | کلرید ، سولفات $$(SO _ $ ^ {2-})$$ |
کاتیون و آنیون در جدول تناوبی
بر اساس محل قرارگیری اتمها در جدول تناوبی میتوان تشکیل کاتیون یا آنیون را پیشبینی کرد. هالوژنها همواره آنیون تشکیل میدهند درحالیکه یونهای فلزات قلیایی و قلیایی خاکی به صورت کاتیون هستند. بیشتر فلزات همچون آهن، نقره و نیکل، کاتیون تشکیل میدهند درحالیکه نافلزات همچون اکسیژن، کربن و گوگرد به طور معمول به صورت آنیون هستند.
البته برخی از اتمها نیز بسته به شرایط، آنیون یا کاتیون تشکیل میدهند. از نمونههای این اتمها میتوان به هیدروژن اشاره کرد که به صورت یا وجود دارند. عناصر گروه ۱۸ جدول تناوبی عناصر موسوم به گازهای نجیب هستند که به دلیل آرایش الکترونی خود تمایلی به تشکیل یون ندارند و به همین دلیل، واکنشپذیر نیستند.
آنیون و کاتیون در الکتروشیمی
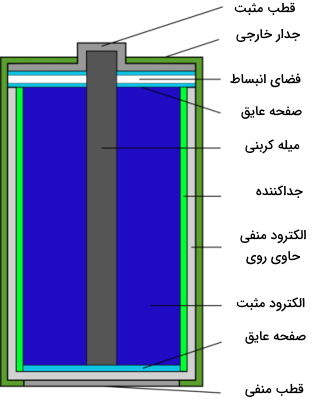
یک شیمیدان از خواص یونی در اهداف مختلفی بهره میگیرد که از جمله آن میتوان به کروماتوگرافی تبادل یونی اشاره کرد که بر اساس جدایش مولکولها به کمک فاز ساکن بنا شده است. خواص یونی همچنین در الکتروشیمی و عملکرد باتریها نقش اصلی را ایفا میکنند. باتریها شامل دو الکترود رسانا به نامهای کاتد و آند هستند. کاتد، بخش مثبت الکترود را تشکیل میدهد که در آن، با ورود الکترونها، خروج جریان الکتریکی را شاهد هستیم. در بین الکترودها نیز، الکترولیت به صورت مایع یا ژل وجود دارد که حاوی یونهای باردار است.
در اثر واکنش الکترولیت با الکترودها، جریان الکتریکی تولید میشود. به طور مثال، در باتریهای خشک، عنصر روی به طور معمول به عنوان آند و منگنز دیاکسید به عنوان کاتد الکترولیت مورد استفاده قرار میگیرد. علاوه بر این، در باتریهای روی-کادمیم، عنصر روی، محفظه باتری را نیز تشکیل میدهد که در طول استفاده، به مرور، اکسایش پیدا میکند و به همین دلیل بعد از مدتی، مواد از داخل آن به بیرون نشت پیدا میکنند.
در باتریهای قابل شارژ همچون باتریهای لیتیوم-یونی، این فرآیند شیمیایی، به دلیل ساختار داخلی متفاوت، برگشتپذیر است که سبب شارژ مجدد باتری میشود. به دلیل خواص یونی آب شور، دانشمندان در تلاش هستند تا با ترکیب آب شیرین و شور و با بهرهگیری از پتانسیل تولید برق، به منبعی سبز برای تولید برق دست پیدا کنند. در تصویر زیر، سلول خشک روی-کربن نشان داده شده است.
یونهای تک اتمی
در بحث کاتیون و آنیون باید به طور مختصری در خصوص تشکیل یونهای تکاتمی هم صحبت کنیم. یونهای تکاتمی از طریق حذف یا اضافه کردن الکترونها از لایه ظرفیت اتم تشکیل میشوند. در حقیقت، اوربیتالهای لایههای داخلی اتمها با الکترونهایی پر شدهاند که به شدت تحت تاثیر بار مثبت هسته قرار دارند و بنابراین، در برهمکنشهای شیمیایی شرکت نمیکنند اما لایه ظرفیت، بسته به نوع آرایش الکترونی، بسیار واکنشپذیر است. به فرآیند گرفتن یا از دست دادن الکترون از یک اتم یا مولکول، «یونش» (Ionization) میگویند.
اتمها را میتوان از طریق بمباران پرتوها یونیزه کرد اما در حالت سادهتر نیز این اتفاق از طریق انتقال الکترونها بین اتمها یا مولکولها اتفاق میافتد. این انتقال الکترونی برای رسیدن به حالت پایدار الکترونی و پیروی از قاعده اکتت صورت میگیرد.
به طور مثال، اتم سدیم در گروه ۱ از جدول تناوبی را در نظر بگیرید. این عنصر، در لایه ظرفیت خود تنها یک الکترون دارد و زیرلایههای آن تعداد ۲ و ۸ الکترون دارند. با حذف این یک الکترون، اتم سدیم به پایداری میرسد و لایههای آخر آن ۸ الکترون و آرایش الکترونی مشابه با نئون خواهد داشت. با حذف الکترون، اتم سدیم به کاتیون تبدیل میشود. یونش سدیم را میتوان به کمک معادله شیمیایی زیر نشان داد.
البته برای اینکه سدیم، از قاعده اکتت پیروی کند میتوانست ۷ الکترون جذب کند اما حذف یک الکترون، بسیار سادهتر از جذب ۷ الکترون خواهد بود. در نتیجه، اتم سدیم در همه حالتها، برای رسیدن به پایداری، الکترون از دست میدهد.
در مقابل، اتم کلر، در لایه ظرفیت خود هفت الکترون دارد و برای رسیدن به آرایش پایدار گاز نجیب، تنها به یک الکترون نیاز دارد و با این کار به آنیون تبدیل خواهد شد. یونش کلر را نیز به صورت زیر نشان میدهیم:
با ترکیب این دو خاصیت، یعنی از دست دادن الکترون سدیم و دریافت الکترون توسط کلر، شاهد یک واکنش خواهیم بود. با ترکیب این دو اتم خنثی و تبادل الکترون، هر دو کاتیون و آنیون تشکیل شده، با تشکیل یک پیوند یونی، به یکدیگر متصل میشوند و شبکه بلوری را تشکیل میدهند که به نمک طعام معروف است. این واکنش را در زیر مشاهده میکنید:
یونها و مولکولهای چنداتمی
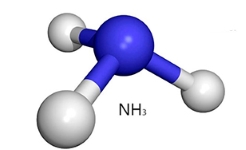
فرآیند یونش، تنها به اتمهای منفرد محدود نمیشود بلکه امکان تشکیل یونهای چنداتمی نیز وجود دارد. یونها و مولکولهای چنداتمی از طریق حذف یا اضافه کردن یونهای عنصری همچون به مولکولهای خنثی بوجود میآیند. به طور مثال، زمانیکه آمونیاک ، یک پروتون جذب کند، یک کاتیون آمونیوم تشکیل خواهد شد. کاتیون آمونیوم و آمونیاک، هر دو با تعداد برابر الکترون، آرایش الکترونی یکسانی دارند اما در کاتیون آمونیوم، یک پروتون اضافه داریم که بار خالص مثبت را ایجاد میکند.
نحوه نمایش کاتیون و آنیون
پیشتر در خصوص نحوه نمایش کاتیون و آنیون صحبت کردیم اما در این بخش میخواهیم توضیح دقیقتری را به همراه مثالهای بیشتر مطرح و شکلهای مختلف نمایش کاتیون و آنیون را بررسی کنیم.
زمانیکه فرمول شیمیایی یک یون را مینویسیم، بار الکتریکی آنرا دقیقا بعد از نماد شیمیایی کاتیون یا آنیون ذکر میکنیم. زمانی که یک کاتیون با دو بار مثبت داشته باشیم، آنرا به صورت به جای مینویسیم. البته درصورتیکه تنها یک بار مثبت (یا منفی) داشته باشیم، از ذکر عدد خودداری میکنیم. در روشی جایگزین نیز میتوانیم یک کاتیون همچون آهن با دو بار مثبت را به صورت نشان دهیم.
نمایش اعداد اکسایش
در رابطه با فلزات واسطه، اعداد اکسایش را با اعداد رومی نشان میدهیم. به طور مثال، را به شکل آهن (II) یا نشان میدهیم. بنابراین، اعداد رومی بیانگر عدد اکسایش و علامتهای مثبت و منفی، بار الکتریکی عناصر را نشان میدهند. این دو نوع نمایش را میتوان در یونهای تکاتمی به جای یکدیگر استفاده کرد اما اعداد رومی را نمیتوان برای نمایش یونهای چنداتمی به کار برد. با این وجود، از ترکیب این روشها برای نمایش مراکز فلزی در کمپلکسهای چنداتمی بهره میگیریم.
جمعبندی
در این آموزش، مفهوم کاتیون و آنیون را مورد بررسی قرار دادیم. دیدیم که در حقیقت، کاتیون و آنیون نوعی از یک یون با بار مخالف هستند. اگر بار خالص مثبت داشته باشیم، کاتیون و اگر بار خالص منفی داشته باشیم، آنیون خواهیم داشت. همچنین، نحوه نمایش کاتیون و آنیون را در نماد شیمیایی عنصر نشان دادیم و این نمایش را در مولکولها و یونهای چنداتمی نیز مورد بررسی قرار دادیم و به کمک یک جدول، به بررسی تفاوتهای آنیون و کاتیون پرداختیم.
آزمون کاتیون و آنیون
۱. چه عاملی سبب میشود یک اتم کاتیون یا آنیون شود و این موضوع چگونه به تعداد پروتون و الکترون مربوط است؟
برتری تعداد پروتون از الکترون باعث ایجاد کاتیون و برتری تعداد الکترون منجر به آنیون میشود.
افزایش تعداد نوترون نسبت به پروتون موجب تشکیل کاتیون و بالعکس آنیون خواهد شد.
برتری تعداد نوترون و پروتون نسبت به الکترون فقط روی پایداری یون تاثیر میگذارد.
افزایش تعداد پروتون نسبت به نوترون باعث تشکیل آنیون و افزایش نوترون باعث کاتیون میشود.
اگر تعداد پروتون در یک اتم بیشتر از تعداد الکترون باشد، بار مثبت ایجاد و کاتیون تشکیل میشود. اگر تعداد الکترون از پروتون بیشتر شود، اتم بار منفی یافته و آنیون خواهد شد. موضوع مهم، نسبت پروتون به الکترون است و تغییر در تعداد نوترون تاثیری بر کاتیون یا آنیون شدن ندارد.
۲. در واکنش بین سدیم (Na) و کلر (Cl)، با توجه به جایگاه این عناصر در جدول تناوبی، الکترون چگونه منتقل میشود و چه یونهایی تشکیل میشوند؟
هر دو عنصر الکترون دریافت میکنند و یون منفی تشکیل میدهند.
سدیم یک الکترون به کلر میدهد، Na⁺ و Cl⁻ تشکیل میشود.
سدیم یک الکترون از کلر میگیرد، Na⁻ و Cl⁺ تشکیل میشود.
سدیم دو الکترون به کلر میدهد، Na²⁺ و Cl²⁻ ایجاد میشود.
وقتی سدیم (یک فلز قلیایی) و کلر (یک هالوژن) با هم واکنش میدهند، سدیم تمایل دارد یک الکترون خود را از دست بدهد و به کاتیون با بار مثبت (Na⁺) تبدیل شود. کلر نیز الکترون جذب میکند و به آنیون با بار منفی (Cl⁻) تبدیل میشود. این رفتار مربوط به موقعیت آنها در جدول تناوبی و قاعده اکتت است.
۳. در ترکیب یونی چگونه تعادل بار الکتریکی بین کاتیون و آنیون باعث خنثی شدن ترکیب میشود؟
کاتیون و آنیون هر دو با از دست دادن الکترون، بار خود را برابر میکنند.
هر اتم کلسیم با یک اتم کلر ترکیب میشود تا تعادل بار برقرار شود.
آنیون بار مثبت کاتیون را افزایش میدهد تا کل ترکیب منفی شود.
کاتیون دو بار مثبت را تامین میکند و دو آنیون هر کدام یک بار منفی را جبران میکنند.
در ترکیب ، یون دارای دو بار مثبت است و دو یون هرکدام یک بار منفی دارند. بنابراین مجموع بار مثبت و منفی با هم برابر میشود و ترکیب حالت خنثی پیدا میکند.
۴. در نمادگذاری یونهای تکاتمی و یونهای چنداتمی، چه تفاوتی در نحوه نوشتن بار و عدد اکسایش وجود دارد؟
یونهای چنداتمی فقط با علامت + یا - و بدون هیچ عددی نمایش داده میشوند.
در هر دو نوع یون، عدد اکسایش همیشه قبل از نماد عنصر نوشته میشود.
برای یون تکاتمی، بار در پرانتز بعد از نام عنصر میآید اما برای یون چنداتمی عدد اکسایش نوشته میشود.
بار روی یون تکاتمی مستقیم بعد از نماد عنصر میآید و برای عدد اکسایش فلزات واسطه از عدد رومی کنار نام استفاده میشود.
در نمایش یون تکاتمی، بار الکتریکی مستقیما بعد از نماد شیمیایی قرار میگیرد و اگر یون دو یا چند بار داشته باشد، ترتیب نوشتن علامت (مانند 2+) اهمیت دارد. برای فلزات واسطه، عدد اکسایش معمولا با عدد رومی کنار نام عنصر ذکر میشود. برخلاف این، در یونهای چنداتمی استفاده از عدد رومی مرسوم نیست و فقط علامت بار قرارداده میشود.













قسمت اعدا رومیش کامل و….
ممنون
از نظر مطالعه خوب به نظر میاد
از نظر مطالعه خوب به نظر میاد ولی خیلی تحقیق نشده