قانون مارکونیکوف – به زبان ساده
از قانون مارکونیکوف به منظور توضیح خروجی برخی از واکنشهای افزایشی در شیمی بهره میگیرند. شیمیدان روسی، «ولادیمیر واسیلیویچ مارکونیکوف» (Vladimir Vasilyevich Markovnikov) اولین کسی بود که در سال 1865، این قانون را ارائه داد. قانون مارکونیکوف خروجی واکنش افزایشی به هنگام اضافه کردن «اسید پروتونی» (Protic Acid) را به یک آلکن نامتقارن پیشبینی میکند.

قانون مارکونیکوف چیست ؟
زمانیکه یک اسید پروتونی (HX) به آلکنی نامتقارن اضافه شود، هیدروژن اسیدی به کربنی متصل میشود که تعداد هیدروژن متصل به آن بیشتر باشد و همچنین، گروه هالوژن به اتم کربنی متصل خواهد شد که گروههای آلکیل متصل بیشتری به آن اتم کربن داشته باشیم.
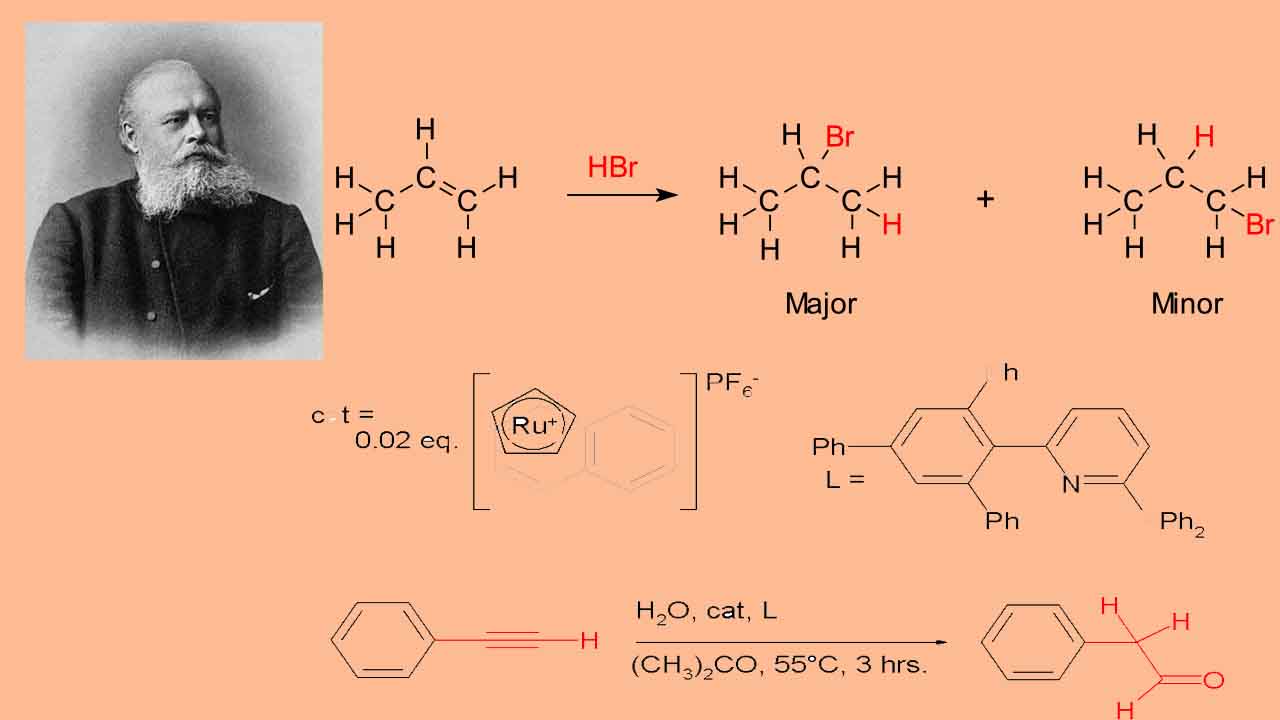
برای بیان سادهتر قانون مارکونیکوف میتوان گفت هیدروژن به کربن با هیدروژن بیشتر و هالوژن به کربن با هیدروژن کمتر متصل میشود. از جمله واکنشهایی که قانون مارکونیکوف را نشان میدهند میتوان به واکنش افزایش هیدروبرمیک اسید (HBr) به پروپن اشاره کرد که در تصویر زیر نشان داده شده است.
از واکنش بالا میتوان دریافت که فرآورده بیشتر، از قانون ماکونیکوف پیروی میکند و این درحالیست که فرآورده کمتر، از این قانون پیروی نمیکند. واکنش افزایشی را در نظر بگیرید که در آن، یک آلکن با آب برای تولید الکل واکنش میدهد. پیشرفت این واکنش با تشکیل یک کربوکاتیون همراه است. مشاهده میشود که در این واکنش، گروه هیدروکسیل به کربنی متصل میشود که پیوندهای کربن-کربن بیشتری داشته باشد درحالیکه اتم هیدروژن به اتم کربن با تعداد بیشتر پیوندهای کربن-هیدروژن متصل خواهند شد.
مکانیسم قانون مارکونیکوف
برای درک بهتر مکانیسم قانون مارکونیکوف بهتر است مثال قبل را در نظر بگیریم که شامل افزایش هیدروبرمیک اسید به پروپن بود. مکانیسم قانون مارکونیکوف را میتوان به دو مرحله زیر تقسیم کرد.
مرحله اول در مکانیسم قانون مارکونیکوف
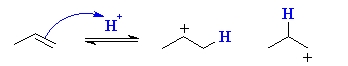
با پروتوندهی به آلکن، کربوکاتیون پایدارتری به تولید میرسد. به کمک تصویر زیر در مییابیم که دو نوع کربوکاتیون از طریق پروتوندهی به یک آلکن به تولید میرسد که یکی، کربوکاتیون نوع اول و دیگری، کربوکاتیون نوع دوم است. با این وجود، کربوکاتیون نوع دوم بسیار پایدارتر است و بنابراین، تشکیل آن نسبت به کربوکاتیون نوع اول، اولویت بیشتری دارد.
مرحله دوم در مکانیسم قانون مارکونیکوف
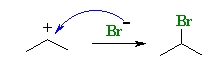
در این مرحله، یون هالید نوکلئوفیل به کربوکاتیون حمله میکند و در اثر این واکنش، آلکیل هالید به تولید میرسد. از آنجایی که اولویت با تشکیل کربوکاتیون نوع دوم است، فرآورده عمده این واکنش، ۲-برمو پروپان خواهد بود که در تصویر زیر نشان داده شده است.
لازم به ذکر است که قانون مارکونیکوف به طور ویژه بمنظور کاربرد آن در واکنش افزایشی تبدیل هیدروژن هالیدها به آلکنها توسعه پیدا کرده است. نقطه مقابل واکنش افزایش مارکونیکوف، واکنش افزایشی «ضد مارکونیکوف» (Anti-Markonikov) و بر پایه «فضاگزینی» (Regioselectivity) واکنش انتخاب شده است.
واکنش ضد مارکونیکوف
همانطور که میدانید، آلکنها به گروهی از هیدروکربنهای سیرنشده (غیراشباع) تعلق دارند و هر مولکول از آنها شامل حداقل یک پیوند دوگانه است. به دلیل وجود الکترونهای پای، این مولکولها در واکنشهای افزایشی شرکت میکنند که در آنها، الکتروفیلها به پیوند دوگانه کربن-کربن حمله میکنند تا فرآوردههای دیگری را تولید کنند.
زمانیکه در حضور پراکسید، به آلکن نامتقارن اضافه شود، ۱-برموپروپان ایجاد میشود که برخلاف قانون مارکونیکوف و تشکیل ۲-برمو پروپان است. به این نوع از واکنش، واکنش ضد مارکونیکوف میگویند.
واکنش ضد مارکونیکوف را همچنین میتوان به عنوان نمونهای از واکنش افزایشی آلکنها و استثنائی برای قانون مارکونیکوف دانست. چنین واکنشی را تنها با میتوان مشاهده کرد و با یا قابل مشاهده نیست.
مکانیسم واکنش افزایشی ضد مارکونیکوف
واکنش افزایشی ضد مارکونیکوف از مکانیسم رادیکال آزاد پیروی میکند. ترکیب پراکسید در واکنش به تولید رادیکال آزاد کمک میکند. مکانیسم کلی واکنش افزایشی ضد مارکونیکوف در ادامه آمده است.
- تولید رادیکال آزاد از طریق «گسست جور» (Homolytic Cleavage) ترکیب پراکسید
- حمله رادیکال آزاد تولید تولیدی به هالید هیدروژن برای تشکیل رادیکال هالید
- حمله رادیکال آزاد تولیدی به مولکول آلکن برای تشکیل رادیکال آلکیل
- حمله رادیکال آلکیل تولیدی به هالید هیدروژن برای تشکیل آلکیلهالید از طریق گسست جور پیوند هالید هیدروژن
مثال هایی از واکنش های افزایشی مارکونیکوف و ضد مارکونیکوف
در ادامه، مثالهایی را در خصوص واکنش مارکونیکوف و ضد مارکونیکوف بیان میکنیم.

هیدراسیون آلکن ها
زمانی که آلکنها را به کمک برخی از اسیدهای آبی (به طور معمول سولفوریک اسید) فرآوری کنیم، در نتیجه واکنش افزایشی الکتروفیلی، یک الکل به عنوان فرآورده خواهیم داشت. فضاگزینی چنین واکنشهایی را میتوان به کمک قانون مارکونیکوف پیشبینی کرد. در نتیجه، این نوع از واکنشها را میتوان در دسته واکنشهای مارکونیکوف طبقهبندی کرد. در هیدراسیون آلکنها، یون ، همچون یک الکتروفیل عمل میکند و با حمله به آلکن، کربوکاتیون واسط تولید خواهد شد. حمله نوکلئوفیلی توسط مولکولهای آب به کربوکاتیون در ادامه کار، یون اکسونیوم تولید میکند که با پروتونگیری، به فرآورده الکل مورد نظر میرسیم.
هیدروبوراسیون - اکسیداسیون آلکن ها
زمانیکه آلکنها را با بوران در حضور هیدروژن پراکسید یا سدیم هیدروکسید فرآوری کنیم، فرآورده نهایی، یک الکل خواهد بود. در این واکنش اکسیداسیون افزایشی الکتروفیلی، اتم بور نقش یک الکتروفیل دارد. این واکنش از قانون ماکونیکوف پیروی نمیکند و میتوان آنرا در دسته واکنشهای ضد مارکونیکوف قرار داد.
سنتز آلکیل کلریدها
سنتز آلکیل کلریدها از طریق اضافه کردن هیدروکلریک اسید به یک آلکن امکانپذیر است اما آلکنها با سرعت بسیار کمی با واکنش میدهند. این مشکل را میتوان با تغییر شرایط واکنش حل کرد. زمانیکه یک آلکن با تریمتیل سیلیل کلرید و آب فرآوری شود، به سرعت به پیوند دوگانه اضافه میشود و فرآورده به تولید میرسد که این واکنش از قانون مارکونیکوف پیروی میکند.
واکنش بازآرایی کربوکاتیون ها
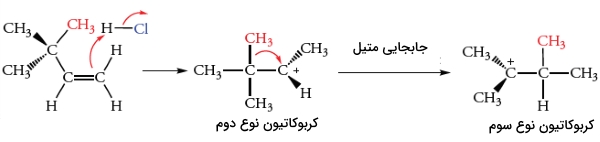
قانون مارکونیکف سبب میشود تا فرآورده بیشتر واکنشهای افزایشی را پیشبینی کنیم اما در برخی موارد، ایزومرهای ساختاری نیز به تولید میرسند. به طور مثال، اضافه کردن HCl به ۳-متیل-۱-بوتن، علاوه بر تولید فرآورده مورد نظر یعنی ۲-کلرو-۳-متیل بوتان، ۲-کلرو-۲متیل بوتان نیز به تولید میرسد.
این سوال پیش میآید که منشا این فرآورده ناخواسته چیست. در پاسخ باید گفت کربوکاتیون تشکیل شده در مرحله اول، در اثر بازآرایی (نوآرایی) به اجزای پایدارتری تبدیل میشود که در ادامه، با کلرید واکنش میدهد.
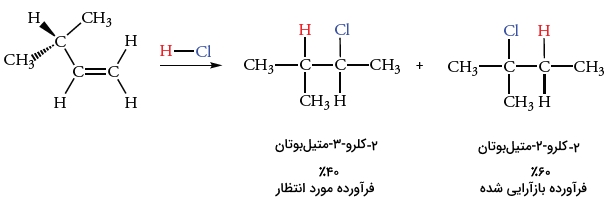
فرآورده مورد نظر ما از طریق واکنش یون کلرید هستهدوست با کربوکاتیون نوع دوم تشکیل میشود. این اتفاق، زمانی انجام میگیرد که پروتون توسط واکنش افزایش مارکونیکوف به پیوند دوگانه اضافه شود. فرآورده ایزومری، زمانی به تولید میرسد که یون کلرید نوکلئوفیلی با کربوکاتیون نوع سوم واکنش دهد.
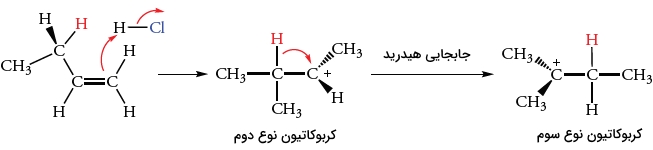
این کربوکاتیون زمانی تشکیل میشود که اتم هیدروژن در به همراه جفتالکترون پیوندی خود به طرف مرکز کربوکاتیون مجاور حرکت کند. به این جابجایی، «جابجایی هیدرید ۱و۲» میگویند زیرا یک یون هیدرید بین اتمهای کربن مجاور حرکت میکند.
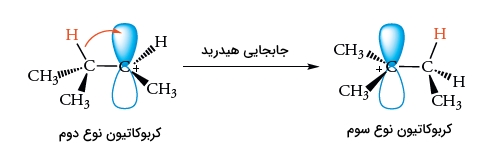
جابجایی هیدرید ۱و۲، کربوکاتیون نوع دوم را به کربوکاتیون پایدارتر نوع سوم تبدیل میکند. کربوکاتیون نوع سوم با یون کلرید واکنش میدهد تا فرآورده ایزومری به تولید برسد. برخی از کربوکاتیونهای نوع دوم نیز بدون نوآرایی با یون کلرید واکنش میدهند تا فرآورده مورد نظر را تولید کنند. مقدار نسبی فرآوردهها به نحوه به دام انداخته شدن کربوکاتیون در مقایسه با سرعت فرآیند بازآرایی بستگی دارد.
بازآرایی مشابه با جابجایی هیدرید زمانی اتفاق میافتد که یک گروه آلکیل با جفتهای پیوندی خود به اتم کربن مجاور حرکت کند. این نوع از نوآرایی زمانی اتفاق میافتد که کربوکاتیون واسط پایدارتری به تولید برسد. واکنش ترکیب ۳و۳-دیمتیل-۱-بوتن با HCl، نمونهای از این واکنش بازآرایی است.
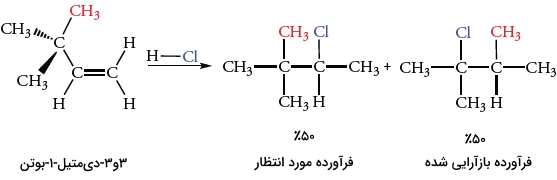
با توجه به قانون مارکونیکوف و اضافه کردن یک پروتون به کربنی با استخلاف کمتر در پیوند دوگانه، کربوکاتیون نوع دوم را بدست میدهد. این کربوکاتیون نوع دوم با یون کلرید هستهدوست واکنش میدهد تا فرآورده مورد نظر را تولید کند. فرآورده بازآرایی شده از طریق واکنش یون کلرید با کربوکاتیون نوع سوم به تولید میرسد. این اتفاق در اثر جابجایی گروه متیل با جفتالکترونهای پیوندی از مرکز چهارعضوی به مرکز کربوکاتیون نوع دوم مجاور انجام میگیرد. به این جابجایی، «جابجایی متیل» (Methyl Shift) میگویند.













سلام
ببخشید دلیل اینکه واکنش ضد مارکونیکف فقط با HBr انجام میشه و با HCL و HI انجام نمیشه چی هست؟
با سلام؛
در این رابطه باید به نوع اسید هم توجه کرد. به طور مثال، HCl اسید بسیار پایداری است پیوند بین هیدروژن و کلر در آن قویتز از پیوند بین هیدروژن و ید در HBr است و شکست پیوندها به طور متقارن رخ نمیدهد. همچنین، قدرت پیوندی HI نیز برای انجام «گسست جور» حاصل از یون پراکسید کافی نیست.
با تشکر از همراهی شما با مجله فرادرس
سلام
ولی ببخشید منظور من این هست که هیدروژن هالید مورد نظر هنگامی که حمله الکتروندوستی انجام میده واضح است که باید از کربن شماره سوم حمله کنه که به گروه آلکیل بیشتری متصله و بار منفی بیشتری روش متمرکز هست ، سوال من این بود که این افزایش رو نمیتونیم طبق قاعده مارکونیکف پیش ببریم ؟! اگر اینطور باشه که من شخصا در رفرنس موریسون_بوید مشاهده نکردم چنین توضیحی رو و در آنجا نوشته شده بود که طبق این قاعده تجربی هیچکدام از دو فرآورده 2_هالو پنتان و 3_هالو پنتان فرآورده اصلی نیستند ! پس تکلیف در چنین مواقعی چی هست؟!
و ممنون از تیم پرکار فرادرس
البته اگر لطف کنید خوب میشود که در زمینه المپیاد دانش آموزی نیز اقدامی انجام دهید و فیلم آموزشی تهیه کنید.
با تشکر.
با سلام؛
هر دو فرآورده امکان تشکیل دارند به این معنی که نمیتوان تنها یک فرآورده را به عنوان فرآورده نهایی بیان کرد.
با تشکر
سلام
خسته نباشید
طی افزایش هیدروژن هالید به 2_پنتن چه اتفاقی میافتد؟
با سلام؛
علاوه بر مطالعه این مطلب پیشنهاد میکنیم مطلب «واکنش افزایشی — به زبان ساده» را نیز مطالعه کنید.
با تشکر از همراهی شما با مجله فرادرس