اسید آمینه چیست؟ – کاربرد، انواع و عملکرد به زبان ساده
اسید آمینه یکی از مهمترین ترکیبات بدن انسان به شمار میآید. اسید آمینهها به عنوان واحدهای سازنده پروتئینها، عملکردهای حیاتی بدن را کنترل میکنند. هر ویژگی آناتومیکی و فیزیولوژیکی موجودات زنده از طریق وجود اسیدهای آمینه امکان پذیر میشود.

اسید آمینه چیست؟
«اسید آمینه» (Amino Acids) یک مولکول آلی است که سه مؤلفه اصلی دارد: یک گروه آمینه (-NH2)، یک گروه اسید کربوکسیلیک (-COOH) و یک گروه R یا زنجیره جانبی که برای هر اسید آمینه اختصاصی است.
اسیدهای آمینه واحدهای ساختاری اساسی پروتئین را تشکیل میدهند. درست همان طور که حروف الفبا را میتوان به روشهای مختلفی برای تشکیل انواع بی پایان کلمات ترکیب کرد، تعداد محدودی از اسیدهای آمینه را میتوان در توالیهای مختلف با یکدیگر در ارتباط قرار داد، تا بتوانند مجموعه بزرگی از انواع پروتئینها را تشکیل دهند. شکل سه بعدی منحصر به فرد هر پروتئین که از توالی خطی اسیدهای آمینه حاصل میشود، عملکرد اختصاصی هر پروتئین را در بدن تعیین میکند.
گیاهان با استفاده از کربن و اکسیژن موجود در هوا، هیدروژن موجود در آب و نیتروژنی که از طریق تثبیت نیتروژن به شکل قابل استفاده تبدیل شده است، آمینو اسیدهای مورد نیاز خود را میسازند.
حیوانات میتوانند اسیدهای آمینه خاصی را سنتز کنند. اسیدهای آمینه مهم که توسط حیوانات ساخته نمیشوند و یا با سرعت کافی در بدن برای پاسخگویی به نیازهای فیزیولوژیکی قابل تهیه نیستند، باید از رژیم غذایی دریافت شوند. به این اسیدهای آمینه، «اسیدهای آمینه ضروری» (Essential Amino Acids) گفته میشود. اسیدهای آمینه ضروری با توجه به نوع جاندار متفاوت است. در واقع، همه مهرهداران به آمینو اسیدهای خاصی احتیاج دارند که سلولهای آنها قادر به سنتز این اسیدهای آمینه نیستند. حیوانات نشخوارکننده (مانند گاو) در معده خود دارای باکتریهایی هستند که میتوانند اسیدهای آمینه ضروری بدن حیوان را سنتز کنند.
اگرچه بیش از 100 اسید آمینه در طبیعت وجود دارند، اما بدن انسان برای عملکرد طبیعی خود تنها به 20 اسید آمینه به نام «اسیدهای آمینه استاندارد» (Standard Amino Acid) احتیاج دارد. تقریبا نیمی از این اسیدهای آمینه استاندارد به عنوان اسیدهای آمینه ضروری در نظر گرفته میشوند که بدن قادر به ستز آنها نیست و باید از مواد غذایی تامین شوند.
منابع اسیدهای آمینه
اسیدهای آمینه مورد نیاز بدن از راههای متفاوتی تامین میشوند. در این جا برخی از منابع انواع اسیدهای آمینه میپردازیم:

اسیدهای آمینه استاندارد
در انسان 20 اسید آمینه به عنوان اسیدهای آمینه استاندارد یا اسیدهای آمینه «پروتئینوژنیک» (Proteinogenic) شناخته شدهاند. همان طور که از نام پروتئینوژنیک (ساختمان پروتئین) مشخص است، این اسیدهای آمینه با کد ژنتیکی استاندارد کد گذاری شده و در فرایند سنتز پروتئین شرکت میکنند. آنها از یک الگو mRNA در فرآیندی به نام ترجمه تشکیل میشوند که با استفاده از این الگو اطلاعات ژنتیکی که به شکل اسیدهای نوکلئیک رمزگذاری شدهاند، به اسیدهای آمینه که برای سنتز پروتئین ضروری هستند، ترجمه میشوند. وجود توالی مشخصی از این اسیدهای آمینه که تولید یک پروتئین واحد را بر عهده دارند، برای حفظ شرایط هموستاز (حفظ محیط داخلی پایدار) بدن انسان ضروری به شمار میآیند.
از این 20 اسید آمینه استاندارد، 19 اسید آمینه به عنوان مولکولهای نوری فعال چپگرد به دلیل وجود اتم کربن مرکزی نامتقارن در طبیعت وجود دارند، در حالی که تنها یکی از این اسید آمینهها به نام گلایسین از نظر نوری خنثی است، به همین دلیل اسیدهای آمینه استاندارد الگوی 1 + 19 را نشان میدهند.
این اسیدهای آمینه اغلب توسط بدن سنتز میشوند، اما منابعی غنی از این ترکیبات در مواد غذایی مانند تخم مرغ، انواع گوشت و غلات وجود دارند.
اسیدهای آمینه ضروری
تقریباً نیمی از 20 اسید آمینه استاندارد را اسیدهای آمینه ضروری مینامند، زیرا در اثر واکنشهای شیمیایی، آنها نمیتوانند توسط بدن انسان از ترکیبات دیگر ساخته شوند. به همین دلیل، بدن انسان، آنها را باید از طریق رژیم غذایی دریافت کند. در انسان، اسیدهای آمینه اساسی شامل موارد زیر است:
- لیزین (Lysine)
- ایزولوسین (Isoleucine)
- فنیل آلانین (Phenylalanine)
- لوسین (Leucine)
- متیونین ( Methionine)
- تریپتوفان (Tryptophan)
- ترئونین (Threonine)
- والین (Valine)
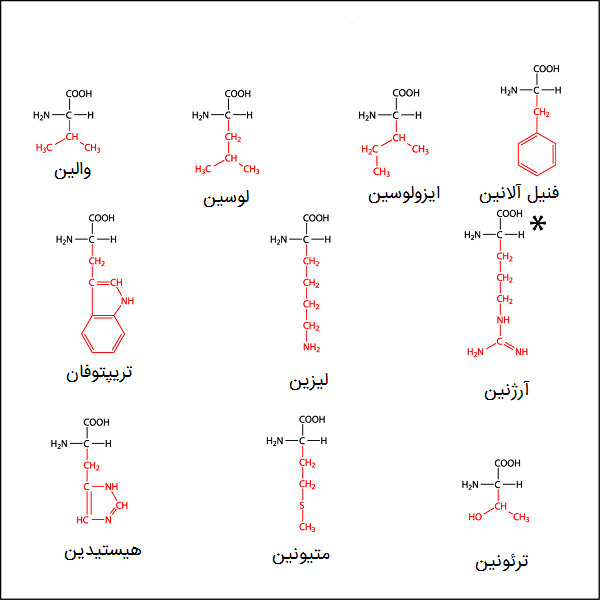
آرژنین و هیستیدین همچنین ممکن است به عنوان اسیدهای آمینه ضروری طبقهبندی شوند، زیرا این دو اسید آمینه فقط در کودکان به عنوان اسید آمینههای ضروری مطرح هستند، به دلیل متابولیسم توسعه نیافته کودکان، آنها قادر به ساخت آرژنین و هیستیدین نیستند. بنابراین، تعداد اسیدهای آمینه ضروری در انسان به صورتهای مختلف 8 یا 10 مورد ذکر میشود.
اسیدهای آمینه استاندارد باقی مانده، غیرضروری هستند. اگرچه میتوان آنها را از مواد غذایی به دست آورد اما بدن نیز در صورت نیاز میتواند آنها را سنتز کند.
اسیدهای آمینه غیر استاندارد
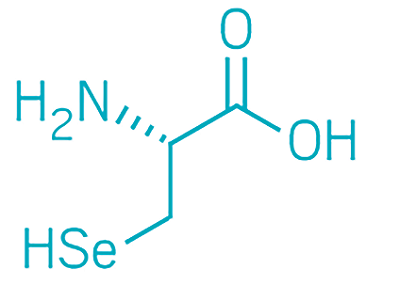
علاوه بر 20 آمینو اسید استاندارد و دو اسید آمینه ویژه که شامل «سلنوسیستئین» (Selenocysteine) و «پیرولیزین» (Pyrolysine) هستند و توسط DNA به صورت غیر عادی کد گذاری میشوند، تعداد زیادی اسید آمینه غیر استاندارد یا غیر پروتئینوژنیک نیز وجود دارند. اسیدهای آمینه غیر استاندارد یا در پروتئینها یافت نمیشوند (مانند اسیدهای آمینه کارنیتین، گابا و L-DOPA) و یا در کدهای ژنتیکی استاندارد (مانند هیدروکسی پرولین و سلنومتیونین) کد گذاری نشدهاند. این اسیدهای آمینه ممکن است از تغییرات ایجاد شده در برخی از اسیدهای آمینه استاندارد پس از تشکیل پروتئین (در مرحله ترجمه و سنتز پروتئین) به وجود آمده باشند.
برخی از این اسیدهای آمینه غیر استاندارد در شهاب سنگها شناسایی شدهاند، خصوصاً در نوعی که به نام «کندریت کربنی» (Carbonaceous Chondrite) شناخته شده است. بیش از 79 اسید آمینه غیر استاندارد در شهاب سنگ اولیه مرچیسون نیز که یک نوع کندریت کربنی است وجود دارد. میکروارگانیسمها و گیاهان هم میتوانند اسیدهای آمینه غیر استاندارد را تولید کنند که در آنتی بیوتیکهای پپتیدی مانند «نیسین» (Nisin) وجود دارند. نیسین به عنوان نگهدارنده مواد غذایی در صنایع غذایی مورد استفاده قرار میگیرد.
ساختمان اسید آمینه
در بیوشیمی، اصطلاح اسید آمینه غالباً زمانی مورد استفاده قرار میگیرد که به طور خاص به اسیدهای آمینه آلفا اشاره شود. اسید آمینههای آلفا شامل اسیدهای آمینهای هستند که در آنها گروههای آمینو و کربوکسیلات به یک کربن واحد به نام α- کربن یا کربن آلفا وصل شدهاند. ساختار کلی این اسیدهای آمینه آلفا پروتئینوژنیک را میتوانید در شکل زیر ببینید.
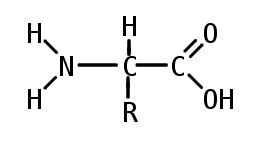
در ساختمان این اسید آمینهها R یک زنجیره جانبی را نشان میدهد که برای هر اسید آمینه اختصاصی است. در انواع گروه جانبی یک استثنا وجود دارد؛ در ساختار اسید آمینه پرولین زنجیره جانبی بر روی ستون فقرات اسید آمینه یک ساختار حلقه تشکیل میدهد که در آن یک گروه آمینه ثانویه جایگزین گروه آمینه اولیه میشود، به همین دلیل به این اسید آمینه، «ایمنواسید» (Immunoacid) میگویند.
هنگامی که اسیدهای آمینه برای تشکیل پروتئین به هم متصل میشوند، گروه آمین بازی و گروه کربوکسیل اسیدی در کنار هم خنثی میشوند. به همین دلیل، زنجیرههای جانبی اسیدهای آمینه خاصیت اسید و بازی پروتئینها را تعیین میکنند. بنابراین، اسیدهای آمینه معمولاً توسط دو خاصیت شیمیایی اصلی زنجیره جانبی طبقهبندی میشوند:
- بار گروه R: بار زنجیره جانبی تعیین کننده این است که پروتئین مانند اسید ضعیف عمل کند یا یک باز ضعیف باشد.
- قطبیت گروه R: قطبی بودن گروه R تمایل اسید آمینه به تعامل با آب در pH خنثی را نشان میدهد.
این خواص بر تعامل اسیدهای آمینه با سایر ساختارهای موجود در پروتئین و همچنین برهم کنش آنها با پروتئینهای دیگر تأثیر میگذارند. به عنوان مثال، پروتئینهای محلول در آب دارای سطوح غنی از اسیدهای آمینه قطبی مانند سرین و ترئونین هستند. در مقابل، پروتئینهای غشایی اینتگرال اغلب در بخش درونی خود دارای اسیدهای آمینه آبگریز (که تمایل به تعامل با آب ندارند) هستند که باعث میشوند این پروتئینها بتوانند در لایه لیپیدی غشای سلولی قرار بگیرند.
پروتئینهایی که باید به مولکولهایی با بار مثبت متصل شوند، دارای سطوح غنی از اسیدهای آمینهای با بار منفی مانند گلوتامات و آسپارتات هستند، در حالی که پروتئینهای متصل به مولکولهای دارای بار منفی، در سطح خود زنجیرههایی از اسید آمینههایی با بار مثبت مانند لیزین و آرژینین دارند.
ایزومرها
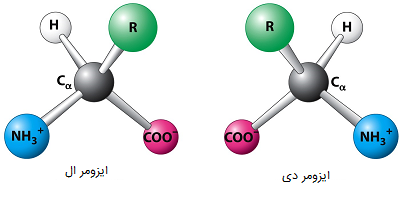
بیشتر اسیدهای آمینه در دو حالت ایزومر نوری ممکن، به نامهای ایزومرهای D و ایزومرهای L وجود دارند. اسیدهای آمینه L، اکثر اسیدهای آمینه موجود در پروتئینها را تشکیل میدهند. اسیدهای آمینه D در برخی از پروتئینها که توسط ارگانیسمهای آبی مانند حلزونهای مخروطی تولید میشوند، دیده شدهاند. همچنین در دیوارههای سلولی پروتئوگلیکانی باکتریها نیز ایزومرهای D اسیدهای آمینه یافت میشوند.
طبقهبندی اسیدهای آمینه بر اساس ساختمان آنها
اسیدهای آمینه براساس نوع ساختمان و گروههای جانبی که دارند در گروههای مختلفی دستهبندی میشوند. در اینجا به معرفی برخی از دستههای اسیدهای آمینه میپردازیم:
اسیدهای آمینه آلیفاتیک
اسیدهای آمینه آلیفاتیک، اسید آمینههای غیرقطبی و آبگریزی هستند که با افزایش تعداد اتمهای کربن موجود در زنجیره جانبی آنها، خواص آبگریزی آنها نیز افزایش مییابد. اسیدهای آمینه آلیفاتیک شامل موارد زیر هستند:
- آلانین (Alanine)
- گلایسین (Glycine)
- ایزولوسین
- لوسین
- پرولین (Proline)
- والین
اگرچه گلایسین دارای اتمهای کربنی کمی است، اما هیچ کدام از خواص آب دوستی یا آبگریزی در آن مشاهده نمیشود. متیونین گاهی اوقات در گروه اسیدهای آمینه آلیفاتیک قرار میگیرد، زیرا زنجیره جانبی آن حاوی یک اتم گوگرد به جای اتمهای کربن و هیدروژن است، اما مانند گروه آلیفاتیک، در حضور سایر مولکولها به شدت واکنش نشان نمیدهد. عدم واکنش پذیری اسیدهای آمینه آلیفاتیک به این دلیل است که آنها بار مثبت یا منفی ندارند اما توزیع بار در کل مولکول برابر است.
اسیدهای آمینه آروماتیک
آمینو اسیدهای آروماتیک یا معطر شامل «فنیل آلانین» (Phenylalanine)، «تیروزین» (Tyrosine) و «تریپتوفان» (Tryptophan) هستند و هیچ بار الکتریکی ندارند. این مولکولها در دو حالت آبگریز (فنیل آلانین و تریپتوفان) و غیر آبگریز (تیروزین) در طبیعت وجود دارند.
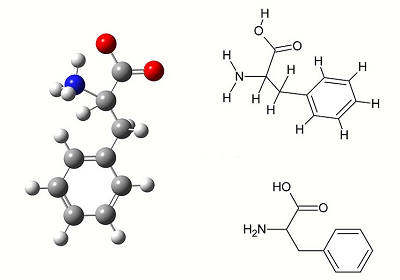
کلمه آروماتیک (Aromatic) به اتصال یک حلقه آروماتیک بسیار پایدار اشاره دارد که به راحتی با سایر ترکیبات یا عناصر واکنش نمیدهد. این ترکیبات، به عنوان ترکیبات آریل نیز شناخته میشوند، ترکیبات آروماتیک در بدن انسان فراوان هستند. هر نوکلئوتید در DNA و RNA از مولکولهای آروماتیک تشکیل شده است.
اسید آمینه هیستیدین گاهی اوقات به اشتباه در گروه آروماتیکها قرار میگیرد. گروههای آمینی هیستیدین ممکن است مانند آروماتیکها باشند اما این اسید آمینه با بار مثبت ضعیف و خصوصیات آبگریزی که دارد، بسیار واکنش پذیر است.
اسیدهای آمینه بازی
در حالی که نام اسیدهای آمینه نشان میدهد که تمام آنها خاصیت اسیدی دارند اما برخی از اسیدهای آمینه دارای زنجیره جانبی بازی (قلیایی) هستند که این زنجیره جانبی از اتمهای نیتروژن تشکیل شده است. این زنجیرههای جانبی بازی به پروتونهای موجود (مولکول های هیدروژن) متصل میشوند و بنابراین بار مثبت میگیرند. اسیدهای آمینه موجود در این گروه همه آبگریز هستند. سه اسید آمینه بازی عبارتند از:
- آرژینین (Arginine)
- لیزین
- هیستیدین (Histidine)
آرژنین به دلیل داشتن سه گروه نیتروژنی دارای بیشترین بار مثبت در تمام اسیدهای آمینه است که این بار مثبت برای انجام عملکردهای این اسید آمینه در سنتز پروتئینها و عملکردهای آنزیمی و کاتالیزوری ضروری است. لیزین همچنین دارای بار مثبت زیادی است، در حالی که هیستیدین به دلیل عدم داشتن نیتروژن در گروه آمینی خود، بار مثبت بسیار ضعیفی دارد.
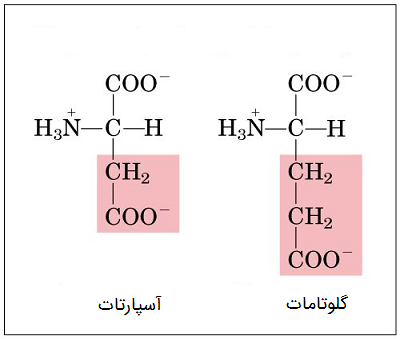
اسیدهای آمینه اسیدی
اسیدهای آمینه اسیدی شامل دو اسید آمینه به نامهای «اسید آسپارتیک» (Aspartic acid) و «اسید گلوتامیک» (Glutamic acid) هستند. پسوند اسید در نام این اسیدهای آمینه به سادگی خواص آن ها را مشخص میکند، اگرچه گاهی به این دو اسید آمینه آسپارتات و گلوتامات نیز گفته میشود که همین امر میتواند گیج کننده باشد. به جای گروههای نیتروژن، در زنجیره جانبی این اسیدهای آمینه، گروههای کربوکسیلیک اسید قرار گرفتهاند.
براساس خاصیت اسیدی، این اسیدهای آمینه قادرند پروتونها را در واکنش با سایر ترکیبات یا عناصر از دست بدهند و بنابراین دارای بار منفی میشوند. اسیدهای آمینه اسیدی آب دوست (هیدروفیل) هستند.
اسیدهای آمینه هیدروکسیلیک
اسیدهای آمینه هیدروکسیلیک گروه کوچک دیگری از اسیدهای آمینه را تشکیل میدهند و تنها دو اسید آمینه در این گروه جای میگیرند که شامل موارد زیر هستند:
- سرین (Serine)
- ترئونین
این اسیدهای آمینه قطبی، آب دوست و بدون بار هستند که یک گروه هیدروکسیل به عنوان زنجیره R در آنها دیده میشود.
اسیدهای آمینه حاوی گوگرد
«سیستئین» (Cysteine) و «متیونین» (Methionine) تنها اسیدهای آمینه حاوی اتم گوگرد هستند. سیستئین میتواند با سیستئین دیگری از طریق یک پل دی سولفید پیوند برقرار کند و دیمر اکسیده شدهای به نام «سیستین» (Cystine) را تشکیل دهد. سیستین در بافتهای همبند، مو، انگشت و ناخنها به مقدار زیادی یافت میشود.
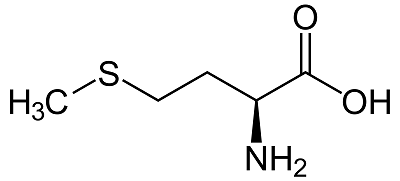
در اسیدهای آمینه حاوی گوگرد، زنجیره جانبی از یک گروه تیول (-SH) تشکیل شده است. وقتی گروه تیول یا S را در یک ساختار شیمیایی اسید آمینه مشاهده میکنید، میتوانید مطمئن باشید که این ماده سیستئین یا متیونین است. سیستئین از دو مولکول کوچکتر تشکیل شده و در اصل شامل یک اسید آمینه آلانین با یک گروه تیول اضافی است. متیونین حاوی یک اتر تیول با دو گروه جانبی در هر دو طرف اتم گوگرد است که آن را بسیار آبگریز میکند.
اسیدهای آمینه آمیدی
زنجیره جانبی در اسیدهای آمینه «آمیدیک» (Amidic) دارای یک گروه آمید (-CONH2) است و نباید با گروه جانبی آمینی اسیدهای آمینه لیزین، آرژنین و هیستیدین اشتباه گرفته شود.
به آمید حاصل از گلوتامیک اسید، اسید آمینه «گلوتامین» (Glutamine) گفته میشود و آمید تشکیل شده از اسید آسپارتیک را اسید آمینه «آسپاراژین» (Asparagine) مینامند. بنابراین، درک این موضوع آسان است که چرا اسیدهای آمینه آمیدی تنها در حضور اسید گلوتامیک کافی و اسید آسپارتیک قادر به انجام کار خود هستند.
آسپاراژین یک آمید آب دوست و بدون بار از اسید آسپارتیک است که با سایر مولکولها واکنش نشان نمیدهد. گلوتامین نیز به طور مشابه فاقد بار و آب دوست است و حالت آمیدی از اسید گلوتامیک است.
پروتئین و اسیدهای آمینه
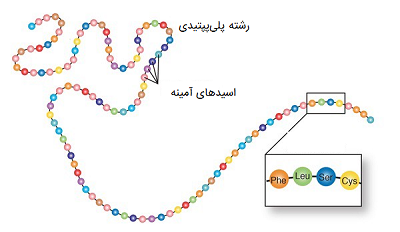
بین پروتئین و اسیدهای آمینه در اصل یک رابطه وابستگی وجود دارد. اسیدهای آمینه، مونومرها یا واحدهای کوچک تشکیل دهندهای هستند که برای تشکیل پلیمرها به یکدیگر متصل میشوند. در ابتدا اسیدهای آمینه به یکدیگر میپیوندند و الیگوپپتیدهایی به طول تقریبا ۲۰ اسید آمینه را تولید میکنند، این الیگوپپتیدها در کنار هم قرار گرفته و پلی پپتیدهای طولانیتری ایجاد میشوند که میتوانند در جهتهای مختلفی دچار پیچ خوردگی شده و پروتئینها را تشکیل دهند. توالی اسیدهای آمینه مبتنی بر بخشهای عملکردی کدهای ژنتیکی هستند که از DNA گرفته شده است.
سنتز پروتئین در داخل سلول اتفاق میافتد، جایی که بخش هایی از کد ژنتیکی درون هسته سلول رونویسی شده و این کدها از طریق RNA پیامرسان به سیتوپلاسم سلول میروند. RNA پیامرسان (mRNA) پس از قرار گرفتن بین قسمتهای بزرگ و کوچک یک ریبوزوم به کدهای اسیدهای آمینه ترجمه میشوند. این کار از طریق عملکرد RNA انتقالی (tRNA) امکان پذیر است. هر tRNA به اسید آمینه اختصاصی خود متصل میشود و آنها را براساس کدهای ژنتیکی mRNA در ریبوزوم کنار هم قرار میدهد.

هر mRNA از صدها نوکلئوتید تشکیل شده است که هر سه نوکلئوتید در کنار هم یک کدون اختصاصی برای اسیدهای آمینه را میسازند. به عنوان مثال، کدی که به tRNA میگوید اسید آمینه متیونین را وارد زنجیره در حال ساخت ریبوزوم کند، کدون AUG است که از قرارگیری سه نوکلئوتید با بازهای آلی A ،U و G در کنار هم حاصل میشود.
پس از اتمام ترجمه mRNA، زنجیره پپتیدی تشکیل شده از ریبوزوم آزاد میشود و با توجه به طول و فرم آن، در قالب یک پپتید یا پروتئین کاربردی تکامل مییابد.
ساختار پروتئین با توجه به تا خوردگی و پیچیدگیهایی که دارد، میتواند در چهار سطح تقسیمبندی شود:
- ساختمان اولیه: ساختار اولیه صرفا از پیوند بین اسیدهای آمینه تشکیل میشود.
- ساختمان ثانویه: این ساختمان در اثر تشکیل پیوندهای هیدروژنی بین بخشهای مختلف اسیدهای آمینه ایجاد میشود.
- ساختمان سوم: در ساختار سوم علاوه بر پیوندهای هیدروژنی بیشتر، پلهای نمکی و پیوندهای دیسولفیدی نیز اضافه میشود.
- ساختمان چهارم: این ساختمان شامل دو یا چندین زنجیره پلیپپتیدی است که ساختمان سه بعدی در فضا ایجاد کردهاند.
این چهار ساختار به شکل ساده در تصویر زیر نشان داده شدهاند.

عملکرد اسیدهای آمینه
اسیدهای آمینه به روشهای مختلفی در بدن عمل میکنند. مطالعات سالهای اخیر نشان دادهاند که اسیدهای آمینه نه تنها واحدهای ساختمانی پروتئینی و مولکولهای سیگنالینگ سلولی هستند بلکه به عنوان تنظیم کنندههای بیان ژن و تنظیم کنندههای آبشار فسفوریلاسیون پروتئینی نیز عمل میکنند.
اسیدهای آمینه همچنین پیشساز بسیاری از هورمونهای پروتئینی هستند و از نظر زیستی اهمیت بسیاری دارند. علاوه بر این موارد، برخی از اسیدهای آمینه مسیرهای متابولیکی کلیدی لازم برای محافظت، رشد، تولید مثل و ایمنی بدن را نیز تنظیم میکنند. با این وجود، افزایش سطح اسیدهای آمینه و نتایج حاصل از سنتز آنها به شکل آمونیاک و هموسیستئین میتواند باعث اختلالات عصبی، استرسهای اکسیداتیو و بیماریهای قلبی و عروقی شود.
مطالعات در زمینه عملکرد اسیدهای آمینه هنوز در مراحل ابتدایی قرار دارد و عملکرد کامل آنها، همچنین توانایی اسیدهای آمینه برای فعالیت به عنوان یک گروه یا در یک سیستم کامل، هنوز ناشناخته است. تعادل بهینه اسید آمینه در رژیم غذایی بسیار مهم است، اما اطلاعات کافی برای میزان بهینه مصرف اسیدهای آمینه در دسترس نیست و بنابراین دستور العملی برای چگونگی مصرف این ترکیبات در رژیم غذایی وجود ندارد.
مصرف مکملهای غذایی اسیدهای آمینه عملکردی، مانند آرژینین، سیستئین، گلوتامین، لوسین، پرولین و تریپتوفان برای طیف وسیعی از اختلالات مرتبط با سلامتی در هر مرحله از زندگی از مرحله جنینی تا سالمندی نتایج مثبتی به همراه داشته است، از جمله این اختلالات میتوان به اختلال عملکرد روده، چاقی، دیابت، بیماری قلبی و عروقی و اختلالات متابولیک و ناباروری اشاره کرد.
علاوه بر این، مکملهای اسیدهای آمینه توسط ورزشکاران برای افزایش توده عضلانی و کاهش چربی بدن میتوانند مورد استفاده قرار گیرند. با این حال، تاکنون مواردی از عوارض جانبی شناختی (مربوط به سیستم عصبی) و آسیبهای کلیوی در ارتباط با مصرف مکملهای اسید آمینه گزارش شده است.
سایر عملکردهای بیولوژیکی اسیدهای آمینه
آمینو اسیدها علاوه بر عملکردشان در شکلگیری پروتئینها، نقشهای مهم بیولوژیکی دیگری نیز دارند. اسیدهای آمینه استاندارد گلیسین و گلوتامات که در اکثر پروتئینها یافت میشوند، میتوانند به عنوان انتقال دهندههای عصبی عمل کرده و به ترتیب سیگنالها را در سیستم عصبی مهار و تقویت کنند. اسید آمینه غیر استاندارد کارنیتین در حمل و نقل لیپیدها درون سلول استفاده میشود. بسیاری از اسیدهای آمینه برای سنتز مولکولهای غیر پروتئینی مورد استفاده قرار میگیرند که در ادامه به برخی از آنها اشاره میشود:
- تریپتوفان: این اسید آمینه پیشساز سروتونین است، یک انتقال دهنده عصبی که در تنظیم احساسات و خلق و خو اهمیت دارد.
- گلایسین: اسید آمینه گلایسین یکی از واکنش دهندهها در سنتز پورفیرینها از جمله هِم است که یکی از اجزای تشکیل دهنده مولکولهای هموگلوبین موجود در گلبولهای قرمز به شمار میآید.
- آرژنین: برای سنتز هورمون نیتریک اکسید مورد استفاده قرار میگیرد.
مواد حاصل از اسیدهای آمینه کاربردهای مهمی در پزشکی و صنایع غذایی دارند. به عنوان مثال، میتوان به موارد زیر اشاره کرد:
- آسپارتام (آسپارتیل-فنیل آلانین-1-متیل استر): این ترکیب یک شیرین کننده مصنوعی است.
- مونو سدیم گلوتامات: این ماده به عنوان افزودنی غذایی به شمار میآید که باعث تقویت طعم مواد غذایی میشود.
- ترکیب ۵- هیدروکسی تریپتوفان (HTP-5): این ترکیب برای درمان مشکلات عصبی مرتبط با PKU (فنیل کتونوری) و همچنین افسردگی (به عنوان جایگزینی برای L- تریپتوفان) استفاده میشود.
- ال- دی هیدروکسی فنیل آلانین (L-DOPA): ال- دوپا، دارویی است که برای درمان علائم بیماری پارکینسون مورد استفاده قرار میگیرد.
مکملهای اسید آمینه
یکی از محبوبترین مکملهای اسید آمینه، ترکیبی از اسیدهای آمینه زنجیرهای شاخهدار (Branched-Chain Amino Acids) یا (BCAAs) یعنی لوسین، ایزولوسین و والین است. براساس مطالعات انجام شده BCAA سنتز پروتئینهای ماهیچه را بیش از 30٪ تحریک میکنند.

اعتقاد بر این است که اسیدهای آمینه زنجیرهای شاخهدار نقش مهمی در مسیرهای سیگنالینگ داخل سلولی مربوط سنتز پروتئین دارند. این امر از بسیاری جهات اثبات شده است اما همچنان نیاز به مطالعات بیشتری در این زمینه وجود دارد. آنچه مشخص است مکملهای BCAA علائم مرتبط با سیروز کبدی و نارسایی مزمن کلیه را کاهش میدهند. ادعاهای دیگر در مورد عملکرد این مکملها هنوز به طرز رضایت بخشی اثبات نشده است.
اگر مطالعه این مطلب برای شما مفید بود، آموزشها و مطالب زیر نیز به شما پیشنهاد میشود:













باسلام و خداقوت، بنده تازه میخام واردشغل زنبورداری بشم،برای زنبورها متیونین و لوسین و ایزولوسین و تریپتوفان خیلی مهمه هرگرده ای نداره
میخاستم بپرسم منابع هرکدام ازین اسیآمینه هادرکدام گرده هاست؟
ب تفکیک بفرمایید کدام گرده ی گل بیشترین متیونین و لوسین و ایزولوسین و تریپتوفان را دارد؟ ازچه گلهایی تغذیه کندتا این اسیدآمینه ها دریافت شود؟
باسلام خدمت خانم دلخواهی وتشکر از مطالب خوب شما .
در برخی از کتاب های بیوشیمی سه اسید آمینه بازی هیستدین ولیزین و آرژنین به عنوان سید آمینه های آبدوست معرفی شده اند
چرا هیستیدین به تعداد زیادی در هموگلوبین وجود دارد؟
درود فراوان سپاس بیکران
متن خیلی مفیدی بود. خیلی کامل بود
سلام ضمن تشکر از خانم دلخواهی، مطلب بسیار خوبی بود.
در مورد مقدار اسید آمینه آزاد و اسیدآمینه کل در یک محصول و اینکه نقش کدامیک اساسی تر و مهمتر است را بفرمایید.