گشتاور دو قطبی در شیمی – به زبان ساده
گشتاور دو قطبی یا «ممان دوقطبی» (Dipole Moment)، معیاری برای اندازهگیری قطبیت یک پیوند به شمار میآید که آنرا با نشان میدهند. گشتاور دو قطبی زمانی اتفاق میافتد که جدایشی بین بارهای مثبت و منفی داشته باشیم. گشتاور دوقطبی را به صورت حاصلضرب قدر مطلق بار در فاصله بین دو بار تعریف میکنند که رابطهای به شکل زیر دارد:


برای مولکولهای دواتمی، گشتاور پیوند با گشتاور دو قطبی مولکول برابر است. واحد SI برای دوقطبی الکتریکی را به صورت کولون-متر تعریف میکنند. البته این مقدار، در مقیاس مولکولی، عدد بسیار بزرگی است و در نتیجه، گشتاور دوقطبی را با واحد «دبای» (Debye) نشان میدهند. ممان دوقطبی را زمانی خواهیم داشت که بارهای مخالف با اندازه ، جدایشی با فاصله یک آنگستروم داشته باشند. در نتیجه:
تعیین جدایش بارها
گشتاور دو قطبی اطلاعاتی در خصوص جدایش بارها در یک پیوند بدست میدهد. به طور مثال، گشتاور دوقطبی هیدروژن کلرید برابر با است. همچنین، این ماده، طول پیوندی برابر با دارد. با محاسبه آن برای ، مقدار بار برابر با خواهد بود.
میدانیم که بار یک الکترون برابر با است. بنابراین، بار جزئی بر روی اتم کلر، برابر با 0/18 بار یک الکترون خواهد بود:
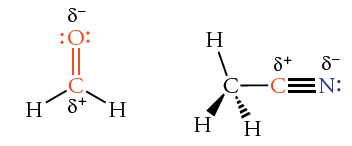
گشتاور دو قطبی نوع خاصی از پیوند، در ترکیبات مختلف مقداری تقریبا برابر دارد. به طور مثال، گشتاور دوقطبی کربن-هیدروژن، مقدار کمی خواهد بود چراکه کربن و هیدروژن، مقادیر الکترونگاتیوی مشابهی با طول پیوند کوتاه دارند. در نتیجه، پیوند ، پیوند کووالانسی قطبی نیست. در مقابل، ممان دوقطبی پیوند در مولکولی همچون کلرومتان، عدد بزرگی است. مقادیر الکترونگاتیوی کربن و کلر به ترتیب برابر با 2/5 و3 ذکر میشود.با مقایسه الکترونگاتیوی و با توجه به اینکه اتم کلر، الکترونگاتیوی بیشتری نسبت به کربن دارد، این اتم، الکترونهای پیوندی را به طرف خود جذب میکند.
گشتاور دو قطبی پیوندهای چندگانه بین کربن و اکسیژن و بین کربن و نیتروژن، مقادیر بزرگی دارند. بنابراین، پیوند دوگانه کربن-اکسیژن در متانال و پیوند سهگانه کربن-نیتروژن در «سیانومتان» (Cyanomethane)، هر دو به شدت قطبی هستند.
گشتاور دو قطبی در مولکولهای دو اتمی و چند اتمی
در مولکولهای دواتمی، تنها یک پیوند (یگانه یا چندگانه) وجود دارد. در نتیجه، ممان دوقطبی پیوند، همان ممان دوقطبی مولکولی است که مقداری بین دارد. در مولکولهای چنداتمی، بیش از یک پیوند وجود دارد.
همانطور که در ادامه نیز به آن خواهیم پرداخت، ممان دوقطبی مولکولی کل را به صورت جمع برداری ممان دوقطبی در پیوندهای جداگانه معرفی میکنند.
قطبیت پیوند و هندسه مولکولی
برخی از مولکولها، پیوندهایی قطبی دارند اما فاقد مقدار خالص گشتاور دوقطبی هستند. لازم به ذکر است که قطبیت یک مولکول، به دو عامل زیر بستگی دارد:
- قطبیت پیوند
- شکل مولکول
گشتاور دو قطبی مولکولی با جمع برداری ممانهای دوقطبی جداگانه در هر پیوند برابر است. برای نشان دادن رابطه بین ممان دوقطبی و هندسه مولکولی، مولکول دیاکسید کربن را در نظر میگیریم. پیوندهای کربن-اکسیژن، قطبی هستند و جهت دوقطبی در آن، در جهت اتم کربن به سمت اتم الکترونگاتیوتر اکسیژن است. در نتیجه، گشتاورهای پیوند کربن-اکسیژن، یکدیگر را خنثی میکنند و مولکول، هیچ ممان دوقطبی نخواهد داشت.
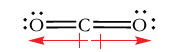
حال، مولکول تتراکلرومتان را با فرمول و دیکلرو متان در نظر بگیرید. هر دو مولکول، پیوندهای قطبی کربن-کلر با جهت کربن به سمت کلر دارند. مولکول تتراکلرومتان، ممان دوقطبی ندارد چراکه جمع برداری ممان پیوند برابر با صفر است. در مقابل، دیکلرومتان، گشتاور دو قطبی برابر با دارد. جمع برداری دو پیوند کربن-کلر به صورت نیمساز زاویه پیوندی نشان داده شده است. علت ایجاد گشتاور دوقطبی، وجود پیوندهای کربن-کلر ذکر میشود. نتیجه دو گشتاور پیوند کوچکتر کربن-هیدروژن، جهتی برابر با جهت کلی ممان دوقطبی دارد. در نتیجه، این مقدار کوچک، گشتاور پیوندهای کربن-کلر را تقویت میکند.
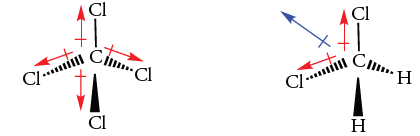
مثال
مولکول آب را در نظر بگیرید. از این تصویر میتوان جهت تعیین جهت و مقدار گشتاور دوقطبی استفاده کرد. اختلاف بین الکترونگاتیوی اکسیژن و هیدروژن برای هریک از پیوندهای هیدروژن-اکسیژن، 1/2 است. همچنین، از آنجایی که اکسیژن، الکترونگاتیوی بیشتری دارد، کشش بیشتری به الکترونهای اشتراکی وارد میکند. علاوه بر این، اکسیژن، دو جفتالکترون ناپیوندی نیز دارد.
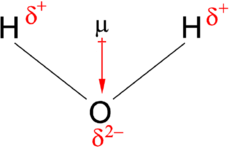
در نتیجه، اینطور میتوان بیان کرد که جهت گشتاور دوقطبی، از بین دو اتم هیدروژن، به طرف اتم اکسیژن خواهد بود. با استفاده از رابطه اصلی محاسبه گشتاور دوقطبی، مقدار ممان دوقطبی برابر با محاسبه خواهد شد که این مقدار با ضرب فاصله بین اتم اکسیژن و هیدروژن در اختلاف بار بین آندو حاصل میشود. گشتاور پیوند برابر با است. در نتیجه، ممان دوقطبی خالص برابر خواهد بود با:
اگر این مطلب برای شما مفید بوده است، آموزشها و مطالب زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزش نرمافزارهای مهندسی شیمی
- آموزش شیمی آلی ۲
- اوربیتال مولکولی — به زبان ساده
- طیف سنجی مولکولی — به زبان ساده
^^













سلام خوبین ببخشین چرا کروسین زعفران به راحتی درآب حل میشه
سلام ممان دوقطبی co(gly)3چه طور محاسبه میشه
گشتاور قطبی NH3 صفر است؟
سلام 85
سلام میشه توضیح بدید که چرا ممان دوقطبی در پارا نیتروفنول بزرگتراز فنول و فنول بزرگتراز نیترو بنزنه؟
با سلام؛
برای پاسخ یه این نوع از سولات بهتر است از تعریف گشتاور دوقطبی استفاده کنید. به طور مثال باید زاویه بین گروه فنول و نیترو را پیدا کنید. هرقدر زاویه بزرگتری داشته باشیم، ممان دوقطبی کمتر خواهد بود.
با تشکر از همراهی شما با مجله فرادرس
esu چیست و در فرمول گشتاور،آیا فاصله بر حسب متر و بار برحسب کولن نیست؟
با سلام؛
esu که به آن کولناستات یا فرنکلین هم میگویند، واحد فیزیکی برای بار الکتریکی در سیستم esu-cgs است و با توجه به نوع واحدها، دیمانسیونها در فرمول اصلی نیز بر حسب آنگستروم و esu بیان شدهاند تا گشتاور دوقطبی بر حسب «دبای» تعریف شود.
از همراهی شما با مجله فرادرس سپاسگزاریم.