کشت سلول چیست و چگونه انجام می شود؟ – آموزش به زبان ساده
کشت سلول یک ابزار بسیار متنوع در بررسی سؤالات اساسی تحقیقات علمی و همچنین ترجمه و بیان ژن است. سلولها ممکن است مستقیماً از بافت خارج شده و قبل از کشت با روشهای آنزیمی یا مکانیکی تجزیه شوند، یا ممکن است از یک رده سلولی یا سویه سلولی که قبلاً ایجاد شده است، مشتق شوند. در این مطلب به بررسی کشت سلولی، انواع آن و تجهیزات و شرایط مورد نیاز آزمایشگاه کشت سلول میپردازیم.
کشت سلول چیست؟
کشت سلولی یک ابزار ارزشمند است که سیستمهایی را برای مطالعه فیزیولوژی و بیوشیمیایی سلولهای سالم و بیمار در اختیار دانشمندان قرار میدهد. کشت سلولی رشد سلولهای یک حیوان یا گیاه در یک محیط مصنوعی و کنترل شده است. سلولها یا مستقیماً از ارگانیسم خارج میشوند و قبل از کشت تجزیه میشوند یا از رده سلولی یا سویه سلولی که قبلاً ایجاد شده است، جدا میشوند. برخی شرایط کشت بستگی به نوع سلول دارد، با این حال، هر کشت باید شامل یک ظرف مناسب با بستر یا محیطی باشد که مواد مغذی (مانند اسیدهای آمینه، کربوهیدراتها، ویتامینها، مواد معدنی) عوامل رشد یا هورمونهای ضروری برای کشت سلولها را تامین میکند. گازها (O2 ، CO2)، محیط فیزیک و شیمیایی (pH، فشار اسمزی، دما) نیز نقش مهمی در تنظیم رشد مناسب سلول در محیط مصنوعی ایفا میکنند.
کشت سلولی اولیه هنگامی ایجاد میشود که سلولها مستقیماً از بافت حیوانی یا گیاهی جمع آوری شده و در شرایط آزمایشگاهی رشد کنند. پس از ایجاد، خرده کشت سلولهای اولیه یک کشت سلولی ثانویه ایجاد میکند، که برخلاف ردههای سلولی، به طور نامحدود تقسیم نمیشود. از آنجا که اکثر سلولها در نهایت تقسیم خود را متوقف میکنند (یک فرایند عادی به عنوان پیری شناخته میشود) سلولهای اولیه و خرده کشت آنها طول عمر محدودی دارند. با این حال، ممکن است این کشتهای سلولی به یک خط سلولی جاودانه تبدیل شوند. این دگرگونی میتواند خود به خود یا از طریق القای شیمیایی یا ویروسی اتفاق بیفتد، در آن زمان خط سلولی مورد نظر پیوسته میشود و میتواند برای مدت طولانی حفظ شود.
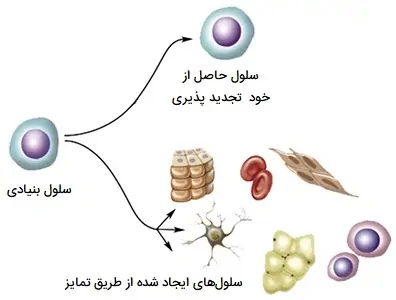
سلولهای بنیادی برای خود طبقهای هستند. سلولهای بنیادی بالغ میتوانند خود را تجدید کرده و چند منظوره باشند و بتوانند با بسیاری از انواع سلولی که مشخصه بافت یا اندامی است که در آن رشد کرده اند تمایز قائل شوند. این به اندامها و بافتها اجازه میدهد تا سلولهای مرده را دوباره پر کنند و بافتهای آسیب دیده را بازسازی کنند. این ویژگیها همچنین سلولهای بنیادی بالغ کشت داده شده را به الگوی ایده آل برای برخی از تحقیقات تبدیل میکند.
تاریخچه کشت سلول
سیدنی رینگر فیزیولوژیست انگلیسی قرن نوزدهم محلولهای نمک حاوی کلریدهای سدیم، پتاسیم، کلسیم و منیزیم را برای حفظ ضربان قلب جدا شده حیوان در خارج از بدن توسعه داد. در سال 1885 ویلهلم روکس قسمتی از پلاک نخاعی جنینی مرغ را برداشت و آن را در محلول نمک گرم برای چند روز نگهداری کرد و اصل کشت بافت را ایجاد کرد. راس گرانویل هریسون، که در دانشکده پزشکی جانز هاپکینز و سپس در دانشگاه ییل کار میکرد، نتایج آزمایشات خود را در سالهای 1907 تا 1910 منتشر و روش کشت سلول و بافت را ایجاد کرد.
انواع کشت سلول
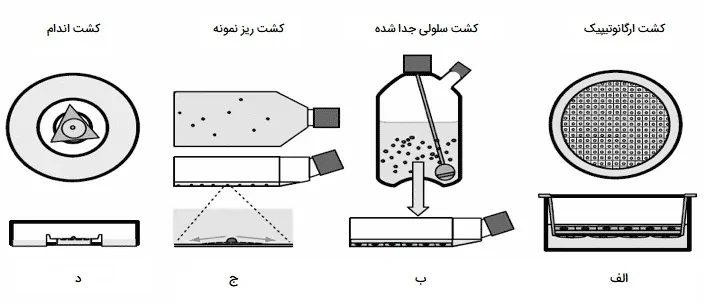
شیوههای مختلف کشت سلول از چپ به راست در تصویر زیر نشان داده شده است. ابتدا کشت اندام روی یک دیسک فیلتر روی یک شبکه فولادی ضد زنگ مثلثی بر روی یک چاهک محیط، که در بخش زیر نشان داده شده است. دوم، کشت ریزنمونه در یک فلاسک، با بخش زیرین و جزئیات بزرگتر در بخش در پایین ترین شکل، که رشد پیوندی و شعاعی را در زیر فلشها نشان میدهد. سوم، یک ظرف هم زده با تجزیه آنزیمی که یک سوسپانسیون سلولی را تولید میکند که در نمودار پایین به عنوان یک لایه تکثیر شده است. چهارم، یک فیلتر چاه که آرایهای از سلولها را نشان میدهد، که در بخش پایین نمودار دیده میشود، همراه با سلولهای ماتریکسی و استرومایی.
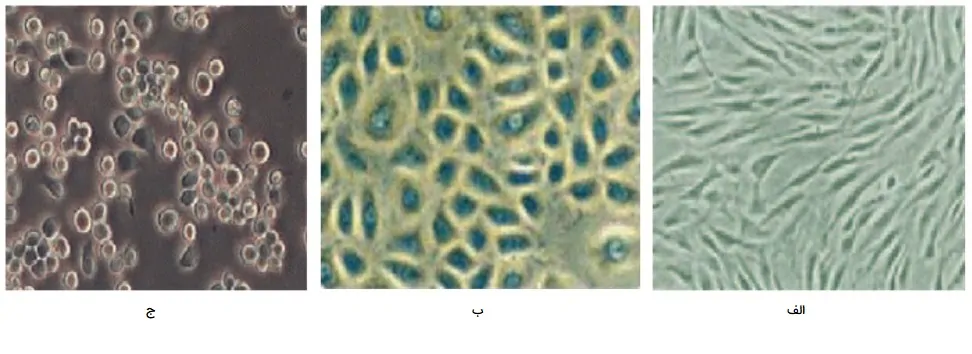
مورفولوژی سلول ها در کشت سلول
سلولها در کشت سلول را میتوان بر اساس شکل و ظاهر آنها (به عنوان مثال، مورفولوژی) به سه دسته اصلی تقسیم کرد. فیبروبلاستیک، شبه - اپیتلیال و شبه - لیمفوبلاست تقسیم کرد که در ادامه هر کدام را بیشتر توضیح میدهیم.
- «سلولهای فیبروبلاستیک» (Fibroblastic cells). سلولهای فیبروبلاستیک (یا شبیه به فیبروبلاست) دوقطبی یا چندقطبی هستند، شکل دراز دارند و به یک بستر متصل میشوند.
- «سلولهای شبه اپیتلیال» (Epithelial-like cells). سلولهای شبه اپیتلیال دارای شکل چند ضلعی با ابعاد منظمتر هستند و در لکههای مجزا به یک بستر متصل میشوند.
- «سلولهای شبه لنفوبلاست» (Lymphoblast-like cells). سلولهای شبه لنفوبلاستی شکل کروی دارند و معمولاً بدون اتصال به سطحی در حالت تعلیق رشد میکنند.
شرایط مورد نیاز در آزمایشگاه کشت سلول
در زمینه بالینی، کشت سلولی بیشتر با ایجاد سیستمهای مدلی مرتبط است که زیست شناسی سلولی اولیه را مطالعه کرده، مکانیسم بیماری را تکثیر یا سمیت ترکیبات دارویی جدید را بررسی میکنند. یکی از مزایای استفاده از کشت سلول برای این کاربردها امکان دستکاری ژنها و مسیرهای مولکولی است. علاوه بر این، همگن بودن جمعیت سلولهای کلونال یا انواع سلولهای خاص و سیستمهای کشت تعریف شده، متغیرهای ژنتیکی یا محیطی مداخله کننده را حذف میکند و بنابراین امکان تولید دادههایی با قابلیت تکرارپذیری بالا و ثبات بهتر را فراهم میکند که هنگام مطالعه سیستمهای کل ارگانها قابل اطمینان نیست. در ادامه موارد مربوط به آزمایشگاه کشت سلولی را بیشتر بررسی میکنیم.
ایمنی آزمایشگاه کشت سلول
کاربرد هیجان انگیز تکنیکهای کشت سلولی در تحقیقات زیست پزشکی نیازمند مدیریت خطرات احتمالی مرتبط با عوامل عفونی (به عنوان مثال، HBV یا HIV) است که توسط سلولهای کشت شده نگهداری میشود، بلکه کنترل معرفهایی که میتوانند ماهیت سمی، خورنده یا جهش زا داشته باشند. این خطرات احتمالی میتوانند سلامت کارکنان آزمایشگاه را هنگام ورود به بدن (به عنوان مثال، از طریق تماس پوست و غشاهای مخاطی با مواد جامد، مایعات یا آئروسلها) به خطر بیندازند و در صورت برخورد نادرست با آنها باعث به خطر انداختن محیط زیست خواهد شد. بنابراین قبل از شروع هرگونه کار کشت سلولی، قرار گرفتن در معرض کاهش یا حذف عوامل خطرناک باید به حداقل برسد تا عفونت، بیماری زایی، واکنشهای آلرژیک و تماس با سموم آزاد شده به حداقل برسد.
این را میتوان با آموزش دقیق پرسنل آزمایشگاه و اجرای روشهای استاندارد کشت سلولی، که باید به طور منظم توسط اعضای آزمایشگاه و کمیته ایمنی موسسه مورد بازبینی و تجدید نظر قرار گیرد، به دست آورد. علاوه بر این، هنگام کار با سلولهای اولیه جدا شده مستقیماً از بافت انسان، مهم است که اهداکنندگان که از آنها سلولها برای عوامل بیماری زا گرفته شده اند، غربالگری شود. واکسیناسیون به روز در برابر بیماریهای عفونی مانند هپاتیت B نیز برای کارکنان آزمایشگاهی که با سلولهای اولیه کار میکنند بسیار توصیه میشود. در ادامه راهنمای ایمنی کار در آزمایشگاه سلولی را توضیح داده ایم.
- هر یک از کارکنان آزمایشگاه مسئول سلامت و ایمنی خود و دیگران است که ممکن است تحت تأثیر کار انجام شده در آزمایشگاه کشت سلولی قرار بگیرند.
- تجهیزات حفاظتی شخصی باید هنگام ورود به آزمایشگاه کشت سلولی پوشیده شده و هنگام خروج یا آلودگی هرگونه وسایل حفاظتی شخصی برداشته شوند. هنگام دست زدن به عوامل خطرناک، دستکشهای آلوده باید بلافاصله برداشته شوند و در زبالههای خطرناک زیستی دفع شوند و بلافاصله دستها شسته شوند.
- در معرض قرار دادن پوست با پوشیدن کفش های باز، شلوارهای کوتاه و دامن توصیه نمیشود.
- مصرف غذا، نوشیدنی، ذخیره مواد غذایی، سیگار کشیدن، استفاده از لوازم آرایشی یا استفاده از لنزهای تماسی در آزمایشگاه کشت سلولی مجاز نیست.
- هنگام کار در آزمایشگاه کشت سلولی نباید از تلفن همراه استفاده کرد.
- لباسهای گشاد (مانند روسری، گردنبند آویزان) باید قبل از شروع کار برداشته شوند و موها باید به پشت بسته شوند.
- آزمایشگاه کشت سلولی (به عنوان مثال، انکوباتورها، هودهای لامینار و سطوح کار) باید مرتباً با یک ماده ضدعفونی کننده تمیز شود.
- تمام ابزارهای آزمایشگاهی در تماس با عوامل بالقوه عفونی یا خطرناک باید قبل و بعد از کار با آنها ضد عفونی شوند. مواد بالقوه عفونی و خطرناک باید از راه توصیه شده خود ضدعفونی و دفع شوند.
- اقلام تیز (به عنوان مثال، نوک پیپت) باید بلافاصله از طریق جعبههای تعیین شده دفع شوند.
- قبل از خروج از آزمایشگاه کشت سلولی، دستها باید شسته شوند.
- مامور ایمنی آزمایشگاه باید در مواجهه با ریختن عوامل عفونی یا خطرناک مطلع شود تا راهکاری مناسب برای مهار و سم زدایی توصیه کند.
مدیریت ایمن خطوط سلولی
کمیته مشورتی در مورد عوامل بیماری زا خطرناک (ACDP) یک نهاد ملی است که توسط مدیر ایمنی و بهداشت (HSE) اداره میشود. در مورد خطرات و موارد ناشی از تماس با عوامل بیماری زا برای کارکنان و سایر افراد توصیه میکند و این موارد را منتشر کرده است. از آنجا که برخی از انواع سلولها بیماریزا هستند یا عوامل بیماریزا را حمل میکنند، مهم است که ابتدا گروه خطر آنها را تعیین کرده و اقدامات ایمنی مناسب را انجام دهیم. این شامل ارزیابی خطرات کتبی و بررسی امکانات آزمایشگاهی است.
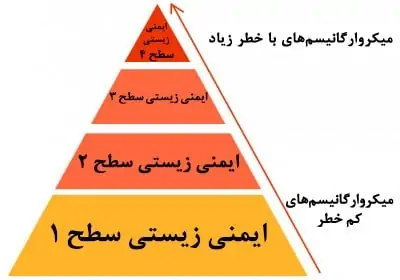
میکروارگانیسمهای طبقه بندی شده به عنوان گروه خطر 1 (به عنوان مثال، اشریشیا کولی K-12) یا گروه خطر 2 (به عنوان مثال، استافیلوکوکوس اورئوس) خطرات کم یا متوسطی را برای کارکنان آزمایشگاه و جامعه نشان میدهند و به پیشگیری یا گزینههای درمانی مؤثر متکی هستند. کار کشت سلولی با عوامل بیولوژیکی گروه خطر 3 (به عنوان مثال، کروناویروس مرتبط با سندرم حاد تنفسی حاد (SARS-CoV)) و 4 (به عنوان مثال، ویروس ابولا) شامل عوامل بیولوژیکی است که خطرات زیادی برای سلامتی دارند و ممکن است در صورت عفونت فاقد گزینههای درمانی باشند.
بنابراین، فضاهای آزمایشگاهی باید سطح مهار مربوط به گروه خطر انواع سلولهای کشت شده را ارائه دهند. به این سطوح ایمنی زیستی (BSL) گفته میشود و اعداد مربوطه (BSL1-4) را حمل میکند. به این ترتیب، آزمایشگاههای تعیین شده به عنوان BSL1 از روشهای استاندارد میکروبیولوژیکی پیروی میکنند، در حالی که آزمایشگاههای BSL2 باید به پرسنل آموزش دیده یعنی افرادی که به آنها آموزش داده شده است که در کار با وسایل تیز احتیاط کنند و با استفاده از تجهیزات فیزیکی مهار و همچنین کابینتهای ایمنی زیستی کلاس II، آئروسلهای عفونی را محدود کنند.
روش های ایمن در آزمایشگاه کشت سلول
به منظور اطمینان از محیط کار ایمن با ردههای سلولی و عوامل زیستی، تجهیزات حفاظتی شخصی (PPE) باید در آزمایشگاه کشت سلولی استفاده شوند. روپوش، دستکش و عینک آزمایشگاهی مانعی بین کارکنان آزمایشگاه و منابع بالقوه خطرناک ایجاد میکند. علاوه بر این، کابینتهای ایمنی زیستی بر جریان ثابت و یک طرفه هوای فیلتر شده توسط HEPA تکیه کرده و یک فضای کاری محصور و تهویه شده ایجاد میکنند.
این امر قرار گرفتن محققان و محیط در برابر مواد خطرناک مرتبط با سلولهای کشت شده را به حداقل میرساند، در حالی که همزمان از کشت سلولی در برابر آلودگیها محافظت میکند. در حین کار با محیط کشت سلولی و انجام آزمایشات در آزمایشگاه کشت سلولی، همچنین توصیه میشود که برگه اطلاعات ایمنی مواد (MSDS) مربوط به معرفهای آزمایشگاهی را مرور کنید. در آن خصوصیات شیمیایی و فیزیکی محصول ذکر شده، مسیرهای مناسب ذخیره سازی و دفع مشخص شده است، در مورد خطرات احتمالی سلامتی و سمیت اطلاع رسانی میشود و در مورد PPE که هنگام استفاده از این محصول باید در نظر گرفته شود توصیه شده است.
تجهیزات آزمایشگاه کشت سلولی
با وجود تکنیکها و روشهای مختلف انجام شده در آزمایشگاههای مختلف کشت سلولی، موضوع مشترک کار کشت سلولی آسپسی یا بی میکروب (ایجاد یک محیط کوچک عاری از میکروارگانیسمهای بیماری زای ناخواسته، از جمله باکتریها، ویروسها، قارچها و انگلها) است. از آنجا که آسپسی یک جزء مهم در کار موفق کشت سلولی است، یک اتاق جداگانه یا منطقه تعیین شده باید به این کار اختصاص داده شود و برای اهداف دیگر استفاده نشود. چندین قطعه از تجهیزات میتوانند به دستیابی به چنین فضای کاری استریل کمک کرده و به طور کلی منجر به کارآیی، دقت و ثبات بیشتر عملکرد کشت سلولی شوند. تجهیزات توصیه شده برای آزمایشگاه کشت سلول در ادامه ذکر شده اند.
- میکروسکوپ نوری معکوس. برای ارزیابی مورفولوژی سلول و شمارش سلولها.
- یخچال، فریزر (منفی 20 درجه سانتیگراد، منفی 80 درجه سانتیگراد)، ذخیره نیتروژن مایع. به منظور ذخیره سلولها، مواد سلولی و اجزای کشت.
- سانتریفیوژ. برای متراکم کردن سلولها.
- pH متر. برای تعیین pH مناسب اجزای محیط.
- پیپت و پیپتور. برای تقسیم حجمهای مختلف.
- محیط کشت سلولی و اجزای تکمیلی. برای کشت سلولها در اجزای مطلوب.
- «هماسی سنج» (Hemacytometer). برای شمارش سلولها، سینتیک رشد را تعیین کرده و تهیه تراکم آبکاری مناسب.
- اتوکلاو. برای استریل سازی پیپتها و سایر تجهیزات در تماس با سلولها.
- پمپ خلاء. برای آسپیراسیون محیط کشت سلولی.
- حمام آب (با قابلیت تنظیم درجه حرارت). برای گرم کردن محیط کشت سلولی.
- ظروف کشت سلول. برای کشت سلولها در قالبهای مختلف (به عنوان مثال، فلاسکها، ظروف پتری، پلیتهای 96 خانهای)
- ظروف زباله (زیست خطرناک). برای دفع صحیح زبالهها.
رده های سلولی در کشت سلول
انتخاب یک رده سلولی برای کشت سلولی بستگی زیادی به خواص عملکردی و بازخوانیهای خاص مورد نیاز مدل سلولی دارد. ردههای سلولی انتخاب شده نیز باید با تجهیزات موجود و الزامات گروه خطر خاص خود هماهنگ شوند. سلولهای کشت شده در آزمایشگاه را میتوان به سه نوع مختلف طبقه بندی کرد: سلولهای اولیه، سلولهای تبدیل شده و سلولهای خود تجدیدپذیر.
سلولهای اولیه
«سلولهای اولیه» (Primary cells) مانند فیبروبلاستهای بدست آمده از بیوپسی پوست و سلولهای کبدی جدا شده از ریزنمونههای کبدی، مستقیماً از بافت انسان جدا میشوند. تحقیقات زیست پزشکی و ترجمهای اغلب به استفاده از این نوع سلولها متکی است زیرا آنها نماینده خوبی از بافت منشأ خود هستند. با این حال، محدودیتهای شدید ایمنی زیستی در ارتباط با استفاده از این نوع سلولها وجود دارد. علاوه بر این، سلولهای اولیه به طور کلی به عنوان محدود توصیف میشوند و بنابراین به عرضه مداوم ذخایر متکی هستند زیرا تکثیر آنها پس از تعداد محدودی از تقسیمات سلولی متوقف میشود و گسترش سلول اغلب غیرممکن است.
سلول های تبدیل شده
«سلولهای ترنسفرم شده» (Transformed cells) را میتوان به طور طبیعی یا با دستکاری ژنتیکی تولید کرد. در حالی که استفاده از چنین ردههای سلولی نامیرایی منجر به ایجاد یک پلت فرم سلولی میشود که نرخ رشد سریع و شرایط پایدار برای نگهداری و شبیه سازی ایجاد میکند، ژنوتیپ دستکاری شده آنها ممکن است منجر به ناهنجاریهای کاریوتیپی و فنوتیپهای غیر فیزیولوژیکی شود. از سوی دیگر، ردههای سلولی استاندارد مشتق شده از گونههای انسانی یا غیر انسانی (به عنوان مثال، تخمدان همستر چینی (CHO)، HeLa ، سلولهای اندوتلیال ورید ناف انسان (HUVEC)) اغلب مشخص میشود و بنابراین راه اندازی آنها آسانتر است.
سلول های خود تجدید پذیر
«سلولهای خود تجدید شونده» (Self-renewing cells) به عنوان مثال، سلولهای بنیادی جنینی، سلولهای بنیادی پرتوان القایی، سلولهای بنیادی عصبی و رودهای شامل میشوند. این سلولها قابلیت تمایز به انواع دیگر سلولها را دارند، در حالی که خاصیت خود تجدیدپذیری آنها امکان نگهداری طولانی مدت در شرایط آزمایشگاهی را فراهم میکند. انواع سلولهای خود تجدیدپذیر اغلب به عنوان نمایندههای فیزیولوژیکی مرتبط با مکانیسمهای in vivo عمل میکنند. خطوط سلولی را میتوان به صورت تجاری بدست آورد، جایی که اقدامات کنترل کیفیت خاصی در نظر گرفته شده است که ثبات ژنومی و عدم وجود آلایندهها را تضمین میکند. مکانهای دیگر برای تأمین خطوط سلولی میتوانند بانکهای سلولی یا دیگر آزمایشگاههای کشت سلولی باشند. معرفی ردههای سلولی جدید در آزمایشگاه همیشه باید با آزمایش Mycoplasma PCR همراه باشد تا از کشت تمیز اطمینان حاصل شود.
کشت سلولی ریز محیط ها
صرف نظر از رده سلولی انتخاب شده، یک مورد مشترک انتخاب شرایط رشد مناسب خواهد بود. این شامل قالب رشد سلول نیز میشود. مزایا و معایب متعددی در ارتباط با کشت سلولها در حالت سوسپانسیون یا کشت پلیت وجود دارد. در حالی که سلولهای در حال رشد سریع در حالت سوسپانسیون برای آزمایشهایی که هدف آنها جداسازی پروتئینهای نوترکیب است مناسبتر بوده، سلولهای چسبنده برای مطالعاتی که قطبیت سلولها جزء اساسی عملکرد سلول است (به عنوان مثال، سلولهای اپیتلیال)، مناسبتر هستند. سلولهای رشد کرده در حالت سوسپانسیون به طور کلی اشکال کروی را در پیش میگیرند، در حالی که سلولهای چسبنده مورفولوژیهای خوشهای یا چند ضلعی را نشان میدهند.
محیط کشت سلول چیست؟
هدف از ساخت محیط کشت سلولی، ایجاد محیطی که حداکثر انتشار سلول را ممکن میسازد، در درجه اول از طریق دستگاه انکوباتور (یعنی دما، رطوبت، تنشهای O2 و CO2) و محیط کشت سلول پایه و مکملهای آن به دست میآید. این شامل نه تنها تامین مواد مغذی مانند کربوهیدراتها، ویتامینها، اسیدهای آمینه، مواد معدنی، عوامل رشد، هورمونها، بلکه اجزایی است که خواص فیزیک و شیمیایی مانند pH محیط کشت و فشار اسمزی سلولی را کنترل میکنند.
علاوه بر این، بستر رشد جامد یا نیمه جامد و تراکم سلولی به ترتیب محکم شدن ماتریکس سلولی و برهم کنشهای سلولی را امکان پذیر میسازد، که بیشتر بر تقلید یک ریز محیط فیزیولوژیکی مرتبط نظارت میکند. تنوع زیادی از ترکیبات محیط کشت سلولی برای نیازهای انواع سلولی خاص ایجاد شده است و میتوان آنها را بر اساس سطح سرم مکمل آنها طبقه بندی کرد.
سرم در کشت سلول
سرم به شکل سرم گاوی (FBS) معمولاً به محیط پایه اضافه میشود که قبلاً حاوی فرمولاسیون استاندارد مبتنی بر اسیدهای آمینه، ویتامینها، منابع کربن (به عنوان مثال، گلوکز) و نمکهای معدنی است. سرم فاکتورهای رشد و هورمونها را در اختیار سلولها قرار میدهد و به عنوان حامل لیپیدها و آنزیمها و انتقال دهنده ریزمغذیها و عناصر کمیاب عمل میکند. با این حال، برخی قصد دارند مکملهای پایه را با عوامل مشتق از حیوانات مانند سرم کاهش دهند، زیرا این یک جزء تعریف نشده است که میتواند بین دستهها بسیار متفاوت باشد. همچنین یک محصول کشت سلولی پرهزینه است، خطر ایجاد اثرات نامطلوب تحریک کننده یا بازدارنده بر رشد و عملکرد سلولی را به همراه دارد و اگر از تأمین کنندگان معتبر تهیه نشده باشد ممکن است آلودگی ایجاد کند.
محیطهای کاهش یافته یا فاقد سرم بر فرمولاسیونی تکیه میکنند که سرم را با اجزای تعریف شده بیشتر کاهش داده یا جایگزین میکند. این به طور کلی تولید کشتهای سلولی با قوام بیشتر در رشد و بازده بیشتر در برنامههای آزمایشی پایین دست را موجب میشود. غلظت مکملها را نیز میتوان با توجه به نیازهای خاص انواع سلولها تنظیم کرد.
تنظیمات سطح دما ، pH ، CO2 و O2 در کشت سلول
دمای پایدار برای کشت سلولی را میتوان از طریق دستگاههای انکوباتور که دمای محیط کشت سلولی را به شدت تنظیم و نظارت میکنند، بدست آورد. با تکثیر سلولها، رشد آنها به انرژی مورد نیاز در محیط، به عنوان مثال به شکل گلوکز، نیاز دارد. هنگامی که متابولیزه میشود، محصولات جانبی آن شامل پیروویک اسید، لاکتیک اسید و CO2 است. از آنجا که سطح pH به تعادل CO2 و HCO3 (بی کربنات) وابسته است، افزودن بافرهای مبتنی بر بی کربنات به محیط کشت سلولی میتواند غلظت CO2 را متعادل کند.
سایر بافرهای pH میتوانند طبیعت آلی داشته باشند و شامل 4 - (2-هیدروکسی اتیل) - 1 - پیپرازین اتان سولفونیک اسید (HEPES) (10 - 25 میلی مولار) یا 3 - (N-morpholino) پروپانسولفونیک اسید (MOPS) (20 میلی مولار) باشند. بسیاری از محیطهای کشت سلولی حاوی شاخصهای pH (به عنوان مثال، فنل قرمز) هستند که محدوده رنگی بین شرایط اسیدی (زرد) و قلیایی (صورتی) را نشان میدهند.
علاوه بر این، نوسانات غلظت CO2 جوی نیز میتواند سطح pH را تغییر دهد. بنابراین سلولها باید در انکوباتورها کشت داده شوند تا تنش CO2 نیز در 5 تا 7 تنظیم شود. برای تأخیر در تغییر PH، گلوکز ممکن است با منبع کربن دیگری مانند گالاکتوز یا فروکتوز جایگزین شود. اگرچه این امر سرعت رشد سلولها را کند میکند، اما تجمع محصولات جانبی مانند اسید لاکتیک را نیز کاهش میدهد. برای کشتهای سلولی خاص که شرایط پاتولوژیک یا فیزیولوژیکی را تحت تنش اکسیژن کم (هیپوکسی) تقلید میکنند، توصیه میشود از دستگاههای انکوباتور هیپوکسیک با غلظت اکسیژن 1 تا 21 درصد قابل تنظیم با نیتروژن استفاده کنید.
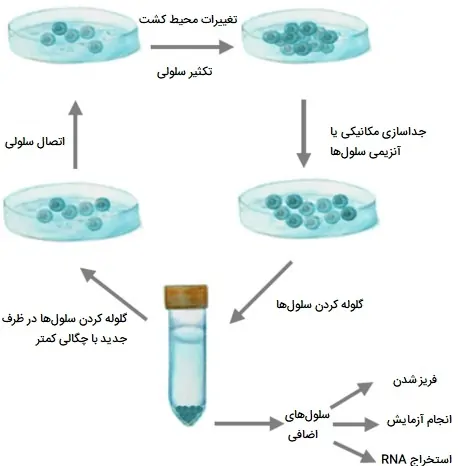
پاساژ سلولی یا ساب کالچر
هنگامی که فضای موجود در ظرف کشت سلولی به حدود 80 درصد محل تلاقی (پوشش) میرسد، سلولها باید برای ادامه رشد به ظروف جدید منتقل شوند. این فرایند، که به آن «پاساژ دادن» (passaging) میگویند، ساب کالچرها یا ساب کلونها را ایجاد میکند و نیاز به هضم آنزیمی یا اختلال مکانیکی تک لایه سلول چسبنده برای جدا کردن سلولها از بستر کشت بافت تیمار شده دارد. ردههای سلولی چسبنده در فلاسکها یا پلیتها نگهداری میشوند و تغییرات منظم محیط، تکثیر سالم سلول را تضمین میکند. هنگامی که 80 درصد تلاقی حاصل شد، سلولها از نظر آنزیمی یا مکانیکی از بسترهای آبکاری خود جدا میشوند. سلولهای جدا شده را میتوان در لوله فالکون جمع آوری و گلوله کرد. با زیرمجموعهای از این سلولها میتوان ظروف کشت سلولی جدیدی را کاشت، در حالی که سلولهای باقی مانده را میتوان منجمد یا برای آزمایشهای پایین دست استفاده کرد.
روش های کشت سلول آسپتیک
در این بخش به شیوههایی که باید توسط کارکنان آزمایشگاه برای محافظت از سلولهای کشت اعمال شود، میپردازیم. در واقع، عفونتهای میکروبیولوژیکی مشکل اصلی برای حفظ سلولها در شرایط آزمایشگاهی هستند. عوامل عفونی مانند باکتریها برای سلولهای یوکاریوتی سمی هستند و در نهایت منجر به مرگ سلول میشوند. علاوه بر این، حتی سطوح پایین آلودگی میتواند منجر به نتایج غیر طبیعی و تفاسیر علمی اشتباه شود. با پیروی از چندین تکنیک که آسپسی را در آزمایشگاه کشت سلولی تضمین میکند، محققان میتوانند دفعات و وسعت آلودگیها را کاهش داده و از دست دادن سلولها، منابع و زمان را کاهش دهند. این میتواند با حذف ورود میکروارگانیسمها به کشت سلولی از طریق تجهیزات آلوده، محیطها، اجزای کشت سلولی، دستگاههای انکوباتور، سطوح کار و نقص یا باز شدن ظروف کشت سلولی محقق شود.
ایجاد محیط کار آسپتیک
با توجه به اینکه هوای اتمسفر مملو از ریز ذرات دارای ماهیت بالقوه عفونی است، کابینت ایمنی زیستی مهمترین تجهیزات برای محدود کردن ذرات و اجزای معلق در هوا از آلودگی سلولهای کشت شده است. کابینت ایمنی زیستی باید در یک فضای آزمایشگاهی قرار گیرد که جریان هوا را از طریق منابع خارجی باد (به عنوان مثال پنجرهها یا درها) قطع نکند. بیشتر کابینتهای ایمنی زیستی به زمان گرم شدن نیاز دارند و پس از آن سطح کار باید با یک شوینده ضد قارچ (به عنوان مثال 5 درصد تریژن) و 70 درصد اتانول رفع آلودگی شود. تمام تجهیزات وارد شده به کابینت ایمنی زیستی نیز باید اسپری شده و با اتانول 70 درصد پاک شوند. با این حال، تعداد اقلام مورد استفاده در کابینت ایمنی زیستی باید حداقل باشد تا مانع از عبور هوا نشود. کابینت ایمنی زیستی فقط باید پس از اتمام استفاده روزانه از آن خاموش شود و لامپ ماوراء بنفش (UV) روشن شود تا سطوح در معرض دید در طول شب استریل شود.
تمیز نگه داشتن تمام سطوح دیگر در تماس با ظروف کشت سلولی یا اجزای محیطی بسیار مهم است. این موارد شامل دستگاه انکوباتور، سانتریفیوژ، میکروسکوپ، حمام آب، یخچال و فریزر است. دستگاههای انکوباتور از جنس استیل ضد زنگ به راحتی تمیز میشوند و سطوح را از خوردگی محیط مرطوب محافظت میکنند. برای جلوگیری از رشد میکروبها میتوان محلولهای درمانی را به حمام آب اضافه کرد. در مقیاس بزرگتر، تجهیزات ذخیره شده در فضای کشت سلولی باید عاری از گرد و غبار باشد و تمیز کردن منظم سطوح کشت سلولی توصیه میشود.

کارکنان آزمایشگاه میتوانند با شستن دستها با صابون قبل و بعد از کار با کشت سلولی، به تمیز کردن سطح کار کمک کنند. دستکشهای یکبار مصرف اسپری شده با 70 درصد اتانول و روپوش آزمایشگاهی میتواند میزان آلودگیهای منتقل شده توسط مو، سلولهای پوست یا گرد و غبار را بیشتر کاهش دهد. با این حال، هنگام خروج از فضای کشت سلولی، دستکشها باید برداشته شوند و روپوش آزمایشگاهی نیز فقط در محدوده آزمایشگاه کشت سلولی پوشیده شود. روپوشهای آزمایشگاهی باید به طور منظم در دمای گرم شسته شوند.
استفاده از معرف های آسپتیک و محیط کشت برای کشت سلول
منابع اصلی آلودگی در آزمایشگاه از طریق کارکنان آزمایشگاه، محیط زیست و محیط کشت است. محیطهای تجاری و محصولات تکمیلی کشت سلولی به طور کلی در شرایط استریل عرضه میشوند. علاوه بر این، استریلیزاسیون با فیلتر امکان تولید محیط کشت سلولی را که بر اساس معرفهای کشت غیر استریل ساخته شده است، میدهد، در حالی که اتوکلاو به طور معمول برای استریل سازی تجهیزات در تماس با سلولهای کشت شده استفاده میشود. استریلیزاسیون مایعات را میتوان با رد کردن مایع از یک سیستم فیلتر کم اتصال پلی اترسولفون 0/22 میکرومتر با استفاده از پمپ خلاء انجام داد.
افزودن آنتی بیوتیکها (به عنوان مثال، پنی سیلین/استرپتومایسین) خطر رشد باکتریها را در بطریهای محیط کشت پس از باز شدن ظروف کشت سلولی محدود میکند. با این حال، برخی آزمایشگاهها از استفاده معمول از آنتی بیوتیکها خودداری میکنند زیرا میتواند ظهور سویههای مقاوم باکتری را تسهیل کرده و باعث ایجاد آلودگیهای سطح پایین شده و ممکن است منجر به تداخل با متابولیسم سلولی و ایجاد نتایج تجربی اشتباه شود.
کشت سلول چگونه است؟
برای دستیابی به کشت سلول موفق، شرایط مهم زیر باید رعایت شود:
- دمای انکوباتور باید 36 درجه سانتی گراد باشد.
- pH برای رشد باید بین 7/2 تا 7/4 باشد.
سطوح گلوکز و L - گلوتامین میتوانند بر رشد سلولی تأثیر بگذارند و قبل از اقدام به کشت، باید سطوح صحیح برای هر رده سلولی بررسی شود (سطوح معمولی گلوکز و ال - گلوتامین به ترتیب 1 تا 4 میلی مولار و 2 میلی مولار است). طیف وسیعی از یونهای غیر آلی، اسیدهای آمینه و ویتامینها برای بقاء سلول ضروری هستند و معمولاً از طریق منابع اختصاصی در محیط رشد پایه قرار میگیرند. هر دو اکسیژن و دی اکسید کربن ضروری هستند یا به عنوان مخلوطی از CO2 و هوا که به ظرف کشت داده میشود یا با محکم بستن ظرف برای حفظ CO2 تولید شده توسط متابولیسم سلولی، تأمین میشوند.
مهارت در روش آسپتیک برای حفظ استریل ماندن در طول آماده سازی محیط و مراحل کشت سلول مهم است. علاوه بر این، این یک جزء حیاتی در اطمینان از حفاظت اپراتور در برابر عوامل عفونی است که ممکن است در مواد کشت وجود داشته باشد. برخی از عناصر مهم در تکنیک آسپتیک عبارتند از:
- همه ظروف شیشهای را برای استفاده از کشت و محیط سلولی استریل کنید.
- مراقب پاشیدن، ریختن و ذرات معلق هوا هنگام کار باشید.
- از انتقال مایع به روش طریق ریختن آن خودداری کنید.
- هنگام افزودن (یا تعویض) محیط، هرگز با بطری حاوی محیط گردن فلاسکهای کشت را لمس نکنید یا از یک پیپت برای انتقال محیط به بیش از یک بطری استفاده نکنید. در حالت ایده آل، مقدار کل محیط مورد نیاز برای هر دسته از بطریهای مورد استفاده را تقسیم کنید و بقیه را در دمای 4 تا 8 درجه سانتی گراد ذخیره کنید. برای هر رده سلولی محیط جداگانهای اختصاص دهید.
- مواد تمیز و آلوده را در BSC II (کابینتهای ایمنی زیستی کلاس 2) جدا کنید.
- قرار دادن محیطهای استریل را در معرض فضای بیرونی و کشت سلولی در هوای آزاد (حتی در BSC II) را به حداقل برسانید.
- قبل از برخورد با کشت سلولی، آماده سازی نهایی محیط استریل (یعنی افزودن سرم یا سایر افزودنیها) را انجام دهید.
به دلیل خطرات آلودگی و عفونت متقاطع، کشت سلول در آزمایشگاه تشخیص ویروس بهتر است در ظروف بسته، لولههای پیچ دار و بطریهای تخت انجام شود. WHO استفاده از پلیتهای ۲۴ خانهای برای جداسازی ویروسهای فلج اطفال از نمونههای مدفوع را توصیه نمیکند زیرا این روش برای شرایطی که در بسیاری از آزمایشگاههای شبکه جهانی آزمایشگاه فلج اطفال (Global Polio Laboratory Network) مشاهده میشود نامناسب است. ابتدا کشتها در محیط رشد تکمیل شده با 10 درصد سرم ایجاد میشوند. پس از تشکیل سلولهای تک لایه، کشتها به محیط نگهداری تغییر میکنند که برای حفظ کشتها در حالت سالم تا زمانی که ممکن است بدون تحریک رشد، طراحی شده است این امر با کاهش محتوای سرم معمولاً به 2 درصد به دست میآید.

تهیه ظروف شیشه ای
با توجه به دشواری تمیز کردن و بازیافت ظروف شیشهای با کیفیت، بسیاری از آزمایشگاهها به استفاده از ظروف پلاستیکی کشت سلولی یکبار مصرف روی آورده اند. اگر آزمایشگاهی استفاده از ظروف شیشهای را انتخاب کند، باید اطمینان حاصل شود که همه ظروف شیشهای به طور دقیق تمیز و استریل میشوند تا کشت سلول تحت تأثیر آثار پروتئینی، مواد شوینده، پیروژنها، رسوبات آب و سایر مواد باقی مانده که ممکن است روی ظروف شیشهای رسوب کنند قرار نگیرد. پروتکلهای تمیز کردن ظروف شیشهای باید بر اساس روشهای زیر توسعه داده شوند:
- در جابجایی ظروف شیشهای دقت کنید زیرا بیشتر شکستگیها در حین تمیز کردن رخ میدهد.
- قبل از تمیز کردن، ظروف شیشهای را با اتوکلاو یا خیساندن یک شب در محلول کلر (0/5 درصد) ضد عفونی کنید.
- پیپتها را در ظرف حاوی کلر ضد عفونی کنید.
- همه ظروف شیشهای را در اسرع وقت پس از استفاده بشویید.
- برای جلوگیری از خشک شدن و تمیز کردن اجسام سخت، اقلام آلوده را در آب حاوی مواد ضدعفونی کننده یا پاک کننده نگهداری کنید.
- برای تمیز کردن کامل تمام ظروف شیشهای آزمایشگاهی از مواد شوینده 7X - DECON یا مواد شوینده مشابه استفاده کنید. این مواد شوینده به راحتی از ظروف شیشهای بدون باقی مانده پاک میشوند. (به هیچ عنوان از شوینده مایع ظرفشویی داخلی استفاده نکنید.)
- شیشه را با مالیدن با برس تمیز کنید. به طور دورهای برسها را از نظر سایش بررسی کنید تا از خراشیدن شیشه جلوگیری شود.
- اقلام را به طور کامل با آب لوله کشی تمیز کنید و حداقل 5 تا 7 بار با آب مقطر یا دیونیزه آنها را آب بزنید. حتی کوچکترین مقدار باقی مانده پاک کنندهها، ضد عفونی کنندهها یا اسیدها میتوانند بر رشد کشت سلولی تأثیر بگذارند.
- ظروف شیشهای را روی قفسهها یا تختههای گیره خشک کنید و بعد از خشک شدن آنها را بررسی کنید. اگر ظروف شیشهای کدر هستند، بیوفیلم دارند یا لکهها مشخص هستند، قبل از استفاده تمیز کردن اضافی لازم است.
- ظروف شیشهای کشت سلولی را با استفاده از کوره هوای گرم در دمای 180 درجه سانتیگراد به مدت سه ساعت برای از بین بردن پیروژنها استریل کنید. اجزای غیر شیشهای که ممکن است 180 درجه سانتیگراد را تحمل نکنند باید با روشهای متفاوتی مانند اتوکلاو استریل شوند و مجدداً به صورت آسپتیک مونتاژ شوند.
شستشو با اسید کرومیک: برخی از ظروف شیشهای بسیار کثیف ممکن است به روشهای قوی برای تمیز کردن نیاز داشته باشند و به طور سنتی این امر مستلزم استفاده از اسید کرومیک (10 درصد دی کرومات پتاسیم در 25 درصد اسید سولفوریک) بوده است. با این حال، اسید کرومیک یک ماده خطرناک است و نگرانیهای ایمنی و زیست محیطی دارد. جایگزینهای مؤثر تجاری برای اسید کرومیک وجود دارد که عبارتند از: محصول فیشر، محصولات Contrad 70 یا محصولات علمی VWR Chem - Solv، فرمولاسیون بدون فسفاتRBS-35 ، PCC-54 و Nochromix (همچنین توسط فیشر عرضه میشود). اگر باید از اسید کرومیک استفاده شود، تمام احتیاطهای ایمنی معمول را برای استفاده از اسیدهای غلیظ و محلولهای اسیدی رعایت کنید. مانند سایر مراحل تمیز کردن، همه محلولهای تمیز کننده باید به طور کامل از ظروف شیشهای با تغییرات فراوان آب لوله کشی و به دنبال چندین تغییر آب مقطر شستشو داده شوند.
انتخاب سیستم های کشت سلول
بسیاری از سیستمهای کشت سلولی از رشد ویروسهای فلج اطفال و سایر انتروویروسها پشتیبانی میکنند. به آزمایشگاههای مرجع منطقهای (RRL) توصیه میشود که کشت سلولی را از مجموعههای رسمی تهیه کنند. درخواست برای این ردههای سلولی باید به IVB/VAM ، WHO ، ژنو ارسال شود. آزمایشگاههای ملی فلج اطفال میتوانند به نوبه خود برای تهیه این خطوط سلولی به RRL تعیین شده خود مراجعه کنند. در اسرع وقت پس از دریافت کشت سلولی، یک بانک سلولی باید در نیتروژن مایع یا در صورت عدم دسترسی به آن، در فریزر مکانیکی در دمای منفی 70 درجه سانتیگراد یا کمتر ایجاد شود. سلولهای ذخیره شده در دمای منفی 70 درجه سانتیگراد برای دورههای بسیار طولانی زنده نمیمانند و باید هر 4 تا 6 ماه یکبار احیا شوند، برای جمع آوری پاساژ داده شده و دوباره در دمای منفی 70 درجه سانتیگراد ذخیره شوند.
آماده سازی سیستم های کشت سلولی
سلولها باید با شواهد مستند برای ویژگیهای کلیدی مربوط به کیفیت کشت سلولی که در بالا توضیح داده شد، دریافت شوند. در کار با کشتهای سلولی، پرسنل آزمایشگاه نه تنها باید به جلوگیری از آلودگی میکروبی کشت توجه داشته باشند، بلکه باید از آلودگی محیط کار با مواد کشت سلولی اجتناب کنند. همه کشتها چه تلقیح شده و چه بدون تلقیح باید بالقوه خطرناک تلقی شوند. پس از استفاده، همه كشتها و مایعات آنها باید با اتوكلاو ضد عفونی شوند. آلودگی متقابل بین انواع مختلف سلولها، به ویژه خطوط سلولی پیوسته، خطری است که همیشه وجود دارد. برای جلوگیری از این امر، ردههای سلولی مختلف هرگز نباید به طور همزمان پردازش شوند. همه مناطق کار باید بین آماده سازی انواع سلولهای مختلف کاملاً تمیز شوند.
محیط کشت سلولی مورد استفاده در ویروس شناسی را میتوان به دو دسته اصلی، محیط رشد و محیط نگهداری تقسیم کرد. محيط رشد (GM)، سرم زياد (معمولاً 10 درصد)، رشد سريع سلولها را ترويج میكند. پس از تشکیل یک تک لایه و قبل از تلقیح با ویروس، محیط رشد حذف شده و با محیط نگهداری جایگزین میشود. محیطهای نگهدارنده (MM)، دارای محتوای سرمی کم (معمولاً 2)، برای حفظ کشت سلولی در یک وضعیت ثابت از تکثیر سلولی کند در حالی که متابولیسم سلولی را در طول دوره تکثیر ویروسی حفظ میکنند. سرم جنین گوساله سرم انتخابی است: برای تقویت رشد سلولی مفید است و فاقد مهار کنندههای ویروسی است. در صورت استفاده از سرم از منابع دیگر، باید از نظر وجود مهار کنندههای ویروسهای مورد مطالعه از قبل آزمایش شود. تمام سرمهای مورد استفاده برای کشت سلولی باید در دمای 56 درجه سانتیگراد به مدت 30 دقیقه غیرفعال شوند.
شرایط کشت سلول
شرایط کشت برای هر نوع سلولی بسیار متفاوت است، اما محیط مصنوعی که در آن سلولها کشت میشوند، متشکل از یک ظرف مناسب حاوی یک بستر یا محیط است که مواد مغذی ضروری (اسیدهای آمینه، کربوهیدراتها، ویتامینها، مواد معدنی) عوامل رشد، هورمونها و گازها (O2 ، CO2) و تنظیم کننده محیط فیزیک و شیمیایی (pH، فشار اسمزی، دما) را تأمین میکند. بیشتر سلولها به تکیهگاه وابسته هستند و باید در حالی که به یک بستر جامد یا نیمه جامد متصل شده اند (کشت چسبنده یا تک لایه) کشت داده شوند، در حالی که سایر سلولها را میتوان در محیط کشت (کشت سوسپانسیون) شناور کرد.
نگه داری از سلول ها در کشت سلول
سلولها در دمای مناسب و مخلوط گاز (معمولاً 37 درجه سانتیگراد، 5 درصد CO2 برای سلولهای پستانداران) در یک دستگاه انکوباتور رشد و نگهداری میشوند. شرایط کشت برای هر نوع سلول بسیار متفاوت است و تغییر شرایط برای یک نوع سلول خاص میتواند منجر به بیان فنوتیپهای مختلف شود. جدا از مخلوط دما و گاز، متداول ترین عامل در سیستمهای کشت محیط رشد است. دستور تهیه محیط رشد میتواند از نظر pH، غلظت گلوکز، عوامل رشد و وجود سایر مواد مغذی متفاوت باشد. فاکتورهای رشد مورد استفاده برای مکمل محیط اغلب از خون حیوانات مانند سرم گوساله گرفته میشود. یکی از عوارض این مواد مشتق از خون، احتمال آلودگی کشت به ویروسها یا پریونها، به ویژه در کاربردهای پزشکی بیوتکنولوژی است.
روش فعلی این است که استفاده از این مواد را تا آنجا که ممکن است به حداقل برسانید یا حذف کنید، اما این امر همیشه نمیتواند محقق شود. سلولها را میتوان در محیطهای چسبنده یا سوسپانسیون کشت کرد. برخی از سلولها به طور طبیعی در سوسپانسیون زندگی میکنند، بدون اینکه به سطحی متصل شوند، مانند سلولهایی که در جریان خون وجود دارد. سلولهای چسبنده به سطحی مانند پلاستیک کشت بافت احتیاج دارند که ممکن است با اجزای ماتریکس خارج سلولی پوشانده شود تا خواص چسبندگی را افزایش داده و سایر علائم مورد نیاز برای رشد و تمایز را تأمین کند. بیشتر سلولهای مشتق از بافتهای جامد چسبنده هستند.
دستکاری سلول های کشت شده
از آنجا که سلولها به طور کلی در کشت تقسیم میشوند، رشد میکنند تا سطح یا حجم موجود را پر کنند. این میتواند چندین مشکل ایجاد کند:
- کاهش مواد مغذی در محیط رشد
- تجمع سلولهای مرده
- تماس سلول با سلول میتواند باعث توقف چرخه سلولی شده و باعث تقسیم سلولی شود که به عنوان مهار تماس یا پیری شناخته میشود.
- تماس سلول به سلول میتواند تمایز سلولی را تحریک کند.
از جمله دستکاریهای رایج که بر روی سلولهای کشت شده انجام میشود، تغییرات محیط، سلولهای عبور دهنده و انتقال سلولها است. دستکاریها معمولاً در یک هود ایمنی زیستی یا کابینت جریان آرام برای حذف میکروارگانیسمهای آلوده انجام میشوند. آنتی بیوتیکها (مانند پنی سیلین و استرپتومایسین) و ضد قارچها (مانند آمفوتریسین B) نیز میتوانند به محیط رشد اضافه شوند. همانطور که سلولها تحت فرآیندهای متابولیکی قرار میگیرند، اسید تولید میشود و pH کاهش مییابد. اغلب، یک شاخص pH به منظور اندازه گیری کاهش مواد مغذی به محیط اضافه میشود.
آلودگی های مرتبط با کشت سلول کدام ها هستند؟
از آنجا که به طور کلی نمیتوان از آلودگیها اجتناب کرد، آموزش کارکنان آزمایشگاه کشت سلولی برای تشخیص علائم اولیه به منظور جلوگیری از گسترش آلودگیها به سایر سلولها یا محصولات کشت سلولی مهم است. آلودگیها بیشتر دارای ماهیت بیولوژیکی هستند و میتوانند شامل باکتریها، قارچها، ویروسها و انگلها باشند.
مهم است که آلایندههای بیولوژیکی را محدود کنیم زیرا آنها میتوانند فنوتیپ و ژنوتیپ خط سلولی کشت شده را از طریق رقابت بر سر مواد مغذی، سنتز محصولات جانبی قلیایی، اسیدی یا سمی و تداخل احتمالی اجزای ویروسی با ژنوم کشت سلولی تغییر دهند. سایر آلایندهها ممکن است شامل ناخالصیهای شیمیایی ناخواسته (به عنوان مثال، نرم کنندهها در ظروف کشت سلولی) یا سایر انواع سلولهای کشت شده در آزمایشگاه باشد.
آلودگی باکتریایی در کشت سلول
قلمرو باکتریها شامل میکروارگانیسمهای پروکاریوتی بسیار فراگیر و دارای اندازه چند میکرومتر در قطر، تنوع گسترده در مورفولوژی آنها و زمانهای دو برابر سریعتر از طریق تولید مثل غیرجنسی است. در حالی که ویژگی دوم اجازه میدهد تا در مایع رویی کشت سلولی بلافاصله پس از عفونت تشخیص داده شود، اما گسترش سریع را نیز تسهیل میکند. کشتهای سلولی تحت تأثیر آلودگی باکتریایی به طور کلی در ظاهر کدر به نظر میرسند. علاوه بر این، میزان متابولیک بالای باکتریها میتواند pH محیط کشت را تغییر داده و در نتیجه رنگ فنل قرمز را به زرد تغییر دهد. در حالی که باکتریها ممکن است به عنوان ذرات کوچک در بزرگ نمایی کم میکروسکوپ تشخیص داده شوند، اما شکلهای متمایز آنها به طور کلی در بزرگ نمایی بیشتر تشخیص داده میشود.
در حالی که سویههای باکتریایی مانند E. coli به دلیل اندازه (2 میکرومتر) و تحرک ناشی از تاژکها به راحتی قابل کشف هستند، سویههای دیگر مانند مایکوپلاسما از نظر اندازه کوچکتر (کوچک تر از یک میکرومتر)، بی حرکت هستند و بنابراین به راحتی قابل تشخیص نیست. در نتیجه، عفونتهای مایکوپلاسما میتوانند برای مدت زمان طولانی نادیده گرفته شوند و معمولاً فقط از طریق کاهش کیفیت سلولهای کشت شده آشکار میشوند. این میتواند به عنوان کاهش تکثیر سلولی و مرگ سلولی ظاهر شود. به منظور نظارت بر کشتهای سلولی برای عفونتهای احتمالی با مایکوپلاسما، توصیه میشود که به طور معمول کشتها را با استفاده از واکنش زنجیره ای پلیمراز (PCR)، روش ایمونوسوربنت مرتبط با آنزیم (ELISA) یا رنگ آمیزی ایمنی آزمایش کنید.
آلودگی قارچی در کشت سلول
مخمرها یوکاریوتهای تک سلولی هستند که در طول تولید مثل غیرجنسی، ساختارهای چند سلولی مانند رشته ایجاد میکنند. این سلولهای جوانه زده که به شکل تخم مرغی ظاهر میشوند، میتوانند تقریباً به اندازه 4 میکرومتر رشد کنند و بنابراین در بزرگنمایی کم میکروسکوپ به راحتی قابل تشخیص هستند. کپکها اعضای اضافی فرمانرو قارچها هستند که در کشت سلولی یافت میشوند. رشد آنها با تولید رشتههای چند سلولی، بسیار متصل و نازک (هیف) مشخص میشود. مایع رویی کشت سلولی آلوده به مخمرها یا کپکها کدر به نظر میرسد و اگرچه pH در مراحل اولیه عفونت ثابت میماند، اما در غلظت بالای آلاینده افزایش مییابد. آلودگی مخمر همچنین ممکن است با بوی متمایز همراه باشد. از آنجا که گونههای قارچی میتوانند از طریق اسپورهای هوا منتقل شوند، شناسایی و مهار سریع چنین آلودگیهایی برای جلوگیری از آلوده شدن کشت سلول بسیار مهم است.
آلودگی ویروسی در کشت سلول
ویروسها عوامل عفونی هستند که برای تکثیر خود به سلولهای میزبان تکیه میکنند. به دلیل اندازه محدود آنها تا 300 نانومتر و چرخه حیات درون سلولی آنها، در میکروسکوپ نوری عمومی قابل مشاهده نیستند و تشخیص آنها بسیار مشکل است. در حالی که برخی از ویروسها ممکن است تغییرات مورفولوژیکی را در سلولهای کشت شده ایجاد کنند (اثرات سیتوپاتیک)، گونههای دیگر ممکن است در ژنوم سلولی ادغام شده و فنوتیپ خط سلولی مورد بررسی را تغییر دهند. به عنوان مثال، ویروسها میتوانند از طریق استفاده از محصولات کشت سلولی مشتق از حیوانات مانند تریپسین یا سرم گاوی جنین وارد کشت سلولی شوند و نگرانی جدی بهداشتی برای کارکنان آزمایشگاه محسوب شوند. وجود آلودگیهای ویروسی میتواند چالش برانگیز باشد اما عموماً به PCR ، ELISA ، ایمونوسیتوشیمی یا میکروسکوپ الکترونی وابسته است.
از بین بردن آلودگی های کشت سلول
صرف نظر از نوع آلودگی شناسایی شده، کشتهای سلولی آسیب دیده باید از اتاق کشت سلولی برداشته شده و دور ریخته شوند تا از انتشار عوامل عفونی به دیگر کشتها جلوگیری شود. علاوه بر این، تعیین منبع آلودگی مهم است. توصیه میشود محیط کشت و سایر اجزای کشت سلولی که با سلولهای آلوده در تماس بوده اند را دور بریزید و سطوحی را که ظرف آلوده را لمس کرده اند (مانند دستگاه انکوباتور، کابینت ایمنی زیستی، میکروسکوپ، آسپیراتور) تمیز کنید. درمان یا ادامه کشت سلولهای آلوده توصیه نمیشود، زیرا هرگونه کشت با کشتهای آلوده باعث گسترش احتمالی آلودگیها به ویژه اسپورهای قارچی موجود در هوا میشود.
علاوه بر این، استفاده از ترکیبات ضد قارچی برای مهار عفونت ایجاد شده میتواند متابولیسم سلولهای کشت شده را مختل کند. در صورت تصمیم برای طولانی شدن کشت با استفاده از آنتی بیوتیکها مانند 1 درصد سیپروفلوکساسین، برای کاهش رشد باکتریها، عواقب مشابهی انتظار میرود، ادامه انتشار اندوتوکسینها از باکتریها بر متابولیسم سلولی تأثیر میگذارد و احتمالاً بازخوانی سلولی را باطل میکند. حذف آلایندهها از آزمایشگاه کشت سلولی یک کار بسیار خسته کننده است و اهمیت اقدامات پیشگیرانه و آسپتیک را برای جلوگیری از ریشه زایی آلودگیها در وهله اول تقویت میکند.
پروتکل های مهم در حفظ کشت سلول
در این بخش پروتکلهای اساسی مورد نیاز برای حفظ کشت سلولی را توضیح میدهیم. از آنجا که برخی از این پروتکلها ممکن است نیاز به اصلاح برای مطابقت با الزامات خاص انواع مختلف سلولها داشته باشند، بررسی توصیههای تامین کننده خط سلولی مفید است.
جداسازی سلول های چسبنده از ظروف کشت برای ساب کالچر
سلولهای کشت شده در شرایط آزمایشگاهی به مرور زمان مواد مغذی موجود در محیط را کاهش داده، متابولیتهای سمی را آزاد کرده و تعداد آنها افزایش مییابد. به منظور گسترش یا حفظ کشت سلولی سالم، تولید یک کشت جدید با زیرمجموعه سلولها از کشت اصلی، حذف محصولات جانبی سمی و پر کردن مواد مغذی با محیط تازه ضروری است. وقتی که رشد سلولهای چسبنده به حدود 80 درصد تلاقی برسد زمان مناسبی برای پاساژ دادن حاصل میشود.
سپس میتوان آنها را از نظر آنزیمی هضم یا به صورت مکانیکی جدا کرد تا از سطح آنها خارج شود. در یک کابینت ایمنی زیستی، سلولها با محلول بافر فسفاته (PBS) عاری از +Mg2 و +Ca2 شسته میشوند تا سلولهای مرده از بین بروند و در 37 درجه سانتی گراد با آنزیمهای گوارشی کافی یا عامل شلات کننده برای پوشش تک لایه (به عنوان مثال، تریپسین، دیسپاز، کلاژناز، اتیلن دی آماتراستیک اسید (EDTA)) انکوبه میشوند.
زمان مورد نیاز برای جدا کردن سلولهای متصل شده از بستر و برهمکنشهای سلول با سلول میتواند 1 تا 60 دقیقه طول بکشد و بستگی به نوع سلول و آنزیمهای گوارشی مورد استفاده دارد. میزان تجزیه را میتوان در زیر میکروسکوپ نوری کنترل کرد و پس از تکمیل، ضربه زدن به ظرف کشت باید سلولهای چسبنده باقی مانده را از بین ببرد. سلولهای جدا شده در یک لوله فالکون استریل جمع آوری میشوند و ظرف کشت نیز باید با محیط حاوی یک بازدارنده برای هضم آنزیمی و تجزیه سلولها شسته شود. سلولهای جمع آوری شده را میتوان بر اساس پروتکلهای 4/3 و 4/4 متمرکز و شمارش کرد و در غلظتهای دلخواه در ظروف کشت جدید کاشت. غلظتهای سلولی کمتر (حدود 104 سلول/میلی لیتر) برای ردههای سلولی با سرعت تکثیر سریع مناسب است، در حالی که غلظت بیشتر سلولی (حدود 105 سلول/میلی لیتر) برای سلولهای با سرعت رشد کندتر مناسبتر است.
یک نکته مفید در تکنیک کشت سلول این است که تعداد پاساژهای صورت گرفته از زمان کشت اول را ثبت کنید. برخی از ردههای سلولی برای کارهای تجربی فراتر از تعداد پاساژ معین مناسب نیستند زیرا ناهنجاریهای کروموزومی در طول زمان در تقسیم سلولی در خطوط پستانداران افزایش مییابد.
ساب کالچر کشت های سوسپانسیون سلولی
ساب کالچر کردن کشتهای سوسپانسیون سلولی را میتوان با حذف آسپتیک یک سوم محلول سوسپانسیون سلولی و جایگزینی حجم با محیط کشت کاملاً گرم شده به دست آورد.
گلوله کردن سلول ها
به منظور تغلیظ سلولها برای انتقال به ظرفهای کشت سلول جدید، انجماد یا سایر روشهای تجربی، سوسپانسیون سلولی در دور 300۰ به مدت 10 دقیقه سانتریفیوژ میشود. پس از برداشتن مایع رویی، گلوله سلولی در محیط موردنظر مجدداً از طریق پیپتینگ ملایم سلولها سه بار به بالا و پایین، مجدداً سوسپانسیون میشود. سلولهای منفرد میتوانند کاملاً شکننده باشند و بنابراین توصیه میشود که در سرعتهای بالاتر سانتریفیوژ نکنید و یا پیپت شدید آنها را انجام دهید.
کمیت سلول ها و تعیین زیست پذیری آن ها
سلولها ممکن است در حین کشت یا در حین حمل و عبور از بین بروند. هنگام تکیه بر غلظت خاصی از سلولهای زنده برای شروع کشت یا نیاز به تعداد مشخصی از سلولهای زنده برای سنجش، تمایز بین سلولهای زنده و مرده مهم است. شمارش سلولها هنگام ارزیابی نرخ رشد نیز مفید است. از آنجایی که سلولها معمولاً در میلیونها عدد کشت میشوند، ابتدا تعداد سلولها در حجم کمی شمارش میشود و سپس به حجم کامل سلول تعمیم داده میشود.
برای دستیابی به این هدف، همه سلولها جدا شده، گلوله بندی میشوند و به طور مساوی در حجم متوسط مناسب دوباره سوسپانسون میشوند. در یک رقت 1 : 1 با 0/4 درصد تریپان بلو، حجم کمی از سوسپانسیون سلولی در یک ظرف اپندورف مخلوط میشود. رنگ تریپان بلو تنها در سلولهای غیر قابل نفوذ وارد میشود که بنابراین میتوان آنها را از کمی سازی بعدی حذف کرد. این امر با لود کردن 10 میکرولیتر از مخلوط سلولی در تریپان بلو بر روی هماسیتومتر رخ میدهد.
با استفاده از میکروسکوپ معکوس، کنتراست فاز و بزرگنمایی حداقل 10X، تمام سلولهای واقع در چهار مربع بیرونی شمارش میشوند. سلولهای زنده حاوی یک هاله تیرهتر هستند، در حالی که سلولهای غیر زنده رنگ آبی یا سیاه دارند. برای تعیین تعداد کل سلولهای زنده، تعداد سلولهای موجود در هر چهار مربع بر 4 تقسیم میشود (برای تعیین میانگین تعداد سلول در 1 میلی متر مربع)، ضرب در 104 (برای بدست آوردن تعداد سلول در میلی لیتر)، ضرب در 2 (برای محاسبه ضریب رقت تریپان بلو) و در حجم متوسط اولیه کل سوسپانسیون سلولی ضرب میشود. درصد سلولهای زنده را میتوان با تقسیم تعداد سلولهای بدون لکه بر تعداد کل سلولها و ضرب این نسبت در 100 تعیین کرد. یک کشت سلولی سالم با 80 تا 95 درصد زنده مانی سلول مشخص میشود.

در تصویر بالا تعیین کمیت سلولها با استفاده از تریپان بلو نشان داده شده است. هماسیتومتر با پوشاندن هر دو اتاق شمارش با یک شیشه پوششی تهیه میشود. سپس، 10 میکرولیتر از سوسپانسیون سلولی 1 : 1 با 0/4 درصد تریپان بلو بر روی شکاف پر کننده یکی از محفظههای شمارش بارگذاری میشود. این حجم از طریق مویرگی، شبکهای را که میتوان در میکروسکوپ معکوس با بزرگنمایی حداقل 10X مشاهده کرد، پوشش میدهد. میانگین سلولهایی که مربعهای A - D را پوشش میدهند تعداد سلولها در میلی متر مربع را تعیین میکند. سلولهای زنده در این مربعها با حذف سلولهای غیر زنده که به دلیل جذب تریپان بلو از طریق غشای سلولی نفوذپذیر آنها سیاه به نظر میرسند، شمارش میشوند. فقط سلولهایی که با یکی از حاشیههای افقی و عمودی خارجی همپوشانی دارند باید گنجانده شوند.
فریز و دفریز سلول ها در کشت سلول
هنگامی که مازاد سلولی در ساب کالچر دادن در دسترس قرار گیرد، میتوان آنها را در آن محل از طریق انجماد با عوامل محافظت کننده از طریق سرما حفظ کرد. (به عنوان مثال، گلیسرول یا دی متیل سولفوکسید (DMSO)) که از تشکیل بلورهای مضر خارج یا درون سلولی جلوگیری میکند. به این منظور، سلولها از ظرف کشت جدا شده و مطابق پروتکل پلت سازی توضیح داده میشوند. گلوله سلولی در 1 میلی لیتر محیط انجماد مجدداً سوسپانسیون میشود (به عنوان مثال، محیط جایگزین سرم حذف شده با 10 درصد DMSO) و 106 × 1 سلول به هر کرایوویال منتقل میشود. پس از 20 تا 30 دقیقه، سردکننده به سلولها نفوذ میکند. یک شب در دمای منفی 80 درجه سانتی گراد با سرعت انجماد کنترل شده 1 تا 2 درجه سانتی گراد در دقیقه سرد میشود، سپس ویالها برای نگهداری طولانی مدت به نیتروژن مایع منتقل میشوند.
ذوب سلول های فریز شده در کشت سلول
اکثر سلولهای پستانداران را میتوان در نیتروژن مایع (کمتر از 130 درجه سانتی گراد) برای سالهای زیادی حفظ کرد زیرا تمام فرایندهای بیولوژیکی در این درجه حرارت متوقف میشوند. برای بازیابی سلولها، 10 میلی لیتر از محیط کامل در حمام آب گرم وارد میشود. پس از برداشتن ویال یخ زده از نیتروژن مایع، بلافاصله در حمام آبی 37 درجه سانتی گراد قرار داده و به آرامی میچرخانید تا دو سوم محتویات به طور کامل ذوب شوند. ویال با اتانول 70 درصد پاک میشود و در یک کابینت ایمنی زیستی قرار میگیرد که در آن 1 میلی لیتر از محیط از پیش گرم شده به صورت قطرهای به ویال تا حدی ذوب شده اضافه میشود تا استرس اسمزی ایجاد شده بر سلولها در زمان رقیق شدن DMSO به حداقل برسد.
محتویات ویال که اکنون کاملاً ذوب شده است نیز به صورت قطرهای به 9 میلی لیتر باقی مانده از محیط کامل منتقل شده و در دمای 300 گرم به مدت 3 دقیقه سانتریفیوژ میشود. پس از استنشاق مایع رویی، پلت سلولی را میتوان یکبار در محیط شستشو داد تا باقی مانده سردکنندهها حذف شوند. سپس سلولها در محیط کامل مجدداً معلق شده و به یک ظرف کشت سلولی منتقل میشوند. چسبندگی سلولی باید ظرف 24 ساعت اتفاق بیفتد.
کاربردهای کشت سلول
کشت سلولی یکی از ابزارهای اصلی مورد استفاده در زیست شناسی سلولی و مولکولی است که سیستمهای مدل عالی (به عنوان مثال، مطالعات متابولیک، پیری)، تأثیر داروها و ترکیبات سمی بر روی سلولها و جهش زایی و سرطان زایی را برای مطالعه فیزیولوژی و بیوشیمی طبیعی سلولها ارائه میدهد. همچنین در غربالگری و توسعه داروها و تولید مقیاس وسیع ترکیبات بیولوژیکی (به عنوان مثال، واکسنها، پروتئینهای درمانی) استفاده میشود. مزیت عمده استفاده از کشت سلولی برای هر یک از این کاربردها، قوام و تکرارپذیری نتایجی است که میتوان با استفاده از دستهای از سلولهای کلونال بدست آورد. در ادامه انواع کاربردهای کشت سلول را بیشتر بررسی کرده ایم.
مدل سازی سیستم ها در سلامت و بیماری
کشت سلولی یکی از مهمترین تکنیکها در زیست شناسی سلولی و مولکولی است زیرا بستری را برای بررسی بیولوژی، بیوشیمی، فیزیولوژی (به عنوان مثال، پیری) و متابولیسم سلولهای وحشی و سلولهای بیمار فراهم میکند. تعامل و مسیر عفونت بین سلولهای نوع وحشی و عوامل بیماریزا (به عنوان مثال، باکتریها و ویروسها) نیز میتواند در بهینه سازی محیطهای کشت خاص مورد مطالعه قرار گیرد.
علاوه بر این، ردههای سلولی جاودانه به محققان بینشی در مورد بیولوژی سرطان و از طریق درمان انتخابی سلولهای نوع وحشی با اشعه ماوراء بنفش، ویروسها و سموم و عوامل ایجاد کننده تومور شناخته شده داده است. سرانجام، سلولهای بنیادی پرتوان انسانی (hIPSCs) از افرادی با اختلالات ارثی مشتق شده و نسبت به نوع سلول آسیب دیده که بیماری در آن ظاهر میشود تمایز یافته اند. این سلولهای بدنی مشتق از hIPSC بسترهای مناسبی برای مطالعه مکانیسمهای مولکولی بیماری در ظرف هستند.
توسعه دارو و بررسی دارو
از ابزارهای کشت سلولی میتوان برای غربالگری مواد شیمیایی جدید، لوازم آرایشی و ترکیبات دارویی برای اثربخشی آنها و ارزیابی سمیت سلولی دارو در انواع سلولهای خاص استفاده کرد. انواع سم زدایی مانند سلولهای کبدی و کلیه اغلب برای این اهداف بسیار مورد توجه است. هنگام استفاده از کشتهای همراه یا سلولهای بیمار که از بیماران جداگانه بدست آمده است، همچنین امکان غربالگری داروها برای هدف قرار دادن انتخابی انواع سلولهای خاص (به عنوان مثال، در درمان سرطان)، در دوزهای غیر سمی و با حداقل عوارض جانبی برای بیمار وجود دارد. علاوه بر این، کشت سلولها در مقیاس بزرگ میتواند برای تولید پروتئینهای مهندسی ژنتیک، آنتی بادیها، هورمونها و داروهای زیستی که میتوانند جدا شده و از نظر درمانی استفاده شوند مفید باشد.
ویروس شناسی و تولید واکسن
کشت سلولی با سلولهای پستانداران میزبانی را برای تکثیر ویروسها ارائه میدهد و به محققان اجازه میدهد میزان رشد و شرایط مورد نیاز برای چرخه عفونی خود را مطالعه کنند. علاوه بر این، ویروسهای ضعیف شده مورد استفاده در واکسنهای فلج اطفال، سرخک، آبله مرغان، هاری و هپاتیت B در کشت سلولهای حیوانی افزایش مییابد.
بازسازی و پیوند بافت
hIPSC ها، سلولهای بنیادی جنینی و سلولهای بنیادی بالغ دارای ظرفیت بازسازی و تمایز به انواع سلولهای تخصصی هستند که میتوانند به عنوان بافت یا اندام جایگزین مورد استفاده قرار گیرند. این کشتهای سلولی اغلب در ماتریکس پروتئینی سه بعدی انجام میشود که به سلولها اجازه میدهد خود را در خوشههای سلولی عملکردی (ارگانوئیدها) سازماندهی کنند.
مهندسی ژنتیک و ژن درمانی
بیان ژنهای خاص و تأثیر آنها بر سلولها را میتوان با معرفی مواد ژنتیکی جدید (به عنوان مثال، DNA ، RNA) در هسته سلولهای پستانداران پرورش یافته مورد مطالعه قرار داد. به طور مشابه، اهمیت ژنها در تنظیم مسیرهای خاص را میتوان از طریق خاموش کردن آنها مشاهده کرد. اغلب برای انجام این کارها از ناقلهای ویروسی یا آنزیمهای تخصصی استفاده میشود. تغییر ژنوم سلولها همچنین میتواند به بازسازی ژنهای ناکارآمد در بیماران کمک کند.
مزیت عمده استفاده از تکنیکهای کشت سلولی برای پاسخگویی به این سؤالات اساسی علمی و ترجمهای، همگنی و تکرارپذیری دادههایی است که میتوان با استفاده از ردههای سلولی کلونال تولید کرد. مطالعه یک سیستم سلولی ایزوله شده و ساده سازی شده در یک محیط کاملاً مشخص و کنترل شده، قرار گرفتن در معرض اثرات مخدوش کننده ذاتی در یک سیستم in vivo را محدود میکند و بنابراین امکان ایجاد مجموعه دادههای ساده اما قوی را فراهم میآورد.
محدودیت های کشت سلول
محدودیتهای کشت سلولی شامل پتانسیل دو برابر شدن بیشتر سلولهای طبیعی، احتمال عفونت غیر منتظره با ویروسها یا میکروارگانیسمها یا حتی آلودگی متقابل با انواع دیگر سلولها است. محیطهایی که برای تکثیر سلولها استفاده میشوند غنی از مواد مغذی هستند و بنابراین از رشد بسیاری از موجودات حمایت میکنند. بر این اساس، اکثر روشهای کشت نیاز به شرایط استریل دارند. اغلب از آنتی بیوتیکها برای جلوگیری از رشد آلودگیهای میکروبی ناخواسته استفاده میشود. مشکل دیگر برخی از سلولهای کشت شده تمایل آنها برای تغییر مورفولوژی، عملکردها یا محدوده ژنهای بیان شده است. در ادامه برخی دیگر از محدودیتهای کشت سلول را توضیح داده ایم.
مغایرت بین محیط های سلولی In Vivo و In Vitro
یکی از ارکان تحقیقات کشت سلولی، طراحی محیط سلولی تعریف شده است که در آن میتوان متغیرهای واحد را به منظور نظارت بر پاسخهای سلولی دستکاری کرد. برای دستیابی به این هدف، محیط سلولی در شرایط آزمایشگاهی غالباً بیش از حد ساده میشود و به عنوان مثال به یک نوع تک سلولی تکثیر شده در یک لایه تکیه میکند. با این حال، دادههای تولید شده از چنین سیستم سلولی واقعاً تعاملات پیچیده سلولی بین انواع مختلف سلول و ماتریکسهای خارج سلولی محیط in vivo را فنوکپی (ایجاد حالت ظاهری شبیه به بیماری ژنتیکی دیگر) نمیکند. برای رفع این اشکال، در حال حاضر تحقیقات قابل توجهی در زمینه طراحی کشتهای سلولی همراه وجود دارد که اجازه میدهد سیگنالهای پاراکرین بین سلولهایی که در فضا داخل بدن زندگی میکنند و همچنین ماتریکسهای زیستی که رشد سلولی را در جهت گیری سه بعدی بومی خود تسهیل میکنند انجام شود.
تفاوت بین بیان ژن در سلول های اولیه و سلول های نامیرا
غالباً مناسب ترین انواع سلولها برای پرداختن به سؤالات تحقیقاتی ترجمهای سلولهای اولیه در واقع جداسازی و کشت در شرایط آزمایشگاهی به دلیل تکثیر و ظرفیت عملکردی محدود آنها در شرایط in vivo بسیار دشوار است. برای به تاخیر انداختن پیری، انتقال ویروسی سلولهای اولیه میتواند پروتئینهای سرکوب کننده تومور را جدا کرده، در نتیجه تعداد مجاری احتمالی را افزایش داده و ظهور ردههای سلولی نامیرا را ممکن میسازد. اگرچه این امر باعث تسهیل کشت آنها در داخل بدن میشود، اما این تکنیک بیان ژنهای سرطان زا را نیز معرفی میکند. علاوه بر این، ردههای سلولی نامیرا میتوانند در خلال کشت جهشهایی ایجاد کنند که میتواند با فنوتیپ سلولی تداخل بیشتری داشته باشد و یک سیستم کشت سلولی غیر فیزیولوژیکی ایجاد کند. در جدول زیر از راه حلهای رفع مشکلات در تکنیک کشت سلولی را بررسی کرده ایم.
جدول رفع ایرادها و مشکلات کشت سلول
| مشکل | دلیل احتمالی | راه حل مشکل |
| عدم وجود سلولهای زنده در هنگام ذوب شدن | ذخیره سازی نادرست سلولها | استوک ذخیره شده در نیتروژن مایع را که ذوب نشده فراهم کنید. |
| ذوب کردن نادرست سلولها | سلولهای یخ زده را سریع اما تدریجی آب کنید، سلولهای یخ زده را به صورت قطرهای با محیط گرم شده قبل رقیق کنید، سلولها را به آرامی کنترل کنید و فقط در سرعتهای کم سانتریفیوژ کنید. | |
| قرار گرفتن در معرض گلیسرول | اگر گلیسرول استفاده شده به عنوان ماده محافظ سرما در معرض نور قرار گرفته باشد، محصول جانبی آن آکرولئین ممکن است برای سلولها سمی باشد. | |
| عدم اتصال سلول به کشت پس از ساب کالچر | فعالیت باقیمانده آنزیمهای گوارشی | سلولها را قبل از جایگزینی در محیط از پیش گرم شده کامل بشویید. |
| هضم بیش از حد سلولها | زمان هضم و جلوگیری از فعالیت آنزیمی با استفاده از مهار کننده (FBS برای تریپسین) را کاهش دهید. | |
| آلودگی مایکوپلاسما | انجام آزمایشات معمول PCR مایکوپلاسما روی کشتها | |
| کند شدن رشد سلولها | محیط رشد نامناسب | محیط رشد باید با الزامات رده سلولی کشت مطابقت داشته باشد و (در صورت وجود) حاوی سرم غربال شده باشد. |
| کاهش یا تجزیه اجزای ضروری کشت سلول | از حضور عوامل محرک رشد اطمینان حاصل کنید و اجزای ناپایدار مانند گلوتامین را با GlutaMax جایگزین کنید. | |
| ذخیره نادرست محیط و مکملها | دستورالعملهای سازنده را با دقت دنبال کنید. | |
| تعداد پاساژ بسیار زیاد | نرخ تکثیر کشتهای سلولی ممکن است با ساب کالچرهای مداوم متوقف شود، سلولها باید با استوکهای کم پاساژ جایگزین شوند. | |
| «تلاقی» (Confluency) بسیار کم است | چگالی و غلظت پلتینگ اولیه را افزایش دهید. | |
| «تلاقی» (Confluency) بسیار زیاد است | سلولها باید در مرحله ورود به سیستم خود (در حدود 80 درصد تلاقی) پاساژ داده شوند. | |
| آلودگی مایکوپلاسما | انجام آزمایشات معمول PCR مایکوپلاسما روی کشتها | |
| تغییر سریع PH متوسط | تنش نادرست CO2 | غلظت CO2 انکوباتور را بر اساس غلظت HCO3 محیط تنظیم کنید: 2/0 گرم در لیتر نیاز به سطح دی اکسید کربن 5 درصد دارد، در حالی که 3/7 گرم در لیتر به 10 درصد دی اکسید کربن نیاز دارد. |
| عدم تبادل گاز | درپوش فلاسکهای کشت بافت را شل کنید. | |
| نبود بافر بی کربنات کافی در محیط | افزودن HEPES (10 تا 25 میلی مولار) | |
| آلودگی باکتریایی | بررسی کشتها زیر میکروسکوپ نوری | |
| مرگ سلولی | کمبود CO2 یا نوسان دما | سطح CO2 و دمای دستگاه انکوباتور را کنترل کرده و سلولها را برای مدت طولانی در خارج از دستگاه رها نکنید. |
| تجمع سموم | به طور مرتب محیط کشت سلولی را جایگزین کنید. | |
| فشار اسمزی نادرست | بررسی اسمولالیته محیط کشت سلولی و اثرات احتمالی ترکیبات دارویی افزوده شده یا HEPES. |






















سلام وقتتون بخیر دو تا سوال داشتم استاد عزیز،
1- آیا باید از محیط کشت سلولی که از شب قبل در حمام آبا با دمای 37 درجه سانتیگراد بوده استفاده کرد؟ چرا؟
2- چرا درمان با تریپسین برای تهیه سلول های جنین مرغ ضروری هست اما برای سلول های طحال موش ضروری نیست؟
لطفا اگر امکانش هست راهنمایی بفرمایید با تشکر از شما.