فرمول ساختاری در شیمی چیست؟ – به زبان ساده + مثال
فرمول ساختاری در شیمی نوعی نمایش ترسیمی است که آرایش اتمها در یک مولکول و پیوندهای شیمیایی میان آنها را نشان میدهد و تصویری روشن از نحوه اتصال اتمها ارائه میکند. برخلاف فرمول مولکولی که تنها نوع و تعداد اتمها را بیان میکند، فرمول ساختاری بهطور دقیق مشخص میکند اتمها چگونه به هم متصل شدهاند. در این مطلب از مجله فرادرس میآموزیم فرمول ساختاری چیست و چگونه باید آن را ترسیم کرد.
- میاموزید فرمول ساختاری چیست و چه انواعی دارد.
- با روش نمایش پیوند، الکترون و بار الکتریکی در فرمول ساختاری آشنا میشوید.
- یاد میگیرید فرمول ساختاری بر چه اساسی برای مولکولها رسم میشود.
- فرمول ساختاری اسکلتی را شناخته و روش رسم آن را میآموزید.
- انواع فرمول مولکولی، تجربی و شیمیایی و تفاوت آنها را مرور میکنید.
- با فرمول ساختاری هیدروکربنها و آلکانها آشنا میشوید.


در ابتدای این مطلب میآموزیم فرمول ساختاری چیست. سپس با نمایش پیوند، الکترون و بار الکتریکی در فرمول ساختاری آشنا میشویم. پس از آن فرمول اسکلتی، فرمول مولکولی، فرمول تجربی، فرمول شیمیایی و تفاوت این فرمولها را یاد میگیریم. در نهایت با سایر روشهای نمایش مولکول و اهمیت فرمول ساختاری آشنا میشویم. با مطالعه این مطلب تا انتها میتوانید به شکلی کامل بیاموزید فرمول ساختاری چیست.
فرمول ساختاری چیست؟
فرمول ساختاری یک ترکیب شیمیایی در واقع تصویری گرافیکی از ساختار مولکولی آن است که بر پایه روشهای شیمی ساختاری به دست میآید و نحوه اتصال اتمها به یکدیگر را نشان میدهد. در فرمول ساختاری، معمولا اتمها، پیوندهای بین آنها و الکترونهای غیر پیوندی نمایش داده میشوند. در این نوع نمایش، پیوندها با خط بین اتمها که با نماد عنصر مشخص میشوند نمایش داده میشوند. همچنین الکترونهای غیرپیوندی به شکل نقطههایی اطراف نماد شیمیایی عنصر قرار میگیرند.
در این نوع نمایش، پیوندهای شیمیایی موجود در مولکول نیز بسته به شیوه ترسیم، به صورت مستقیم یا غیرمستقیم مشخص میشوند. فرمولهای ساختاری در فرمهای مختلفی وجود دارند تا بتوانند بین جزئیات و شفافیت ساختار مولکول تعادلی برقرار کنند. به طور عمده، فرمول ساختاری به دو دسته فرمول گسترده و فرمول فشرده تقسیم میشوند. در تصویر زیر، روش نمایش فرمول ساختاری نشان داده شده است.

فرمول ساختاری گسترده
در فرمول ساختاری گسترده، اتمها، پیوندها و الکترونها با خطوط، حروف و نقطهها به شکل کامل نمایش داده میشوند. این روش نمایش بیشتر برای مولکولهای کوچک یا پیچیده به کار میرود. برای مثال، فرمول ساختاری گسترده مولکول بوتان به شکل زیر است. این فرمول میتواند با پیوندهای بین هیدروژن و کربن، بدون نشان دادن این پیوندها و همچنین به صورت خطی نمایش داده شود.
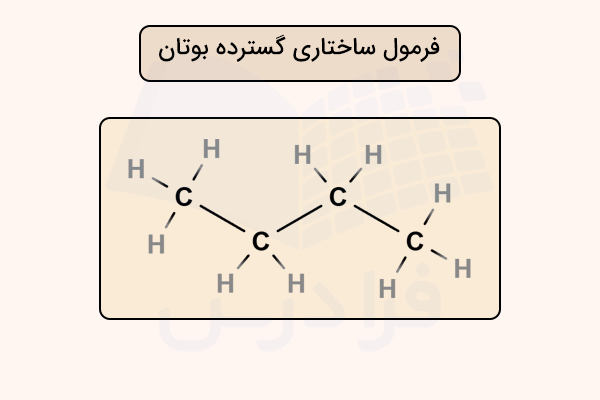
همانطور که شماهده میکنید در این نوع نمایش مولکول، هر پیوند با یک خط نمایش داده شده است. هر اتم کربن با ۴ پیوند به اتمهای دیگر متصل شده است و این شیوه نمایش میتواند با نمایش ندادن پیوند بین اتم کربن و هیدروژن خلاصه شود. همچنین، در ترکیبات هیدروکربنی که تنها از کربن و هیدروژن تشکیل شدهاند میتوان تنها خطوطی را به جای پیوند بین کربنهای متصل به هیدروژن نمایش داد. در ادامه این روش نمایش را بیشتر بررسی خواهیم کرد.
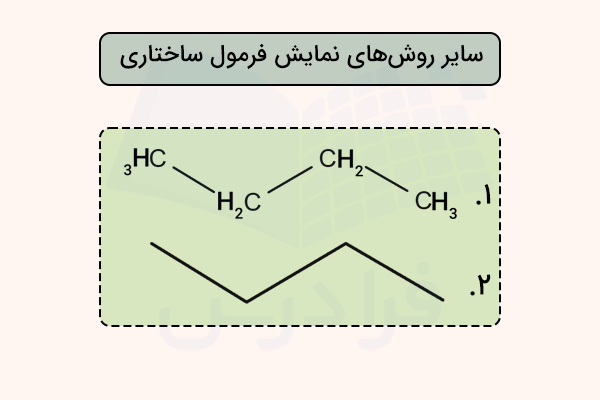
فرمول ساختاری فشرده
فرمولهای ساختاری فشرده مانند فرمول ساختاری معمولی، ترتیب اتصال اتمها را نشان میدهند، اما برای صرفهجویی در فضا و نوشتن سریعتر، بهصورت یک خطی نوشته میشوند. این نوع فرمولها زمانی که بخواهیم نشان دهیم یک گروه از اتمها به یک اتم مشخص متصل هستند نیز بسیار کاربردیاند. در واقع در فرمول ساختاری فشرده، پیوندها و الکترونهای غیرپیوندی نمایشداده نمیشوند اما تعداد و ترتیب اتصال اتمها مشخص میشود.
اگر تا این قسمت از مطلب را مطالعه کردهاید، با فرمول ساختای مولکولها و انواع آن آشنا شدهاید. در ادامه این مطلب نیز به بررسی بیشتر این فرمول میپردازیم.
پیشنهاد میکنیم برای مطالعه بیشتر این نوع مطالب و دسترسی همیشگی و رایگان به آنها در موبایل خود، اپلیکیشن رایگان مجله فرادرس را نصب کنید تا همیشه به مطالب مجله فرادرس دسترسی داشته باشید.
برای نصب اپلیکیشن رایگان مجله فرادرس، کلیک کنید.
برای درک بهتر تفاوت فرمول ساختاری گسترده و فشرده، به این فرمولها برای مولکول بوتان توجه کنید.
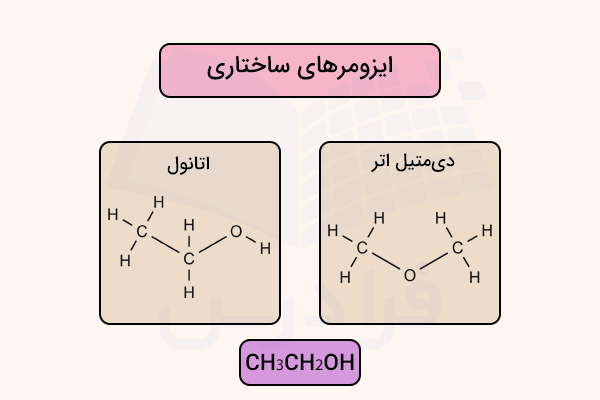
در چنین حالتی، برای مشخص کردن این که اتمها به صورت یک واحد در نظر گرفته میشوند، آنها را داخل پرانتز قرار میدهند. برای نمونه، فرمول ساختاری فشرده اتانول به صورت CH3CH2OH نوشته میشود، در حالی که فرمول مولکولی آن C2H6O است.
مثال فرمول ساختاری فشرده و گسترده
برای درک بهتر روش نمایش فرمول ساختاری گسترده و فشرده، به مثالهای بعد دقت کنید. فرمول CH3CH2OH برای نمایش اتانول به کار میرود. در این شیوه، از پرانتز برای نشان دادن گروههای تکراری یکسان استفاده میشود. حال به فرمول ساختاری گسترده برای اتانول دقت کنید.
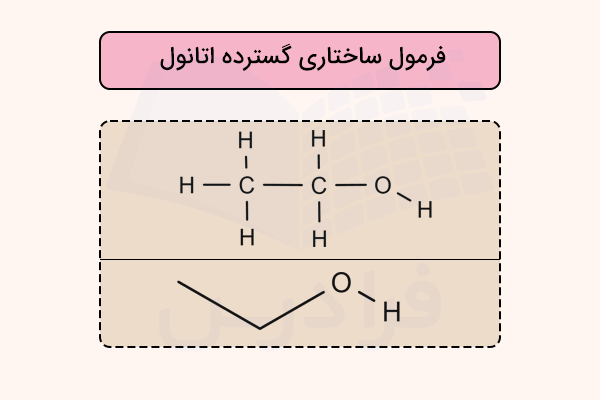
اگر پرانتز درون فرمول ظاهر شود، اتصال گروه داخل پرانتز به نزدیکترین اتم غیرهیدروژن در سمت چپ است و اگر در ابتدای فرمول قرار گیرد، اتصال به اتم سمت راست در نظر گرفته میشود. به عنوان مثال، (CH3)2CHOH یا CH(CH3)2OH هر دو ساختار ۲-پروپانول را نشان میدهند.
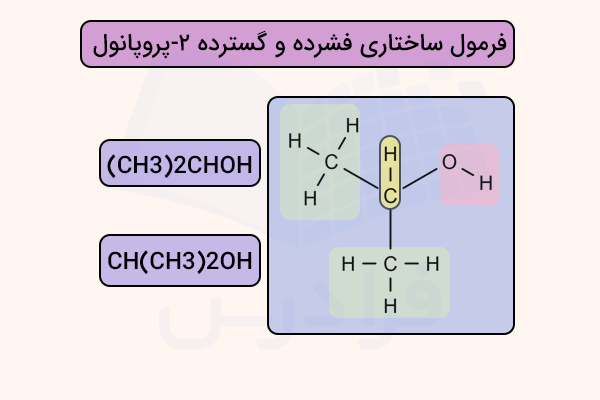
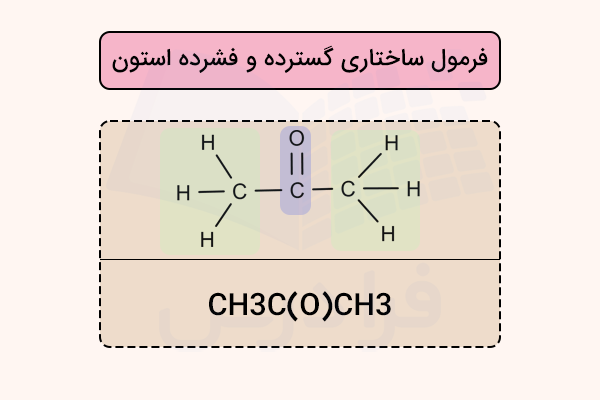
در این نوع فرمولنویسی، تمام اتمها از جمله اتمهای هیدروژن به طور کامل نوشته میشوند. همچنین نمایش گروههای کربونیل اهمیت دارد. در فرمول ساختاری فشرده، پیوند C=O به طور ضمنی با قرار گرفتن O در پرانتز مشخص میشود. برای مثال، CH3C(O)CH3 ساختار استون را نشان میدهد. این دو ساختار در تصویر زیر مشخص شدهاند.
نکته
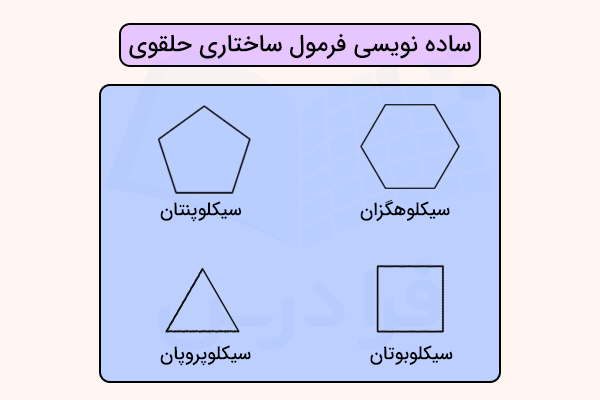
نوع دیگری از سادهنویسی، بهویژه برای ترکیبهای حلقوی، حذف نمادهای کربن و هیدروژن و نمایش تنها خطوط پیوند است. برای نمونه، سیکلوپنتان اغلب به صورت یک پنجضلعی منتظم رسم میشود که هر گوشه آن نمایانگر یک اتم کربن با تعداد کافی اتمهای هیدروژن برای تکمیل چهارظرفیتی کربن است. به همین شکل، سیکلوپروپان، سیکلوبوتان و سیکلوهگزان بهترتیب به صورت مثلث، مربع و ششضلعی نمایش داده میشوند.
یادگیری شیمی یازدهم با فرادرس
برای درک بهتر این موضوع که فرمول ساختاری چیست، ابتدا باید با مفاهیمی چون الکترون ظرفیت، ایزوتوپها، ترکیبات آلی و ایزومرهای ساختاری را بشناسیم. پیشنهاد میکنیم برای درک بهتر این مفاهیم، به مجموعه فیلم آموزش دروس یازدهم فرادرس، بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مسائل میپردازد.
همچنین، با مشاهده فیلمهای آموزش فرادرس که در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه فرمول ساختاری دسترسی داشته باشید.
- فیلم آموزش شیمی عمومی ۱ و ۲ مرور و حل مساله فرادرس
- فیلم آموزش شیمی ۱ پایه دهم گواهینامه فرادرس
- فیلم آموزش شیمی ۱ پایه دهم حل سوالات تشریحی امتحانات نهایی فرادرس
نمایش پیوند در فرمول ساختاری
پیوند شیمیایی در واقع جایی است که دو اتم به انتقال یا اشتراکگذاری الکترون به هم متصل میشوند. فرمول ساختاری اغلب برای نمایش ترکیبات آلی و کووالانسی استفاده میشود که دارای پیوندهای کووالانسی هستند. در فرمولهای ساختاری، پیوندهای کووالانسی با خطهایی که نمادهای اتمی را به هم وصل میکنند نمایش داده میشوند و نوع پیوند با تعداد و شکل این خطها مشخص میشود. پیوند یگانه که حاصل اشتراک یک جفت الکترون میان دو اتم است، با یک خط مستقیم و پیوسته نشان داده میشود.
برای مثال پیوند یگانه با یک خط تیره، پیوند دوگانه با دو خط موازی و پیوند سهگانه با سه خط موازی بین اتمها نمایش داده میشود. این نمایشها در مولکولهای کربن دی اکسید و نیتروژن در زیر نمایش داده شده است.
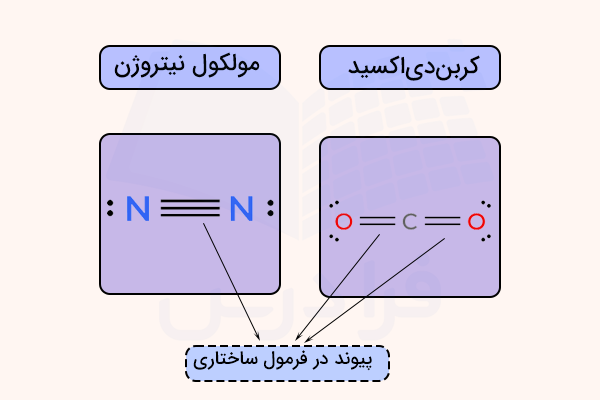
نمایش الکترون در فرمول ساختاری
الکترونها معمولا به صورت دایرههای توپر رنگی نمایش داده میشوند. هر دایره نشاندهنده یک الکترون است و دو دایره نشاندهنده یک جفت الکترون است. معمولا وجود یک جفت الکترون بیانگر بار منفی نیز هست. با استفاده از این دایرههای رنگی، تعداد الکترونهای موجود در لایه ظرفیت هر اتم مشخص میشود و این موضوع اطلاعات توصیفی بیشتری درباره توانایی واکنشپذیری آن اتم در مولکول ارائه میدهد.
برای تشخیص غیر پیوندی بودن جفت الکترون یا بار الکتریکی مولکول، باید مقدار الکترونهای ظرفیت اتمها را حساب کنیم. هر پیوند شامل ۲ الکترون است که بین اتمها به اشتراک گذاشته شده است. اگر تعداد پیوندها به علاوه تعداد الکترونهای غیر پیوندی اتم از تعداد الکترونهای ظرفیت آن بیشتر باشد، بدین معنی است که مولکول بار منفی دارد. همچنین اگر تعداد پیوندها به علاوه تعداد الکترونهای غیرپیوندی کمتر از تعداد الکترون ظرفیت اتم باشد، مولکول بار مثبت دارد.
در صورت برابر بودن این دو، تعداد المترونهای غیر پیوندی به تعداد صحیح نمایش داده شده است. همچنین در بسیاری از منابع الکترونهای غیرپیوندی رسم نمیشود. برای درک بهتر این موضوع به سه مولکول زیر دقت کنید.
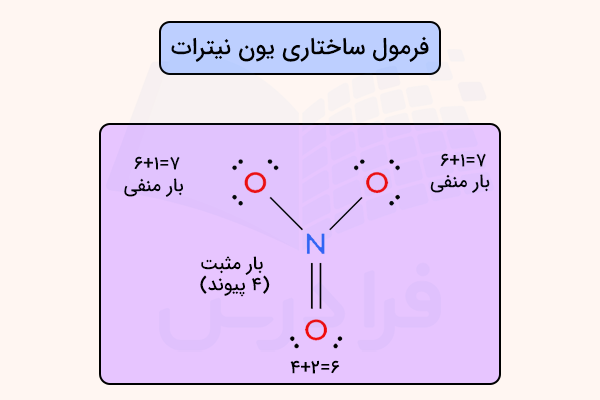
نکته
نکتهای که باید به آن توجه داشت این است که در بیشتر فرمولهای ساختاری، جفتالکترونهای ناپیوندی نشان داده نمیشوند. این موضوع میتواند گمراهکننده باشد، زیرا این الکترونها به همان اندازه الکترونهای پیوندی در شیمی آلی نقش دارند و حذف آنها ممکن است باعث نادیده گرفتن اهمیتشان شود. هرگاه لازم باشد، این الکترونها معمولا با جفتی از نقطهها نمایش داده میشوند، اگرچه در برخی منابع از خط نیز استفاده میشود.
نمایش بار الکتریکی در فرمول ساختاری
در بسیاری از موارد، اتمها ممکن است دارای بار الکتریکی مثبت یا منفی باشند، زیرا هشتتایی آنها کامل نشده است. اگر اتمی یک جفت الکترون کم داشته باشد یا دارای یک پروتون اضافی باشد، بار مثبت خواهد داشت. اگر اتم دارای الکترونهایی باشد که به اتم دیگری پیوند نخوردهاند، بار منفی خواهد داشت. در فرمولهای ساختاری، بار مثبت با نماد «+» در بالا و سمت راست یک کروشه اطراف ساختار و بار منفی به همین شکل با نماد «-» نشان داده میشود.
برای مثال، ساختار یون سولفات را در تصویر زیر مشاهده میکنید.
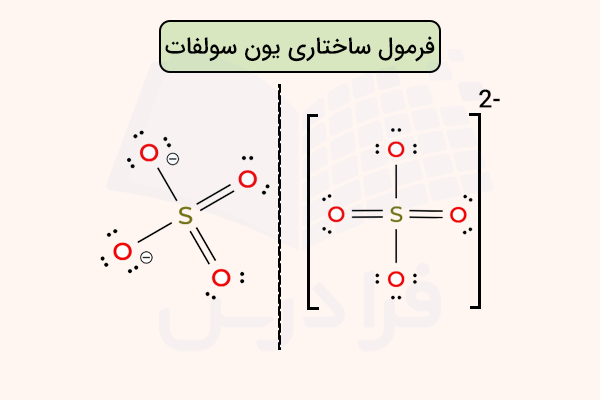
همانطور که در تصویر بالا مشاهده میکنید، دو اکسیژن، یک بار منفی دارند زیرا ظرفیت آن ها ۶ الکترون است و ۳ جفت الکترون و یک پیوند (۷ الکترون) به آنها متصل است.
اساس نمایش فرمول ساختاری
نمایش پیوندها با خطوط بین اتمها بر پایه قواعد بنیادی ظرفیت پیوندی بنا شدهاند و تضمین میکنند که اتمها به آرایش الکترونی پایدار برسند. برای عناصر دوره دوم جدول تناوبی، این پایداری اغلب با قاعده هشتتایی توصیف میشود که بر دستیابی به هشت الکترون ظرفیت تاکید دارد. در ترسیمها، این موضوع به این معناست که برای نمونه اتم کربن چهار پیوند تشکیل میدهد تا لایه ظرفیت خود را کامل کند.
تنها اتم هیدروژن است که به دلیل آرایش الکترونی خود میتواند با یک پیوند (به اشتراک گذاری الکترون خود با یک الکترون دیگر) به آرایش پایدار دوتایی برسد. به همین شکل سایر اتمها با به اشتراک گذاری الکترون به آرایش هشتایی میرسند. برای مثال، اکسیژن معمولا دو پیوند تشکیل میدهد و دو جفتالکترون ناپیوندی دارد که در فرمولهای ساختاری ساده اغلب به صورت ضمنی در نظر گرفته میشوند.
نیتروژن نیز معمولا سه پیوند و یک جفتالکترون ناپیوندی دارد. البته در برخی موارد، بهویژه برای عناصری فراتر از دوره دوم، نقض قاعده هشتتایی مشاهده میشود. با این حال، در فرمولهای ساختاری رایج در شیمی آلی، پایبندی به این قاعده برای عناصر گروه اصلی اصل اساسی نمایش فرمول ساختاری محسوب میشود، مگر در موارد استثنایی مانند ترکیبهای بور، برای نمونه بور تری فلوئورید که در آن تنها شش الکترون پیرامون اتم بور وجود دارد.
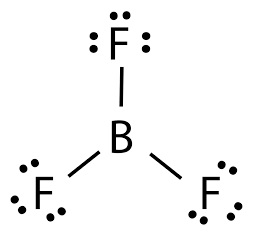
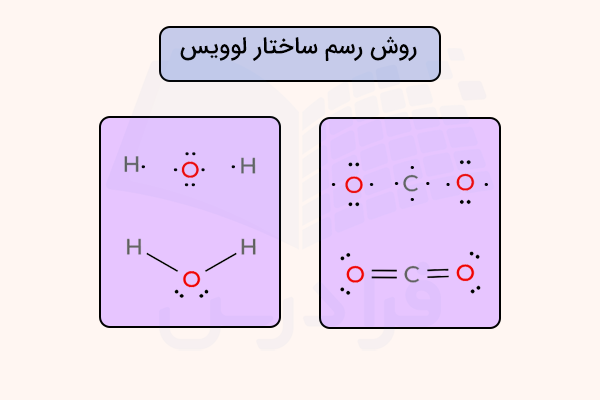
ساختار لوویس
ساختار لوویس یانمایش الکترون نقطه مولکولها، فرمولهای گرافیکی دوبعدی هستند که نحوه اتصال اتمها و همچنین جفتالکترونهای تنها یا الکترونهای جفتنشده را نشان میدهند، اما ساختار سهبعدی مولکول را نمایش نمیدهند. این نوع نمایش بیشتر برای مولکولهای کوچک به کار میرود. هر خط نمایانگر ۲ الکترون مربوط به یک پیوند یگانه است. وجود ۲ یا ۳ خط موازی بین دو اتم به ترتیب نشاندهنده پیوند دوگانه یا سهگانه است. بهجای خطوط، گاهی از جفت نقطهها برای نمایش جفتالکترونهای پیوندی استفاده میشود.
ساختار لوییس برای محاسبه بارهای رسمی و بررسی نحوه پیوند اتمها به یکدیگر بسیار مناسب است، زیرا هم الکترونها و هم پیوندها را به طور همزمان نشان میدهد. این ساختارها تصویری کلی از هندسه مولکولی و هندسه الکترونی ارائه میدهند که بسته به وجود پیوندها و جفتالکترونهای تنها تغییر میکند و از این طریق میتوان زاویههای پیوندی و نوع هیبریداسیون را نیز تعیین کرد.
مراحل رسم ساختار لوویس
برای رسم صحیح ساختار لوویس، مراحل زیر انجام میشود.
- محاسبه مجموع الکترونهای ظرفیتی: تعداد الکترونهای ظرفیت همه اتمها را جمع میکنیم.
- رسم چارچوب اولیه: اتم مرکزی (اتم کمالکترونگاتیوتر، بهجز هیدروژن) را در وسط قرار داده و با پیوند یگانه به اتمهای اطراف وصل میکنیم.
- تکمیل هشتتایی اتمهای پیرامونی: الکترونهای باقیمانده را به صورت جفتالکترون ناپیوندی ابتدا به اتمهای بیرونی اختصاص میدهیم تا هشتتایی آنها کامل شود (یا قاعده دوتایی برای هیدروژن).
- تکمیل هشتتایی اتم مرکزی: اگر اتم مرکزی هشتتایی نشود، با تبدیل جفتالکترونهای ناپیوندی به پیوند دوگانه یا سهگانه، کمبود آن را جبران میکنیم.
برای درک بهتر این ساختار، به روش رسم ساختار لوویس و فرمول ساختاری مولکول آب و کربن دی اکسید در تصویر زیر دقت کنید.
فرمول ساختاری اسکلتی
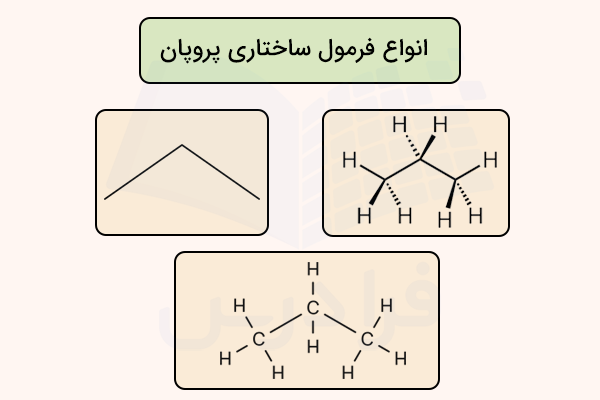
در فرمول ساختاری اسکلتی، میتوان جهت پیوندهای ملوکول را در فضا تعیین کرد. به کمک رسم فرمول اسکلتی ساختاری میتوان کایرالیته ملوکولهای را تعیین کرد. در این نوع نمایش، پیوندهایی که با خطوط ساده نمایش داده میشوند، پیوندهایی هستند که درون صفحه مولکول قرار دارند.
در این نوع نمایش میتوان با استفاده از دو مدل گوه و خطچین، مشخص کرد که پیوند در جلوی صفحه مولکول قرار دارد یا در پشت آن است. ویژگیهای فرمول اسکلتی در ادامه معرفی شده است.
- هر راس یا انتهای خط در فرمول اسکلتی نشاندهنده یک اتم کربن است.
- هر خط در فرمول اسکلتی یک پیوند کووالانسی است.
- هیدروژنهای متصل به اتمهای کربن در این فرمول نمایش داده نمیشوند.
- اتمهای غیرکربن و هیدروژن با نماد شیمیایی نمایش داده میشود.
- زنجیرهها به شکل زیگزاگ رسم میشوند تا زاویه تقریبی ۱۰۹٫۵ درجه (هندسه چهاروجهی) را نشان دهند.
- ساختارهای حلقوی به صورت چندضلعی رسم میشوند.
- در مولکولهای پیچیده مانند استروئیدها، این روش باعث کاهش شلوغی و تمرکز بر گروههای عاملی میشود.
- در صورت نیاز، برای نشان دادن استریوشیمی از پیوند گوهای و خطچین استفاده میشود.
در تصویر زیر، سه نوع نمایش فرمول ساختاری برای مولکول پروپان رسم شده است. در مدل سمت چپ، فرم خطی که در آن اتمهای کربن و هیدروژن بدون نماد شیمیایی مشخص شدهاند. شکل سمت راست که مدل گوه - خطچین است و هیدروژنهای متصل با گوه جلوی صفحه و هیدروژنهای متصل با خط چین در پشت صفحه قرار دارند. در نهایت شکل پایین که فرم استاندارد نمایش فرمول ساختاری است.
فرمول مولکولی چیست؟
فرمول مولکولی بر اساس ترکیب واقعی یک ماده نوشته میشود و نشان میدهد هر ترکیب از چه عناصری و به چه تعداد تشکیل شده است. گاهی فرمول مولکولی با فرمول تجربی یکسان است، اما در بسیاری از موارد اطلاعات کاملتری ارائه میدهد. با این حال، فرمول مولکولی نشان نمیدهد که اتمها چگونه به یکدیگر متصل شدهاند.
به همین دلیل، هنگام بررسی ایزومرها میتواند گمراهکننده باشد، زیرا ایزومرها تعداد و نوع اتمهای یکسانی دارند، اما ساختار متفاوتی نشان میدهند. برای مثال، فرمول مولکولی اتانول است. همچنین، فرمول مولکولی ماده دیمتیل اتر نیز است. در صورتی که این دو ماده ایزومر ساختاری هم بوده و دو ماده کاملا متفاوت هستند. ساختار این دو ماده در تصویر زیر مشخص شده است.
فرمول تجربی چیست؟
فرمول تجربی سادهترین نسبت عددی میان اتمهای تشکیلدهنده یک ترکیب را با استفاده از اعداد صحیح نشان میدهد. این نوع فرمول اطلاعات بسیار محدودی درباره یک ماده ارائه میکند، زیرا از روی آن نمیتوان ساختار، شکل یا خواص ترکیب را تعیین کرد. از آنجا که ترکیبهای شیمیایی زیادی ممکن است فرمول تجربی یکسانی داشته باشند، کاربرد این فرمول محدود است.
برای نمونه، فرمول تجربی ترکیب با تقسیم همه زیرنویسها بر ۲ به صورت به دست میآید. پیشنهاد میکنیم برای درک بهتر تفاوت فرمول تجربی و مولکولی و درک ارتباط بین آنها، مطلب روشهای تعیین فرمول مولکولی و فرمول تجربی مجله فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
فرمول شیمیایی چیست؟
فرمول شیمیایی روشی برای بیان ترکیب اتمی مواد است و نشان میدهد که یک ترکیب از چه عناصری و به چه تعداد تشکیل شده است. در این شیوه، از نماد هر عنصر استفاده میشود و تعداد اتمهای آن عنصر با عدد زیرنویس مشخص میگردد. برای مثال، فرمول شیمیایی آب که از یک اتم اکسیژن و دو اتم هیدروژن تشکیل شده است، به شکل () است.
برای نوشتن فرمول شیمیایی، ابتدا باید نماد شیمیایی عناصر جدول تناوبی را بشناسیم. همچنین، برای نمایش تعداد عناصر موجود در یک فرمول شیمیایی، به شکل زیروند در زیر آنها نوشته میشوند. در جدول زیر، فرمول شیمیایی برخی از ترکیبات شیمیایی نمایش داده شده است.
| نام ماده | فرمول شیمیایی |
| ناشسته | |
| گلوکز | |
| استیک اسید (سرکه) | |
| اتیل الکل |
تفاوت فرمول ساختاری و فرمول شیمیایی
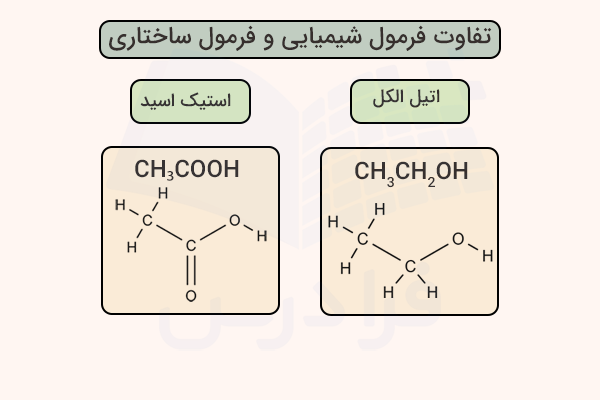
فرمول ساختاری ترتیب قرارگیری اتمها در یک مولکول و نحوه اتصال آنها را نشان میدهد. در این نوع نمایش، نوع پیوند میان اتمها مانند پیوند یگانه، دوگانه یا سهگانه نیز مشخص میشود. پیوندهای کووالانسی با خط نمایش داده میشوند و تعداد خطها بیانگر نوع پیوند است. فرمولهای ساختاری اهمیت زیادی دارند، زیرا اطلاعاتی درباره ساختار و خواص ترکیب ارائه میکنند که فرمولهای تجربی و مولکولی بهتنهایی قادر به نمایش آنها نیستند.
در قسمت قبل، فرمول شیمیایی ۴ ترکیب را بررسی کردیم. در این ترکیبات، روش اتصال اتمها به یکدیگر مشخص نیست. فرمول ساختاری به ما این امکان را میدهد تا بدانیم هر اتم به کدام اتم دیگر، با چه نوع پیوندی و در چه جهتی تشکیل شده است. برای درک بهتر این موضوع، به فرمول ساختاری ترکیبات اتیل الکل و استیک اسید قسمت قبل دقت کنید.
فرمول ساختاری هیدروکربن ها
هیدروکربنها ترکیبهایی هستند که فقط از اتمهای کربن و هیدروژن ساخته شدهاند. اگر این اتمها تنها با پیوندهای یگانه به هم متصل باشند، ترکیب حاصل آلکان نامیده میشود. سادهترین آلکان، متان است. هنگامی که هیدروکربنها یک یا چند پیوند دوگانه داشته باشند، آلکن نامیده میشوند. سادهترین آلکن، اتن با فرمول است که در آن میان دو اتم کربن یک پیوند دوگانه وجود دارد.
فرمول ساختاری هیدروکربنها معمولا با استفاده از خطهای ساده و بدون نمایش اتمهای کربن و هیدروژن نمایش داده میشود. در تصویر زیر، فرمول ساختاری چند هیدروکربن نمایش داده شده است.
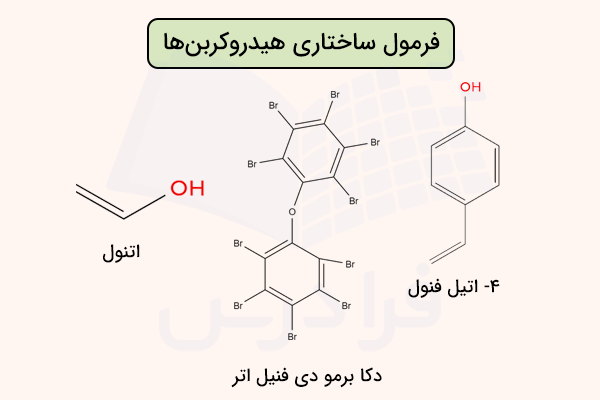
تفاوت فرمول شیمیایی مولکولی ساختاری و تجربی
در قسمت های قبل آموختیم فرمول ساختاری چیست. فرمول ساختاری نحوه اتصال اتمها و نوع پیوندها را نشان میدهد. فرمول مولکولی نوع و تعداد واقعی اتمها در یک مولکول را نشان میدهد، اما نحوه اتصال آنها را مشخص نمیکند. برای مثال فرمول میتواند مربوط به دو ترکیب متفاوت باشد (n-بوتان و ایزوبوتان)، اما فرمول مولکولی تفاوت آنها را نشان نمیدهد.
فرمول تجربی سادهترین نسبت عددی بین اتمها در یک ترکیب را نشان میدهد و نه تعداد واقعی آنها مشخص نمیشود. برای مثال فرمول مولکولی گلوکز () و فرمول تجربی آن () است. در جدول زیر، تفاوت این سه فرمول نمایش داده شده است.
| نوع فرمول | ویژگی |
| فرمول ساختاری | مشخص کننده اتصال و نوع پیوند اتمها |
| فرمول مولکولی | مشخص کننده تعداد واقعی اتمها |
| فرمول تجربی | مشخص کننده سادهترین نسبت اتمها |
اهمیت فرمول ساختاری
فرمول ساختاری به شناخت نحوه اتصال اتمها در یک ترکیب مولکولی کمک میکند. این ساختار مشخص میتواند به دانشمندان در تشخیص ایزومری مولکولها، درک مکانیسم واکنش، درک خواص فیزیکی مواد، درک هندسه مولکولی و ... کمک کند. در ادامه اهمیت شناخت فرمول ساختاری را در این پدیدهها توضیح میدهیم.

تشخیص ایزومری
فرمولهای ساختاری نقش مهمی در درک ایزومری دارند، زیرا تفاوت در نحوه اتصال اتمها را بهروشنی نشان میدهند، تفاوتی که میتواند با وجود یکسان بودن فرمول مولکولی، به رفتارهای کاملا متفاوت منجر شود. برای نمونه، فرمول ساختاری بهخوبی تفاوت میان نرمال بوتان و ایزوبوتان را که هر دو دارای فرمول هستند، از طریق نمایش زنجیر خطی در یکی و ساختار شاخهدار در دیگری مشخص میکند.
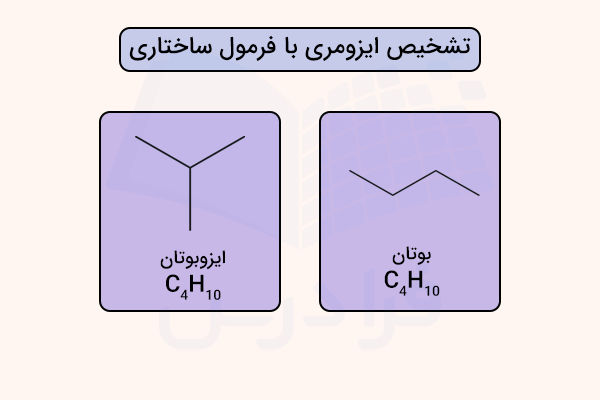
مکانیسم واکنش
فرمولهای ساختاری ابزار مهمی برای نمایش مکانیسمهای واکنش به شمار میروند، زیرا امکان دنبال کردن گسستن و تشکیل پیوندها را در مراحل مختلف واکنش فراهم میکنند. در واکنشهای آلی مانند جانشینی هستهدوست، نمایش دقیق پیوندها به درک ساختار گونههای حدواسط کمک میکند.
درک خواص فیزیکی
فرمول ساختاری با آشکار ساختن الگوی پیوندها و شکل مولکول، به پیشبینی خواص فیزیکی مولکول کمک میکند. برای مثال تفاوت در نقطه جوش آلکانهای زنجیر مستقیم و شاخهدار که ناشی از تفاوت در نیروهای بینمولکولی است، با کمک فرمولهای ساختاری بهخوبی قابل توضیح است.
هندسه مولکولی و فرمول ساختاری
شناخت این که اتمها در یک مولکول چگونه در کنار یکدیگر قرار گرفتهاند و از چه راهی به هم متصل شدهاند، نقش اساسی در تعیین هویت آن مولکول دارد. ایزومرها ترکیبهایی هستند که ممکن است تعداد اتمهای یکسان و در نتیجه فرمول مولکولی مشابهی داشته باشند، اما به دلیل تفاوت در فرمول ساختاری، خواص فیزیکی و شیمیایی کاملا متفاوتی از خود نشان دهند. این تفاوتها اهمیت توجه به ساختار مولکولی را در کنار فرمول شیمیایی بهخوبی نشان میدهد.
همچنین استفاده از فرمول ساختاری گسترده یا خطی با استفاده از مدل گوه و خط چین به کمک نظریه وسپر می تواند به تشخیص هندسه مولکول کمک کند. برای تشخیص چگونگی تشخیص شکل مولکول، مطلب شکل مولکول مجله فرادرس را مطالعه کنید.
سایر روشهای نمایش ترکیبات شیمیایی
برای نمایش ترکیبات شیمیایی، روش های مخلفی وجود دارد که انتخاب آن ها بسته به هدف نمایش مولکول و همچنین بزرگی یا سکل هندسی مولکول تعیین میشود. در قسمت های قبل آموختیم فرمول ساختاری گسترده و فشرده مولکول چگونه رسم میشود. همچنین در ادامه، مدل های فضاپرکن، خط زاویه و نمایش سهبعدی مولکول را بررسی میکنیم.
برای درک بهتر تفاوتهای این شیوههای نمایش، این نوع نمایشها برای مولکول اتان در تصویر زیر نمایش داده شده است.
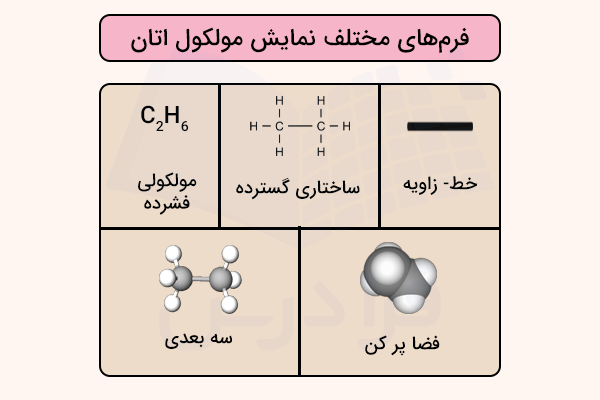
مدل فضاپرکن
در مدل فضاپرکن، شکل سه بعدی مولکول و ساختار آن به شکل کرههایی نمایش داده میشود که شعاع آنها با نسبتهایی از اندازه واقعی شعاع اتمی رسم میشود. در این مدل گاهی اتمهای مختلف با رنگهای مختلف نمایش داده میشوند.
فرمول خط زاویه
از آنجا که ترکیبهای آلی گاهی ساختارهای پیچیدهای دارند، برای نمایش سادهتر اتمهای کربن و هیدروژن از فرمولهای خط زاویه استفاده میشود. در این روش، به جای نوشتن نماد اتمها، از خطها استفاده میشود. هر نقطهای که دو خط به هم میرسند یا انتهای یک خط، نشاندهنده حضور یک اتم کربن است.
اتمهای هیدروژن نیز به طور ضمنی در نظر گرفته میشوند تا چهار پیوند کربن کامل شود. سایر اتمهایی که به کربن متصل هستند، مانند اکسیژن یا نیتروژن، بهصورت صریح نوشته میشوند.
فرمول ساختاری سه بعدی
در بعضی موارد لازم است آرایش دقیق سهبعدی بخشهایی از یک مولکول نشان داده شود. برای این کار، پیوندها با استفاده از نمادهای قراردادی خاصی رسم میشوند تا جهتگیری آنها در فضا مشخص شود.
محدودیت و گسترش فرمول ساختاری
فرمولهای ساختاری ابزار اصلی شیمیدانان برای نشان دادن نحوه اتصال اتمها در یک مولکول هستند. با این حال، این روش نمایش با وجود سادگی و کاربرد گسترده، کامل نیست و محدودیتهایی دارد. در کنار این محدودیتها، پیشرفت فناوری باعث شده روشهای جدیدی برای تکمیل و توسعه این نمایشها به وجود بیاید.
در ادامه این موارد را بررسی میکنیم.
محدودیت فرمول ساختاری
با وجود کاربرد فراوان، فرمولهای ساختاری نمیتوانند همه جنبههای واقعی یک مولکول را نشان دهند. مهمترین محدودیتهای آنها عبارتاند از:
- ناتوانی در نمایش واقعی سهبعدی
- حذف برخی اطلاعات مهم
- مشخص نبودن استریوشیمی
- دشواری در نمایش مولکولهای بزرگ
ناتوانی در نمایش سه بعدی
فرمولهای ساختاری معمولا دوبعدی هستند، در حالی که مولکولها در فضای سهبعدی قرار دارند. بنابراین زاویههای دقیق پیوند و شکل فضایی واقعی به طور کامل مشخص نمیشود. برای مثال، ساختار چهاروجهی متان روی کاغذ به صورت تخت دیده میشود.
حذف برخی اطلاعات مهم
در فرمولهای اسکلتی یا فشرده، اتمهای هیدروژن اغلب نوشته نمیشوند و به صورت ضمنی در نظر گرفته میشوند. این موضوع ممکن است باعث اشتباه در شمارش ظرفیت پیوندی یا تشخیص ایزومرها شود.
مشخص نبودن استریوشیمی
اگر از نشانههایی مانند گوه و خطچین استفاده نشود، اطلاعات مربوط به آرایش فضایی و کایرالیته مشخص نخواهد بود. در نتیجه چند ایزومر فضایی ممکن است یکسان به نظر برسند.
دشواری در نمایش مولکولهای بزرگ
در مولکولهای بسیار بزرگ مانند پروتئینها، فرمول ساختاری بسیار شلوغ و پیچیده میشود و خواندن و تحلیل آن دشوار است.
گسترشها و روشهای نوین
برای جبران این محدودیتها، ابزارها و روشهای جدیدی توسعه یافتهاند که نمایش دقیقتری از مولکولها ارائه میدهند. نرمافزارهای مدلسازی سهبعدی، نمادگذاری متنی برای پردازش رایانهای و مدلسازی کوانتومی از مواردی است که به استفاده از فرمول ساختاری در کنار روشهای نوین کمک میکنند.
در ادامه این موارد را بررسی میکنیم.
نرم افزارهای مدل سازی سه بعدی
برنامههایی مانند ChemDraw و Avogadro امکان تبدیل ساختارهای دوبعدی به مدلهای سهبعدی را فراهم میکنند. در این محیطها میتوان مولکول را چرخاند و شکل واقعی آن را بررسی کرد. پیشنهاد میکنیم برای درک بهتر این نرم افزارها و روش کار با آنها، فیلم آموزش ChemDraw کم دراو برای رسم ساختارهای شیمیایی فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
نمادگذاری متنی
سیستم SMILES روشی فشرده برای نوشتن ساختار مولکولهاست که به نرمافزارها اجازه میدهد آنها را تحلیل کرده و مدل سهبعدی بسازند. برای مثال رشته CC(O)C نمایانگر ایزوپروپانول است.
مدل سازی کوانتومی
در شیمی محاسباتی، روشهایی مانند نظریه تابعی چگالی برای محاسبه ساختار و توزیع الکترونها به کار میروند. نرمافزار Visual Molecular Dynamics با استفاده از دادههای برنامههایی مانند Gaussian امکان بررسی دقیق اوربیتالها و شکل مولکول را فراهم میکند.
آزمون فرمول ساختاری
برای درک بهتر آنچه در این مطلب از مجله فرادرس آموختید، به سوالات زیر دقت کنید. در نهایت پس از پاسخدهی به تمامی سوالات میتوانید با کلیک بر روی گزینه «دریافت نتیجه آزمون»، تعداد پاسخهای صحیح خود را مشاهده کنید.
تمرین و آزمون
۱. فرمول مولکولی یک مولکول، چه چیزی را نمایش میدهد؟
شکل سهبعدی مولکول
تعداد و نوع اتمهای مولکول
زاویه بین پیوندها در مولکول
قطبیت یک مولکول
فرمول مولکولی بر خلاف فرمول ساختاری نوع اتصال اتمها را نشان نیدهد و تنها تعیین میکند مولکول از چه اتمهایی و با چه نسبتی تشکیل شده است.
کدام گزینه دو ایزومر ساختاری را نمایش میدهد؟
و
و
دی متیل اتر و اتانول ()
و
ایزومرهای ساختاری ایزومرهایی هستند که اتمهایی یکسان با تعداد دارند و ترتیب و نحوه اتصال اتمها به هم متفاوت است. به همین دلیل تنها گزینه سوم که شامل ۱ فرمول مولکولی برای ۲ مولکول متفاوت است میتواند نشاندهنده ایزومر ساختاری باشد.
۳. کدام فرمول نمایش دهنده یک پلیمر است؟
ر ترکیبات پلیمری، فرمول ساختاری با پرانتز دور قسمت تکرار شونده در ساختار مولکول و نماد n که تکرار را نمایش میدهد مشخص میشود. این شیوه نمایش به دلیل بزرگ بودن ساختار این ملوکولها است.
۴. تعداد اتمهای کربن در مولکول زیر چند عدد است؟
۱
۲
۳
۴
برای تشخیص تعداد اتمهای مشخص در یک فرمول ساختاری کافی است تعداد اتمها را با استفاده از زیروندهای آنها مشخص کرده و با هم جمع کنیم. در این ترکیب، تنها سه اتم کربن با نماد C وجود دارد.
۵. نوع پیوند بین اتمهای کربن در ترکیب زیر کدام است؟
پیوند یگانه
پیوند دوگانه
پیوند سهگانه
پیوند یونی
۶. کدام فرمول ساختاری فشرده مربوط به تصویر زیر است؟
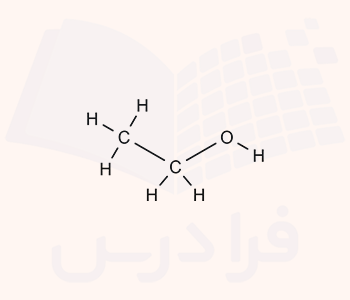
۷. کدام فرمول ساختاری فشرده مربوط به تصویر زیر است؟
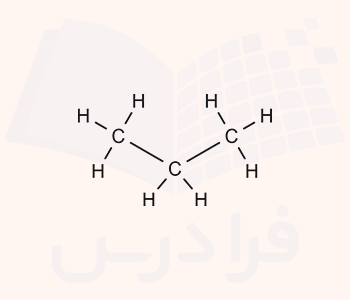
۸. نمایش صحیح فرمول فشرده کدام گزینه است؟
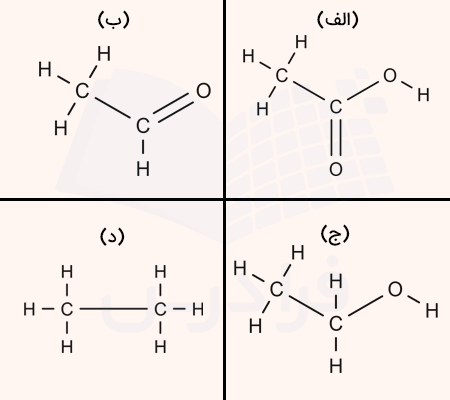
الف
ب
ج
د
۹. نمایش صحیح فرمول ساختاری اتن کدام مورد است؟
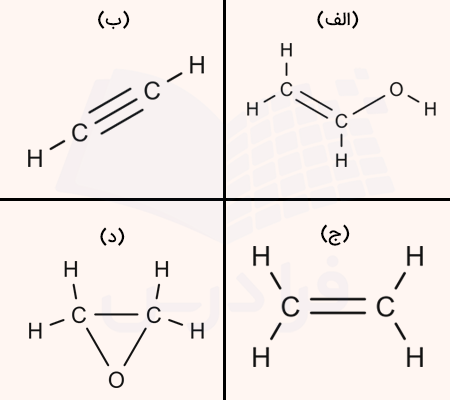
الف
ب
ج
د
۱۰. فرمول فشرده کدام گزینه را نمایش میدهد؟
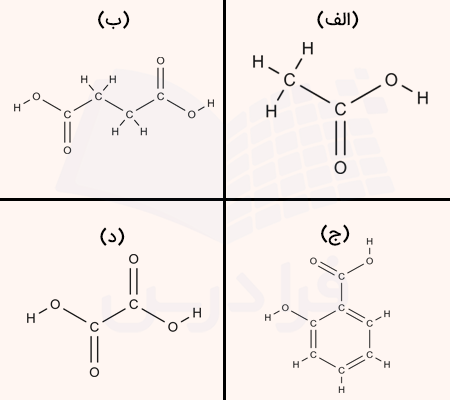
الف
ب
ج
د












