باکتریوفاژ چیست؟ – به زبان ساده
باکتریوفاژ (Bacteriophage) ویروسی است که باکتریها را آلوده میکند. این اصطلاح معمولاً در فرم کوتاه شده، فاژ استفاده میشود. باکتریوفاژ از ترکیب کلمه باکتری و لغت یونانی فاژین به معنای خوردن ساخته شده است. برخلاف ویروسهایی که یوکاریوتها (گیاهان، حیوانات و قارچها) را آلوده میکنند، فاژها از نظر ساختار و عملکرد بسیار متفاوت هستند. به طور معمول، آنها از یک پروتئین خارجی پوسته یا «کپسید» (Capsid) تشکیل شدهاند و مواد ژنتیکی را محصور میکنند. ماده ژنتیکی فاژها میتواند RNA باشد، اما معمولاً آنها از DNA دو رشتهای ساخته شدهاند. اندازه و طول ژنوم فاژها بین 2 تا 200 کیلو جفت باز در هر رشته از اسید نوکلئیک متفاوت است.
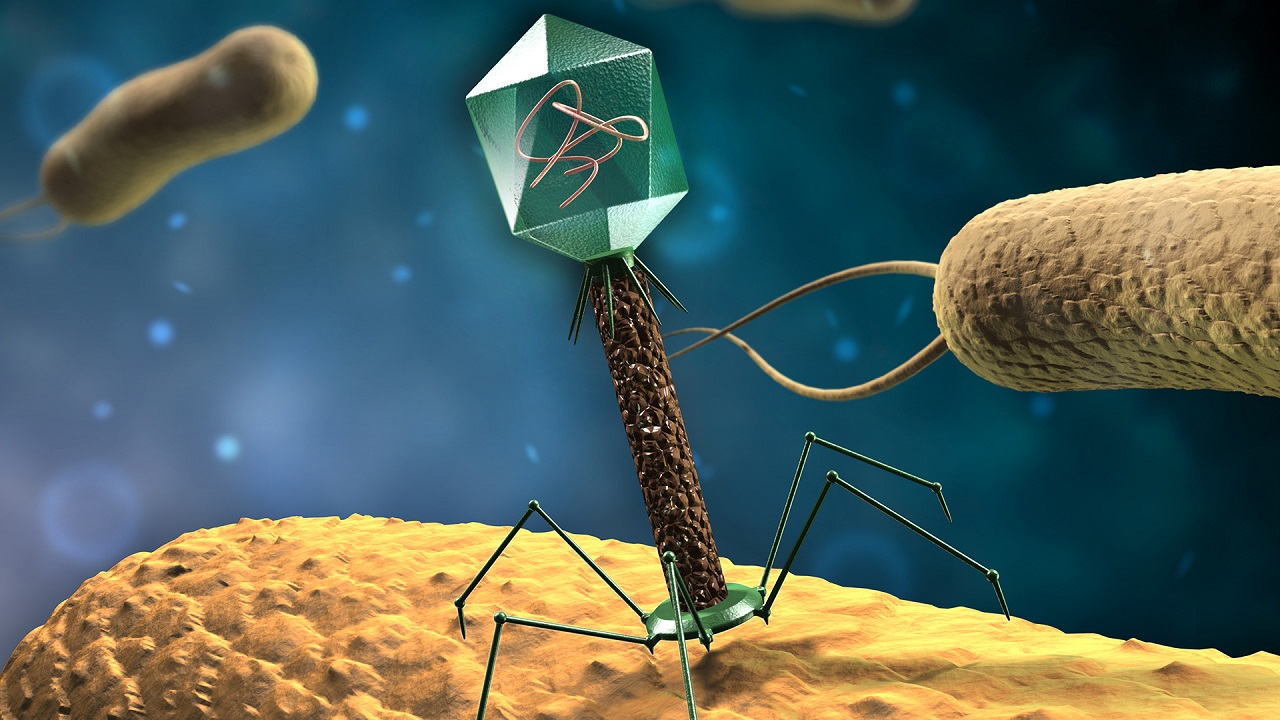

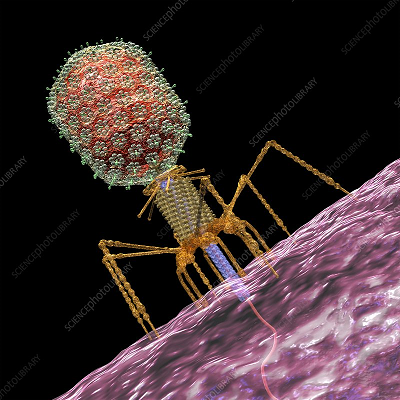
در حالی که بسیاری از ویروسها برای بدن انسان مضر هستند، ویژگی فاژها به عنوان عوامل بالقوه برای از بین بردن باکتریهای بیماریزا (معروف به فاژ درمانی) مورد استفاده قرار میگیرد که در بخشهای بعدی در مورد آنها بحث خواهد شد.
فاژها همه گیر هستند و در بسیاری از مناطق و جاهایی که باکتریها به وفور وجود دارند، مانند خاک یا روده حیوانات میتوانند رشد کنند. یکی از متراکمترین منابع طبیعی برای فاژها و ویروسهای دیگر، آب دریا است که در هر میلیلیتر در سطح از آن تا 109 ویریون یا ذرات کامل ویروس یافت شده است. حداکثر 70 درصد باکتریهای دریایی ممکن است به فاژها آلوده شوند.
ساختار باکتریوفاژ
ساختار کلاسیک یک باکتریوفاژ در تصویر زیر نشان داده شده که دارای تقارن پیچیدهای است. سر باکتریوفاژ که درون آن ماده ژنتیکی فاژ قرار دارد، دارای «تقارن ایکوزوآی» (Icosahedral Symmetry) است، در حالی که دم آن تقارن مارپیچی دارد. صفحات پایه شش ضلعی فاژها دارای چندین الیاف دم مانند هستند که از آنها به سمت خارج منشعب میشوند. در واقعیت، این ساختار عمدتاً در فاژهای (T-even) و (Coliphages) وجود دارد. سایر باکتریوفاژهای پیچیده ممکن است فاقد الیاف دم مانند بوده و یا حتی گاهی فاژها ممکن است دارای دمهای انقباضی باشند.
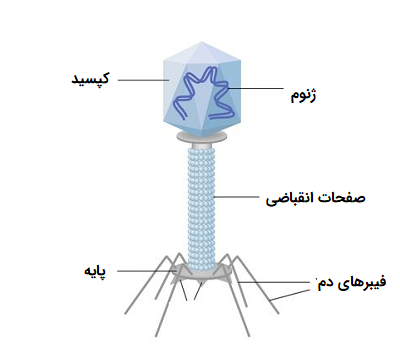
مورفولوژیهای فاژهای مختلف دیگری نیز تاکنون مورد بررسی قرار گرفته است که از جمله آنها میتوان به خانوادههایی از فاژهایی با رشتههای طویل به نام «اینووریده» (Inoviridae)، فاژهایی با ساختارهای میله مانند، یا خانواده فاژهای کروی «سیتوویده» (Cystoviridae) اشاره کرد.
همانند سازی فاژها
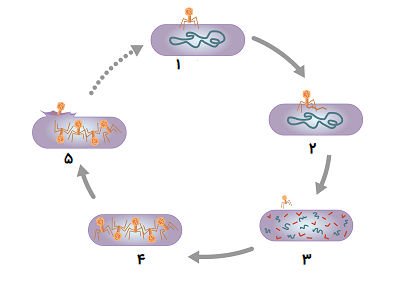
باکتریوفاژها میتوانند تنها در یک سلول میزبان تولید مثل کنند و ممکن است یک چرخه لیتیک یا یک چرخه لیزوژنیک داشته باشند. تعداد کمی از ویروسها قادر به انجام هر دو چرخه هستند. در چرخه لیتیک (Lytic Cycle) مشخصه فاژهای ویروسی مانند فاژ T4، در آخرین مرحله عفونت، دیواره سلولهای میزبان شکسته شده یا لیز میشوند و در این حالت پس از همانند سازی فاژها سلولهای میزبان میمیرند. پس از نابودی سلول میزبان یا باکتریها، ویروسها باید میزبان جدیدی برای تکثیر مجدد خود پیدا کنند.
در مقابل، «چرخه لیزوژنی» (Lysogenic Cycle) فاژها، سلول میزبان را از بین نمیبرد. ژنوم فاژ در کروموزوم باکتری وارد شده و در طی تقسیم سلولی، ژنوم فاژ یکپارچه به همراه کروموزوم میزبان تکثیر میشود. بنابراین، چرخه لیزوژنیک به سلول میزبان اجازه میدهد تا زنده بماند و تولید مثل کند و به این ترتیبویروس در فرزندان سلول نیز تکثیر میشود.
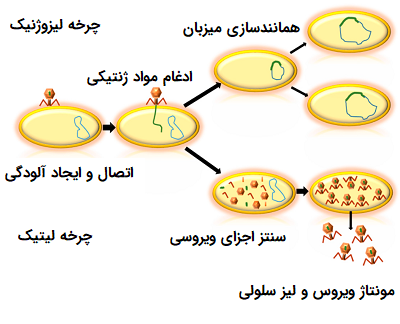
فاژهایی که قادر به انجام هر دو چرخه لیتیک و چرخه لیزوژنیک، مانند «فاژ لامبدا» (Lambda Phage) هستند، به عنوان «فاژهای معتدل» (Temperate Phages) شناخته میشوند. به عنوان مثال، DNA فاژ لامبدا با DNA کروموزومی یک باکتری ادغام میشود و همراه آن تکثیر میشود. هنگامی که ژنوم فاژ بخشی از کروموزوم باکتری باشد، به آن «پروفاژ» (Prophage) گفته میشود. اگر ژنوم فاژ در کروموزوم میزبان گنجانده نشده باشد، اما جدا از آن باقی بماند، پلاسمید نامیده میشود.
این فاژ که به صورت خفته باقی مانده است، همراه با DNA میزبان تکثیر شده و به سلولهای دختری نیز منتقل میشود، این روند تا زمانی که سلول میزبان به دلیل تابش پرتوهایی با انرژی بالا یا وجود برخی مواد شیمیایی خاص آسیب نبیند، ادامه مییابد. سپس پروفاژ در فرآیندی به نام «القای پروفاژ» (Prophage Induction) از کروموزوم میزبان خارج میشود. پس از القا، فاژ از طریق چرخه لیتیک تولید مثل ویروس را آغاز میکند که منجر به مرگ سلول میزبان میشود.
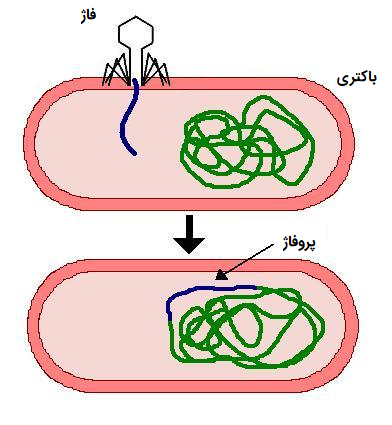
بعضی اوقات بیان ژنهای پروفاژ میتواند فنوتیپ باکتریهای میزبان را تغییر دهد. در برخی موارد، این پدیده با نام تبدیل لیزوژنیک برای سلامت انسان از نظر پزشکی اهمیت دارد. به عنوان مثال، باکتریهای ایجاد کننده «دیفتری» (Diptheria) به نام باکتری «کورینه باکتریوم دیفتری» (Corynebacterium Diphtheriae)، برای انسان بیضرر است، مگر اینکه به فاژ β آلوده شود. سپس ژنهای پروفاژ، باکتریهای میزبان را به تولید سمومی که برای انسان خطرناک هستند تحریک میکنند.
اتصال و نفوذ به باکتری
برای ورود به سلول میزبان، باکتریوفاژها به گیرندههای خاصی روی سطح باکتریها، از جمله لیپوپلی ساکاریدها، اسیدهای تیکوئیک، پروتئینها یا حتی تاژکها متصل میشوند. این ویژگی قفل و کلید به این معنی است که یک باکتریوفاژ فقط میتواند برخی باکتریهایی که دارای گیرندههای خاصی هستند که میتوانند به آنها وصل شوند را آلوده کند. از آنجا که ویروسهای فاژ فعالانه حرکت نمیکنند، در هنگام شناور شدن، در محلولهایی مانند خون یا آب دریا باید به برخوردهای تصادفی با گیرندههای مناسب تکیه کنند.
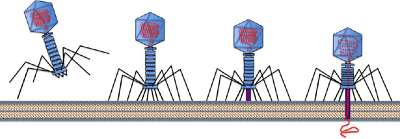
باکتریوفاژهای پیچیده مانند فاژهای T4، T2 و T6 تصور میشود که از حرکاتی شبیه سرنگ برای تزریق مواد ژنتیکی خود به داخل سلول استفاده میکنند. الیاف دم مانند آنها بعد از برقراری تماس با گیرنده مناسب، صفحه پایه را به سطح سلول نزدیک میكنند. پس از اتصال کامل، تغییرات کنفورماسیونی باعث انقباض دم میشوند (این انقباضات احتمالاً با کمک ATP موجود در دم صورت میگیرد). ماده ژنتیکی ممکن است از طریق غشای سلولی منتقل شود و یا این که روی سطح غشا رسوب کند. سایر باکتریوفاژها ممکن است از روشهای مختلفی برای وارد کردن مواد ژنتیکی خود استفاده کنند. در این زمان کپسید خالی فاژ در خارج از سلول میزبان به عنوان جسمی خالی از مواد ژنتیکی باقی میماند.
سنتز پروتئینها و اسید نوکلئیک
در مدت زمان کمی، گاهی اوقات فقط چند دقیقه، آنزیم پلیمراز باکتریایی شروع به ترجمه mRNA ویروسی و سنتز پروتئین میکند. برای فاژهای مبتنی بر RNA، تکثیر RNA در مراحل اولیه انجام میشود. پروتئینهای اولیه و چند پروتئین موجود در فاژ یا ویروس ممکن است RNA پلیمراز باکتریایی را تغییر دهند، به گونهای که ترجیحاً mRNA ویروسی را رونویسی کند. در این حالت سنتز طبیعی پروتئین و اسیدهای نوکلئیک میزبان مختل شده است و مجبور است محصولات ویروسی تولید کند. این محصولات به بخشی از ویروسهای جدید درون سلول تبدیل میشوند، در واقع این محصولات، پروتئینهایی هستند که به جمعآوری ویروسهای جدید یا پروتئینهای درگیر در لیز سلولی کمک میکنند.
مونتاژ ویریون
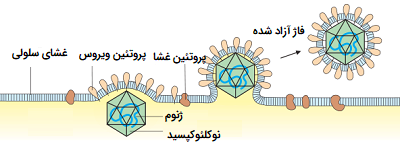
در مورد فاژ T4، ساخت ذرات ویروس جدید فرایندی پیچیده است که نیاز به استفاده از مولکولهای کمکی ویژه دارد. صفحه پایه ابتدا تشکیل شده و بعد از آن ساختار دم ساخته میشود. سرپوش یا کپسید فاژ که به طور جداگانه تهیه شده، به طور خود به خود به دم متصل میشود. DNA به شکلی که هنوز مشخص نیست، به طور موثر درون ساختار کپسید قرار میگیرد. کل روند حدود 15 دقیقه طول میکشد.
انتشار ویروسها
فاژها ممکن است از طریق لیز سلول یا ترشح سلول میزبان آزاد شوند. در مورد فاژ T4، فقط بیش از 20 دقیقه پس از تزریق، 250 - 300 فاژ هنگام ترکیدن سلول آزاد میشوند. لیز سلولی توسط آنزیمی به نام لیزوزیم حاصل میشود که به غشای سلولی حمله کرده و آن را تجزیه میکند. با این حال، برخی فاژها ممکن است یک رابطه همزیستی را ایجاد کنند که در آن سلول میزبان به طور مداوم ذرات جدید ویروس را ترشح کند. ویروسهای جدید از غشای پلاسمایی به بیرون جوانه میزنند و بخشی از غشای باکتری را با خود خارج میکنند تا به ویروسهای دارای یک پاکت ویروسی تبدیل شوند. همه ویروسهای آزاد شده قادر به آلوده کردن باکتری جدید هستند.
فاژ درمانی (Phage Therapy)
فاژها به عنوان عوامل ضد باکتریایی پس از کشف مورد آزمایش قرار گرفتند. با این حال، آنتی بیوتیکها تاکنون کاربردیتر از فاژها بودند. تحقیقات در مورد فاژ درمانی در بسیاری از جوامع مورد استقبال قرار نگرفته است، اما فاژ درمانی از دهه 1940 در اتحاد جماهیر شوروی سابق به عنوان جایگزینی برای آنتی بیوتیکها برای درمان عفونتهای باکتریایی استفاده شده است.
تکامل سویههای باکتریایی از طریق انتخاب طبیعی که در برابر داروهای متعدد مقاوم هستند، موجب شده است که برخی محققان پزشکی فاژها را به عنوان گزینه جایگزینی برای استفاده از آنتی بیوتیکها مورد ارزیابی قرار دهند. برخلاف آنتی بیوتیکها، فاژها (همان طور که برای میلیونها بار این کار را انجام دادهاند)، همراه با باکتریها سازگار میشوند، بنابراین ایجاد مقاومت پایدار باکتریها نسبت به آنها بعید به نظر میرسد. علاوه بر این، هنگامی که یک فاژ مؤثر بر یک نوع خاص از باکتری یافت شود، تا زمانی که همه باکتریها در بدن از بین نرفته باشند، به کشتن باکتریهای اختصاصی خود ادامه خواهد داد.
نوع خاصی از فاژ غالباً فقط یک نوع خاص باکتری را آلوده میکند (نوع خاص شامل چندین گونه و زیرگروههای خاص درون یک گونه را در بر میگیرد)، بنابراین محققان فاژ درمانی باید مطمئن شوند که نوع صحیح باکتریها را شناسایی میکنند که این کار حدود 24 ساعت طول میکشد. گاهی اوقات از مخلوط چندین سویه فاژ برای ایجاد درمان طیف گستردهتر استفاده میشود. یک مزیت دیگر فاژ درمانی این است که در این روش فاژها به هیچ باکتری دیگری حمله نمیکنند و باعث میشود که این نوع آنتی بیوتیک با طیف باریکی کار کند. با این حال، این یک نقطه ضعف در مورد عفونتها با انواع مختلف باکتری نیز به شمار میآید که اغلب عفونتها اینگونه (عوامل عفونی باکتریهای مختلف هستند) عمل میکنند. مشکل دیگر باکتریوفاژها این است که به سیستم ایمنی بدن حمله میکنند.
فاژها هنگام تماس مستقیم با عفونت بهتر عمل میکنند، بنابراین بهتر است از آنها به طور مستقیم روی زخم باز استفاده شوند. این امر به ندرت در شرایط بالینی فعلی که عفونتها به صورت سیستمیک رخ میدهند، کاربرد دارد. علیرغم موفقیتهایی که در روش فاژ درمانی در اتحاد جماهیر شوروی سابق نسبت به سایر روشهای درمانی که با شکست مواجه شده بودند، به دست آمده است، بسیاری از محققان که در مورد بیماریهای عفونی مطالعه میکنند، این سوال را مطرح میکنند که آیا فاژ درمانی به اهمیت پزشکی خود دست خواهد یافت یا خیر. هیچ آزمون بالینی بزرگی برای آزمایش اثربخشی فاژ درمانی وجود ندارد، اما تحقیقات در این مورد، به دلیل افزایش مقاومت آنتی بیوتیکی ادامه دارد.













مجله فرادرس بهترینه? من واقعا لذت میبرم از مطالب دانشگاهی که ساده بیان شدن و یاد می گیرم. خدا قوت.