سیستم ترمودینامیکی – به زبان ساده
در این آموزش، با سیستم ترمودینامیکی (Thermodynamic System) و انواع آن آشنا میشویم.


سیستم ترمودینامیکی و انواع آن
یک سیستم ترمودینامیکی از اجزایی تشکیل شده است که ویژگیهای ترمودینامیکی آن قابل بررسی است. هر سیستم ترمودینامیکی توسط محیط اطرافش احاطه شده است و میتواند از طریق یک مرز، انرژی و کار با این محیط رد و بدل کند. مرز سیستم ترمودینامیکی مانند یک دیوار فرضی عمل میکند که سیستم و محیطش را جدا میسازد. در واقعیت، محیط بلافصل مجاور سیستم به طور مستقیم با آن اثر متقابل دارد و بنابراین بر رفتار و ویژگیهای آن تأثیر زیادی میگذارد.
به طور مثال، اگر در حال مطالعه یک موتور خودرو هستیم، گازوئیل داخل سلیندرها که در حال اشتعال است، یک سیستم ترمودینامیکی محسوب میشود؛ پیستون، سیستم اگزوز (تخلیه دود)، رادیاتور (خنککننده) و هوای بیرون، محیط سیستم را تشکیل میدهند. در اینجا مرز از سطح داخلی سیلندر و پیستون تشکیل شده است.
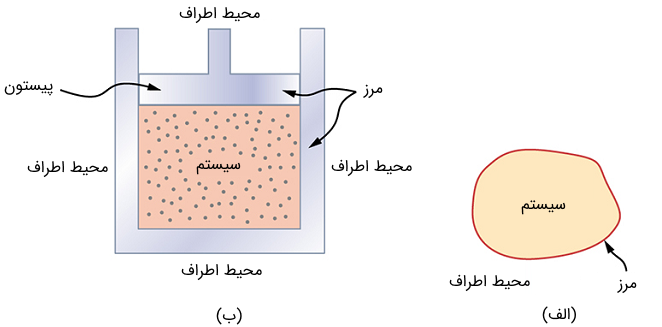
به صورت عادی، یک سیستم با محیط اطرافش اثر متقابل دارد. حال اگر سیستمی کاملاً از محیط اطرافش جدا شده باشد (مانند حجمی از گاز داخل دیوارههای ثابت و عایق)، به آن سیستم بسته یا ایزوله میگویند. در واقعیت، یک سیستم بسته تنها در حالتی وجود دارد که کل جهان را به عنوان سیستم در نظر بگیریم. اغلب سیستمها به عنوان سیستم باز در نظر گرفته میشوند که میتوانند انرژی و ماده با محیط رد و بدل کنند.

وقتی یک سیستم ترمودینامیکی را بررسی میکنیم، به تغییرات از یک محل به محل دیگر داخل سیستم در تمام لحظات توجهی نداریم، بلکه روی ویژگیهای ماکروسکوپیک (بزرگ مقیاس) تمرکز داریم که متوسطی از ویژگیهای میکروسکوپیک (مقیاس جزءنگر) تمام مولکولها و یا اجزای سیستم است. از این رو، هر سیستم ترمودینامیکی به عنوان یک محیط پیوسته در نظر گرفته میشود که ویژگیهای آن در تمام فضای داخلش یکنواخت است. در واقع، فرض میکنیم که سیستم در حالت تعادل قرار دارد گرچه میتوان به طور مثال سیستمی را بررسی کرد که در طول سیستم افت حرارت دارد، اما آنچه در اینجا بحث میکنیم پیرامون سیستمهای در حال تعادل است.
همانطور که برای بررسی یک سیستم مکانیکی باید برآیند نیروهای خارجی و گشتاورهای وارد بر آن را مورد توجه قرار دهیم، به طور مشابه در مورد سیستمهای مکانیکی هم همینطور عمل میکنیم، یعنی انتقال حرارت بین بخشهای مختلف سیستم و یا بین محیط اطراف با سیستم را مورد بررسی و آزمایش قرار میدهیم. در نهایت، باید برآیند آنها به حالت تعادل سیستم بیانجامد. در این حالت، دمای بخشهای مختلف سیستم یکسان است و انتقال حرارت خالص از سیستم صفر میشود.
بنابراین وقتی میگوییم دو جسم در حالت تعادل حرارتی با یکدیگر قرار دارند، یعنی دمای آن دو یکسان شده است. اصلی که بر این شرایط حاکم است قانون صفرم ترمودینامیک است. طبق قانون صفرم ترمودینامیک، اگر جسم ۱ با جسم ۲ و جسم ۳ در شرایط تعادل حرارتی باشد، آنگاه جسم ۲ و جسم ۳ نیز با یکدیگر در تعادل حرارتی هستند. میتوانیم این قانون را به زبان ریاضی به صورت زیر بنویسیم:
اگر و آنگاه .
بنیادیترین راه برای تعریف دما به این صورت است: دو جسم باید از لحاظ ترمودینامیکی دمای یکسانی داشته باشند، اگر انتقال حرارت خالص بین آنها در حالت تماس حرارتی و رسیدن به تعادل حرارتی صفر باشد. قانون صفرم ترمودینامیک به صورت یکسان بر تمام بخشهای سیستم اعمالشدنی است. برای آسانتر شدن این بحث فرض میکنیم سیستم فقط از یک نوع ماده (مانند آب داخل مخزن) یکنواخت تشکیل شده است. ویژگیهای قابل اندازهگیری سیستم حداقل شامل حجم، فشار و دما میشود. بازه متغیرهای مشخصه مرتبط به نوع سیستم بستگی دارد. برای مثال، برای یک بند پلاستیکی در حالت کشیده شده متغیرهای مرتبط شامل طول، تنش و دما هستند. رابطه بین این ویژگیهای اساسی سیستم معادله حالت سیستم نام دارد. این معادله برای یک سیستم بسته به صورت نمادین به شکل زیر نوشته میشود:
که در آن ، و به ترتیب حجم، فشار و دمای سیستم در یک شرایط مشخص هستند. اصولاً این معادله برای هر سیستم ترمودینامیکی وجود دارد اما همیشه در دسترس نیست، گرچه اشکال معادله بالا برای مادههای گوناگونی به صورت تجربی و یا تئوری به دست آمده است. رابطه زیر مثالی از معادله حالت برای یک گاز ایدهآل است:
که در آن ثابت گازها است.
کمیتهای موجود در رابطه بالا را میتوان در دو دسته کلی تفکیک کرد. کمیتهایی که به میزان و مقدار ماده بستگی دارند (مانند حجم و تعداد مولهای ماده) متغیرهای مقداری هستند و کمیتهایی که به مقدار ماده بستگی ندارند (مانند دما و فشار) متغیرهای شدتی نام دارند. برای فهمیدن تفاوت بین این دو نوع کمیت به توضیحات و مثالهای این قسمت توجه کنید:
اندازه یک متغیر مقداری با دو برابر شدن اندازه ماده داخل سیستم، دو برابر میشود در حالی که متغیرهای شدتی میتوانند ثابت بمانند. یعنی اگر ماده داخل سیستم را دو برابر کنیم، حجم یا انرژی کلی سیستم دو برابر میشود، ولی دما و فشار سیستم ثابت نگه داشته شده اند.
اگر این مطلب برای شما مفید بوده است، آموزشها و مطالب زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای مکانیک سیالات
- آموزش مکانیک سیالات (مرور و حل تست کنکور ارشد)
- مجموعه آموزشهای فیزیک
- آموزش جامع فیزیک دبیرستان
- پیوستگی و بقای جرم در سیالات — از صفر تا صد
- سینماتیک سیالات — مقدمهای بر مکانیک
- اصل ارشمیدس — به زبان ساده
^^