خصلت نافلزی چیست و چه رابطه ای با شعاع اتمی دارد؟ – به زبان ساده
خصلت نافلزی به تمایل عناصر به دریافت الکترون و تشکیل آنیون (یون منفی) اشاره دارد. عناصر نافلزی که الکترونگاتیوی بالا، تعداد الکترونهای ظرفیت بالا و شعاع اتمی کوچک دارند تمایل زیادی به دریافت الکترون و تشکیل آنیون برای رسیدن به آرایش الکترونی هشتایی (اوکتت) دارند. خاصیت نافلزی در جدول تناوبی در هر ردیف از چپ به راست افزایش و در هر گروه از بالا به پایین کاهش مییابد. در واقع خاصیت نافلزی و شعاع اتمی رابطه عکس دارند. در این مطلب از مجله فرادرس میآموزیم خصلت نافلزی چیست و چه اثری بر خواص مواد میگذارد.
- میآموزید خصلت نافلزی چیست و چه اثری بر الکترونها میگذارد.
- اثر تغییر شعاع اتمی بر خصلت نافلزی را درک میکنید.
- با روند تغییر خصلت فلزی و سایر خواص دورهای در جدول تناوبی آشنا میشوید.
- عوامل موثر بر خصلت نافلزی و روند تغییر هر یک را در جدول تناوبی درک میکنید.
- یاد میگیرید رابطه واکنشپذیری و خصلت نافلزی چیست.
- تفاوتهای خصلت فلزی و خصلت نافلزی مواد را درک میکنید.

در ابتدای این مطلب میآموزیم خصلت نافلزی چیست و چه تفاوتی با خصلت فلزی دارد. سپس رابطه شعاع اتمی و خصلت نافلزی را بررسی میکنیم. در ادامه، روند تغییر خصلت نافلزی در جدول تناوبی و عوامل موثر بر آن را بررسی میکنیم. پس از آن، خصلت نافلزی را در شبه فلزات بررسی کرده و در نهایت، رابطه این خصلت را با واکنشپذیری مواد توضیح میدهیم. با مطالعه این مطلب تا انتها میتوانید به شکلی کامل بیاموزید خصلت نافلزی چیست.
خصلت نافلزی چیست؟
به تمایل عناصر به دریافت الکترون و تشکیل آنیون خصلت نافلزی گفته میشود. در حالت کلی، عناصر غیر فلزی الکترونگاتیوی بالا و تمایل به دریافت الکترون زیاد دارند و در عناصر فلزی تمایل به از دست دادن الکترون و الکترونگاتیوی کم است. به صورتی که میتوان گفت فلزات کاتیون و نافلزات آنیون تشکیل میدهند.
این خاصیت الکترونی و آرایش الکترونی عناصر نافلزی بر بسیاری از خواص این عناصر تاثیر میگذارد. به شکلی که تمامی عناصر غیرفلزی خواصی تقریبا مشابه و تکرار شونده دارند که در ادامه توضیح داده میشود.
- نافلزات معمولا سخت و شکننده هستند.
- این عناصر میتوانند به شکل گاز، مایع یا جامد وجود داشته باشند.
- این عناصر جلای فلزی ندارند.
- نافلزات تعداد الکترونهای ظرفیت بیشتری نسبت به فلزات دراند.
- هدایت الکتریکی و گرمایی در عناصر نافلزی بسیار پایین است.
- خصلت نافلزی در عناصر گروه ۱۷ و ۱۶ جدول تناوبی بیشتر است.
- عنصر هیدروژن با وجود اینکه در گروه اول جدول تناوبی قرار دارد و کاتیون تشکیل میدهد، خاصیت فلزی ندارد و به عنوان نافلز شناخته میشود.
- نافلزات چگالی کمتری نسبت به عناصر فلزی دارند.
یادگیری شیمی یازدهم با فرادرس
برای درک بهتر این موضوع که خصلت نافلزی چیست، ابتدا باید با مفاهیمی چون انتقال الکترون، مواد فلزی و نافلزی، ترکیبات یونی و ویژگیهای آنها، شعاع کووالانسی، شعاع یونی و شعاع فلزی آشنا شویم. پیشنهاد میکنیم برای آشنایی بیشتر با این مفاهیم، به مجموعه فیلم آموزش دروس پایه دوازدهم، بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که در ادامه آورده شده است میتوانید به آموزشهای بیشتری در زمینه خصلت نافلزی عناصر دسترسی داشته باشید.
- فیلم آموزش شیمی ۱ پایه دهم فرادرس
- فیلم آموزش شیمی ۱ پایه دهم حل سوالات تشریحی امتحانات نهایی فرادرس
- فیلم آموزش شیمی ۳ پایه دوازدهم فرادرس
رابطه شعاع اتمی و خصلت نافلزی
شعاع اتمی، فاصله بین هسته اتم و آخرین لایه الکترون آن (لایه ظرفیت) است. هرچه شعاع اتمی کمتر باشد، فاصله بین هسته اتم و الکترونها کمتر بوده و هسته با قدرت بیشتر الکترونها را به سمت خود میکشد. در نتیجه، جدا کردن الکترون نه تنها بسیار سخت خواهد بود بلکه هسته اتم تمایل دارد الکترونهای بیشتری را برای پایدار شدن نیز به سمت خود جذب کند.
به همین علت است که اندازه شعاع اتمی رابطهای معکوس با خصلت نافلزی دارد و هرچه شعاع اتمی کمتر باشد، خصلت نافلزی بیشتر خواهد بود. در مقابل، هرچه شعاع اتمی بیشتر باشد، فاصله بین هسته و اکترونها بیشتر شده و اثر جاذبه هسته بر الکترونها کمتر است. در نتیجه جدا کردن الکترون از اتم راحتتر خواهد بود.
روند تغییر شعاع اتمی در جدول تناوبی
در جدول تناوبی عناصر، اتمها بر اساس افزایش عدد اتمی، افزایش الکترونها و پروتونها در ۷ ردیف و ۱۸ گروه دستهبندی شدهاند. در هر ردیف جدول تناوبی با حرکت از چپ به راست، تعداد لایههای الکترونی برابر بوده و تعداد الکترونها و پروتونها به آنها افزوده میشود. بدین ترتیب، اثر پوششی الکترونی درونی در حرکت از چپ به راست ردیفهای جدول تناوبی زیاد نیست و هسته اتم میتواند مستقیما الکترونهای اضافه شده را به سمت خود جذب کند. به همین دلیل، شعاع اتمی در هر ردیف جدول تناوبی کاهش مییابد. با کم شدن شعاع اتمی، الکترونگاتیوی افزایش یافته و خصلت نافلزی افزایش مییابد.

در هر گروه جدول تناوبی با حرکت از بالا به پایین، یک لایه الکترونی به لایههای الکترونی اتمها افزوده میشود. در این موارد، اثر لایه افزوده شده، هم به تنهایی شعاع اتمی را افزایش داده و هم اثر پوششی الکترونهای درونی را افزایش داده و بار موثر هسته را میکاهد. به همین دلیل در هر گروه جدول تناوبی با حرکت از بالا به پایین، شعاع اتمی افزایش یافته و خصلت نافلزی کاهش مییابد.
روند تغییر خصلت نافلزی در جدول تناوبی
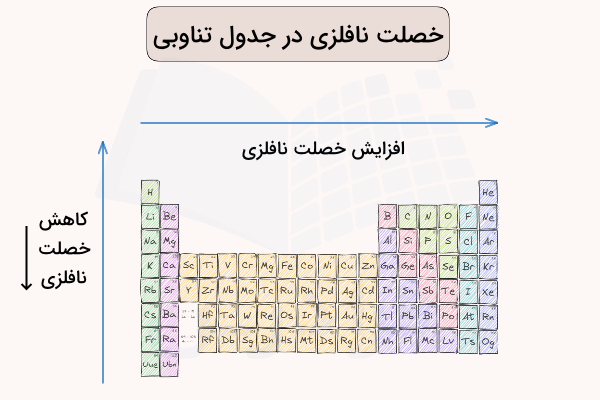
خصلت نافلزی در هر ردیف جدول تناوبی با حرکت از چپ به راست، افزایش مییابد. با حرکت از چپ به راست در هر ردیف جدول تناوبی الکترونگاتیوی افزایش یافته و تمایل عناصر برای دریافت الکترون افزایش مییابد. پیشنهاد میکنیم برای آشنایی بیشتر با روند تغییر این خصلت و موارد مربوط به آن در جدول تناوبی، فیلم آموزش تفاوت عناصر فلزی، نافلزی و شبه فلزی در جدول تناوبی فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
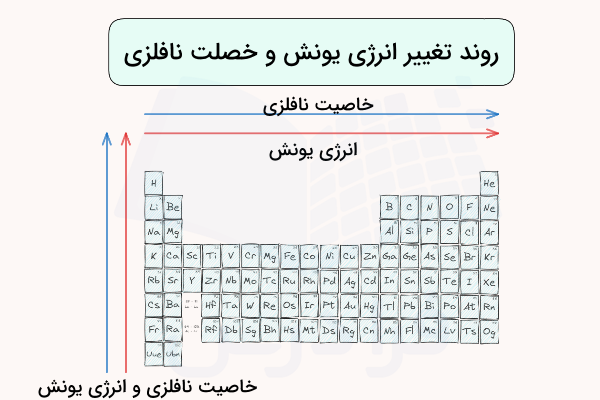
با حرکت از بالا به پایین در هر گروه جدول تناوبی، خصلت نافلزی کاهش مییابد. با حرکت در هر گروه جدول تناوبی، الکترونگاتیوی کاهش یافته و به تعداد لایههای الکترونی افزوده میشود. به همین دلیل تمایل عناصر به دریافت الکترون و خصلت نافلزی کاهش مییابد. در تصویر زیر، روند تغییر خصلت نافلزی در جدول تناوبی مشخص شده است.
عوامل موثر بر خصلت نافلزی
در قسمتهای قبل آموختیم خصلت نافلزی چیست. عوامل مختلفی میتوانند بر خصلت نافلزی عناصر اثر بگذارند. مهمترین این عوامل، شعاع اتمی، آرایش الکترونی عناصر و مقدار الکترونگاتیوی آنها است. در ادامه میآموزیم نحوه اثر این عوامل بر خصلت نافلزی چیست.
شعاع اتمی
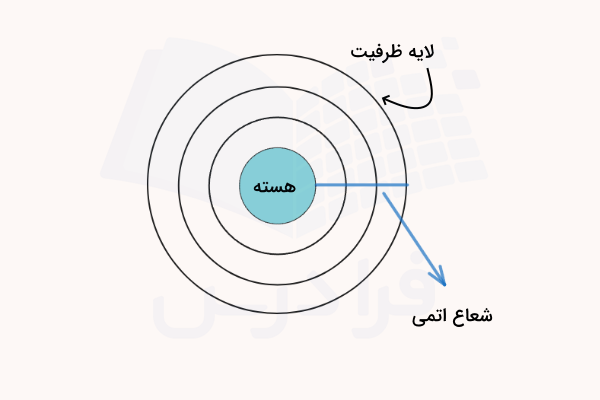
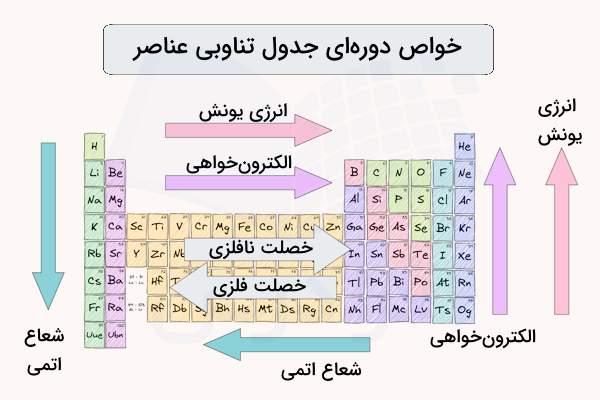
شعاع اتمی در واقع فاصله هسته اتم تا الکترونهای لایه ظرفیت (آخرین لایه الکترونی) آن است. هرچه شعاع اتمی کمتر باشد، فاصله الکترونها تا هسته اتم کمتر بوده و مقدار الکترونگاتیوی و خصلت نافلزی بیشتر میشود. در مقابل هر چه شعاع اتمی عناصر بیشتر باشد، اثر جاذبه هسته روی الکترونهای لایه ظرفیت عنصر کمتر شده و مقدار الکترونگاتیوی و خصلت نافلزی کمتر است. در تصویر زیر شکل شعاع اتمی نمایش داده شده است.
به همین دلیل است که در هر دوره جدول تناوبی با حرکت از چپ به راست جدول (از گروه فلزات قلیایی به سمت نافلزاتی مانند هالوژنها)، خصلت نافلزی افزایش مییابد. همچنین در هر گروه جدول تناوبی با افزایش شعاع اتمی در هر گروه از بالا به پایین، خصلت نافلزی کاهش مییابد. بدین ترتیب، اتم فلوئور بیشترین خصلت نافلزی را دارد. در اتم نافلزات گازهای نجیب، اثر پر بودن لایهها و اوربیتالهای الکترونی، مقدار الکترونخواهی این عناصر را کاهش میدهد. به همین علت مقدار خصلت نافلزی اتم فلوئور از گاز نجیب پس از آن بیشتر است.
انرژی یونش
انرژی یونش انرژی مورد نیاز برای انتقال یک الکترون از یک اتم به اتمی دیگر در حالت گازی است. در نافلزات، این پارامتر مقدار زیادی داشته و مستقیما بر خصلت نافلزی تاثیرگذار است. به دلیل تمایل نافلزات به جذب الکترون، الکترونهای این عناصر با قدرت بیشتری به هسته آنها جذب میشوند. به همین دلیل، جدا کردن الکترون از لایه ظرفیت این عناصر بسیار دشوارتر از عناصر فلزی است. در نتیجه، مقدار انرژی یونش برای این عناصر بیشتر از اتمهای فلزی است.
روند تغییر انرژی یونش و خصلت نافلزی در جدول تناوبی در تصویر زیر مشخص شده است. میتوان گفت که انرژی یونش و خصلت نافلزی رابطهای مستقیم دارند و هرچه انرژی یونش بیشتر باشد، مقدار خصلت نافلزی نیز بیشتر است.
الکترونگاتیوی
الکترونگاتیوی تمایل یک اتم به جذب الکترون توسط نیروی جاذبه هسته مثبت است. در عناصر نافلزی الکترونگاتیوی مقدار زیادی دارد و این پارارمتر رابطهای مستقیم با خصلت نافلزی دارد. عنصر فلوئور در گروه ۱۷ جدول تناوبی بیشترین الکترونگاتیوی و بیشترین خصت نافلزی را دارد. در تصویر زیر روش تشکیل یون فلوئور و خصلت نافلزی آن را مشاهده میکنید.

آرایش الکترونی
یکی از مهمترین عوامل تاثیر گذار بر خصلت نافلزی، آرایش الکترونی عناصر است. عناصر نافلزی (بجز هیدروژن) در گروههای ۱۳ تا ۱۸ جدول تناوبی قرار گرفتهاند. در این عناصر، اوربیتالهای p درحال پر شدن است. این عناصر تمایل دارند تا با دریافت الکترون، اوربیتالهای p خود را پر کرده و به آرایش الکترونی گاز نجیب برسند. برای مثال، به آرایش الکترونی عناصر اکسیژن، فلوئور و فسفر دقت کنید.
اتم اکسیژن با دریافت ۲ الکترون به آرایش هشتایی میرسد. اتمهای فلوئور و فسفر نیز با دریافت به ترتیب ۱ و ۳ الکترون به آرایشی پایدار میرسند.
تعداد الکترونهای ظرفیت
تعداد الکترونهای ظرفیت یکی دیگر از عوامل تاثیرگذار بر خصلت نافلزی و خصلت فلزی است. همانطور که در قسمت قبل مشاهده کردید، در اتم نافلزات، الکترونهای ظرفیت در اوربیتال p جای میگیرند که میتواند ۶ الکترون را در خود جای دهد. این عناصر نسبت به اتمهای فلز قلیایی و قلیایی خاکی که تنها ۲ الکترون در لایه ظرفیت خود دارند، تعداد بیشتری الکترون ظرفیت دارند. بدین ترتیب تعداد الکترونهای ظرفیت اتمهای غیرفلزی بیشتر از اتمهای فلزی است.
شبه فلزات و خصلت نافلزی
عناصر شبهفلز موادی هستند که هم خواص فلزی را از خود نشان میدهند و هم برخی از خواص غیر فلزی را دارند. خصلت غیرفلزی برای عناصر شبه فلز، مقداری بین فلزات و نافلزات را دارد. الکترونگاتیوی و انرژی یونش برای این عناصر مقادیری میانی دارد. این عناصر هم میتوانند رسانای ضعیف الکتریسیته باشند، هم جلای فلزی داشته باشند و هم سخت و شکننده باشند. پیشنهاد میکنیم برای آشنایی بیشتر با خواص این عناصر، مطلب شبه فلزات در جدول تناوبی مجله فرادرس را مطالعه کنید.
رابطه واکنش پذیری و خصلت نافلزی
در قسمتهای قبل آموختیم روند تغییر خصلت نافلزی و سایر پارامترهای دورهای در جدول تناوبی چیست. خصلت نافلزی به تمایل اتمها به دریافت الکترون، تشکیل آنیون و رسیدن به آرایش الکترونی گاز نجیب گفته میشود. هرچه خصلت نافلزی عناصر بیشتر باشد، راحتتر آنیون تشکیل داده و واکنشپذیرتر خواهند بود.
عناصر غیرفلزی میتوانند با مواد مختلفی واکنش دهند. از ترکیب مواد نافلزی با عناصر فلزی، معمولا ترکیبات یونی تشکیل میشود که در آنها آنیون غیرفلزی و کاتیون فلزی است. از ترکیب دو عنصر نافلزی معمولا ترکیبات کووالانسی تشکیل میشود که با به اشتراکگذاری الکترون با یکدیگر پیوند بر قرار میکنند. در ادامه برخی از واکنشهای رایج عناصر غیر فلزی برای مثال آورده شده است.
- واکنش فلز و نافلز و تولید نمک یونی
- واکنش اکسید غیرفلزی و آب و تولید اسید
- واکنش اکسید نافلزی و باز و تولید نمک

تفاوت خصلت نافلزی و خصلت فلزی
در این مطلب از مجله فرادرس آموختیم خصلت نافلزی چیست. تشخیص تفاوت بین خصلت نافلزی و خصلت فلزی یکی از کلیدهای درک رفتار شیمیایی عناصر مختلف در تشکیل پیوند و واکنشهای شییمایی است. در ادامه، تفاوتهای عمده خصلت نافلزی و خصلت فلزی را بررسی میکنیم.
| خصلت نافلزی | خصلت فلزی |
| مقدار تمایل اتم به گرفتن الکترون | تمایل اتم به از دست دادن الکترون |
| تشکیل آنیون | تشکیل کاتیون |
| الکترونگاتیو | الکتروپوزتیو |
| انرژی یونش بالا | انرژی یونش پایین |
| شعاع اتمی کمتر | شعاع اتمی بیشتر |
| تعداد الکترون ظرفیت بیشتر | تعداد الکترون ظرفیت کمتر |
| شکننده و غیربراق | براق و چکشخوار |
| هدایت الکتریکی و گرمایی کم | هدایت الکتریکی و گرمایی زیاد |
| دمای ذوب و جوش پایین | دمای ذوب و جوش بالا |












