پیل سوختی چیست؟ – به زبان ساده
امروزه، نقش انرژیهای نو و تجدیدپذیر در تولید انرژی الکتریکی بر کسی پوشیده نیست. در کنار انرژیهای خورشیدی، بادی، زمینگرمایی و زیستتوده، انرژی حاصل از پیل سوختی نیز اهمیت فراوانی پیدا کرده است. در این آموزش با پیل سوختی و انواع آن آشنا میشویم.


پیل سوختی چیست؟
پیل سوختی دستگاهی است که از طریق یک واکنش شیمیایی برق تولید میکند. همه پیلهای سوختی دو قطب الکتریکی (الکترود) به نام آند و کاتد دارند. در واقع، واکنشهای شیمیایی در این الکترودها صورت میگیرد و منجر به تولید الکتریسیته میشود. علاوه بر این، هر پیل سوختی الکترولیت و کاتالیست نیز دارد؛ نقش الکترولیت جابهجایی ذرات باردار بین الکترودها است، در حالی که کاتالیست سرعت واکنشها را در الکترودها افزایش میدهد.
با اینکه هیدروژن سوخت اصلی ورودی پیل محسوب میشود، برای شکل گرفتن واکنش، به اکسیژن نیز نیاز است. یکی از بزرگترین جذابیتهای پیل سوختی این است که الکتریسیته با کمترین میزان آلودگی تولید میشود. در واقع، بیشترین میزان از اکسیژن و هیدروژن ورودی به پیل، در نهایت به شکل یک محصول فرعی بیخطر، یعنی آب، ترکیب خارج میشود. عملاً، هر پیل سوختی مقدار خیلی کمی جریان مستقیم برق تولید میکند و به همین دلیل تعداد زیادی پیل در دستههای بزرگی که پشته یا استک (Stack) نامیده میشوند برای تولید برق مورد استفاده قرار میگیرند.
تاریخچه پیل سوختی
علیرغم اینکه پیل سوختی از فناوریهای نوین محسوب میشود، اما بیش از 150 سال موضوع آشنایی برای پژهشگران بوده است. ویلیام رابرت گروو (William Robert Grove) در سال 1838 «پیل گروو» را ساخت که الکترودهای پلاتینی غوطهور در سولفات روی داشت و ۱۲ آمپر جریان با ولتاژ ۱٫۳ ولت تولید میکرد. پیش از این نیز، ویلیام نیکلسون (William Nicholson) و آنتونی کارلیسل (Anthony Carlisle) فرایند استفاده از برق را برای جداسازی اکسیژن و هیدروژن شرح داده بودند، اما به گفته خود گروو، «ترکیب گازها برای تولید برق گامی بسیار دورتر از آنچه تا آن زمان پیموده بودند به نظر میرسید.»
کریستین شوباین (Christian Schönbein)، دوست گروو، که مکاتبات وی را نیز انجام میداد، به همراه گروو، نظریه شیمیایی را مورد بحث قرار دادند و پاگندروف نیز نظریه برخورد را مورد بررسی قرار داد تا در نهایت بخشهایی از عملکرد و تئوری واکاوی شد. گروو با استفاده از نتایج این تحقیقات شاهکار خود را به اتمام رساند و اولین پیل سوختی را ساخت که «باتری گازی» نام گرفت.
فردریش ولیهلم اوستوالد (Friedrich Wilhelm Ostwald) یکی از بنیانگذاران شیمیفیزیک، درک زیادی از نحوه عملکرد پیلهای سوختی فراهم کرد. در سال 1893 او به صورت تجربی ارتباط اجزای مختلف پیل را تشریح کرد: الکترودها، الکترولیت، عوامل اکسیداسیون و کاهش، آنیونها و کاتونها. در واقع، اوستوالد در امتداد حرفه و تخصص خود که شرح ارتباط خواص فیزیکی و واکنشهای شیمیایی بود، معمای باتری گازی گروو را حل کرد. توضیحات او در مورد اصول شیمی نهفته در پیل سوختی، زمینه را برای کار محققان بعدی روی پیل سوختی فراهم کرد.
پیل سوختی چگونه کار میکند؟
هدف از ساخت پیل سوختی تولید جریان برق به گونهای است که با جریان خروجی از پیل، مثلاً بتوان یک موتور الکتریکی را راهاندازی و یا چراغی روشن کرد. به دلیل ماهیت عملکردی الکتریسیته، جریان تولیدی در پیل سوختی در نهایت به آن باز میگردد تا یک مدار را کامل کند. در واقع، این واکنشهای شیمیایی هستند که جریان را تولید میکنند و اصل عملکرد پیل سوختی را شکل میدهند.
انواع مختلفی پیل سوختی وجود دارد که تا حدی متفاوت از یکدیگر عمل میکنند، اما به طور کلی، اتمهای هیدروژن به آند پیل وارد و در آنجا در یک واکنش شیمیایی یونیزه شده و دارای بار مثبت میشوند. جریان الکترونهای جدا شده از هیدروژن، جریان داخل سیم را شکل میدهد. اگر جریان متناوب (AC) نیاز باشد، جریان مستقیم خروجی از پیل وارد دستگاه به نام اینورتر میشود تا به جریان متناوب مطلوب تبدیل شود.
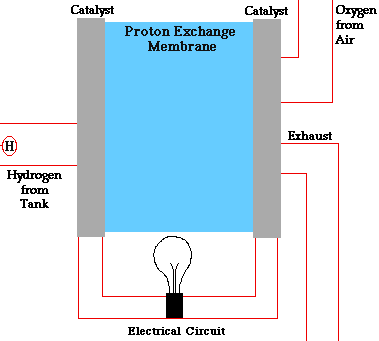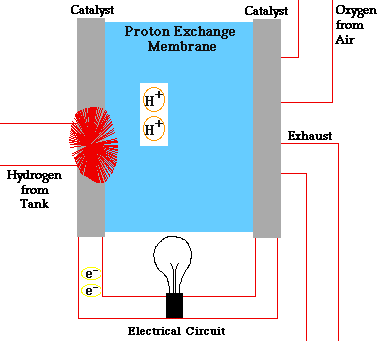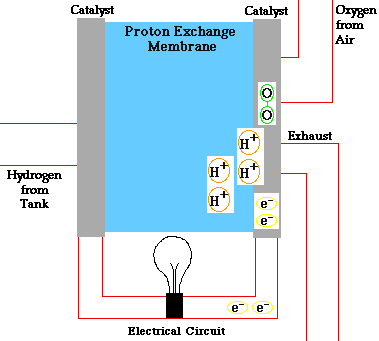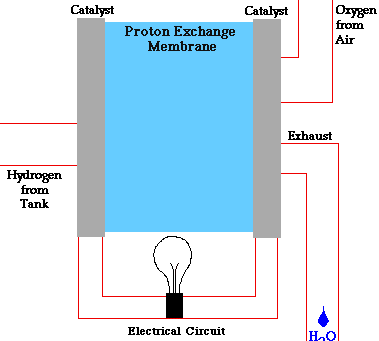
در پیل سوختی، اکسیژن به کاتد وارد شده و در بعضی انواع پیل سوختی در آنجا با الکترونهایی که از مدار بر میگردند و یونهای هیدروژن که از طریق الکترولیت از آند عبور کردهاند، واکنش میدهد. در انواع دیگر، اکسیژن به همراه الکترونها از الکترولیت گذشته و در آند با یون هیدروژن واکنش میدهد.
الکترولیت نقشی کلیدی در پیل سوختی ایفا میکند، زیرا باید به یونهای مشخصی اجازه عبور بین کاتد و آند را بدهد. اگر الکترونهای آزاد یا ذرات دیگر بتوانند از الکترولیت عبور کنند، واکنش شیمیایی را دچار اختلال خواهند کرد.
ترکیب هیدروژن و اکسیژن چه در آند اتفاق بیفتد و چه در کاتد، ماحصل آن آب خواهد بود که از پیل خارج میشود. میتوان گفت تا وقتی که ورودی اکسیژن و هیدروژن پیل تأمین شود، برق نیز تولید خواهد شد.
مزیت دیگر پیل سوختی در مقایسه با دیگر منابع این است که پیل سوختی به صورت شیمیایی برق تولید میکند و نه با واکنش احتراق؛ بنابراین محدودیتهای قوانین ترمودینامیکی مانند محدودیت کارنو را ندارد و در نتیجه، پیل سوختی در استخراج انرژی از یک سوخت، بهینهتر و کارآمدتر عمل میکند. علاوه بر این، حرارت اتلافی پیل را نیز میتوان کنترل و از آن برای افزایش کارایی سیستم استفاده کرد.
اما چرا نمیتوان پیل سوختی را به راحتی تهیه کرد؟ با اینکه تشریح طرز کار پیل سوختی دشوار نیست، اما ساخت یک پیل سوختیِ کمهزینه، کارآمد و قابل اطمینان کار بسیار دشواری است.
محققان و مخترعان برای دستیابی به کارآمدی بیشتر، مدلهای مختلفی از پیل را طراحی کردهاند که جزئیات فنی هر کدام متفاوت از دیگری است. در ساخت پیل، مسئلهای که بیشترین محدودیت را برای سازندگان ایجاد میکند، انتخاب الکترولیت است. برای مثال، طراحی الکترودها و انتخاب مواد سازنده آنها به الکترولیت بستگی دارد. امروزه انواع الکترولیتهای متداول عبارتند از: آلکالی، کربنات مذاب، اسید فسفریک، غشاء تبادل پروتون (PEM) و اکسید جامد. سه نوع اول الکترولیت مایع دارند و دو مدل آخر الکترولیت جامد.
نوع پیل سوختی به الکترولیت آن بستگی دارد. بعضی از پیلها به هیدروژن خالص نیاز دارند، بنابراین به دستگاهها یا قطعات اضافهای نیز برای خالص کردن سوخت احتیاج خواهند داشت، مانند تبدیلگر (Reformer) یا بهساز سوخت. انواع دیگر پیل، ناخالصی را میپذیرند، اما باید دمای کاری آنها بالاتر باشد تا کارآمدی خود را حفظ کنند.
هر گونهای از پیل سوختی مزایا و معایبی دارد، اما هنوز هیچکدام به اندازهای بهصرفه نیست تا جایگزین مدلهای سنتی تأمین انرژی مانند نیروگاههای هستهای یا فسیلی شود.
انواع مختلف پیلهای سوختی
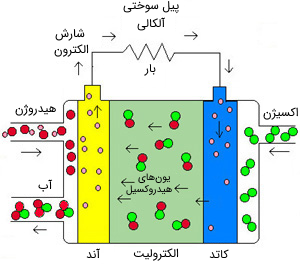
در پیل سوختی آلکالی از اکسیژن و هیدروژن متراکم برای سوخت و از هیدروکسید پتاسیم (KOH) در آب به عنوان الکترولیت استفاده میشود. بازده آن تقریباً 70 درصد و دمای کاریاش 150 تا 300 درجه سانتیگراد است. همچنین، توان خروجی این نوع پیل سوختی در بازه 300 وات تا 5 کیلووات است.
از این نوع پیل در فضاپیمای آپولو برای تأمین برق و آب آشامیدنی همزمان با آن استفاده شد. این نوع از پیل به هیدروژن خالص نیاز دارد، الکترودهای آن از جنس پلاتین و گران قیمت هستند و مانند هر مخزن سیال دیگری امکان نشتی دارد.
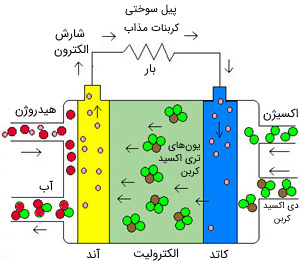
پیل سوختی کربنات مذاب (MCFC) از ترکیبات نمک مانند سدیم یا منیزیم در دمای بالا به عنوان الکترولیت استفاده میکند. بازده آن از 60 تا 80 درصد متغیر است و دمای کاری آن در حدود 650 درجه سانتیگراد است. تاکنون واحدهایی از این نوع با ظرفیت بیش از 2 مگاوات ساخته شدهاند و طراحی واحدهایی با ظرفیت 100 مگاوات نیز موجود است. دمای بالای کاری در این پیلها، آسیب ناشی از مونوکسید کربن را محدود میکند و همچنین گرمای اتلافی میتواند برای تولید برق بیشتر بازیابی شود. الکترود-کاتالیستهای این نوع پیل سوختی که از جنس نیکل است، به نسبت الکترودهای پلاتینی نوع قبلی، قیمت بالایی ندارد؛ اما دمای کاری بالا، انتخاب مواد الکترود و کاربردهای ایمن آن را محدود میکند (به طور مثال، این دمای کاری برای استفادههای خانگی بسیار بالا و غیرایمن است).
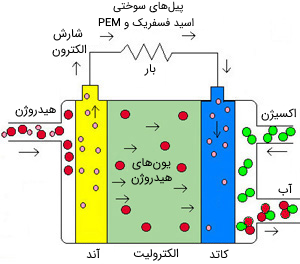
پیل سوختی اسید فسفوریک (PAFC) نیز به طریق مشابه از اسید فسفریک به عنوان الکترولیت استفاده میکند. بازدهی این نوع پیل در حدود 40 تا 60 درصد بوده و دمای کاری آن بین 150 تا 200 درجه سانتیگراد است. توان پیلهای سوختی موجود از این نوع تا 200 کیلووات است، اما توان واحدهایی تا 11 مگاوات نیز آزمایش شده است. پیلهای سوختی اسید فسفوریک غلظت کربن مونوکسید را تا 1٫5 درصد میپذیرند که این باعث میشود گستره انتخاب سوخت برای آن گستردهتر باشد. با این حال، اگر گازوئیل به عنوان سوخت مورد استفاده قرار گیرد، باید سولفور آن زدوده شود. این نوع پیل به الکترود-کاتالیست پلاتینی نیاز دارد و علاوه بر آن، قطعات داخلی نیز باید نسبت به محیط اسیدی خورنده مقاوم باشند.
پیل سوختی با غشاء تبادل پروتون (PEM) با الکترولیت پلیمری کار میکند که در قالب یک صفحه نازک و نفوذپذیر درآمده است. بازده آن 40 تا 50 درصد، دمای کاریاش حدود 80 درجه سانتیگراد و توان خروجی آن معمولاً بین 50 تا 250 کیلووات است. الکترولیت جامد و انعطافپذیر این سلولها نشتی نداشته و ترک نمیخورد. گرچه دمای پایین کاری، پیلهای PEM را برای کاربردهای خانگی و درون خودرو مناسب کرده است، اما سوخت آنها باید تصفیه و خالص شده و دو الکترود پلاتینی در هر دو طرف غشاء قرار گیرد که خود، هزینه ساخت آن را افزایش میدهد.
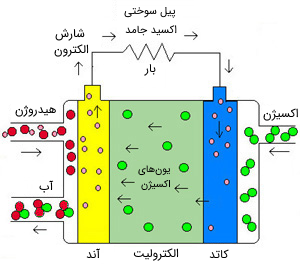
پیلهای اکسید جامد (SOFC) از نوعی اکسید فلز به عنوان الکترولیت بهره میبرند که ترکیبی سرامیکی و سخت است. بازده این پیلها در حدود 60 درصد و دمای کاری آنها تقریباً 1000 درجه سانتیگراد است که این دمای بالا کاربری آنها را محدود میکند. خروجی این پیلها تا 100 کیلووات گزارش شده است. در چنین دمای بالایی به تبدیلگر یا بهساز برای جداسازی هیدروژن نیازی نیست و گرمای اتلافی نیز میتواند بری تولید برق بیشتر بازیابی و استفاده شود.
یکی دیگر از انواع پیل سوختی، نوع میکروبی آن است. این نوع پیل یک مخزن ذخیره باکتری دارد که با تجزیه قند یا سایر مواد ارگانیک و حتی فاضلاب توسط باکتریها برق تولید میکند. نکته مهم در این نوع پیل، تأمین مواد ارگانیک به روشی قابل اطمینان است، زیرا در صورت عدم رسیدن به موقع غذا، باکتریها از بین میروند.
واکنشها در پیل سوختی
برای درک بهتر عملکرد پیل سوختی بهتر است با واکنشهای اساسی و برخی اصطلاحات در شیمی آشنا شویم. در یک پیل سوختی، واکنش احتراق هیدروژن در واقع به دو نیمواکنش الکتروشیمیایی تقسیم میشود:
در معادله اول، چون الکترونها توسط واکنش آزاد میشوند، اکسایش رخ داده است و در معادله دوم چون الکترونها در معادله مصرف میشوند، کاهش رخ داده است.
همچنین، آند به الکترودی گفته میشود که در آن اکسایش اتفاق بیفتد یا در حالت کلیتر الکترون از آن خارج شود. کاتد نیز به الکترودی گفته میشود که واکنش کاهش در آن رخ دهد و در واقع الکترون به آن وارد شود.
طراحی و محاسبات کلی پیل سوختی
به طور خلاصه، در طراحی پیل سوختی با استفاده از اصول ترمودینامیکی، قوانین نرست، گیبس و... چگالی جریان و تعداد الکترونهای لازم محاسبه شده و سپس با در نظر گرفتن قیود از پیش تعیین شده، به طور مثال در انتخاب نوع الکترولیت، محاسبات مربوط به اندازه، دما و... قابل انجام است. در اینجا به طور خلاصه به برخی روابط کلی مربوط به محاسبات طراحی پیل سوختی اشاره میکنیم.
ولتاژ
معادله نرنست (Nernst equation) که نقش مهمی در محاسبات مربوط به پیل سوختی ایفا میکند، در حالت کلی به شکل زیر است:
که در آن، ولتاژ بازگشتپذیر، ثابت فارادی، دما، ثابت گازها، تعداد الکترونها و ضریب فعالیت اجزاست.
بازده پیل سوختی
بازده واقعی پیل سوختی همواره باید کمتر از بازده ترمودینامیکی آن باشد. دو دلیل اصلی برای این مسئله، افت ولتاژ و اتلاف مربوط به سوخت است. بازده واقعی پیل به صورت زیر محاسبه میشود:
بازده ترمودینامیکی پیل، یعنی در واقع نشان میدهد که حتی در شرایط ایدهآل چه میزان از آنتالپی موجود در سوخت میتواند به کار تبدیل شود.
بازده ولتاژ اتلاف مربوط به اثرات بازگشتناپذیری انرژی جنبشی را نشان میدهد. این اتلافها در نمودار جریان-ولتاژ پیل قابل مشاهده و از طریق رابطه زیر قابل محاسبه است:
که در آن، ولتاژ کاری پیل و ولتاژ بازگشتپذیر ترمودینامیکی آن است.
همچنین بازده سوخت بیان میکند که همه سوخت وارد شده به پیل در واکنش الکتروشیمیایی شرکت نمیکند و مقداری از آن ممکن است در واکنشهای حاشیهای وارد شود. این بازده از طریق رابطه زیر قابل محاسبه است:
جریان
باید توجه داشت که در محاسبات پیل سوختی، چگالی جریان اهمیت بیشتری نسبت به خود جریان دارد. اغلب نمودارهای مربوط به عملکرد پیل نیز بر مبنای چگالی جریان رسم میشوند. چگالی جریان را غالباً با نشان داده و از رابطه زیر محاسبه میکنند:
که در آن، نشان دهنده جریان و سطح مقطع است. واحد چگالی جریان آمپر بر سانتیمتر مربع () است، اما میتوان برحسب مول بر سانتیمتر مربع () نیز آن نشان داد. نمونهای از نمودار ولتاژ سلول برحسب چگالی جریان در زیر آورده شده است.
فیلم آموزش پیلهای سوختی
برای آشنایی بیشتر با پیلهای سوختی، میتوانید به آموزش ویدئویی «پیلهای سوختی – مفاهیم و ساختار» مراجعه کنید. در این آموزشِ ۱۳ ساعت و ۳۱ دقیقهای، مباحث ترمودینامیکی و سینتیکی عمومی پیلهای سوختی PEM ،DM ،MC و Alkaline به صورت اجمالی پرداخته شده و پس از آن، هر کدام از پیلهای مذکور به صورت تخصصی معرفی شدهاند. در درس اول این آموزش، مقدمهای درباره مفاهیم مربوط به پیلهای سوختی بیان شده و در درس دوم بازدهی و ولتاژ مدار باز آنها به طور کامل مورد بحث قرار گرفته است. درس سوم مربوط به ولتاژ عملیاتی پیل سوختی است که به تفصیل به آن پرداخته شده است. پیلهای سوختی غشای پروتونی، پیلهای سوختی قلیایی، پیلهای سوختی متانول مستقیم و پیلهای سوختی دمای بالا و متوسط از انواع مهم پیلهای سوختی هستند که به ترتیب، در درسهای چهارم تا هفتم معرفی شدهاند.
- برای دیدن فیلم آموزش پیل های سوختی – مفاهیم و ساختار + اینجا کلیک کنید.
اگر این مطلب برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- انواع باتری — از صفر تا صد
- انواع اینورترهای خورشیدی — به زبان ساده
- محاسبه قیمت برق از روی قبض — به زبان ساده
^^












چرا از این تکنولوژی برای تولید برق و آب برای مناطق خشک کشور استفاده نمیشه؟
گاز که داریم، باقی نیازهای این تکنولوژی هم در کشور موجوده.
سلام ، بسیار عالی بود
فقط یک سوال داشتم؟؟؟ چرا حتما باید هیدروژن با اکسیژن واکنش بدهد چرا دوباره اتم هیدروژن کامل نمیشود؟؟؟
در پیل سوختی، یون هیدروژن با اکسیژن واکنش میدهد تا آب تولید شود. این واکنش، یک واکنش اکسایش-کاهش است که در آن هیدروژن اکسید شده و اکسیژن کاهش مییابد. این واکنش، یک واکنش برگشتپذیر نیست و بنابراین، هیدروژن نمیتواند دوباره کامل شود.
سلام
خیلی ممنون از تیم خوب فرادرس که با زبانی ساده و قشنگ اکثر مفاهیم درسی رو توضیح دادید.
دمتون گرم من خیلی از وبسایت شما یاد گرفتم
با درود و سپاس برای مطالب ارزشمندی که ارائه فرمودید.بنده می خواستم بپرسم امکانش هست از مطالب موجود برای تحقیقات استفاده شود..بدون تردید با ذکر منبع
سلام.
لطفاً «شرایط استفاده از مجله فرادرس» را مطالعه کنید.
موفق باشید.
بسیار عالی
به زبان ساده و با استفاده از تصاویر مختلف بهترین آموزش را ارائه کردید.
در ذهن تثبیت شد ??
سلام.
خوشحالیم که این آموزش برایتان مفید بوده است.
سالم و سربلند باشید.
خوب
بسیار عالی بود
سپاس فراوان