ماکروفاژ چیست؟ – انواع، عملکرد و سایر دانستنی ها – به زبان ساده
ماکروفاژ سلول ایمنی ذاتی بوده که در بدن انسان و حیوانات متعلق به دسته بیمهرگان و مهرهداران وجود دارد. به نظر میرسد خون فقط یک مایع قرمز است اما دارای تعداد زیادی سلول از جمله مونوسیتها است که منشا ماکروفاژها هستند. این سلولها از طریق خون به محل عفونتها میرسند و با ورود به بافتهای مختلف مشغول مبارزه با عوامل مهاجم میشوند. در محل زخم یا بریدگی، سلولهای بافت آسیب دیده تقاضای کمک میکنند و هنگامی که رگهای خونی به مونوسیتها اجازه ورود به بافت آلوده را میدهند مقداری از پلاسمای خون نیز به داخل منطقه نفوذ میکند. این مایعات اضافی و مواد شیمیایی آزاد شده توسط سلولهای آلوده میتوانند باعث التهاب شوند. این التهاب ممکن است آزاردهنده باشد اما در این شرایط ماکروفاژها به بدن برای مبارزه با عفونت کمک قابل توجهی میکنند.
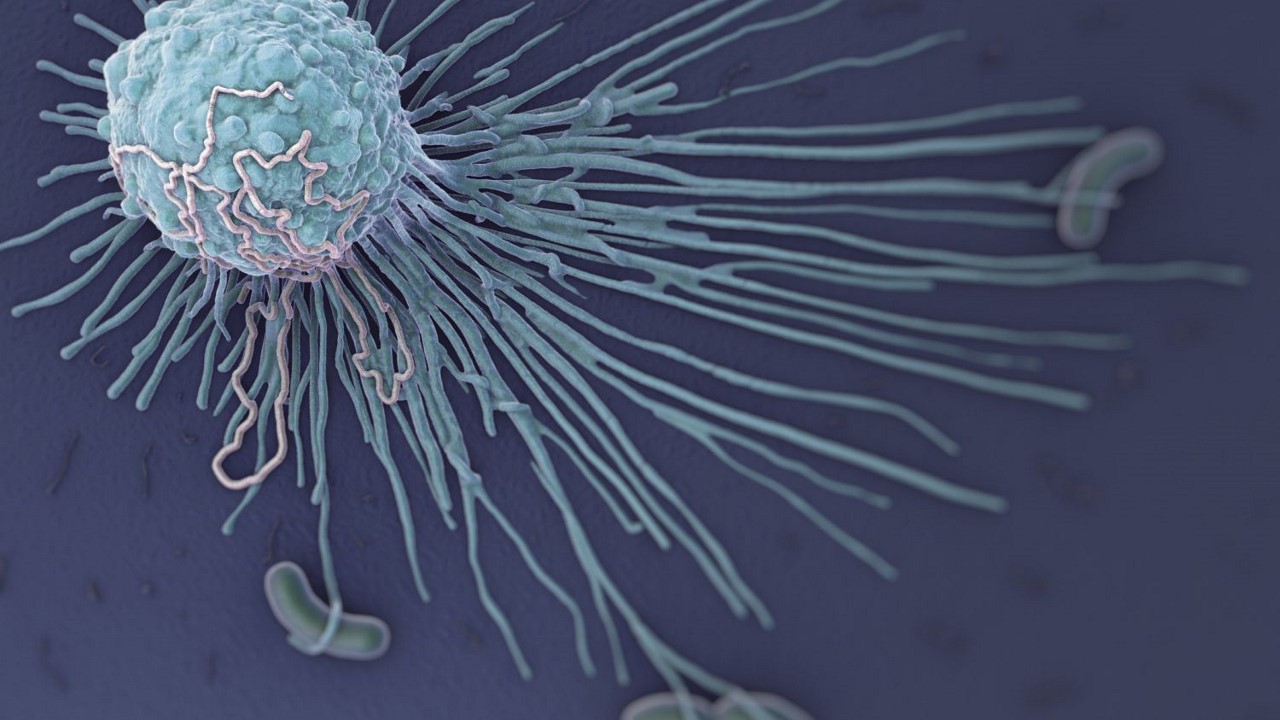
ماکروفاژ چیست؟
«ماکروفاژ» (Macrophage) نوعی سلول مخصوص بلع است، به این معنی که با بلعیدن ذرات دیگر یا سلولهای کوچکتر وظیفه خود را انجام میدهد. ماکروفاژ ها از انواع گلبولهای سفید حیاتی سیستم ایمنی بدن هستند که به طور مداوم در بافتها در حال گشتزنی هستند، سلولهای مرده و ذرات خارجی را که متعلق به بدن نیستند پیدا کرده و با فرآیند فاگوسیتوز (حالتی از بلعیدن یا ذرهخواری) آنها را از بین میبرند.
از آنجا که ماکروفاژها نمیتوانند اهداف خاصی را شناسایی کنند، بخشی از پاسخ ایمنی ذاتی در نظر گرفته میشوند. این سلولها به طور مستقیم به پاسخ ایمنی اختصاصی نیز کمک میکنند.
انواع ماکروفاژها تا حد زیادی به محل بافتی بستگی دارند که در آن حضور مییابند، به عنوان مثال در کبد، آنها به عنوان سلولهای کوپفر شناخته میشوند، همچنین در بافت چربی از آنها به عنوان ماکروفاژهای بافت چربی نیز یاد میشود. اگرچه آنها به دلیل ماهیت فاگوسیتی موثر شناخته شدهاند، اما مطالعات نشان دادهاند كه عملکرد آنها فراتر از بحثهای ایمونولوژیک است. نقش در ترمیم و متابولیسم بافت نمونههایی از برخی عملکردهای غیر ایمونولوژیک ماکروفاژها در بافتهای مختلف بدن هستند.
منشأ ماکروفاژ کجاست؟
برای مدت زمان طولانی، ماکروفاژ ها به عنوان مونوسیتهای موجود در بافت توصیف میشدند. به همین ترتیب، آنها عمدتاً به عنوان اشکال متمایز شده مونوسیتها در بافتهای مختلف بدن حضور داشته و فعالیت میکردند، اما مطالعات جدید نشان میدهند که لزوماً چنین نیست. طبق مطالعات اخیر که بر روی مونوسیتهای Ly6chi متمرکز بوده، مشخص شده است که این مونوسیتها میتوانند به داخل بافت مهاجرت کرده در حالی که به ماکروفاژ تمایز نیافته باشند.
همچنین نشان داده شد که مونوسیتها در بافت خارج عروقی، قادر به برداشتن آنتیژنها و انتقال آنها به غدد لنفاوی هستند بدون اینکه به ماکروفاژ ها متمایز شوند. علاوه بر داشتن منشأ مونوسیت موجود در گردش خون، اکنون بسیاری از مطالعات شواهدی پیدا کردهاند که نشان میدهند بخش زیادی از ماکروفاژ های موجود در بافت از پیشسازهای جنینی کیسه زرده یا کبد جنین سرچشمه میگیرند. در بزرگسالان، بسیاری از ماکروفاژ ها از مغز استخوان نشات میگیرند که این نشان میدهد هنوز یک جمعیت مشخص از ماکروفاژها ممکن است از تمایز مونوسیتها ناشی شوند.
ماکروفاژها برای انجام عملکردهای خود از طریق جریان خون و سیستم لنفاوی هر دو انتقال مییابند. ماکروفاژهای ثابت از نظر مکانی در مناطق خاصی متمرکز میشوند که بیشتر در معرض نفوذ ذرات خارجی هستند مانند ریهها یا روده، ماکروفاژ ها میتوانند در بسیاری از مناطق دیگر بدن و بافتهای مختلف مانند پوست و همچنین اعضای سیستم ایمنی بدن مانند طحال، غدد لنفاوی و مغز استخوان دیده شوند. از منظر لغوی و تاریخی، ماکروفاژها (Makros = بزرگ، فاژین = خوردن) در قرن نوزدهم توسط جانورشناس روسی «متنیکُف» (Metchnikoff)، در یک مطالعه اساسی در مورد لاروهای ستاره دریایی کشف شدند.
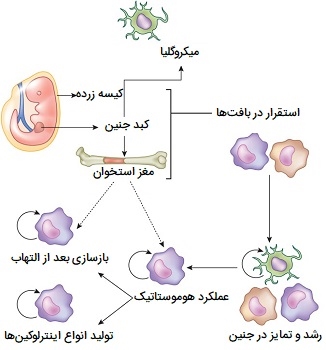
انواع ماکروفاژ ها
ماکروفاژها یک جمعیت ناهمگن از سلولهای ایمنی هستند که چندین عملکرد متنوع در پاسخهای هومواستاتیک (پاسخهای ایمنی با همکاری خون) و ایمنی بدن دارند. مونوسیتها و ماکروفاژ ها در کنار هم به عنوان یک گروه به نام سیستم فاگوسیت تک هستهای شناخته میشوند که قبلاً به عنوان سیستم رتیکولو اِندوتلیال شناخته میشدند. انواع مختلف ماکروفاژ ها با توجه به محل حضور آنها نامگذاری میشوند که در جدول زیر ذکر شدهاند.
| نام سلول ماکروفاژ | محل حضور در بدن |
| «ماکروفاژ های بافت چربی» (Adipose Tissue Macrophages) | بافت چربی |
| مونوسیتها | مغز استخوان و خون |
| «سلولهای کوپفر» (Kupffer Cells) | کبد |
| «هیستوسیتهای سینوسی» (Sinus Histiocytes) | گرههای لنفاوی |
| ماکروفاژ های آلوئولار (سلولهای گرد و غبار) | آلوئولهای (کیسههای هوایی) ریوی |
| ماکروفاژ های بافتی (هیستوسیتها) تبدیلشده به سلولهای غول پیکر | بافت همبند |
| میکروگلیا | سیستم عصبی مرکزی |
| «سلولهای هافباور» (Hofbauer Cells) | جفت |
| سلولهای مزانژیال داخل گلومرولی | کلیه |
| استئوکلاستها | استخوان |
| سلولهای اپی تلیوئید | گرانولوم (یک نوع پاسخ التهابی پوستی) |
| ماکروفاژ های پالپ قرمز (سلولهای پوشش سینوسی) | بخش قرمز طحال |
| ماکروفاژ های صفاقی | حفره صفاقی |
ماکروفاژ های بافت چربی
«ماکروفاژهای بافت چربی» (Adipose Tissue Macrophages) در بافت چربی ساکن هستند، تعداد ماکروفاژهای موجود در بافت چربی بسته به وضعیت متابولیسم متفاوت است. درصد ماکروفاژهای موجود در بافت چربی از 10 درصدِ حجمِ بافت در افراد لاغر تا تقریبا 40 درصد در انسانهای چاق متغیر است. افزایش تعداد ماکروفاژ های بافت چربی با افزایش تولید چربی مولکولهای پیش التهابی ارتباط دارد و ممکن است به عواقب آسیبشناسی وضعیت و شرایط بیمار چاق کمک کند. ماکروفاژ ها سلولهای تغییرپذیری هستند که برای سازگاری با محیطهای مختلف بافتی میتوانند طیف وسیعی از فنوتیپهای (حالتهای ظاهری) مختلف را به خود بگیرند.
بر این اساس، ماکروفاژ ها میتوانند فنوتیپهای پیش التهاب یا ضد التهابی از خود نشان دهند که به طور معمول در فنوتیپ M1 (حالت فعال کلاسیک) و فنوتیپ M2 (حالت فعال شده جایگزین) طبقهبندی میشوند. افزایش جذب ماکروفاژها در بافت چربی چند عامل دارد، مرگ سلولهای چربی بر اثر عوامل پاتولوژیک مشاهده شده در بافت چربی در حال گسترش، یکی از عوامل است. ماکروفاژ ها فاگوسیتهای ویژهای هستند که سلولهای در حال مرگ، مرده یا بقایای سلولی را از بین میبرند. در بافت چربی، وجود سلولهای چربی مرده مشخصه چاقی است. ماکروفاژهای اطراف سلولهای چربی در حال مرگ یا مرده ساختارهای تاج مانند (CLS) تشکیل میدهند.
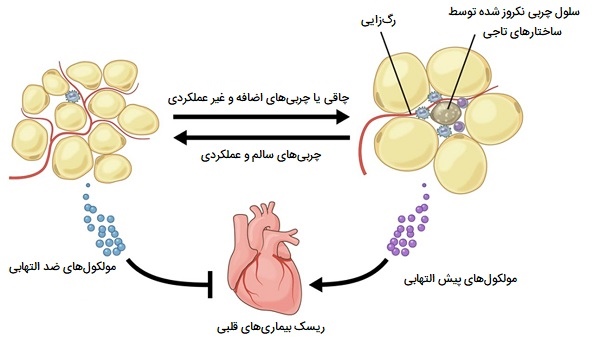
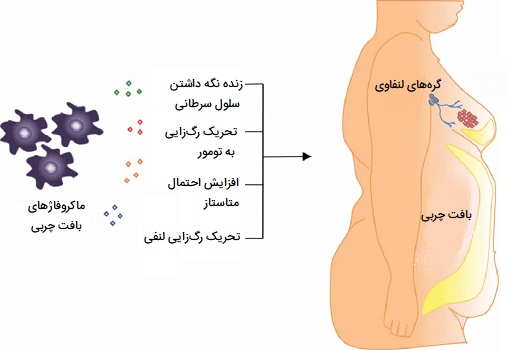
علاوه بر افزایش تعداد ماکروفاژها در بافت چربی، چاقی همچنین باعث ایجاد تغییر فنوتیپی در این سلولها به سمت فنوتیپ فعال شده کلاسیک (M1) میشود. علاوه بر این، سیتوکینهای التهابی مانند فاکتور نکروزکننده تومور آلفا توسط ماکروفاژها تولید میشود. همچنین حضور آنها به توسعه مقاومت به انسولین و ایجاد دیابت نوع 2 در افراد چاق کمک میکند. ماکروفاژهای بافت چربی جدا شده از بیماران چاق تولید کننده فاکتورهای رشد، سیتوکینها، کموکینها و آنزیمهای پروتئولیتیک در تنظیم رشد تومور، رگزایی، تهاجم و گسترش متاستاتیک و شبیه ماکروفاژهای موجود در استرومای تومور هستند.
کاهش وزن حاد نیز با افزایش و در عین حال استخدام ماکروفاژها در بافت چربی همراه است. با این حال ماکروفاژهای عملکننده پاسخ التهابی را تقویت نمیکنند بلکه لیپولیز (تجزیه تری گلیسریدها به گلیسرول و اسیدهای چرب) را تنظیم میکنند. ماکروفاژهای موجود در استرومای تومور، اصطلاحاً ماکروفاژ های مرتبط با تومور (TAMs) رشد تومور و متاستاز را تقویت میکنند.
نفوذ ماکروفاژ مرتبط با تومور به احتمال ضعیف با ابتلا به سرطان پستان، دهانه رحم، مثانه و مغز ارتباط دارد. تعامل پاتوفیزیولوژیک بین ماکروفاژهای مرتبط با تومور و سلولهای اطراف آن، مانند سلولهای اندوتلیال، پیشرفت تومور را افزایش میدهد. تحقیقات نشان دادهاند که بافت چربی اطراف تومورها بهویژه در افراد چاق، به عنوان مخزن ماکروفاژی برای ماکروفاژهایی که رگزایی به تومور را تحریک میکنند عمل میکنند.
مونوسیت ها
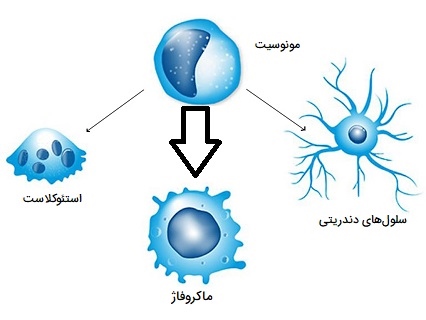
مونوسیتها نوعی لکوسیت یا گلبول سفید هستند، آنها بزرگترین نوع لکوسیتها بوده و میتوانند به ماکروفاژها و سلولهای دندریتیک از نژاد میلوئید متمایز شوند. این سلولها به عنوان بخشی از سیستم ایمنی ذاتی مهرهداران نیز بر روند ایمنی انطباقی تأثیر میگذارد. مونوسیتها از نظر ظاهری دارای شکل آمیبی (آمیبوئید) بوده و سیتوپلاسم فاقد اندامک دارند به همین دلیل به آنها آگرانولوسیتها گفته میشود. مونوسیتها 2 تا 10 درصد از کل گلبولهای سفید خونی در بدن انسان را تشکیل میدهند و نقشهای مختلفی در عملکرد ایمنی بدن دارند. چنین نقشهایی عبارتند از:
- ذخیره شدن به صورت ماکروفاژهای ساکن در شرایط عادی.
- مهاجرت در حدود 8 - 12 ساعت اول در پاسخ به سیگنالهای التهابی از محلهای عفونت در بافتها
- تمایز به ماکروفاژها یا سلولهای دندریتیک برای ایجاد پاسخ ایمنی.
در یک انسان بالغ، نیمی از مونوسیتها در طحال ذخیره میشوند، این سلولها پس از ورود به فضاهای مناسب بافتی به ماکروفاژ ها تبدیل میشوند و میتوانند در اندوتلیوم به سلولهای کف یا فوم (نوعی سلول ماکروفاژ حاوی کلسترول) تبدیل شوند. مونوسیتها همچنین میتوانند به سلولهای دندریتیک که ماده آنتیژن را پردازش و به سلولهای T ارائه میدهند، متمایز شوند. به علاوه مونوسیتها سیتوکین و کموکاین ترشح میکنند که انواع دیگر گلبولهای سفید خون را برای پاسخ فعال میکنند. حداقل سه نوع مونوسیت در خون انسان وجود دارند که شامل موارد زیر هستند:
- مونوسیت کلاسیک که با بیان سطح بالایی از گیرنده سطحی سلول به نام CD14 (یک نوع پروتئین تولیدی توسط سلول ماکروفاژ) مشخص میشود.
- مونوسیت غیر کلاسیک بیان سطح پایین CD14 و همچنین بیان گیرنده CD16 تشخیص داده میشود.
- مونوسیت حد واسط که با بیان سطح بالا CD14 و بیان سطح پایین CD16 مشخص میشود.
مونوسیتها، ماکروفاژ ها و سلولهای دندریتی سه عملکرد اصلی را در سیستم ایمنی بدن انجام میدهند که فاگوسیتوز، ارائه آنتیژنها و تولید سیتوکین هستند. فاگوسیتوز فرآیند جذب میکروبها و ذرات است که بدنبال آن هضم و تخریب آنها صورت میگیرد. مونوسیتها فاگوسیتوز را با استفاده از پروتئینهای میانجی مانند آنتیبادیها یا زائدههای پوشاننده پاتوژن و همچنین با اتصال مستقیم به میکروب از طریق گیرندههای تشخیصی عوامل بیماریزا انجام میدهند. مونوسیتها همچنین قادر به از بین بردن سلولهای میزبان آلوده به سمیت سلولیِ وابسته به آنتیبادی هستند.
تفاوت ماکروفاژ و مونوسیت چیست؟
در بیشتر موارد، تفاوت بین مونوسیتها و ماکروفاژها بر اساس موقعیت و ساختار آنها مشخص میشود. باید توجه داشت که مونوسیتها به طور معمول به مدت 1 یا 2 روز در گردش خون هستند، اما زمانی که از خون خارج شده و به ماکروفاژ تبدیل شوند در بافتهای مختلف بدن یا مایع خارج سلولی مشاهده شده و عمر بیشتری دارند. از طرف دیگر، مونوسیتها در مقایسه با ماکروفاژ ها که بزرگترین سلولهای سفید خون به شمار میروند، کوچک هستند. با توجه به اندازه، مونوسیتها قطر بین 7 تا 9 میکرومتر داشته در حالی که ماکروفاژها قطری حدود 21 میکرومتر دارند.
ماکروفاژهای کبد
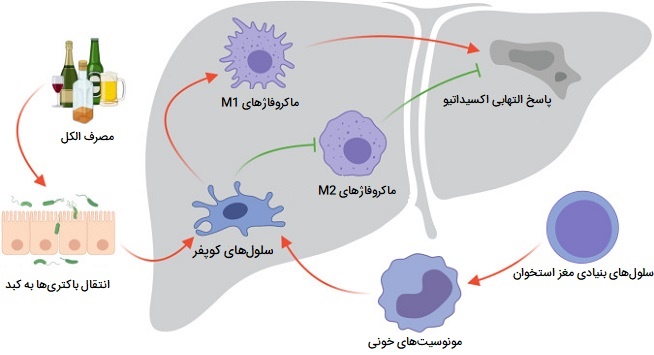
ماکروفاژ های کبد یا «سلولهای کوپفر» (Kupffer Cells) سلولهای خاصی هستند که در لومن سینوزوئیدهای کبدی (نوعی مویرگ) در کبد قرار دارند و به سلولهای اندوتلیال آنها، که دیواره رگهای خونی را تشکیل میدهند چسبیده هستند. سلولهای کوپفر بیشترین تعدادِ ماکروفاژهای ساکن بافت را در بدن دارند، آنها بخشی از سیستم فاگوسیتهای تکهستهای را تشکیل میدهند.
باکتریهای روده، اندوتوکسینهای باکتریایی و بقایای میکروبی که از دستگاه گوارش از طریق ورید پورت (سیاهرگ بزرگی که از سمت دستگاه گوارش بر میگردد) به کبد منتقل میشوند، در ابتدا با سلولهای کوپفر، اولین سلولهای ایمنی کبد در تماس خواهند بود. به همین دلیل است که هرگونه تغییر در عملکرد سلولهای کوپفر میتواند به بیماریهای مختلف کبدی مانند بیماری الکلی کبدی، هپاتیت ویروسی، کلستاز کبدی (افزایش برخی از آنزیمهای کبدی)، استئو هپاتیت، فعالسازی یا رد کبد در حین پیوند کبد و فیبروز و سیروز کبدی منجر شود.
ماکروفاژهای ریه یا آلوئولار
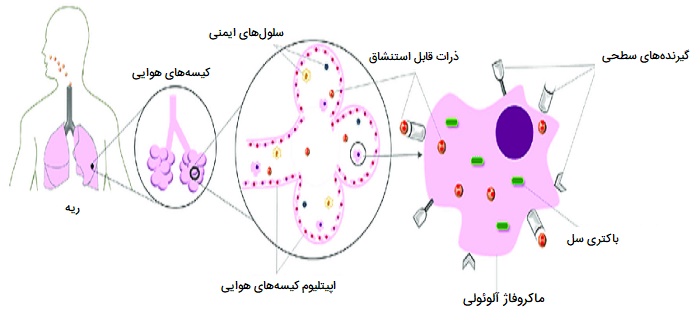
ماکروفاژ آلوئولار (یا سلول غبار) نوعی ماکروفاژ یا یک فاگوسیت حرفهای است که در حفرات کیسههای هوایی ریه، نزدیک پنوموسیتها یافت میشود، اما از دیواره جدا شده است. فعالیت ماکروفاژ های آلوئولار نسبتاً زیاد بوده، زیرا در یکی از مرزهای اصلی بین بدن و محیط خارج قرار دارند. آنها مسئول از بین بردن ذراتی مانند گرد و غبار یا میکروارگانیسمها از سطوح تنفسی هستند. ماکروفاژهای آلوئولار غالباً حاوی دانههایی از مواد بیرون رونده مانند ذرات کربن هستند که از سطوح تنفسی گرفته شدهاند. چنین گرانولهای سیاهی ممکن است به ویژه در ریههای سیگاریها یا در ریه ساکنان شهرهای آلوده دیده شوند.
ماکروفاژ های آلوئولار فاگوسیتهایی هستند که نقش مهمی در هموستازی بدن، دفاع میزبان و بازسازی بافت دارند. تراکم جمعیت آنها برای بسیاری از فرآیندها تعیینکننده است. آنها بسیار سازگار هستند و میتوانند بسیاری از مواد ترشحی را آزاد کرده تا به این ترتیب با استفاده از چندین گیرنده سطحی، با سلولها و مولکولهای دیگر ارتباط برقرار کنند. ماکروفاژهای آلوئولار همچنین در فاگوسیتوز سلولهای آپوپتوز (مرگ خود خواسته سلول) و نکروز (مرگ سلولهای بافتی) شده نقش دارند.
میکروگلیا چیست؟
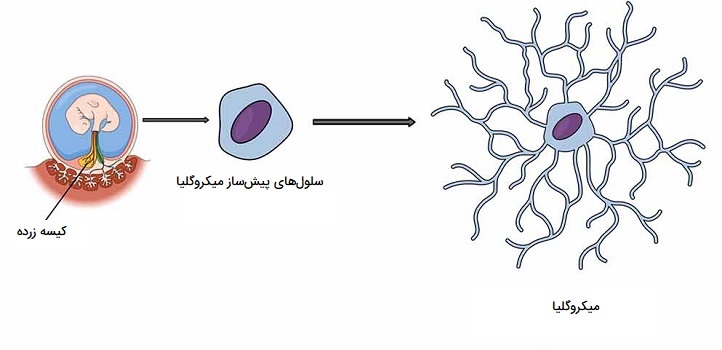
میکروگلیا نوعی سلول عصبی (سلول گلیالی) است که در سراسر مغز و نخاع وجود دارد. میکروگلیاها 10 تا 15 درصد از کل سلولهای موجود در مغز را تشکیل میدهند. به عنوان سلولهای ماکروفاژ ساکن در محل، آنها در نقش اولین و اصلیترین دفاع ایمنی فعال در سیستم عصبی مرکزی (CNS) عمل میکنند. میکروگلیا (و سایر نوروگلیاها از جمله آستروسیتها) در مناطق بزرگ و غیر همپوشان در سراسر دستگاه عصبی مرکزی توزیع میشود. میکروگلیاها سلولهای کلیدی در مراقبت کلی مغز هستند که به طور مداوم سیستم عصبی مرکزی را برای یافتن پلاکها، نورونها و سیناپسهای آسیبدیده یا غیرضروری و عوامل عفونی بررسی کرده و آنها را مهار میکنند.
از آنجا که این فرایندها باید برای جلوگیری از آسیب احتمالی مهلک کارآمد باشند، میکروگلیاها حتی به تغییرات پاتولوژیک کوچک (ورود حداقل عوامل پاتوژن) در سیستم عصبی مرکزی بسیار حساس هستند. بخشی از این حساسیت با وجود کانالهای پتاسیم منحصر به فرد حاصل میشود که حتی به تغییرات اندکی در غلظت پتاسیم خارج سلولی پاسخ میدهند. شواهد اخیر نشان میدهند که میکروگلیا همچنین نقش اصلی را در حفظ عملکرد طبیعی مغز در شرایط سالم به عهده دارند. میکروگلیا همچنین به طور مداوم عملکردهای عصبی را از طریق تماس مستقیم بدنی کنترل کرده و در صورت لزوم از اعصاب محافظت میکنند.
در هنگام ایجاد التهاب سلولهای میکروگلیایی باید سریع واکنش نشان دهند تا التهاب کاهش یابد و عوامل عفونی قبل از آسیب به بافت عصبیِ حساس، از بین بروند. به دلیل کمبود آنتیبادی در سیستم عصبی نسبت به سایر نقاط بدن (تعداد کمی از آنتی بادیها برای عبور از سد خونی مغزی به اندازه کافی کوچک هستند)، میکروگلیاها باید بتوانند اجسام خارجی را بشناسند، آنها را ببلعند و به عنوان سلولهای ارائه دهنده آنتیژن، باعث فعالسازی سلولهای T شوند.
ماکروفاژهای جفت یا سلول های هافباور
«سلولهای هافباور» (Hofbauer Cells) هیستوسیتهای ائوزینوفیل بیضی شکل دارای سیتوپلاسم فراوان و همراه با گرانولها و واکوئلهای زیادی بوده که موجود در جفت هستند و منشأ مزانشیمی دارند. این سلولها در مزودرم پُرزهای جفتی، به ویژه در اوایل بارداری زیاد هستند. اعتقاد بر این است که آنها نوعی ماکروفاژ هستند و به احتمال زیاد در جلوگیری از انتقال عوامل بیماریزا از مادر به جنین نقش دارند.
ماکروفاژهای کلیه
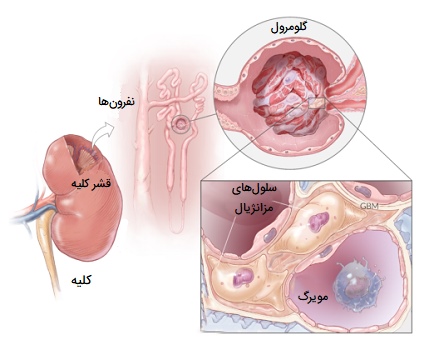
ماکروفاژ های کلیه یا سلول های مزانژیال داخل گلومرولی در بین مویرگهای گلومرولی درون هر پیکر کلیه قرار دارند. این سلولهای مزانژیال ماکروفاژهایی بوده که شبیه سلولهای پِری سیت (سلولهای بنیادی مزانشیمی) هستند. آنها به طور معمول 30 درصد از مویرگهای گلومرولی را پوشش میدهند همچنین هر دو دارای پروتئینهای وایمیتین و دِسمین هستند. پنج عملکرد شناخته شده از سلولهای مزانژیال داخل گلومرولی وجود دارد که شامل موارد زیر هستند:
- پشتیبانی ساختاری مویرگهای گلومرولی
- تنظیم میزان فیلتراسیون گلومرولی
- تشکیل ماتریکس مزانژیال
- فاگوسیتوز (ذرهخواری)
- نظارت بر غلظت گلوکز لومن مویرگی
سلولهای مزانژیال داخل گلومرولی فعالیت انقباضی دارند و شروع انقباض این سلولها مانند انواع عضله صاف است. انقباض سلولهای مزانژیال همراه با انقباض غشای پایه اندوتلیوم مویرگهای گلومرولی است. این امر باعث کاهش سطح غشای پایه و در نتیجه کاهش میزان فیلتراسیون گلومرولی میشود. سلولهای مزانژیال داخل گلومرولی ماتریکس خارج سلولی را سنتز و ترشح میکنند که این ماده حاوی فیبرونکتین، کلاژن نوع IV، پرلکان و لامینین است.
آنها یک نمونه غیر معمول از سلولهای فاگوسیتوز کننده (فاگوسیتیک) هستند که منشأ آنها عضله صاف است و حاصل بلوغ سلولهای مونوسیت نیستند. سلولهای مزانژیال داخل گلومرولی به نوتروفیلها کمک میکنند تا سلولهای مزانژیالی دیگر که تحت آپوپتوز هستند و همچنین سایر بقایای سلولی را از بین ببرند. این سلولهای داخل گلومرولی از طریق فرآیندهای ارسال شده به لومن مویرگ، غلظت گلوکز لومن مویرگی را کنترل میکنند.
استئوکلاست ها
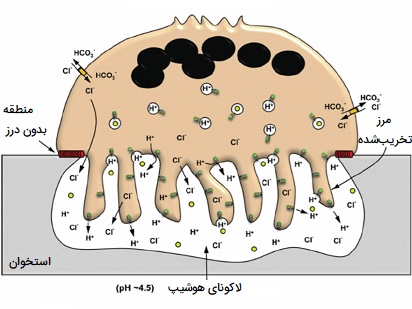
استئوکلاستها یا ماکروفاژ های شکننده بافت استخوانی نقش بسیار مهمی در مراقبت، تعمیر و بازسازی بافت استخوانی ستون فقرات دارند. این سلولها با ترشح اسید و آنزیم کلاژناز، پروتئینها و مواد معدنی هیدراته شده را در سطح مولکولی تجزیه و هضم میکنند، فرآیندی که به عنوان تحلیل استخوان شناخته میشود. این روند همچنین به تنظیم سطح کلسیم خون کمک میکند. استئوكلاستها در سطوح استخوانی كه مورد بازجذب قرار میگیرند، مشاهده میشوند، در چنین سطوحی، استئوکلاستها در فرورفتگیهای کم عمق جذبی موسوم به لاکونای هوشیپ (Howship's lacunae) قرار دارند. محلهای جذب به علت اثر فرسایشی استئوکلاستها در لایههای زیرین استخوانی ایجاد میشوند.
جذب ماتریکس استخوان توسط استئوکلاستها شامل دو مرحله است: انحلال اجزای غیر آلی (مواد معدنی) و هضم ترکیبات آلی ماتریکس استخوان. استئوكلاستها یونهای هیدروژن را به محفظه زیر استئوكلاستی پمپ میكنند و بنابراین یک محیط کوچک اسیدی ایجاد میكنند که حلالیت ماده معدنی استخوان را افزایش میدهد، در نتیجه باعث آزاد شدن و ورود مجدد مواد معدنی استخوان به سیتوپلاسم استئوکلاستها شده تا به مویرگهای اطراف منتقل شوند. پس از حذف مواد معدنی، کلاژناز و ژلاتیناز در محفظه زیر پلاستیک ترشح میشوند. این آنزیمها کلاژن و سایر اجزای آلی ماتریکس استخوان بدون کلسیم را هضم و تخریب می کنند.
محصولات تجزیه شده توسط استئوکلاستها فاگوسیتوز میشوند، این سلولها به دلیل خواص فاگوسیتوزی خود، به عنوان یک جز از «سیستم فاگوسیتهای تکهستهای» (MPS) در نظر گرفته میشوند. فعالیت استئوكلاستها توسط هورمونها و سیتوكینها كنترل میشوند. کلسیتونین، هورمونی از غده تیروئید است که فعالیت استئوکلاستی را سرکوب میکند. استئوکلاستها گیرنده «هورمون پاراتیروئید» (PTH) ندارند، با این حال این هورمون استئوبلاستها (سلولهای استخوانساز) را تحریک میکند تا سیتوکین موسوم به عامل تحریک استئوکلاست که یک محرک قوی فعالیت استخوانسازی است را ترشح کند. یک ادنتوکلاست، سلولی استئوکلاستی است که با جذب ریشه دندانهای شیری مرتبط است.
سلول های اپی تلیوئید
طبق یک دیدگاه مشترک سلولهای اپی تلیوئید (که هیستوسیتهای اپی تلیوئید نیز نامیده میشوند) مشتقات ماکروفاژهای فعال شده بوده و شبیه سلولهای اپیتلیال (بافت پوششی) هستند. از نظر ساختاری، سلولهای اپی تلیوئید به صورت کشیده با سیتوپلاسم ائوزینوفیلیک (دانهدار) کمرنگ و هسته مرکزی بیضیشکل یا کشیده بوده، که چگالی کمتری نسبت به لنفوسیتها دارند. بارزترین ویژگی این سلولها داشتن دستگاه گلژی وسیع است، حدود 6 بخش گلژی همراه با چندین وزیکول صاف و دانهدار ممکن است در این سلولها وجود داشته باشند. سلولهای اپی تلیوئید دارای غشای سلولی کاملاً پیکربندی شده در آرایههای زیپمانند هستند که سلولهای مجاور را به هم پیوند میدهند.
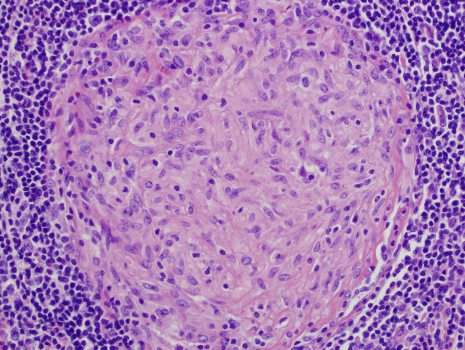
این سلولها در تشکیل گرانولومها (گرانولوم سلول اپیتلیوئید را میتوان به عنوان مجموعهای از سلولهای اپی تلیوئید، ماکروفاژها، لنفوسیتها و سلولهای دندریتیک تعریف کرد، که با بسیاری از بیماریهای جدی مرتبط هستند)، نقش اصلی را بر عهده دارند. تشکیل گرانولوم در مقابله با آن دسته از عوامل بیماریزا اتفاق میافتد که یاد گرفتهاند به روشهای مختلف مانند مقاومت در برابر فاگوسیتوز و از بین بردن ماکروفاژها از سیستم ایمنی میزبان عبور کنند.
قابلیت هضم ماده توسط ماکروفاژها از ویژگیهای مشترک التهاب گرانولوماتوز است. گرانولوماها سعی میکنند این موجودات را احاطه کرده و از رشد و گسترش بیشتر آنها جلوگیری کنند. بیماریهای خطرناک و گسترده در طول تاریخ از جمله سل، جذام و سفلیس و بیماریهای جدیدتر مانند عفونتهای قارچی، سارکوئیدوز (یک نوع بیماری التهابی با علت عصبی) و بیماری کرون از شرایط گرانولوماتوز هستند.
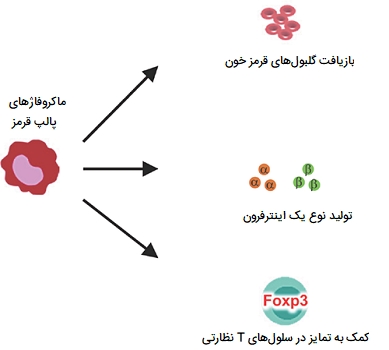
ماکروفاژهای پالپ قرمز
این سلولها فاگوسیتهای تکهستهای هستند که در طحال وجود دارند و به عنوان «ماکروفاژهای پالپ قرمز» (RPMs) شناخته میشوند. آنها برای حفظ هموستازی در خون برای انجام فاگوسیتوز گلبولهای قرمز آسیبدیده و پیر و ذرات منتقل شده از خون لازم هستند. شواهد نشان میدهند که ماکروفاژهای پالپ قرمز عمدتا در طی جنینزایی تولید شده و در طول زندگی بزرگسالان حفظ میشوند. این نوع ماکروفاژ ها از طریق بیان فاکتور رشد بِتا قادر به ایجاد تمایز در سلولهای T نظارتی هستند. آنها همچنین میتوانند در هنگام عفونتهای انگلی، اینترفرونهای نوع 1 ترشح کنند. خون در عروق به «تارهای بیلروت» (Billroth's Cords) یا تارهای پالپ قرمز ختم میشود.
این تارها از فیبروبلاستها و الیاف شبکهای تشکیل شدهاند که یک سیستم خون باز و بدون پوشش اندوتلیال تشکیل میدهند، در داخل این سیمها ماکروفاژهای F4 پیدا میشوند که با سلولهای مشبک این مناطق در ارتباط هستند و در مجموع به عنوان ماکروفاژ های پالپ قرمز شناخته میشوند. خون از طنابهای بیلروت به داخل سینوسهای وریدی پالپ قرمز که با اندوتلیوم ناپیوسته و همچنین الیاف گسترشیافته در زیر غشای پایه به موازات محور سلولی پوشانده شده، منتقل میشوند.
این آرایش الیاف کششی همراه با آرایش موازی سلولهای اندوتلیال سینوسی، خون را در پالپ قرمز از طریق شکافهایی که توسط الیاف تنش ایجاد میشود، گیر میاندازد، بنابراین محل عبور برای گلبولهای قرمز پیر دشوار شده و در تارها گیر کرده و متعاقباً توسط ماکروفاژ های پالپ قرمز فاگوسیتوز میشوند. این فرآیند به عنوان اریترو فاگوسیتوز شناخته میشود که برای بازگرداندن سلولهای قرمز خون و بازیافت آهن مهم است، این عملکرد مهم ماکروفاژها با استفاده از ساختار خاص پالپ قرمز امکان پذیر است. آهن موجود در گلبولهای قرمز توسط ماکروفاژهای پالپ قرمز آزاد شده یا به صورت فریتین در خود گلبول قرمز ذخیره میشود.
همچنین، گلبول قرمز میتواند مقادیر بیشتری آهن را به شکل هموسیدرین (مجموعهای نامحلول از فریتین که تا حدی تخریب شده) ذخیره کند که رسوبات زیادی از این ماده را میتوان در ماکروفاژهای خمیر قرمز مشاهده کرد. ماکروفاژهای پالپ قرمز همچنین با جمعآوری هموگلوبینهای آزاد شده از گلبولهای قرمز ناشی از تخریب داخل عروقی و هاپتوگلوبین، آهن را از طریق اندوسیتوز به دست میآورند. آهن ذخیره شده در ماکروفاژهای طحال مطابق با نیاز مغز استخوان آزاد میشود.
ماکروفاژها فاگوسیتهای حرفهای هستند و در از بین بردن سلولهای مرده و بقایای سلولی بسیار تخصص دارند. این نقش در التهاب مزمن مهم است، زیرا مراحل اولیه التهاب تحت سلطه نوتروفیلها بوده که این سلولها پس از بلوغ توسط ماکروفاژها بلعیده میشوند. نوتروفیل ها در اولین مقابله با التهاب حضور دارند که پس از انجام عملکرد خود، بعد از حدود ۴۸ ساعت، میمیرند و توسط ماکروفاژ ها فاگوسیته میشوند. از بین بردن سلولهای در حال مرگ و بلعیدن مواد خارجی مانند عوامل بیماریزا و در صورت لزوم جذب ماکروفاژ های اضافی، همگی توسط ماکروفاژهای ثابتی انجام میشود، که در مکانهای استراتژیک مانند ریهها، کبد، بافت عصبی، استخوان، طحال و بافت همبند باقی خواهند ماند.
هنگامی که یک ماکروفاژ یک عامل بیماریزا را میبلعد، عامل بیماری در فاگوزوم (کیسه) محبوس میشود و سپس با لیزوزوم (کیسه حاوی آنزیم) جوش میخورد. در داخل فاگولیزوزوم، آنزیمها و پراکسیدهای سمی عامل بیماریزا را هضم میکنند، با این حال، برخی از باکتریها مانند «مایکوباکتریوم توبرکلوزیس» (Mycobacterium tuberculosis) در برابر این روشهای هضم مقاوم شدهاند. ماکروفاژها میتوانند بیش از 100 باکتری را هضم کنند تا اینکه بالاخره به دلیل ترکیبات گوارشی خود از بین بروند. علاوه بر نقش ایمنی، ماکروفاژ ها همچنین در تعدادی از عملکردهای غیر ایمونولوژیکی متفاوت نیز درگیر هستند که انواع عملکرد هموستازی تا بازسازی بافت را شامل میشوند.
انواع ماکروفاژها بر اساس عملکرد
ماکروفاژها در انواع فنوتیپ وجود دارند و با نقشی که در بلوغ زخم بازی میکنند تعیین میشود. فنوتیپها را میتوان به دو دسته عمده تقسیم کرد که شامل M1 و M2 هستند. علیرغم تنوع در روشهای فعالسازی ماکروفاژ ها چندین فرم فعال از آنها وجود دارندکه در ادامه به توضیح هر کدام از آنها پرداختهایم.
ماکروفاژ M1 چیست؟
ماکروفاژ های M1 فنوتیپ غالب مشاهده شده در مراحل اولیه التهاب هستند و توسط سه واسطه اصلی فعال میشوند: «اینترفرون گاما» (IFN - γ)، «فاکتور نکروز تومور» (TNF) و «الگوهای مولکولی مرتبط با آسیب» (DAMPs). ماکروفاژهای M1 یا قاتل (قبلاً به عنوان ماکروفاژ های فعال شده کلاسیک نامیده میشدند) سطح بالایی از اینترلوکین - ۱۲ و سطح پایین اینترلوکین - ۱۰ را ترشح میکنند. این مولکولهای واسطه، یک پاسخ پیش - التهابی ایجاد میکنند به این ترتیب که منجر به تولید سیتوکینهای پیش - التهابی مانند اینترلوکین - 6 و فاکتور نکروز تومور میشوند. ماکروفاژهای M1 دارای عملکردهای پیش - التهابی، ضد باکتریایی و فاگوسیتی هستند.
ماکروفاژهای M2
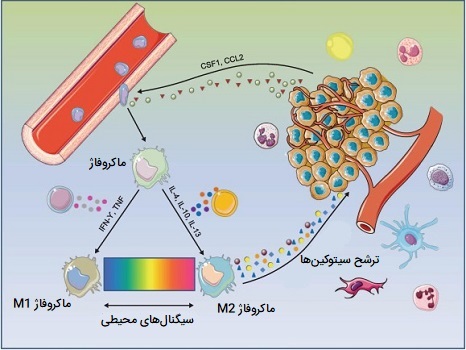
نوعی دیگر از ماکروفاژ های فعال وجود دارند که M2 یا تعمیری (همچنین به عنوان ماکروفاژهای فعال کننده جایگزین نیز شناخته میشوند) نامیده میشوند و به طور گستردهای به ماکروفاژهایی گفته میشوند که در فرآیندهای سازنده مانند ترمیم زخم و ترمیم بافت فعالیت میکنند و آنهایی که فعالسازی سیستم ایمنی بدن را از طریق تولید سیتوکینهای ضد التهابی (مانند اینترلوکین - ۱۰) خاموش میکنند. ماکروفاژ های M2 با تولید و ترشح اینترلوکین - 4 یا اینترلوکین - 13 پاسخی ضد التهابی ایجاد میکنند. M2 شکل ظاهری ماکروفاژهای ساکن بافت است، همچنین ماکروفاژهای مرتبط با تومور عمدتا از فنوتیپ M2 هستند و به نظر میرسد به طور فعال رشد تومور را تقویت میکنند. این سلولها بر اساس نقشهایشان به چهار نوع M2c ، M2b ، M2a و M2d تقسیم میشوند.
یک تغییر فنوتیپ از ماکروفاژهای M1 به M2 در زخمهای حاد وجود دارد اما این تغییر برای زخمهای مزمن ضعیف عمل میکند. این بینظمی منجر به ایجاد ماکروفاژ های M2 ناکافی و در نتیجه سیتوکینهای ضدالتهابی ترمیمکننده زخم خواهد شد، با کمبود این سیتوکینهای ضدالتهاب و وجود تعداد زیاد سیتوکینهای پیش التهاب تولید شده توسط ماکروفاژهای M1، زخمهای مزمن قادر به بهبود به موقع نیستند.
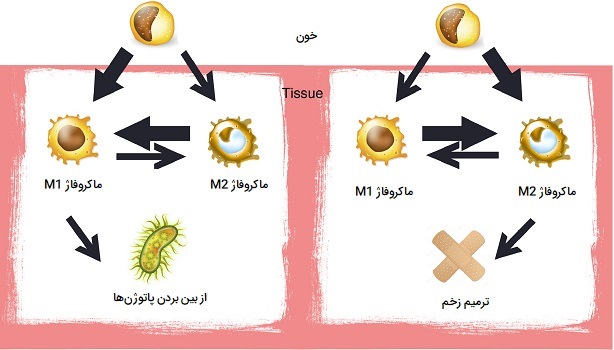
اعمال مختلف ماکروفاژها
ماکروفاژها سلولهای بسیار ناهمگونی هستند که میتوانند در پاسخ به سیگنالهای ریز محیطی عملکرد خود را به سرعت تغییر دهند. اگرچه زیرمجموعههای ماکروفاژ مجزا با تواناییهای عملکردی منحصر به فرد توصیف شدهاند، اما به طور کلی اعتقاد بر این است که ماکروفاژها به جای زیر جمعیتهای پایدار گسسته، طیفی از فنوتیپهای فعالشده را نشان میدهند. آنها فنوتیپهای وابسته به زمینه را که باعث تقویت یا جلوگیری از دفاع ضد میکروبی میزبان، پاسخهای ایمنی ضد تومور و پاسخهای التهابی میشوند را اتخاذ میکنند. با توجه به شرایط مختلف فیزیکی بدن و اندامها، ماکروفاژها عملکردهای مختلفی را انجام میدهند که در ادامه درباره آنها توضیح داده شده است.
نقش ماکروفاژها در گرفتگی عروق
هر دو گروه ماکروفاژهای M1 و M2 در افزایش تصلب شرایین نقش دارند. ماکروفاژهای M1 با التهاب باعث تصلب شرایین میشوند، ماکروفاژ های M2 میتوانند کلسترول را از رگهای خونی حذف کنند، اما وقتی کلسترول اکسید میشود، ماکروفاژهای M2 به «سلولهای کفمانند آپوپتوتیک» (Apoptotic Foam Cells) تبدیل میشوند که در تشکیل «پلاک آتروماتوز» (Atheromatous Plaque) نقش دارند. این نوع پلاک بر اثر تجمع غیر طبیعی مواد در لایه داخلی دیواره شریان ایجاد شده و باعث گرفتگی عروق میشوند.
نقش ماکروفاژها در ترمیم عضلات
اولین قدم برای درک اهمیت ماکروفاژها در ترمیم، رشد و بازسازی عضلات، این است که با شروع استفاده از عضلات آسیبپذیر، دو موج ماکروفاژی ایجاد میشوند. موج اولیه یک جمعیت فاگوسیتیک است که طی دورههای افزایش استفاده از عضلات که با تجزیه و التهاب غشای عضلانی وارد سلولهای ماهیچهای آسیبدیده شده و محتویات داخلی فیبرهای آسیبدیده عضلانی را تجزیه میکنند. این ماکروفاژهای متجاوز فاگوسیتیک حدود 24 ساعت پس از شروع آسیب یا بارگیری سلول عضلانی به بالاترین غلظت خود رسیده و غلظت آنها پس از 48 ساعت به سرعت کاهش مییابند.
گروه دوم انواع غیر فاگوسیتیک هستند که در نزدیکی رشتههای احیا کننده توزیع میشوند، این سلولها بین دو تا چهار روز به اوج خود میرسند و در طی بازسازی بافت عضلانی برای چندین روز در سطح بالا باقی میمانند. تصور بر این است که ماکروفاژها مواد محلولی را آزاد میکنند که بر تکثیر، تمایز، رشد، ترمیم و بازسازی عضلات تأثیر میگذارند. این ویژگی ترمیم بافتی ماکروفاژ ها فقط مختص بافت ماهیچهای نیست و در بسیاری دیگر از اندامهای بدن انسان این سلولها نقش ترمیم و بازسازی را بر عهده دارند.
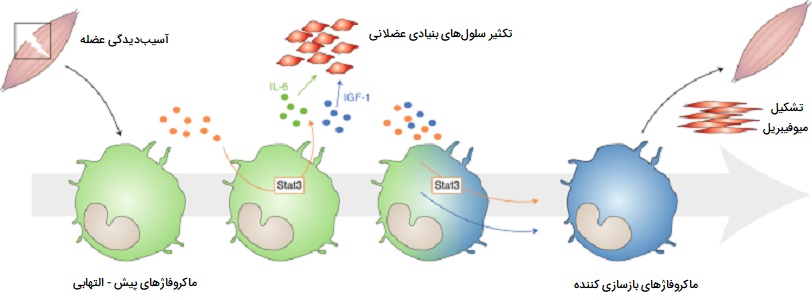
نقش ماکروفاژها در ترمیم زخم
ماکروفاژ ها برای ترمیم زخم ضروری هستند، آنها تا دو روز پس از آسیب به عنوان سلولهای غالب در زخم، جایگزین نوتروفیلهای دارای هسته چندقسمتی میشوند. مونوسیتهای موجود در جریان خون از طریق فاکتورهای محرک آزادشده توسط پلاکتها و سلولهای دیگر به محل زخم جذب شده و و از دیواره رگهای خونی وارد منطقه میشوند.
تعداد مونوسیتهای موجود در زخم یک تا یک و نیم روز پس از آسیبدیدگی به اوج خود میرسند. این مونوسیتها پس از قرار گرفتن در محل زخم، به ماکروفاژهای بالغ تبدیل میشوند. طحال حاوی نیمی از مونوسیتهای ذخیره شده در بدن است که آماده استفاده در بافت آسیب دیده هستند.
نقش اصلی ماکروفاژ، فاگوسیت کردن (بلعیدن) باکتریها و سلولهای بافتی آسیبدیده است و همچنین بافتهای تخریب شده را با آزادسازی پروتئازها از بین میبرند. ماکروفاژها همچنین تعدادی از فاکتورها مانند فاکتورهای رشد و سایر سیتوکینها را به خصوص در روزهای سوم و چهارم پس از زخم ترشح میکنند. این عوامل سلولهای درگیر در مرحله تکثیر برای بهبودی را به منطقه جذب میکنند. ماکروفاژ ها با کمبود اکسیژن در محیط اطراف خود تحریک شده و عواملی را تولید میکنند که باعث رگزایی و افزایش سرعت ترمیم زخم شده و همچنین سلولهایی را تحریک کرده که باعث تولید مجدد سلولهای بافت پوششی محل زخم میشوند. با ترشح این عوامل، ماکروفاژ ها به تسریع روند ترمیم زخم و رفتن به مرحله بعدی التیام کمک میکنند.
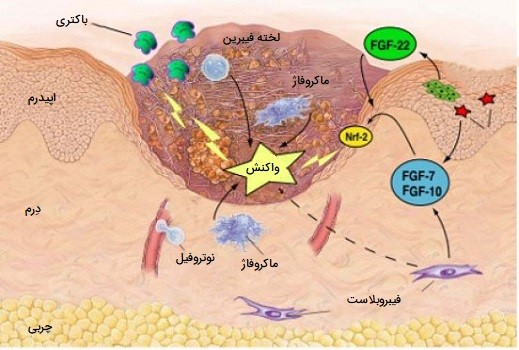
نقش ماکروفاژها در بازسازی اندام
دانشمندان در تحقیقات خود کشف کردهاند که ماکروفاژها علاوه بر خوردن عوامل پاتوژن، بقایای سلولهای مرده و بافتهای تخریبشده، در بازسازی طبیعی اندامها در گونهای از سمندر نقش دارند. تحقیقات به این ترتیب بود که برداشتن ماکروفاژ ها از سمندر منجر به عدم موفقیت در بازسازی اندام و پاسخ ترمیم زخم میشود.
نقش ماکروفاژها در هموستاز آهن
عمر گلبولهای قرمز به طور متوسط 120 روز است و بنابراین به طور مداوم توسط ماکروفاژها در طحال و کبد از بین میروند. ماکروفاژها همچنین ماکرومولکولها را بلعیده و از این رو در فارماکوکینتیک (فرآیند جذب داروها توسط بدن و انتقال بیولوژیکی آنها در بدن طی یک دوره زمانی) قرصها و مکملهای آهن نقشی اساسی دارند.
آهن آزادشده از هموگلوبین یا به صورت داخل سلولی در فریتین (یک پروتئین درون سلولی که آهن را ذخیره کرده و به صورت کنترل شده آزاد میکند) ذخیره میشود یا از طریق فروپورتین (یک پروتئین غشایی که آهن را از داخل سلول به خارج سلول منتقل میکند) در گردش خون آزاد میشود. در مواردی که سطح آهن سیستمیک افزایش یابد یا التهاب وجود داشته باشد، افزایش سطح هپسیدین در کانالهای فروپورت ماکروفاژ منجر به باقی ماندن آهن در ماکروفاژها میشود.
نقش ماکروفاژها در حفظ رنگدانه ها
ملانوفاژها زیرمجموعهای از ماکروفاژ های ساکن بافت هستند که قادر به جذب رنگدانه بومی بدن یا خارج از آن (مانند خال کوبی) از فضای خارج سلول هستند. بر خلاف ملانوسیتهای جانبی دندریتیک (سلولهای تولید کننده ملانین در لایه زیرین اپیدرم پوست)، که ملانوزومها (گرانولهای داخل سلولی حاوی ملانین) را سنتز میکنند و در مراحل مختلف رشد آنها نقش دارند، ملانوفاژها فقط ملانین فاگوسیتوز شده را در کیسههای شبیه لیزوزوم جمع میکنند. این روند به طور مکرر اتفاق میافتد که رنگدانه ماکروفاژ های پوستی مرده توسط جانشینان آنها فاگوسیتوز میشود و در نتیجه تاتوی زده شده بر روی بدن را در همان مکان حفظ میکند.
نقش ماکروفاژها در هموستاز بافت
هر بافتی جمعیت خاصی از ماکروفاژهای ساکن را نگه میدارد که این سلولها پیوندهای متقابل را با استروما (بافتهای ارتباطی و ساختاری مانند عروق و بافت پیوندی) و بافت عملکردی برقرار میکنند. این ماکروفاژهای ساکن، غیر مهاجر بوده و فاکتورهای اساسی رشد را برای حمایت از عملکرد فیزیولوژیکی بافت فراهم میکنند (به عنوان مثال ارتباط متقابل عصبی در سیستم گوارش) و میتوانند به طور فعال از بافت در برابر آسیب التهابی محافظت کنند.
اهمیت ماکروفاژها در بیماری ها چیست؟
به دلیل نقش آنها در فاگوسیتوز، ماکروفاژها در بسیاری از بیماریهای ایجاد شده در سیستم ایمنی بدن نقش دارند. به عنوان مثال، ماکروفاژ ها در تشکیل گرانولوم (تجمع ماکروفاژی در پاسخ به التهاب مزمن) ضایعات التهابی که ممکن است در تعداد زیادی بیماری ایجاد شود، شرکت میکنند. ماکروفاژ به عنوان میزبان عوامل بیماریزای داخل سلولی و فاگوسیتی مسئول بلع و از بین بردن آنها است.
برخی از عوامل بیماریزا این روند را خراب کرده و در داخل ماکروفاژ زندگی میکنند. این شرایط یک محیط را فراهم میکند که در آن پاتوژن از سیستم ایمنی بدن پنهان شده و به همانندسازی و تکثیر میپردازد. بیماریهای با این الگوی رفتاری شامل سل (ناشی از مایکوباکتریوم توبرکلوزیس) و سالک (ناشی از گونههای لیشمانیا) هستند.
به منظور به حداقل رساندن احتمال تبدیل شدن به میزبان باکتریهای داخل سلولی، ماکروفاژها مکانیسمهای دفاعی مانند القای اکسیدِ نیتریک و واسطههای اکسیژن فعال را انجام میدهند که برای میکروبها سمی هستند. ماکروفاژها همچنین توانایی محدود کردن میزان مواد غذایی میکروب و القا اتوفاژی (از بین بردن اجزای ناکارآمد داخل سلولی) را دارند.
نقش ماکروفاژ در بیماری سل
هنگامی که عامل بیماری سل، مایکوباکتریوم توبرکلوزیس توسط ماکروفاژ به دام انداخته شود، از دفاع سلولی اجتناب کرده و از سلول ماکروفاژ برای تکثیر استفاده میکند. شواهد اخیر نشان میدهد که در پاسخ به عفونت ریوی مایکوباکتریوم توبرکلوزیس، ماکروفاژهای محیطی به فنوتیپ M1 بالغ میشوند. فنوتیپ ماکروفاژ M1 با افزایش ترشح سیتوکینهای پیش التهابی (اینترلوکین - ۱ - بتا، فاکتور نکروز توموری آلفا و اینترلوکین - ۶) و افزایش فعالیتهای گلیکولیتیک برای پاکسازی عفونت مشخص میشود.
نقش ماکروفاژها در بیماری سالک
پس از فاگوسیتوز انگل لیشمانیا توسط ماکروفاژ، عامل بیماری خود را در یک واکوئل فاگوسیتیک مییابد. در شرایط عادی این واکوئل فاگوسیتیک به یک لیزوزوم تبدیل شده و محتوای آن هضم میشود. لیشمانیا این روند را تغییر میدهد و از تخریب و هضم آنزیمی جلوگیری میکند. در عوض، این انگل در داخل واکوئل محل سکونت ایجاد کرده و در سلول ماکروفاژ تکثیر میشود که در مراحل بعدی و با توجه به نوع خصوصیات بافت درگیر، تظاهرات بالینی بیماری نیز متفاوت میشود.
نقش ماکروفاژ در سایر بیماری های عفونی
عفونت ماکروفاژها در مفاصل با التهاب موضعی در حین و بعد از مرحله حاد «چیکونگونیا» Chikungunya (ناشی از CHIKV یا ویروس چیکونگونیا) همراه است. در یک تحقیق آنتی ژن ویروسی و RNA ویروسی در ماکروفاژها در مفصل سینوویال فردی که 18 ماه پس از عفونت اولیه دچار عود بیماری اسکلتی عضلانی شده است، پیدا شد. آدنوویروسها (شایعترین علت بیماری چشم صورتی) میتوانند 6 تا 18 ماه پس از عفونت اولیه در ماکروفاژ میزبان به صورت نهفته باقی بمانند. گونه بروسلا از طریق مهار همجوشی فاگوزوم - لیزوزوم میتواند در ماکروفاژ پنهان بماند و باعث تب مالت (تب غیرطبیعی) شود.
نقش ماکروفاژ در بیماری قلبی
ماکروفاژها سلولهای غالب در ایجاد ضایعات پیشرونده پلاک آترواسکلروز هستند. به کارگیری موضعی ماکروفاژها پس از شروع سکته قلبی حاد رخ میدهد. این ماکروفاژها برای از بین بردن بقایای سلولهای آپوپتوتیک و آماده شدن برای بازسازی بافت عمل میکنند.
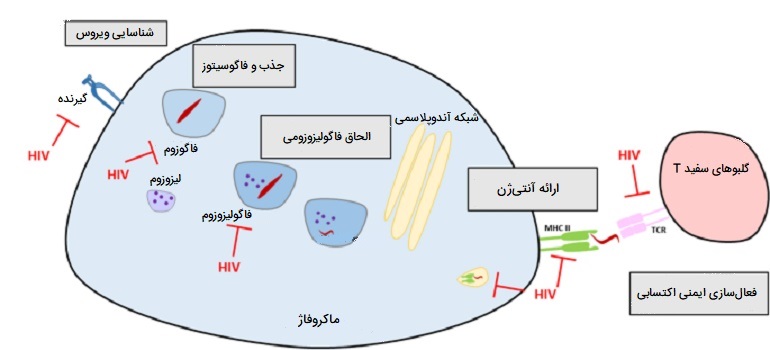
نقش ماکروفاژ در عفونت HIV
ماکروفاژها همچنین در عفونت ویروسی نقص ایمنی انسانی (HIV) نقش دارند. مانند سلولهای T، ماکروفاژها نیز میتوانند به HIV آلوده شوند، و حتی به مخزنی برای تکثیر ویروس در حال حمله در بدن تبدیل شوند. ویروس HIV میتواند از طریق اتصال gp 120 به CD4 و گیرنده غشایی ثانویه CCR5 (گیرنده کموکاین) وارد ماکروفاژ شود. مونوسیتهای در گردش و ماکروفاژها به عنوان مخزنی برای ویروس عمل میکنند. ماکروفاژها بهتر از سلولهای CD4 + میتوانند در برابر عفونت توسط HIV - 1 مقاومت کنند، اگرچه حساسیت به عفونت HIV در زیرگروههای ماکروفاژی متفاوت است.
نقش ماکروفاژ در سرطان
ماکروفاژها میتوانند با رشد و تکثیر سلولهای تومور، ترویج رگزایی تومور و سرکوب سلولهای ایمنی ضد تومور، به رشد و پیشرفت تومور کمک کنند. این سلولها با جذب سلولهای تومور هایپوکسیک (گرسنه اکسیژن) و نکروزکننده تومور، التهاب مزمن را ایجاد میکنند. ترکیبات التهابی مانند فاکتور نکروز تومور آلفا آزاد شده توسط ماکروفاژها عامل هستهای سوییچ ژن کاپا B را فعال میکنند، سپس این عامل هستهای وارد هسته سلول توموری میشود و تولید پروتئینهای متوقف کننده آپوپتوز (مرگ سلولی) را متوقف کرده و باعث تکثیر و التهاب سلول میشوند.
علاوه بر این، ماکروفاژها به عنوان منبعی برای بسیاری از فاکتورهای ضد رگزایی از جمله فاکتور اندوتلیال عروقی (VEGF)، فاکتور نکروز تومور آلفا، فاکتور محرک کلونی ماکروفاژ (M - CSF یا CSF1) و اینترلوکین ۱ و ۶ به رشد تومور کمک میکنند. بررسیها نشان دادهاند که ماکروفاژها در تراوشات تعدادی از تومورها دیده شدهاند. تعداد آنها با پیشبینی ضعیف برخی سرطانها از جمله سرطانهای پستان، دهانه رحم، مثانه، مغز و پروستات ارتباط دارد. تصور میشود ماکروفاژهای مرتبط با تومور (TAMs) یک فنوتیپ M2 بدست میآورند و به رشد و پیشرفت تومور کمک میکنند.
تحقیقات در مدلهای آزمایشگاهی مختلف مطالعه نشان میدهند که ماکروفاژها گاهی اوقات میتوانند عملکردهای ضد توموری پیدا کنند. به عنوان مثال، ماکروفاژها ممکن است دارای فعالیت سیتوتوکسیک برای از بین بردن مستقیم سلولهای تومور باشند، همچنین همکاری سلولهای T و ماکروفاژها برای سرکوب تومورها مهم است. این همکاری نه تنها شامل تماس مستقیم سلول T و ماکروفاژ با ارائه آنتیژن است، بلکه شامل ترشح ترکیبات کافی سیتوکین است که فعالیت ضد توموری سلول T را افزایش میدهند.
نقش ماکروفاژ در چاقی
مشاهده شده است که افزایش تعداد ماکروفاژهای پیش التهاب در بافت چربی افراد چاق به عود عوارض چاقی از جمله مقاومت به انسولین و ابتلا به دیابت نوع 2 کمک میکنند. تعدیل وضعیت التهابی ماکروفاژهای بافت چربی به عنوان یک هدف درمانی ممکن برای درمان بیماریهای مرتبط با چاقی در نظر گرفته شده است. در یک فرد چاق برخی سلولهای چربی منفجر شده و دچار مرگ نکروز میشوند، که باعث تبدیل ماکروفاژهای ساکن M2 به فنوتیپ M1 میشوند. این یکی از دلایل حالت التهابی مزمن سیستمیک همراه با چاقی است.
نقش ماکروفاژ در بیماری التهابی روده
ماکروفاژ های روده اگرچه از نظر ساختار بسیار شبیه به ماکروفاژ های بافتی هستند، اما با توجه به محیط طبیعی خود که در دستگاه گوارش است، ویژگیها و عملکردهای خاصی را طی تکامل به دست آوردهاند. ماکروفاژها به طور کلی و ماکروفاژهای رودهای خاصیت انعطافپذیری بالایی دارند و این امر باعث میشود فنوتیپ آنها با توجه به محیط تغییر کند. مانند سایر ماکروفاژها، ماکروفاژهای رودهای نیز مونوسیتهای متمایز شده هستند که باید با میکروبیوم روده همزیستی کنند. این یک چالش است زیرا باکتریهای مفید موجود در روده ممکن است عامل بیگانه شناخته شده و اهداف بالقوه فاگوسیتوز توسط ماکروفاژ باشند. برای جلوگیری از تخریب باکتریهای روده، ماکروفاژ های روده تفاوتهای کلیدی در مقایسه با سایر انواع ماکروفاژها ایجاد کردهاند.
در ابتدا باید گفت ماکروفاژهای روده پاسخ التهابی را القا نمیکنند، ماکروفاژهای بافتی سیتوکینهای التهابی مختلفی مانند اینترلوکین ۱ و ۶ و همچنین فاکتور نکروز تومور آلفا آزاد میکنند اما ماکروفاژهای روده سیتوکینهای التهابی تولید یا ترشح نمیکنند. این تغییر مستقیماً توسط ماکروفاژهای محیط رودهای ایجاد میشود. سلولهای اپیتلیال اطراف روده، فاکتور رشد بتا را آزاد میکنند که باعث تغییر ماکروفاژ پیش التهابی به ماکروفاژ غیر التهابی میشود. حتی اگر پاسخ التهابی در ماکروفاژ های روده تنظیم نشده باشد، فاگوسیتوز هنوز انجام میشود.
نشان داده شده است که ماکروفاژ های روده در «بیماری التهابی روده» (IBD) مانند «بیماری کرون» (CD) و «کولیت اولسراتیو» (UC) نقش دارند. در یک روده سالم، ماکروفاژهای روده پاسخ التهابی روده را محدود میکنند، اما در یک حالت بیماری، تعداد و تنوع ماکروفاژ های روده تغییر میکنند، این حالت منجر به التهاب روده و علائم بیماری التهابی روده میشود. ماکروفاژهای روده برای حفظ هموستاز روده بسیار مهم هستند. وجود التهاب یا پاتوژن این هموستاز را دستکاری کرده و همزمان ماکروفاژ های روده را تغییر میدهد. هنوز مکانیسم تعیینشدهای برای تغییر ماکروفاژ های روده با جذب مونوسیتهای جدید یا تغییرات دیگر در ماکروفاژهای رودهای وجود ندارد.











سلام ممنون استفاده کردیم لطفا منبع این تحقیق را هم بنویسید
با سلام خدمت شما؛
منابع این مطلب در انتها ذکر شده است.
از همراهی شما با مجله فرادرس سپاسگزاریم.
توضیحات شما ایراد داره…
ماکروفاژ ذاتا در خون وجود ندارد بلکه پس از دیاپدز مونوسیت و تغیر آن و فعال شن ژنهای تغییری ، به ماکروفاژو و دنریتیک تبدیل میشن
پس نه دندریتیک توی خون داریم نه ماکروفاژ
مشکل دوم اینکه شما لنف رو هم عرض با خون گرفتید که این هم اشتباهه
اینکه لنف از خون ناشی شده باشد دلیل بر خون بودن آن نیست
همانگونه که ادرار نیز از خون ناشی می شود ولی هم عرض با خون نیست
شاید شما فرض کنید که چون از خون ناشی و در خون مخلوط می شود ، می توان آن را هم عرض خون دانست اما بابد بگویم که ، اکسترا فلوید هم از خون ناشی و در خون مخلوط می شود ولی جزئی از آن نیست.
با تشکر
دکتر علی بابا
سلام و وقت بخیر؛
مطلب بازبینی و اصلاح شد.
از توجه، دقت و همراهی شما با مجله فرادرس سپاسگزاریم.
یعنی کتاب زیست شناسی که ما تو مدرسه میخونیم نصفش غلط هست
آخر نفهمیدیم چی درست چی غلط