قانون اول ترمودینامیک – به زبان ساده
بسیاری از نیروگاهها و موتورهای حرارتی با تبدیل کردن انرژی، کار مفید تولید میکنند. در تمامی آنها انرژی، جزئی مکانیکی را به حرکت در آورده و منجر به تولید کار میشود. این تبدیل شدن انرژی مبتنی بر قانون اول ترمودینامیک صورت میگیرد. در این مطلب قصد داریم تا این قانون را شرح دهیم.


تعریف قانون اول ترمودینامیک
برای هر سیستمی میتوان خاصیتی تحت عنوان انرژی (E) تعریف کرد. انرژی سیستم از مجموع انرژیهای جنبشی، پتانسیل، شیمیایی و انرژی داخلی () تشکیل شده است. قانون اول ترمودینامیک میگوید تغییرات انرژی یک سیستم برابر با مجموع حرارت وارد شده به آن و کار انجام شده روی سیستم است. در حقیقت میتوان گفت:
در رابطه فوق، W نشان دهنده کاری است که سیستم انجام داده و Q حرارتی است که به سیستم وارد میشود. توجه داشته باشید که در رابطه فوق، انرژیهای پتانسیل و جنبشی و درونی درون ترم E نهفته است.
در قوانین ترمودینامیکی خاصیتهای جدیدی تعریف میشوند. در قانون اول ترمودینامیک نیز خاصیتی تحت عنوان انرژی بر واحد جرم به صورت زیر قابل تعریف است. توجه داشته باشید که معمولا خاصیتهایی که بر واحد جرم هستند، با حرف کوچک نشان داده میشوند. برای نمونه میزان انتقال حرارت بر واحد جرم با q نشان داده میشود. در نتیجه میتوان تغییرات انرژی کل یک سیستم بر واحد جرم را به صورت زیر نمایش داد.
توجه داشته باشید که در اکثر کاربردهای عملی تغییرات انرژی جنبشی، پتانسیل و شیمیایی وجود ندارد. بنابراین قانون اول ترمودینامیک را میتوان به صورت زیر و بر حسب تغییرات انرژی درونی بیان کرد:
در نتیجه:
رابطه ۱
در رابطه بالا Q و W تابع مسیر هستند. منظور ما از تابع مسیر بودن این است که میزان تغییرات خاصیت، وابسته به مسیری است که آن خاصیت طی میکند. این در حالی است که میزان تغییرات انرژی درونی وابسته به حالتی است که U در ابتدا و انتهای فرآیند دارد.
برای نمونه ارتفاع، کمیتی است که تابع حالت است. اگر شما از یک کوه بالا روید، میزان صعودی که داشتهاید وابسته به ارتفاع اولیه و ارتفاع نهایی شما است. بنابراین تغییرات کمیت وابسته به مسیر را با نماد و تغییرات کمیتهای وابسته به حالت را با نماد نمایش میدهند. از این رو قانون اول ترمودینامیک در حالتی که خواص سیستم به صورت دیفرانسیلی تغییر میکند، به شکل زیر بیان میشود.
در روابط مربوط به قانون اول ترمودینامیک، علامت Q در حالتی که انرژی به سیستم وارد میشود، مثبت بوده و در حالتی که انرژی از سیستم خارج میشود، منفی در نظر گرفته میشود. به منظور تعیین علامت W نیز میتوان به همین روش عمل کرد. در حقیقت در حالتی که سیستم روی محیط اطرافش کار انجام میدهد، علامت کار مثبت و در حالتی که محیط روی سیستم کار انجام میدهد، علامتش منفی است. برای نمونه به مثالی که در ادامه ذکر شده، توجه فرمایید.
مثال ۱
سیستم سیلندر پیستونی را در نظر بگیرید که حاوی گاز نیتروژن است. فرض کنید طی فرآیندی ترمودینامیکی، سیستم ۲۰۰ ژول گرما را دریافت کرده و ۳۰۰ ژول کار روی محیط انجام میدهد. تغییرات انرژی درونی سیستم طی این فرآیند را بدست آورید. همانطور که در بالا نیز بیان شد، رابطه قانون اول را میتوان به صورت زیر نوشت:
در این مثال، سیستم گرما دریافت کرده و همچنین روی محیط کار انجام داده است. بنابراین علامت گرما، مثبت و علامت کار نیز مثبت است. با جایگذاری مقادیر در رابطه فوق داریم:
نکته مهم در قانون اول این است که انرژی درونی یک سیستم وابسته به دمای آن است، بنابراین با تغییر انرژی درونی، دمای نیتروژن نیز تغییر کرده است.
فرآیند شبهپایا
در ترمودینامیک فرآیندهایی وجود دارند که به صورت بسیار آهسته انجام میشوند. برای نمونه گازی را در نظر بگیرید که در سیستم سیلندر پیستونی قرار گرفته و به آرامی گرم میشود. این گاز فرآیندی شبه پایا را تجربه کرده. در حقیقت به فرآیندی شبه پایا گفته میشود که سیستم در هر لحظه در تعادل ترمودینامیکیش قرار گرفته باشد.
برای سیستمی که فرآیندی شبه پایا را تجربه کرده، رابطه زیر را میتوان برای کار مبادله شدهاش با محیط نوشت:
بنابراین رابطه مربوط به قانون اول نیز به صورت زیر در میآید.
رابطه ۲
برای نمونه شکل زیر سیلندر پیستونی را نشان میدهد که حاوی گاز بوده و با گذشت زمان به این گاز حرارت وارد میشود. انتقال حرارت به کندی صورت میگیرد، لذا رابطه فوق برای این سیستم صادق است.
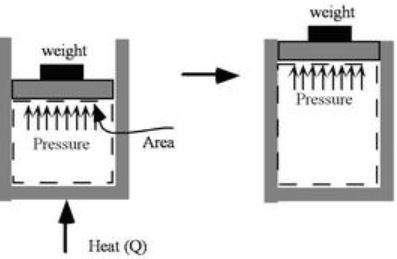
شکلی از قانون اول که با استفاده از رابطه ۲ توصیف میشود را معمولا شکل «جرم کنترل» (Mass Control) قانون اول ترمودینامیک مینامند.
نتایج قانون اول
کاری که در یک فرآیند آدیاباتیک رخ میدهد، تابعی از حالت است. در نتیجه رابطه مربوط به قانون اول را میتوان به صورت زیر بیان کرد:
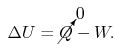
با توجه به این که تابع حالت است، بنابراین W نیز در فرآیندی آدیاباتیک، بایستی تابع مسیر باشد. برای نمونه دو نمودار ارائه شده در شکل زیر را در نظر بگیرید.
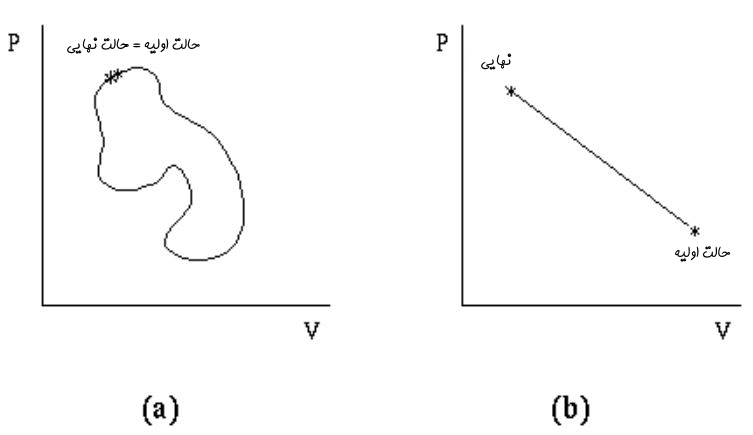
در نمودار سمت راست، خواصی همچون فشار و حجم تابع حالتاند. حال تصویر سمت چپ را در نظر بگیرید. در این نمودار، سیستم یک فرآیند بسته را طی کرده و به حالت اولیهاش برگشته است. با توجه به این که حجم و فشار تابع حالتاند، بنابراین مقدار آنها در حالت اولیه و نهایی با هم برابر هستند.
اما با توجه به اینکه کار تابع مسیر است، بنابراین مقدار آن در نمودار سمت چپ میتواند غیر صفر باشد. توجه داشته باشید که انرژی درونی، تابع حالت است، بنابراین مقدار آن در یک سیکل بسته بایستی برابر با صفر باشد. در حقیقت میتوان گفت:
در این مطلب اصول و قوانین قانون اول ترمودینامیک بیان شد. در مطالب آینده قانون دوم ترمودینامیک و همچنین نتایج این دو قانون را توضیح خواهیم داد.
در صورت علاقهمندی به مباحث مرتبط در زمینه مهندسی مکانیک، آموزشهای زیر نیز به شما پیشنهاد میشوند:












با سلام و احترا:
ضمن تشكر از مطالب مفيد شما، در مطلب قانون اول ترموديناميك، در ارتباط با تعريف مثبت و منفي بودن علامت كار انجام شده و مثال داده شده مغايرت وجود دارد.
سلام.
اصلاحات لازم انجام شد.
از همراهی شما سپاسگزاریم.