عدد اکسایش و تعیین آن – به زبان ساده
در مطالب گذشته وبلاگ فرادرس در مورد پیوندهای شیمیایی و همچنین واکنشهای شیمیایی بحث شد. از این رو در این مطلب قصد داریم تا عددی را توضیح دهیم که تعیینکننده نحوه شکسته شدن یک پیوند در یک واکنش است. این عدد تحت عنوان عدد اکسایش شناخته میشود.


عدد اکسایش عناصر
شیمیدانها معمولا از عددی تحت عنوان عدد اکسایش بهمنظور شناسایی الکترونهای هر اتم در ترکیب استفاده میکنند. توجه داشته باشید که این عدد را هم میتوان به اتمهای آزاد و هم اتمهای درگیر در یک پیوند یونی نسبت داد. معمولا به واکنشی که در آن اتمها الکترون از دست داده یا میگیرند بهترتیب اکسایش و کاهش گفته میشود. سخن را کوتاه کرده و گامهای لازم بهمنظور بدست آوردن عدد اکسایش را توضیح میدهیم.
گام اول
در ترکیبات، عناصری وجود دارند که عدد اکسایش آنها در بیشتر موارد عددی مشخص است. در ادامه قوانینی را بیان میکنیم که با استفاده از آنها میتوان عدد اکسایش عناصر مختلف را حدس زده و در نتیجه در گام دوم عدد اکسایش دیگر عناصر را بدست آورد.
۱. تعیین عناصر حالت پایدار
همواره عناصر واکنش داده نشده یا عناصری که در حالت آزاد خود هستند دارای عدد اکسایش صفر هستند. برای نمونه حالت پایدار اکسیژن بهصورت است. از این رو در حالتی که اکسیژن در یک سمت از واکنش بهصورت باشد، عدد اکسایشِ مربوط به آن برابر با صفر است. مثالی دیگر آلومینیوم است که حالت پایدار آن بهصورت است. از این رو عدد اکسایشِ چنین عنصری نیز صفر است. در تصویر زیر عدد اکسایش سه عنصر در حالت پایدار آنها ارائه شدهاند.
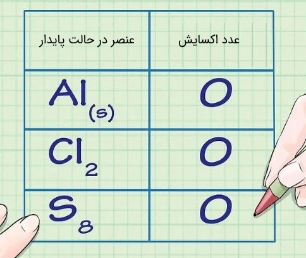
اگر عنصری در سمت واکنشدهندهها یا فرآوردهها وجود داشته باشد که به مولکولی از تنها یک نوع اتم باشد، در این صورت عدد اکسایشِ تمامی آنها نیز برابر با صفر است ().
۲. مشخص کردن یونها
عدد اکسایش یونها برابر با بار آنها است. این قانون هم در مورد یونهای تکی و هم در مورد یونهایی که بخشی از یک ترکیب هستند، صادق است. برای نمونه ترکیب نمک را در نظر بگیرید. عدد اکسایشِ هریک از یونهای سدیم و کلر برابر با بار الکتریکی آنها است.

3. یونهای فلزی و اعداد اکسایش متفاوت
در یک ترکیب شیمیایی، یونهای فلزی میتوانند اعداد اکسایشِ متفاوتی داشته باشند. این در حالی است که اتمهای غیرفلزی به جز در مواردی خاص معمولا عدد اکسایش مشخصی دارند. برای نمونه اتم آهن () را در نظر بگیرید. این اتم میتواند دارای عدد اکسایشی برابر با ۲+ یا ۳+ باشد. این که عدد اکسایشِ دقیق آنها چند باشد، وابسته به عدد اکسایش دیگر اتمهایی است که با آن پیوند داده است.
برای نمونه اتم آلومینیوم را در ترکیب در نظر بگیرید. ما میدانیم که بار یون کلر (به جز در موارد خاص) برابر با ۱- است. از طرفی مجموع بار کل ترکیب باید برابر با صفر باشد. در نتیجه میتوان گفت عددِ آلومینیوم برابر با ۳+ است. در ادامه معادله تعادل نوشته شده است.
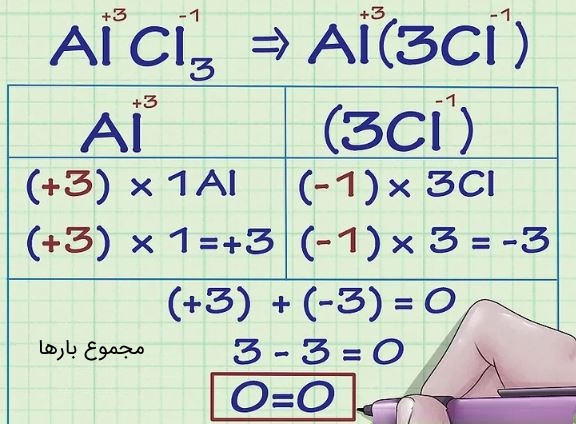
۴. اختصاص دادن عدد اکسایش ۲- به اکسیژن (به جز موارد خاص)
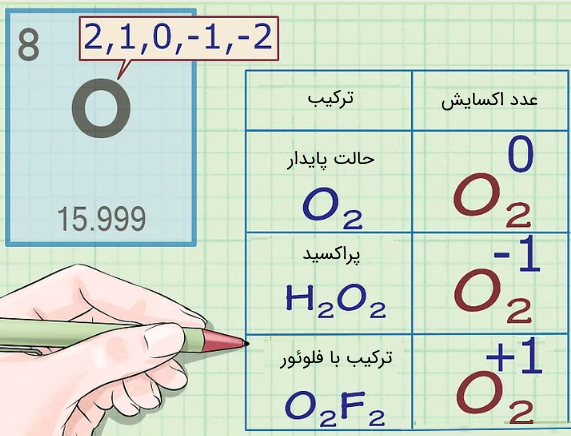
در تقریبا تمامی موارد، اتمهای اکسیژن دارای عدد اکسایشی برابر با ۲- هستند. موارد خاص در ادامه لیست شدهاند.
- وقتی اکسیژن در حالت پایدارِ است، عدد اکسایش هریک از اتمهای اکسیژن برابر با صفر است.
- اگر اکسیژن بخشی از یک پراکسید باشد، در این صورت عدد اکسایش آن برابر با ۱- است. پراکسیدها دستهای از ترکیبات هستند که در آن پیوند تکی اکسیژن-اکسیژن وجود دارد. برای نمونه در مولکول یا همان هیدروژن پراکسید، عدد اکسایش اکسیژن برابر با 1- است.
- زمانی که اکسیژن بخشی از یک سوپراکسید باشد در این صورت عدد اکسایش اکسیژن موجود در آن برابر با است. سوپراکسید نیز به ترکیباتی اطلاق میشود که در آن رادیکال وجود داشته باشد.
- اگر اکسیژن با فلوئور واکنش دهد، در این صورت عدد اکسایش اکسیژن برابر با 2+ است. تنها در ترکیب این قانون برقرار نبوده و عدد اکسایش اکسیژن برابر با ۱+ است.
در تصویر زیر ترکیبات و اعداد اکسایش اکسیژن در این حالتها ارائه شدهاند. توجه داشته باشید که عدد ارائه شده، عدد اکسایش مربوط به یک اتم اکسیژن است.
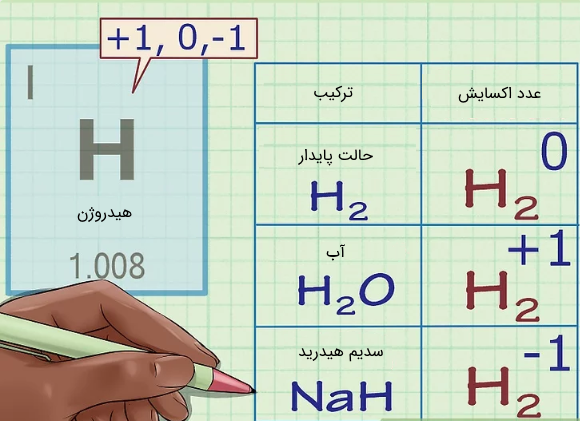
۵. اختصاص دادن عدد اکسایش ۱+ به هیدروژن (به جز در موارد زیر)
همانند اکسیژن، هیدروژن نیز در اکثر موارد دارای عدد اکسایش 1+ است. اما در مواردی نادر و خاص ممکن است این قانون برقرار نباشد. برای نمونه در حالتی که هیدروژن در حالت پایدارِ خود، به صورت قرار دارد، عدد اکسایش هیدروژن برابر با صفر است. هیدروژن قرار گرفته در ترکیباتی تحت عنوان ترکیبات هیدریدی نیز دارای عدد اکسایش ۱- است. برای نمونه در ترکیب یا سدیم هیدرید، عدد اکسایش هیدروژن برابر با ۱- و سدیم برابر با ۱+ است. در تصویر زیر ترکیبات ذکر شده به همراه عدد اکسایش آنها ارائه شدهاند.
۶. اختصاص دادن عدد اکسایش ۱- به فلوئور
همانطور که در بالا و برای هیدروژن و اکسیژن نیز بیان شد، عدد اکسایش برخی از عناصر در اکثر موارد عدد مشخصی است. فلوئور نیز در اکثر ترکیبات دارای عدد اکسایشی برابر با ۱- است. با مقایسه الکترونگاتیوی مشاهده میکنیم، دلیل این عدد نیز الکترونگاتیوی بالای فلوئور است. بنابراین در بیشتر موارد، فلوئور الکترونهای به اشتراک گذشته شده را دریافت میکند.

گام دوم
توجه داشته باشید که بار خالص یک ترکیب برابر با برآیند اعداد اکسایشِ اجزای آن است. بنابراین برای ترکیبات خنثی حاصل جمع اعداد اکسایش نیز برابر با صفر است. برای نمونه فرض کنید میخواهیم عدد اکسایش گوگرد (S) را در ترکیب زیر بدست آوریم:
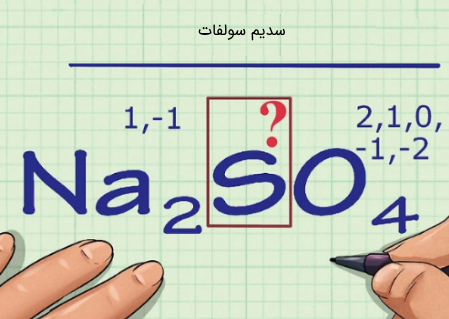
با توجه به اعداد اکسایش بیان شده در بالا، در دومین گام این عناصر را شناسایی کرده و با توجه به قوانین بیان شده برای آنها، اعداد اکسایش آنها را مشخص میکنیم. بر اساس قوانین بیانشده میتوان دید که یون سدیم دارای بار ۱+ و در نتیجه عدد اکسایشِ آن نیز برابر با ۱+ است. از طرفی همانطور که بیان شد جزء اکسیژن نیز دارای عدد اکسایش ۲- است. بنابراین مجموع عدد اکسایشِ دو اتم سدیم و ۴ اتم اکسیژن برابر با ۶- است. در تصویر زیر نحوه بدست آوردن این عدد ارائه شده است.
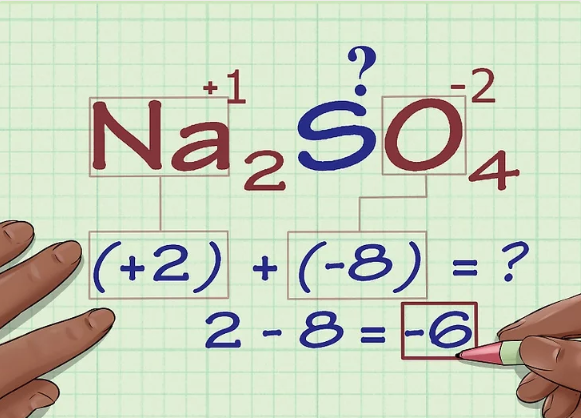
در گام نهایی، مجموع اعداد اکسایشِ تمامی اتمها را برابر با صفر قرار میدهیم. با نوشتن این معادله عدد اکسایشِ گوگرد برابر با ۶+ بدست میآید. در تصویر زیر نحوه نوشتن معادله نیز ارائه شده است.
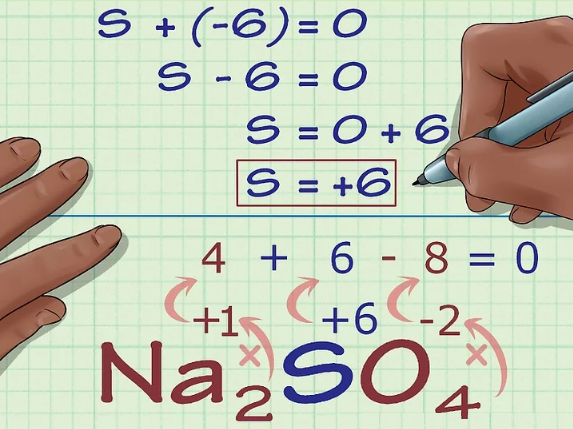
در این مطلب مفهوم اعداد اکسایش و نحوه محاسبه آن را برای بخشی از ترکیبات به صورت گام به گام توضیح دادیم. البته توجه داشته باشید که با استفاده از قوانین بیانشده میتوان عدد اکسایشِ ترکیبات به نسبت سادهتر را بدست آورد. در مطالب نیز آینده نحوه بدست آوردن اعداد اکسایشِ ترکیبات پیچیدهتر را توضیح خواهیم داد. پیشنهاد می کنیم برای آشنایی بیشتر با این دسته سوالات، مطلب خود را بیازمایید شیمی دوازدهم با جواب را مطالعه کنید.
در صورتی که مطلب فوق برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای مهندسی شیمی
- مجموعه آموزش نرمافزارهای مهندسی شیمی
- جدول تناوبی — از صفر تا صد
- عدد اتمی، عدد جرمی و ایزوتوپ — به زبان ساده
- اوربیتال و آرایش الکترونی — به زبان ساده
آزمون تعیین عدد اکسایش
۱. در ترکیبی مانند ، تشخیص استثنای عدد اکسایش اکسیژن چگونه بر اساس نوع پیوند انجام میشود؟
در صورت وجود پیوند اکسیژن-اکسیژن عدد اکسایش به منفی یک تغییر میکند.
وقتی اکسیژن به هیدروژن متصل باشد عدد اکسایش مثبت میشود.
استثنا فقط در ترکیبات دارای فلوئور رخ میدهد.
عدد اکسایش اکسیژن همواره منفی دو است مگر در ترکیب با فلزات.
در ترکیباتی مانند پراکسید هیدروژن () که بین اتمهای اکسیژن پیوند مستقیم وجود دارد، عدد اکسایش اکسیژن از مقدار معمول منفی دو به منفی یک تغییر میکند. بنابراین، وجود پیوند اکسیژن-اکسیژن نشانه استثنای پراکسید است.
۲. برای محاسبه عدد اکسایش یک عنصر ناشناخته در ترکیب خنثی، کدام روش صحیح است؟
مقایسه جرم مولی عناصر در ترکیب
مشاهده رنگ ترکیب قبل و بعد واکنش
بررسی الکترونگاتیوی هر عنصر به تنهایی
استفاده از جمع جبری اعداد اکسایش برای مساویکردن با صفر
روش استفاده از جمع جبری اعداد اکسایش و برابر قرار دادن آن با صفر برای ترکیب خنثی، روشی است که در آن با داشتن اعداد اکسایش عناصر شناخته شده، مقدار عنصر ناشناخته به دست میآید.













مرسی واقعا مفید بود برام 🙂
سپاسگذارم از وقت و انرژی که برای اشتراک مطالب گذاشتید .
سایت شما همیشه کامل ترین مطالب رو در خلاصه و راحت ترین حالت ممکن میگه. ممنونم از شما.
مفید و مختصر
سلام و درود دستتون درد نکنه خدا خیرت بده خیلی محشر بود
دمت گرم
محشر بود خدا خیرت بده 🙂
سلام ممنون توضیح خوبی بود، عدد اکسایشP فسفر در ترکیب FePO4 چی میشه؟ O و Fe باهمن.
آیا اینجوری میشه؟ Fe=-1 وO=-2 و در نهایت P=+9؟
ممنون
عالی
عالی بود فقط لهجش یکم اذیتم کرد
سلام تدریس خدوب هست ولی لحجش خیلی خیلی روی مخه
درود
اتفاقا به نظرم بسیار شیرین صحبت می کنند. برای من حس خوشایندی به ارمغان آوردند.
درودها بر شما و بر ایشان
دقیقا منم همینطور
عالی خسته نباشید
ممنون از توضيحات خوبتون 🙂
محشز