شکل مولکول – به زبان ساده
مولکولها هر کدام دارای شکل مشخصی هستند. شکل مولکول موجب بوجود آمدن خواص مختلف فیزیکی و شیمیایی در آن میشود. مولکولهایی که دارای یک اتم مرکزی هستند، شکلی ساده و قابل پیشبینی دارند. ایده اصلی در شکل مولکول را با نام نظریه «دافعه زوج الکترون لایه ظرفیت» (Valence Shell Electron Repulsion) میشناسند. نظریه VSEPR بیان میکند که الکترونها تا حدی که میتوانند یکدیگر را دفع میکنند تا در بیشترین فاصله ممکن از یکدیگر قرار بگیرند.
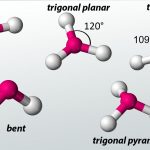
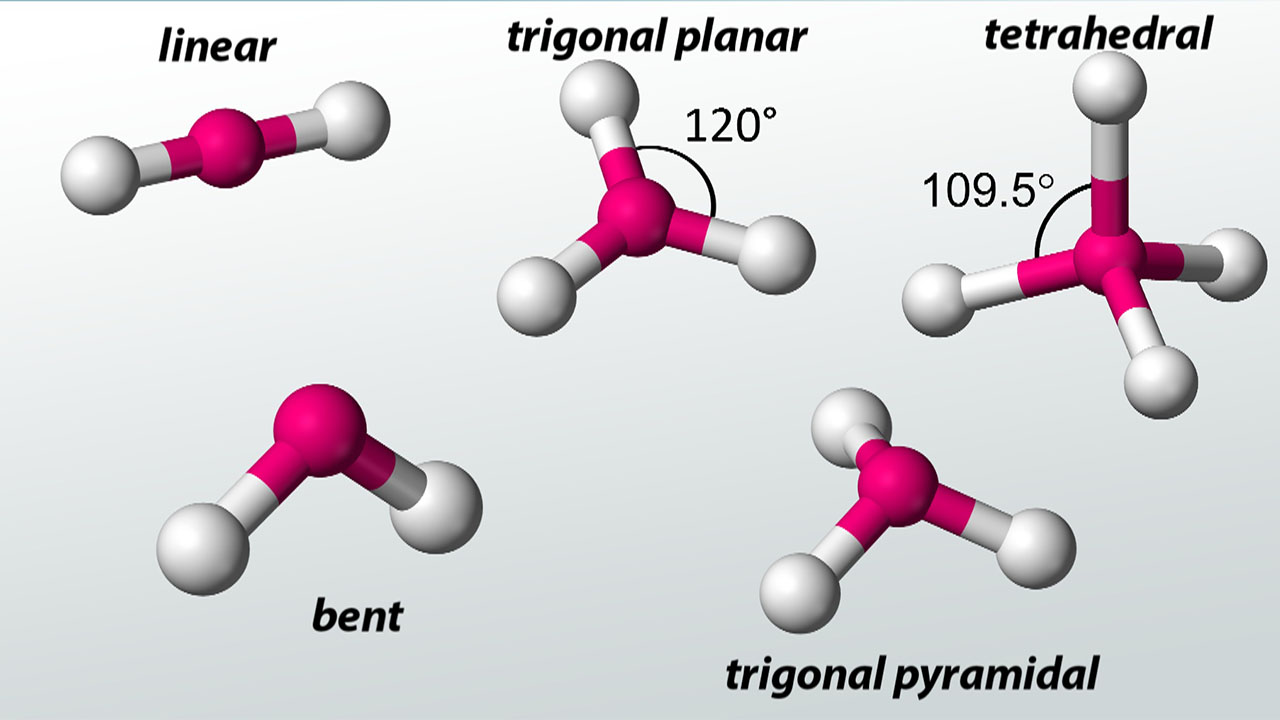
قلمرو الکترونی
دو نوع «قلمرو الکترونی» (Electron Group) وجود دارد: پیوندها و جفتالکترونهای ناپیوندی. به هنگام استفاده از VSEPR برای مولکولهای ساده، اولین کاری که باید انجام دهیم، شمردن تعداد قلمروهای الکترونی در اطراف اتم مرکزی است. این نکته را به یاد داشته باشید که پیوندهای چندگانه را یک قلمرو الکترونی در نظر بگیرید.
تاثیر قلمرو الکترونی در تعیین شکل مولکول
شکل مولکول برای آنهایی که شامل دو اتم باشند به صورت خطی است. چرخش مولکولی که اتم مرکزی آن تنها دو قلمرو الکترونی دارد، به گونهای است که این دو گروه از یکدیگر بیشترین فاصله را داشته باشند. زمانی که دو قلمرو الکترونی به میزان ۱۸۰ درجه از یکدیگر فاصله داشته باشند، اتمهای متصل به آنها نیز به همین میزان از یکدیگر تفاوت دارند. در نتیجه، شکل مولکول به صورت خطی خواهد بود. نمونهای از آنها برای مولکولهای سهاتمی در زیر آمده است:

شکل مولکول با ۳ قلمرو الکترونی
شکل مولکولی که ۳ قلمرو الکترونی داشته باشد، به گونهای است که این گروههای الکترونی در دورترین فاصله از یکدیگر قرار داشته باشند. شکل این نوع از مولکولها به صورت سهضلعی مسطح است.
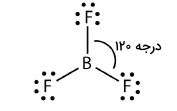
توزیع قلمرو الکترونی در برخی مواد به گونهای است که شکل سهضلعی مسطح داشته باشیم، اما این مواد اتمهایی دارند که تنها با ۲ قلمرو از ۳ قلمرو الکترونی پیوند تشکیل دادهاند. نمونهای از آن، شکل مولکول است که در تصویر زیر آورده شده است:
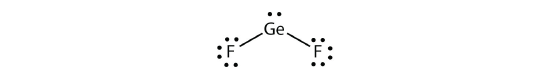
اگر مولکول را از نظر هندسه قلمرو الکترونی بررسی کنیم، شکل این مولکول مثلثی خواهد بود اما شکل حقیقی آن توسط محل اتمها تعیین میشود که خمیده است.
شکل مولکول با ۴ قلمرو الکترونی
مولکولی با چهار قلمرو الکترونی در اطراف اتم مرکزی، شکلی هرمی خواهد داشت. متان با فرمول نمونهای از این شکل مولکول است. در تصویر زیر، نوع نمایش مولکول متان را ملاحظه میکنید. خطوط مستقیم در سطح صفحه قرار دارند.
خطی که به شکل مثلثی اتم هیدروژن را به کربن متصل کرده است به بیرون از صفحه و به سمت خواننده قرار دارد و خطچین مثلثی نیز در خارج صفحه قرار دارد و به گونهای است که از خواننده متن دور میشود.
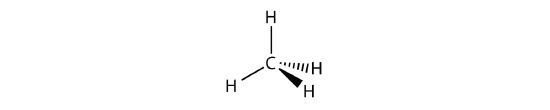
«آمونیاک» مولکولی است که اتم مرکزی آن شامل چهار قلمرو الکترونی است اما تنها سه قلمرو پیوندی دارد و به شکل زیر است:
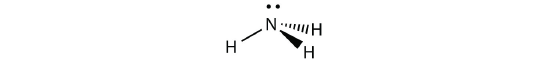
مولکول آب دارای چهار قلمرو الکترونی است که تنها دو قلمرو آن به صورت پیوندی قرار دارند و شکلی خمیده را تشکیل میدهند.
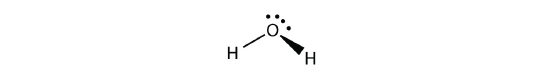
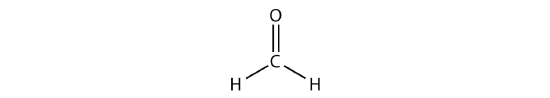
مولکولی با چهار قلمرو الکترونی که تنها یکی از آنها پیوندی باشد، شکلی خطی دارد چراکه این مولکول از نوع دو اتمی است. همانطور که در بالا اشاره شد، پیوندهای دوگانه یا سهگانه را به عنوان یک قلمرو الکترونی در نظر میگیریم. به طور مثال، ساختار لوییس مولکول به صورت زیر است:
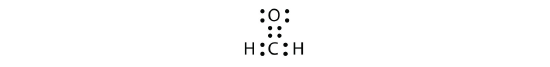
در این مولکول، اتم کربن مرکزی دارای سه قلمرو الکترونی است زیرا پیوند دوگانه را به عنوان یک قلمرو در نظر میگیریم. شکل مولکول نیز در نهایت به صورت سهضلعی مسطح خواهد بود.
هندسه مولکولی
«هندسه مولکولی» (Molecular Geometry)، ساختار سهبعدی یا به بیان دیگر نوع آرایش اتمها در یک مولکول است. فهم ساختار مولکولی ترکیبات به ما در تعیین مواردی اعم از قطبیت، واکنشپذیری، حالت مواد، رنگ، مغناطیس و همچنین فعالیتهای بیولوژیکی کمک میکند. برای تعیین شکل مولکول باید ابتدا ساختار لوییس آن را رسم کنیم. اگرچه ساختار لوییس نوع شکل مولکول را تعیین نمیکند اما در تعیین جفتالکترونهای پیوندی و ناپیوندی موثر است.
بعد از رسم ساختار لوییس، از نظریه VSEPR استفاده میکنیم تا شکل هندسی مولکول را تعیین کنیم. نظریه VSEPR بیان میکند که جفت الکترونها مستقل از اینکه پیوندی باشند یا ناپیوندی، یکدیگر را دفع میکنند. این نظریه نه تنها به جفت الکترونها، بلکه به طور کل به قلمروهای الکترونی میپردازد. قلمرو الکترونی میتواند جفت الکترون پیوندی، جفت الکترون ناپیوندی یا یک پیوند دوگانه یا سهگانه در اطراف اتم مرکزی باشد. به کمک نظریه VSEPR و قلمروهای الکترونی اطراف اتم مرکزی، میتوان شکل مولکول را پیشبینی کرد.
البته شکل مولکول بوسیله هسته و الکترونهای اطراف آن تعیین میشود. آرایش الکترونها و هسته به گونهای است که دافعه به حداقل و جاذبه به حداکثر برسد. بنابراین، شکل مولکول، حالتی تعادلی را بیان میکند که در این حالت، سیستم کمترین انرژی ممکن را داشته باشد. اگرچه این نظریه به پیشبینی توزیع الکترونها میپردازد اما باید نکاتی را نیز مد نظر قرار دهیم. به عبارت دیگر، مفهوم شکل مولکول را باید در دو نوع «هندسه قلمرو الکترونی» (Electron-group Geometry) و «هندسه مولکولی» (Molecular Geometry) جستجو کرد. هندسه قلمرو الکترونی را به کمک تعداد قلمروهای الکترونی تعیین میکنند.
| تعداد قلمرو الکترونی | هندسه قلمرو الکترونی |
| 2 | خطی |
| 3 | سه ضلعی مسطحی |
| 4 | چهاروجهی |
| 5 | سه ضلعی دو هرمی |
| 6 | هشت وجهی |
شکل مولکول همچنین به جفتالکترونهای ناپیوندی نیز بستگی دارد. اگر قلمروهای الکترونی همگی شامل جفتالکترونهای پیوندی باشند، شکل مولکول همانند جدول بالا خواهد بود. اگر مولکولها شامل الکترون ناپیوندی باشند، با مراجعه به جدول پایین میتوانید شکل و زاویه پیوندی را مشاهده کنید.
نحوه نمایش به کمک نظریه VSEPR
همانطور که در بالا اشاره شد، هندسه مولکولی و هندسه قلمرو الکترونی، زمانی که شامل جفت الکترونهای ناپیوندی نباشند، مفهوم یکسانی دارند. نمایش «وسپر» (VSEPR) برای این نوع از مولکولها به صورت خواهد بود. حرف بیانگر اتم مرکزی و حرف تعداد پیوندهای اتم مرکزی است. زمانی که شکل مولکول شامل جفت الکترونهای ناپیوندی باشد، عبارت اضافه میشود. حرف نشانگر تعداد جفت الکترونهای ناپیوندی در مولکول است. به طور مثال، مولکولی با دو قلمرو الکترونی پیوندی و دو جفت الکترون ناپیوندی را با استفاده از نظریه وسپر به صورت نمایش میدهند.
| تعداد قلمرو الکترونی | تعداد جفتالکترون ناپیوندی | نماد VSEPR | شکل مولکول | زاویه پیوند (درجه) | مثال | هندسه مولکول |
| 2 | 0 | خطی | 180 | 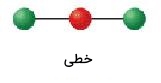 | ||
| 3 | 0 | سهضلعی مسطح | 120 | 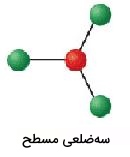 | ||
| 3 | 1 | خمیده | 120 | 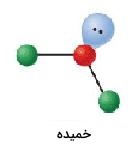 | ||
| 4 | 0 | چهاروجهی | 109/5 |
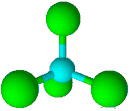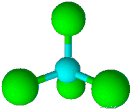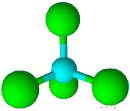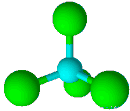 | ||
| 4 | 1 | سهضلعی هرمی | 109/5 | 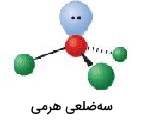 | ||
| 4 | 2 | خمیده | 109/5 | 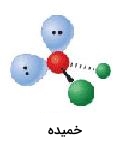 | ||
| 5 | 0 | سهضلعی دو هرمی | 90، 120 | 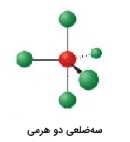 | ||
| 5 | 1 | الاکلنگی | 90، 120 | 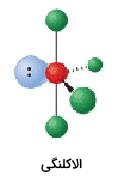 | ||
| 5 | 2 | T شکل | 90 | 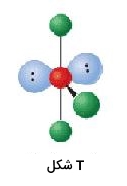 | ||
| 5 | 3 | خطی | 180 | 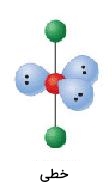 | ||
| 6 | 0 | هشت وجهی | 90 |
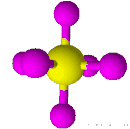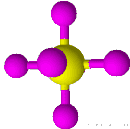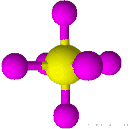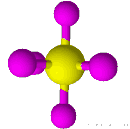 | ||
| 6 | 1 | هرمی | 90 | 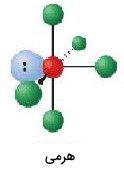 | ||
| 4 | 2 | چهارضلعی مسطح | 90 | 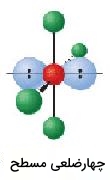 |
مثال
شکل مولکول های آب و دیاکسید کربن را تعیین کنید.
حل:
برای این کار باید ابتدا ساختار لوییس دو مولکول را رسم کرد.
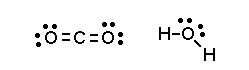
مولکول آب شامل چهار قلمرو الکترونی هست که بر اساس هندسه قلمرو الکترونی باید شکلی چهاروجهی داشته باشد. این مولکول شامل دو پیوند یگانه و ۲ جفت الکترون ناپیوندی است و بنابراین شکل مولکول به صورت خمیده خواهد بود.
مولکول دیاکسید کربن هم دارای دو قلمرو الکترونی است اما هیچ جفت الکترون ناپیوندی به همراه ندارد. بنابراین شکل مولکول دیاکسید کربن خطی خواهد بود چراکه هیچ جفت الکترون ناپیوندی وجود ندارد تا بر نوع آرایش پیوندها تاثیر بگذارد.
شکل مولکول با بیش از یک اتم مرکزی
بکارگیری نظریه وسپر محدود به یک اتم مرکزی نیست و مولکولهایی با چند اتم مرکزی را نیز شامل میشود. در حقیقت، اتمهای زنجیره طویل را به قطعات کوچکتر تقسیم خواهیم کرد. هر بخش یک شکل مخصوص به خود را خواهد داشت. به مثال زیر توجه کنید:
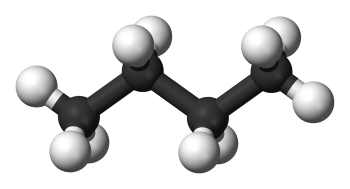
بوتان، مولکولی با فرمول است. فرمول ساختاری آن را میتوان به شکل نشان داد. اگر هر کربن را به قسمتهای کوچکتر تقسیم کنیم، میتوانیم شکل مربوط به هر قسمت را تعیین کنیم. اگر از قسمت چپ مولکول شروع کنیم، میبینیم که کربن دارای سه پیوند یگانه با هیدروژن و یک پیوند یگانه با کربن است و این یعنی ما ۴ قلمرو الکترونی داریم. با بررسی اولین جدول متوجه خواهیم شد که یک چهاروجهی خواهیم داشت. حال، کربن بعدی را مرور میکنیم. ۲ پیوند یگانه با کربن و دو پیوند یگانه با هیدروژن داریم. در نتیجه کربن دوم هم شکلی چهاروجهی دارد چراکه دارای ۴ قلمرو الکترونی است. با ادامه این روند برای دو کربن دیگر هم به شکلهای چهاروجهی میرسیم.
در این مولکول، چهار اتم مرکزی داریم. با تقسیم مولکول به چهار قسمت، شکل مولکول در هر قسمت را مشخص کردیم. البته کار ما در این بخش تمام نمیشود چراکه تنها به قلمروهای پیوندی پرداختیم. باید مولکول را در خصوص وجود جفت الکترونهای ناپیوندی نیز بررسی کنیم که البته بوتان یک آلکان است و جفت الکترون ناپیوندی ندارد. بنابراین، تعداد ۴ چهاروجهی خواهیم داشت. حال، با وجود تعیین شکل هر کدام از اتمهای مرکزی، شکل کلی مولکول به صورت زیر خواهد بود:
زوایای پیوندی
زوایای پیوندی نیز در تعیین شکل مولکول تاثیر دارند. زاویه پیوندی، زاویه بین دو پیوند در مولکول است. میدانیم که الکترونها به خاطر بار یکسان، یکدیگر را دفع میکنند. برای توصیف زوایای پیوندی، باید یک تجسم سهبعدی داشته باشیم. در حقیقت، برای یک چهاروجهی، زاویه پیوندی برخلاف آنچه که تصور میکنیم، 90 درجه نیست. این تصور به دلیل تجسم دو بعدی ما از یک چهاروجهی است در حالیکه زاویه پیوندی برای یک چهاروجهی برابر با خواهد بود.
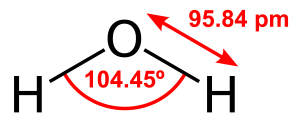
البته این زاویه برای مولکول آب خواهد بود چراکه جفتالکترونهای ناپیوندی به مولکول اکسیژن نزدیکتر هستند و در نتیجه به فضای بیشتری نیاز دارند و بنابراین به علت دافعه ایجاد شده، پیوندهای به یکدیگر نزدیکتر خواهند شد. در تصویر زیر، طول پیوند و زاویه بین پیوندی در مولکول آب نشان داده شده است:
مراحل تعیین شکل مولکول
برای تعیین شکل مولکول به کمک وسپر، کافی است چهار مرحله ساده زیر را انجام دهید:
- ساختار لوییس مولکول را رسم کنید.
- تعداد قلمروهای پیوندی و ناپیوندی را تعیین کنید.
- هندسه قلمرو الکترونی را تعیین کنید. (خطی، سهضلعی مسطح و ...)
- در نهایت با بررسی تعداد جفت الکترونهای ناپیوندی، شکل مولکول را تعیین کنید.
اگر این مطلب برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای نرمافزارهای مهندسی شیمی
- آموزش رسم چند بعدی ساختار شیمیایی با ChemOffice (کم آفیس)
- یون چیست؟ — به زبان ساده
- ثابت تعادل — از صفر تا صد
^^













سلام دوستان، خواستم بدونم این علامت هایی که بین دوتا عنصر هست چی هست؟ شبیه یک مثلثه، یکی شبیه یه جور wifi ئه 🙂
سلام، در صفحه «شیمی فضایی فرادرس» هم اگر جستجو کنید انگار توضیح داده شده است
سلام،اگر اون خط چین منظور هست، فکر کنم نشون می ده پیوند در پشت صفحه است (ساختار مولکول در فضا). همینطور فکر کنم خط پر رنگ به معنی این هست که پیوند در جلوی صفحه است.
بسیار مفید و کامل بود ممنون از وققتون بابت
این مطلب رسم شکل مولکول با زاویه های درستش رو برام اسون کردین