سری بالمر در طیف هیدروژن – به زبان ساده
سری بالمر در طیف اتم هیدروژن دستهای از طیفهای نشری اتم هیدروژن است که در نتیجه انتقال الکترون اتم هیدروژن از حالات برانگیخته متفاوت به لایه دوم الکترونی آن نشر میشود. سری بالمر شامل ۴ خط در ناحیه نور مرئی در طیف اتم هیدروژن است که با نام سری بالمر شناخته میشود. این خطوط در طول موجهای ۴۱۰ نانومتر، ۴۳۴ نانومتر، ۴۸۶ نانومتر و ۶۵۶ نانومتر در محدوده نور مرئی قرار دارند و با استفاده از معادله بالمر و ریدبرگ به دست آمدهاند. سری بالمر در مطالعات نجومی بسیار با اهمیت است. سری بالمر در طیف هیدروژن به اندازهگیری دمای سطح ستارهها کمک میکند. در این مطلب از مجله فرادرس به بررسی این خطوط میپردازیم و ویژگیهای آنها را توضیح میدهیم.
- خواهید آموخت که خطوط بالمر چگونه از انتقالات الکترونی شکل میگیرند.
- میآموزید معادله بالمر و ریدبرگ را برای محاسبه طول موج به کار بگیرید.
- یاد میگیرید تفاوت طیفهای نشری، جذبی و پیوسته را تحلیل کنید.
- با ساختار و نامگذاری خطوط سری بالمر مانند اچ-آلفا آشنا میشوید.
- مفهوم حالت پایه و برانگیخته اتم هیدروژن را خواهید شناخت.
- خواهید دانست مدل بور چگونه توضیحی برای خطوط سری بالمر ارائه میکند.


در ابتدای این مطلب بررسی میکنیم سری بالمر در طیف هیدروژن چیست. سپس درباره فرمول ریدبرگ و ارتباط آن با خطوط بالمر توضیح میدهیم. در ادامه، مفهوم سری در طیف را آموخته و طیف اتم هیدروژن و روش پدید آمدن آن را بررسی میکنیم. با مفاهیمی مانند حالت پایه و حالت برانگیخته اتم هیدروژن آشنا شده و مفهوم طیف نشری خطی را بررسی میکنیم. همچنین، انواع دیگر طیف مانند طیف جذبی و پیوسته را نیز توضیح میدهیم. برای درک بهتر سری بالمر، اختلاف انرژی سطوح مختلف هیدروژن و سایر خطوطی که در طیف هیدروژن وجود دارد را بررسی میکنیم. در نهایت توضیح میدهیم اهمیت سری بالمر در طیف هیدروژن چیست. با مطالعه این مطلب تا انتها میتوانید به شکلی کامل و کاربردی با این خطوط طیفی آشنا شوید.
سری بالمر در طیف هیدروژن
سری بالمر مجموعهای از خطوط نشری اتم هیدروژن است که مربوط به انتقال الکترون از لایههای الکترونی بالاتر به لایه الکترونی دوم اتم هیدروژن میشود. سری بالمر در طیف هیدروژن، در محدوده طیف مرئی قرار دارد و قابل مشاهده است. به همین علت، سری بالمر در طیف هیدروژن با طیفسنجهای نوری به سادگی قابل مشاهده است.
بدون شک هر ویژگی دریافت شده از طیفهای مختلف مواد میتواند سرنخی مهم برای کشف اطلاعات گوناگون درباره آنها باشد. یکی از مهمترین تحقیقاتی که درباره خطوط طیفی اتم هیدروژن انجام شده است، توسط «جان جیکوب بالمر» (Johann Jakob Balmer) در سال ۱۸۶۰ انجام شد. بالمر نتیجه گرفت که بهترین اتم برای بررسی طیف آن و نتیجهگیری بر اساس آن، اتم هیدروژن است که سبکترین اتم موجود در جهان است. بالمر، خطوط جذبی به دست آمده توسط آنگستروم را مطالعه کرد و به این نتیجه رسید که این ۴ خط، با استفاده از فرمول معادله زیر به یکدیگر مربوط میشوند.
$$\lambda = b \left( \dfrac{n_2^2}{n_2^2 -4} \right) \label{1.4.1}$$
این معادله با نام معادله بالمر شناخته میشود. در این فرمول، b برابر با ۳۶۴٫۵۶ نانومتر است و n لایههای الکترونی از ۲ به بعد است (۳ و ۴ و ۵ و ۶)
۴ طول موج اولیه که از معادله بالا به دست میآید، با خطوط کشف شده توسط آنگستروم تطابق زیادی داشتند. بالمر به این نتیجه رسید که سایر خطوط به دست آمده از n=۷ به بعد، در ناحیه نور مادون قرمز خواهند بود. جدول زیر، نشان دهنده طول موج خطوط بالمر در طیف هیدروژن و رنگ آنها در محدوده مرئی است.
| شماره لایه الکترونی برانگیخته | طول موج (نانومتر) | رنگ در ناحیه مرئی |
| ۳ | ۶۵۶ | قرمز |
| ۴ | ۴۸۶ | سبز آبی |
| ۵ | ۴۳۴ | آبی |
| ۶ | ۴۱۰ | نیلی |
| ۷ | ۳۹۷ | بنفش |
| ۸ | ۳۸۹ | غیرمرئی |
| ۹ | ۳۸۳ | غیرمرئی |
| ۱۰ | ۳۸۰ | غیرمرئی |
اگر این خطوط بر اساس طول موج در مقیاس خطی رسم شوند، ظاهر طیف مانند شکل زیر خواهد بود. این خطوط به عنوان سری بالمر شناخته میشوند.

فرمول ریدبرگ
سری بالمر به مجموعهای از خطوط طیفی نشر اتم هیدروژن اطلاق میشود که از انتقال الکترونها از سطوح انرژی بالاتر به سطحی با عدد کوانتومی اصلی ۲ حاصل میشود. چهار انتقال از این سری در ناحیه مرئی طیف نوری قابل مشاهده است و بهطور تجربی توسط فرمول بالمر توصیف میشود.
تعمیم این فرمول، فرمول ریدبرگ است که خطوط دیگر هیدروژن را در خارج از ناحیه مرئی طیف الکترومغناطیسی نیز توصیف میکند.
که در آن طول موج، ثابت ریدبرگ برای هیدروژن ( ) و و اعداد صحیح مربوط به اعداد کوانتومی اصلی در انتقال هستند، به شکلی که است.
خطوط سری بالمر در طیف هیدروژن از نشر فوتونهایی که از انتقال الکترونهای برانگیخته به حالت سطوح انرژی پایینتر حرکت میکنند به وجود میآید. علاوه بر این، برخی از خطوط بالمر در طیف هیدروژن وجود دارند که در محدوده فرابنفش ظاهر میشوند. طول موج این خطوط کوتاهتر از ۴۰۰ نانومتر است. این خطوط در طول موج حدود ۳۶۴٫۶ نانومتر به شکلی پیوسته ظاهر میشوند (نه خطی).
طیف آنگستروم
طیف جذبی و نشری اتم هیدروژن اولین بار توسط «آندرس آنگستروم» (Anders Jonas Ångström) کشف شد. این طیف کشف شده، قدمی مهم و حیاتی برای کشف ساختار اتم به شمار میرود. بیشترین اطلاعاتی که امروزه از ساختار اتمی و مولکولی مواد مختلف میدانیم، با استفاده از اسپکتروسکوپی (طیف سنجی) به دست آمده است.
تصویر زیر، نشان دهنده دو طیف مختلف است. طیف پیوسته که میتوان آن را با استفاده از برانگیخته کردن اتم مواد در حالت جامد یا گاز به دست آورد و طیف نشری که با استفاده از برانگیخته کردن اتم گازی مواد در فشار پایین یا با استفاده از بمباران الکترونی به دست میآید. طیف جذبی هنگامی به وجود میآید که نور از یک منبع پیوسته به گاز خنک شده اتم مورد نظر تابیده شود. خطوط سیاه به دست آمده در طیف جذبی، ساختار، نوع و ویژگیهای گاز را مشخص میکند.
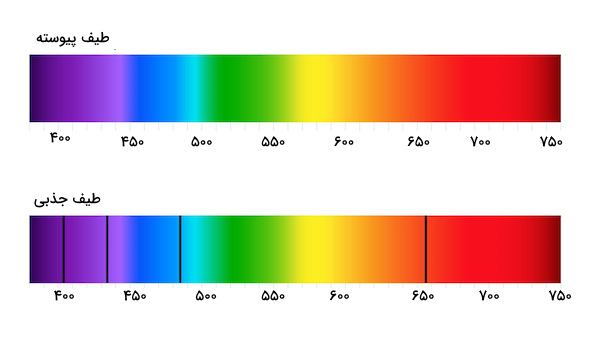
سری بالمر در اثر برانگیخته شدن الکترون اتم هیدروژن و انتقال آن به لایههای بالاتر الکترونی و سپس بازگشت آن به لایه دوم ظاهر میشوند. درواقع، برهمکنش امواج الکترومغناطیسی با اتمها و مولکولها است که باعث به وجود آمدن طیفهای نشری خطی و درک ساختار آنها میشود. برای یادگیری بیشتر درباره این برهمکنشها پیشنهاد میکنیم فیلم آموزش تابش الکترومغناطیس و برهمکنش آنها با اتمها و مولکولها فرادرس را مشاهده کنید. لینک این آموزش در ادامه درج شده است.
انواع خطوط سری بالمر در طیف هیدروژن
سری بالمر با مجموعه خطوطی آغاز میشود که مربوط به انتقال از لایه سوم به لایه دوم است. این مجموعه خطوط با نام اچ-آلفا (H-Alpha) شناخته میشوند و طول موج آنها ۶۵۶٫۳ نانومتر است. خطوط اچ-آلفا با نزدیک شدن خطوط به یکدیگر گسترش مییابد. به دلیل اینکه چشم انسان قادر به جذب طول موجهای متفاوت است، سری بالمر با مجموعهای رنگهای قرمز تا بنفش مشاهده میشود.
کوتاهترین طول موج در سری بالمر در طیف هیدروژن، مربوط به انتقال الکترون از دورترین لایه الکترونی ممکن (بینهایت) به لایه دوم است. این انتقال، خارج از محدوده طیف مرئی قرار دارد. سایر خطوط سری بالمر با نامهای اچ-بتا (H-Beta)، اچ-گاما (H-Gamma) و ... شناخته میشوند. حرف «اچ» نماینده عنصر هیدروژن است.
یادگیری فیزیک دوازدهم با فرادرس
سری بالمر در طیف اتم هیدروژن یکی از ویژگیهای مهمی بود که با کشف آن دانشمندان به ساختار کوانتومی اتم پی بردند. برای یادگیری سری بالمر و طیف اتمی هیدروژن، ابتدا باید با مفاهیمی مانند موجهای الکترومغناطیسی و ویژگیهای آنها آشنا شوید. همچنین، یادگیری مبانی فیزیکی اتمی و هسته ای قدمی مهم در یادگیری و درک طیف خطی عناصر و مباحث مربوط به آنها است. پیشنهاد میکنیم برای یادگیری این مباحث و مفاهیم، به مجموعه فیلم آموزش دروس پایه دوازدهم، بخش فیزیک مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که لینک آنها در ادامه آورده شده است، می توانید به آموزشهای بیشتری در زمینه طیف خطی و سری بالمر دسترسی داشته باشید.
- فیلم آموزش شیمی ۱ پایه دهم
- فیلم آموزش شیمی ۱ پایه دهم حل سوالات تشریحی امتحانات نهایی
- فیلم آموزش شیمی دبیرستان نکته و حل تست کنکور
مثال معادله ریدبرگ
در قسمت قبل توضیح دادیم که طول موج خطوط طیفی بالمر بای اتم هیدروژن با استفاده از فرمول ریدبرگ به دست میآید. با استفاده از فرمول ارائه شده در قسمت قبل، به سوالات زیر پاسخ دهید.
مثال ۱
طول موج امواج الکترومغناطیسی که از انتقال الکترون از لایه سوم به اول اتم هیدروژن ناشی میشود را به دست آورید.
پاسخ
با توجه به فرمول ریدبرگ، و جایگذاری مقادیر و خواهیم داشت:
مثال ۲
مقدار طول موج کم انرژیترین خط در سری بالمر را به دست آورید.
پاسخ
آموختیم که در سری بالمر، الکترونها به لایه دوم الکترونی (حالت پایه دوم) باز میگردند. پس مقدار است. کمانرژیترین گذار الکترونی از لایه سوم به لایه دوم خواهد بود پس است. حال این مقادیر را در معادله ریدبرگ جایگذاری میکنیم.
سری در طیف چیست؟
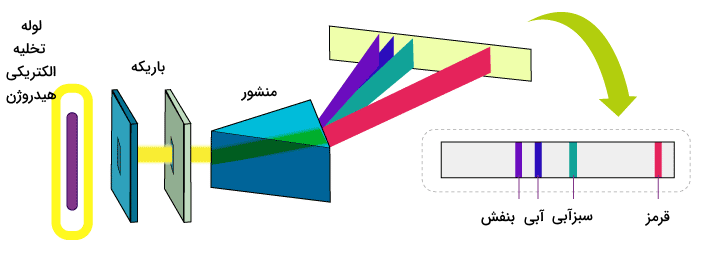
به یک مجموعه از طول موجهای مشخص در یک طیف، سری در طیف گفته میشود. این طول موجها، مشخصکننده ویژگیهای نور یا امواج الکترومغناطیسی هستند که توسط اتمها نشر داده میشوند. اتم هیدروژن، سادهترین اتم موجود در طبیعت است. به همین علت، این اتم سادهترین سریها را در طیف تولید میکند. هنگامی که یک باریکه نور یا موج الکترومغناطیسی به دستگاهی با یک ورودی باریک وارد میشود، هر جزء نور تصویری از منبع را نشان میدهد. تصویر زیر نشان دهنده روش مشاهده طیف هیدروژن به شیوهای ساده است.
در این روش ابتدا لوله حاوی گاز تحت اثر انرژی قرار گرفته و سپس نور ساطع شده از آن از باریکه از عبور داده میشود. باریکه نور عبوری به سمت منشوری هدایت میشود و به رنگهای سازندهاش پخش میشود. طیف هیدروژن شامل ۴ خط در محدوده مرئی است که به ترتیب از طول موج بالا به پایین شامل رنگهای بنفش، آبی، سبزآبی و قرمز است. این رنگها و خطوط قابل مشاهده مربوط به سری بالمر در طیف هیدروژن هستند. در انتقالات الکترونی این اتم، تنها طول موجهایی که مربوط به انتقالات الکترون به حالت پایه دوم این اتم هستند در محدوده مرئی قرار دارند.
این تصاویر میتواند به وسیله دستگاههای طیفسنجی مشخص و آشکارسازی شوند. این تصاویر به فرم خطوط موازی هستند که در کنار یکدیگر با فاصلهای منظم قرار گرفته اند. این تصاویر در طول موجهای بلندتر فاصلهی بیشتری از هم میگیرند. به همین ترتیب، خطوط حاصل از این تصاویر در طول موجهای کمتر، فاصله کمتری دارند.
تصویر زیر نشاندهنده سه سری اول، از جمله سری بالمر در طیف هیدروژن است.
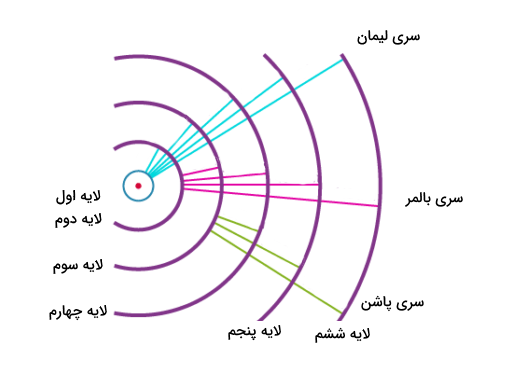
خطوط بالمر بر مبنای انتقال الکترون از لایههای بالاتر اتم هیدروژن به لایه دوم این اتم به وجود میآید. هریک از این انتقالات میزان انرژی منحصر به فرد خود را دارند که باعث پدیدار شدن طول موجهای خاصی در طیف الکترومغناطیسی میشوند. در واقع این مقادیر انرژی مقادیر ثابت و کوانتومی دارند که تغییر نمیکند. مطالعات انجام شده روی اتم هیدروژن بود که به دانشمندان کمک کرد کشف کنند اتم ساختاری کوانتومی با سطح انرژی با فواصل مشخص دارد.
درک ساختار کوانتومی اتم میتواند کمک شایانی به درک ساختار مولکولها و واکنشهای آنها بکند. پیشنهاد میکنیم برای درک بهتر این ساختار، مطلب مدل کوانتومی اتم مجله فرادرس را که لینک آن در ادامه آورده شده است را مطالعه کنید.
طیف اتم هیدروژن چیست؟
الکترونها در یک اتم یا مولکول انرژی جذب کرده و برانگیخته میشوند. این به این معنی است که الکترونها از یک سطح انرژی پایینتر به یک سطح انرژی بالاتر جهش میکنند و هنگام بازگشت به حالت قبلی خود، انرژی آزاد میکنند. این انرژی آزاد شده اغلب به صوت فوتونها نوری با طول موجهای مشخص است. این پدیده توضیحی برای طیف نشری هیدروژن نیز ارائه میدهد.
آزمایشها نشان دادهاند که طولموجهای این فوتونهای نشر شده، ویژگیهای منحصر به فردی از عنصر شیمیایی منتشرکننده نور را مشخص میکنند. این خطوط به عنوان اثر انگشت اتمی شناخته میشوند که نشاندهنده ساختار داخلی اتم هستند.
تصویر زیر، نشاندهنده طیف نشری اتم هیدروژن به همراه طول موجهای خطوط آن است. در صورتی که در طیف نشری مادهای ناشناخته، این خطوط به شکلی گروهی نمایان شوند، وجود هیدروژن در آن نمونه اثبات میشود.

هنگامی که یک اتم هیدروژن یک فوتون جذب میکند، الکترون به سطح انرژی بالاتری منتقل میشود، برانگیخته میشود. وقتی فوتونی از طریق اتم هیدروژن منتشر میشود، الکترون از سطح انرژی بالاتر به سطح پایینتر منتقل میشود. این انتقال با نشر انرژی به شکل نور با طول موج مشخص انجام میشود. در طول این انتقال از سطح بالاتر به سطح پایینتر، انتشار نور اتفاق میافتد. سطوح انرژی کوانتومی اتمها باعث میشود طیف به دست آمده از این انتشارات شامل طولموجهایی باشد که تفاوت در این سطوح انرژی را منعکس میکنند.
برای مثال، خط در طولموج ۶۵۶ نانومتر مربوط به انتقال از لایه سوم الکترونی به لایه دوم الکترونی است. تفاوتهای انرژی بین حالات برانگیخته اتم هیدروژن، طولموجهای ممکن یا به عبارت دیگر فرکانسهای فوتونهایی که هنگام بازگشت الکترونهای برانگیخته به حالات انرژی پایینتر منتشر میشوند را تعیین میکند. مجموعهای از طولموجهای ممکن فوتونها به نام طیف اتم هیدروژن شناخته میشود.
سری بالمر در طیف هیدروژن چگونه به وجود میآید؟
طیف نشری یا جذبی اتم هیدروژن از طریق فرآیندهایی شامل تفکیک مولکول هیدروژن، جذب انرژی، بازگشت به حالت پایه و انتشار تابش به دست میآید.
هریک از این فراینها در ادامه توضیح داده شده است.
تفکیک مولکول هیدروژن
هنگامیکه به مولکول هیدروژن انرژی داده میشود مولکول هیدروژن به دو اتم هیدروژن مجزا تفکیک میشود. این انرژی میتواند به روشهای متفاوتی به مولکول هیدروژن منتقل شود. برای مثال، تخلیه الکتریکی یکی از این روشها است.
جذب انرژی
الکترونهای اتم هیدروژن انرژی داده شده به آنها را جذب میکنند و برانگیخته میشوند. برانگیختگی الکترون به این معنا است که الکترونها حالت پایه اتم هیدروژن که لایه اول الکترونی است را ترک کرده و به سطوح بالاتر الکترونی میروند.
بازگشت به حالت پایه
حالت برانگیخته اتمها ناپایدار است و الکترون های برانگیخته پس از گذت مدت زمانی دوباره به حالت پایه (لایه اول) یا سطوح انرژی پایینتر (باقی لایههای الکترونی پایینتر از حالت برانگیخته) باز میگردند. با بازگشت الکترون به حالت پایه یا پایینتر، انرژی جذب شده به صورت تابش الکترومغناطیسی آزاد میشود.
انتشار تابش
تابش منتشر شده شامل فوتونهایی با طول موجهایی مشخص است که با تفاوت انرژی بین سطوح انرژی الکترونی برابر است. این طول موجها گسسته هستند و با اشکار سازی آنها به وسیله آشکارسازهای مناسب می توان به طیف نشری یا جذبی هیدروژن دست یافت.
حالت پایه اتم هیدروژن
هیدروژن اولین اتم در جدول تناوبی با ۱ پروتون و ۱ الکترون است. حالت پایه اتم هیدروژن حالتی است که الکترون آن اولین لایه الکترونی اتم را اشغال کرده باشد. اولین لایه الکترونی اتم هیدروژن عدد کوانتومی اصلی «n» برابر با ۱ دارد و شامل زیرلایه 1s است. زیرلایه 1s شامل یک اوربیتال کروی شکل s با شعاعی کوچک است که الکترون در آن وجود دارد. عدد کوانتومی فرعی برای الکترون هیدروژن در حالت پایه برابر صفر و عدد کوانتومی مغناطیسی نیز برای آن برابر با صفر است.
الکترون هیدروژن در این حالت در پایدارترین حالت ممکن قرار دارد و انرژیای از خود آزاد نمی کند. آرایش الکترونی هیدروژن در حالت پایه به شکل زیر است.
حالت پایه در درک رفتار اتم هیدروژن اهمیت دارد، زیرا تعیین میکند که چگونه اتمهای هیدروژن با تابش الکترومغناطیسی تعامل دارند. این انتقالات، چه از طریق جذب تابش و انتقال به سطح انرژی بالاتر و چه از طریق تابش انرژی هنگام بازگشت به حالت پایه، خطوط طیفی ایجاد میکند و به شناسایی عنصر کمک میکند. شکل زیر، نشاندهنده شکل تک اوربیتال s است که الکترون هیدروژن در حالت پایه در آن حرکت میکند.
حالت برانگیخته هیدروژن چیست؟
یک اتم هیدروژن در حالت برانگیخته، الکترونی در یک سطح انرژی بالاتر (n>۱) نسبت به حالت پایه دارد. الکترون باید مقداری انرژی جذب کرده باشد تا از حالت پایه به حالت برانگیخته پرش کند و به یک اوربیتال با انرژی بالاتر اطراف هسته منتقل شود. حالات برانگیخته میتوانند سطوح انرژی مختلفی داشته باشند، مانند n=۲، n=۳ و غیره. تصویر زیر نشاندهنده برانگیخته شدن الکترون اتم هیدروژن است.
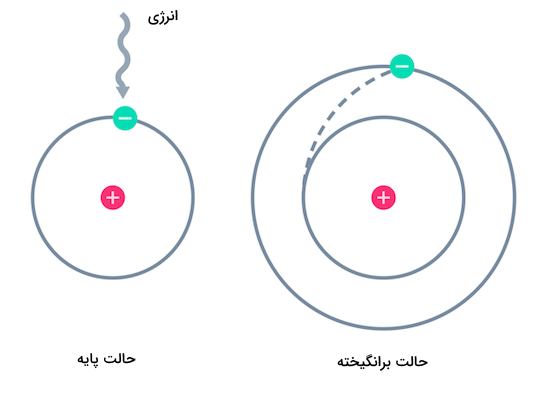
تفاوت اصلی بین یک اتم هیدروژن در حالت پایه و یک اتم هیدروژن در حالت برانگیخته، سطح انرژی الکترونهای آنها است. یک اتم هیدروژن در حالت پایه الکترون خود را در پایینترین سطح انرژی (n=۱) دارد، در حالی که یک اتم هیدروژن در حالت برانگیخته الکترون خود را در یک سطح انرژی بالاتر (n>۱) دارد. اتمهای هیدروژن در حالت برانگیخته ناپایدار هستند و در نهایت با آزاد کردن انرژی به حالت پایه بازمیگردند که یکی از این روشها میتواند ساطع کردن نور (فوتون) باشد.
طیف نشری خطی چیست؟
طیف نشری خطی، طیفی با زمینه سیاه و خطوط رنگی است که این خطوط طول موجهای مشخصی را نشان میدهند. الکترونها در یک اتم بهگونهای آرایش مییابند که انرژی اتم به کمترین میزان ممکن برسد. اگر نور ساطعشده از اتمهای برانگیخته شده از طریق یک منشور مشاهده شود، الگوهایی از خطوط تولید خواهند شد. این خطوط طیف نامیده میشوند و به طولموجهای خاص برای یک عنصر خاص مربوط میشوند. برای به دست آوردن طولموجهای عددی (بر حسب نانومتر)، نیاز است که از نوعی دستگاه آشکارساز استفاده شود.
حالت پایه یک اتم، کمترین حالت انرژی اتم است. زمانی که به این اتمها انرژی داده میشود، الکترونها انرژی را جذب کرده و به یک سطح انرژی بالاتر منتقل میشوند. این سطوح انرژی الکترونها در اتمها بهصورت گسسته هستند، به این معنی که الکترون باید از یک سطح انرژی به سطح دیگری در مراحل مشخص و گسسته منتقل شود، نه بهطور پیوسته. حالت برانگیخته اتم حالتی است که در آن انرژی پتانسیل اتم از حالت پایه بیشتر است. اتم در حالت برانگیخته ناپایدار است و وقتی به حالت پایه باز میگردد، انرژیای را که قبلا جذب کرده بود، بهصورت تابش الکترومغناطیسی آزاد میکند.
تصویر زیر، نمایانگر طیف نشری خطی اتم آهن است.

اتمها میتوانند انرژی را از منابع مختلفی برای ایجاد این انتقالها جذب کنند. هر یک از این گونهها تعداد متفاوتی الکترون دارند که میتوانند انواع مختلفی از برانگیختگیها را تجربه کنند. به نوبه خود، هر گاز رنگ خاص خود را تولید میکند. طیف نشری اتم هیدروژن به تعدادی از سریها تقسیم شده است. طول موج این سریها به وسیله فرمول ریدبرگ به دست آمده است. خطوط طیفی مشاهده شده برای اتم هیدروژن به دلیل انتقالات الکترونی در سطوح انرژی مختلف اتم است. دستهبندی این خطوط به سریهای مختلف به وسیله فرمول ریدبرگ، قدمی مهم در شناخت مکانیک کوانتومی بود. این خطوط در طیف سنجی نجومی برای شناخت میزان هیدروژن موجود در جو و اجرام آسمانی به کار میرود.
طیف جذبی چیست؟
علاوه بر مطالعات در مورد طیف حاصل از نشر اتمها، شیمیدانها از جذب اتمی نیز برای شناسایی و کمیسازی استفاده میکنند. با توجه به تغییرات انرژی در گذار از حالت پایه به حالات برانگیخته، شیمیدانها میتوانند نوع دیگری از طیف گسسته را به دست آورند که با نام طیف جذبی اتم شناخته میشود. در این طیفها یک الگوی طولموج خاص دوباره تولید میشود که میتوان از آن برای شناسایی یک اتم استفاده کرد. در دانشگاهها و صنایع، میتوانند از اسپکتروسکوپ جذب اتمی (AA) یا اسپکتروسکوپ نشر اتمی (AE) برای تجزیه و تحلیل اتمها در یک نمونه استفاده کنند. در تصویر زیر، تفاوت طیف پیوسته، طیف جذبی و طیف نشری مشخص شده است.
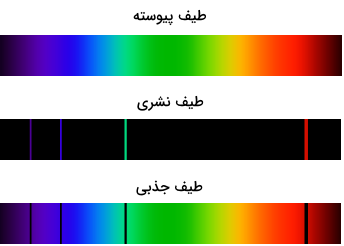
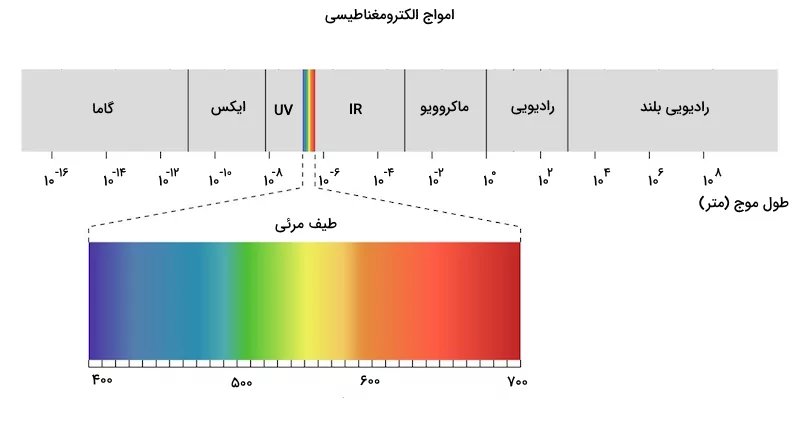
طیف پیوسته چیست؟
رنگین کمان، نمونهای از طیف پیوسته است. رنگهای نمایش داده شده در طیف پیوسته رنگین کمان، در محدوده نور مرئی ( بین ۳۸۰ تا ۷۶۰ نانومتر) قرار دارد. نور در این محدوده طول موج، با چشم غیر مسلح قابل مشاهده است. در شکل زیر، محدودههای مختلف موجهای الکترومغناطیسی به همراه طول موج و نام آنها مشخص شده است.
نور با طول موجهای کوتاهتر و فرکانس بالاتر در سمت چپ این شکل و نورهایی با طول موج بلندتر و فرکاس پایینتر در سمت راست آن قرار دارند.
اختلاف انرژی سطوح هیدروژن
اتم هیدروژن سادهترین اتم است. هسته آن از یک پروتون تشکیل شده است و یک الکترون به دور هسته میچرخد. الکترون معمولا در کمترین حالت انرژی خود به نام حالت پایه قرار دارد. حالت پایه به عنوان ۰ (صفر) الکترونولت (eV) تعریف میشود. تفاوت انرژی بین حالت پایه و اولین حالت برانگیخته ۱۰٬۲ الکترونولت (eV) است. اگر الکترون یک فوتون جذب کند، انرژی فوتون باعث بالا بردن الکترون به حالت برانگیخته میشود. سطوح مختلف انرژی لایههای الکترونی کوانتومی هستند، به این معنی که تنها سطوح انرژی خاصی مجاز هستند.
اگر یک فوتون با طول موج ۱۲۱٫۶ نانومتر (و در نتیجه انرژی ۱۰٫۲ eV) به یک الکترون در اتم هیدروژن برخورد کند، این فوتون توسط الکترون جذب میشود و الکترون را به اولین حالت برانگیخته میبرد. اگر فوتونی با طول موج ۱۰۲٫۶ نانومتر (با انرژی ۱۲٫۱ eV) بر الکترون تابیده شود، الکترون را به دومین حالت برانگیخته خواهد برد. از آنجا که حالات برانگیخته الکترون کوانتومی (بستهای) هستند، الکترونها نمیتوانند با جذب انرژیهایی بین این حالات برانگیخته شوند. به عنوان مثال، یک فوتون با انرژی ۱۱ الکترونولت نمیتواند الکترون در حالت پایه اتم هیدروژن را برانگیخته کند.
هنگامی که الکترون انرژی جذب میکند، به یک سطح انرژی بالاتر (حالت برانگیخته) میرود. برعکس، زمانی که انرژی از دست میدهد، به سطح انرژی پایینتر بازمیگردد و یک فوتون آزاد میکند. انرژی (و به دنبال آن طول موج) این فوتون برابر با تفاوت انرژی بین حالت اولیه و نهایی است. هنگام انتقال از سطح انرژی بالاتر به سطح انرژی پایینتر، الکترون فوتونی با انرژی برابر با اختلاف انرژی دو سطح منتشر میکند. طول موج فوتون منتشر شده با این اختلاف انرژی نسبت معکوس دارد و تفاوتهای کوچکتر منجر به طول موجهای بلندتر میشوند.
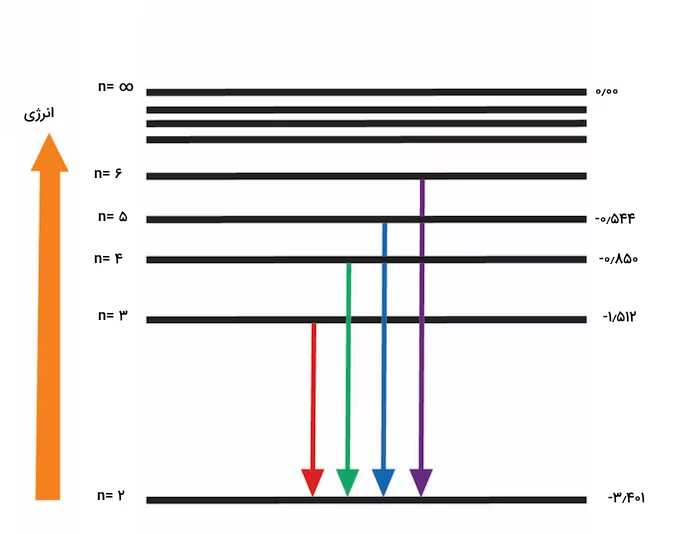
تصویر بالا نشاندهنده اختلاف انرژی سطوح مختلف اتم هیدروژن برای انتقالات الکترونی مربوط به سری بالمر است. این اختلاف انرژیها بر حسب الکترونولت اندازهگیری شده است. این اصل توضیح میدهد که چرا انتقالات مختلف فوتونهایی با طول موجهای متفاوت منتشر میکنند و خطوط متمایزی در یک طیف اتمی تشکیل میدهند.
یونیزه شدن اتم هیدروژن
اگر الکترون انرژی بیشتری از آنچه که میزان انرژی فواصل بین لایههای الکترونی آن است جذب کند، از هسته خارج شده و اتم یونیزه میشود. برای یونیزه کردن یک اتم نیاز به حداقل انرژیای داریم که به آن انرژی یونش گفته میشود. این انرژی باید به اندازهای باشد که الکترون را از مدار جاذبه هسته خارج کند.
یک الکترون ممکن است مستقیما به حالت پایه (لایه اول الکترونی) باز نگردد و ممکن است به سایر لایههای الکترونی با انرژی کمتر برود. برای مثال در سری بالمر در طیف اتم هیدروژن، الکترون از یک حالت برانگیخته بالاتر به حالت برانگیخته اول (لایه دوم الکترونی) باز میگردد. فوتونهای ساطع شده از این بازگشتها دارای طول موجهایی هستند که آنها را در محدوده نور مرئی قرار میدهند.
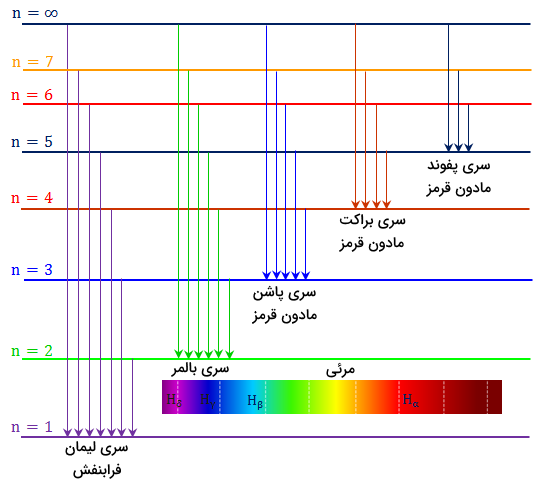
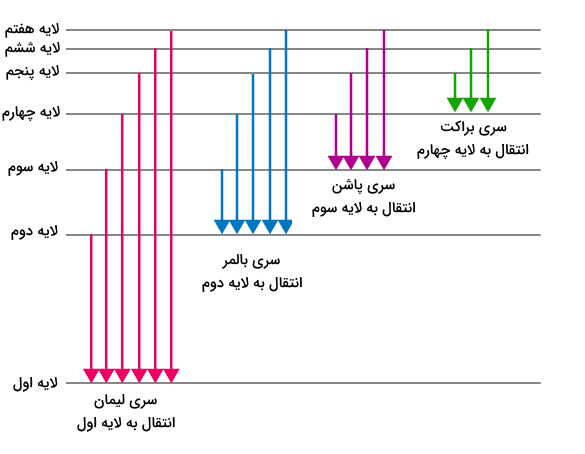
سایر خطوط طیف هیدروژن
سری بالمر در واقع بخشی از طیف نشری هیدروژن است که مربوط به انتقال یک الکترون از لایه دوم الکترونی به هر لایه دیگر میباشد. بهطور مشابه، سایر انتقالات الکترون اتم هیدروژن نیز نامهای سری خاص خود را دارند. برخی از این سریها در زیر آورده شدهاند.
- سری لایمن (Lyman Series): انتقال الکترون اتم هیدرژن به لایه اول الکترونی
- سری پاشن (Paschen Series): انتقال الکرتون اتم هیدروژن به لایه سوم الکترونی
- سری براکت (Brackett Series): انتقال الکترون اتم هیدروژن به لایه چهارم الکترونی
- سری پفوند(Pfund Series): انتقال الکترون اتم هیدروژن به لایه پنجم الکترونی
این سریها نشاندهنده بخشهای مختلف طیف انتشار هیدروژن هستند و هر کدام بازههای طولموج خاصی را پوشش میدهند. تصویر زیر نمایش دهنده این سریها و سطوح انرژی مربوط به آن ها است.
مدل اتمی بور
مدل بور یک نمای ساده از ساختار اتمی ارائه میدهد و توضیح میدهد که چگونه الکترونها در فواصل مشخصی به دور هسته میچرخند که به سطوح انرژی خاصی مربوط میشود. دراین مدل الکترونها مدارهای مشخصی به نام سطوح انرژی را اشغال میکنند بدون اینکه انرژی تابش کنند. همچنین انتقالات بین این مدارها با تغییرات انرژی همراه است، به طوری که الکترون برای حرکت بین سطوح، فوتونی را جذب یا منتشر میکند.
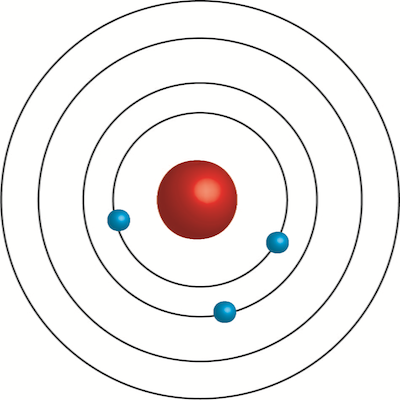
این مدل به ویژه برای توضیح طیفهای نشری اتمی مفید است. در این مدل هر انتقال به یک خط طیفی مربوط میشود. مدل بور با وجود محدودیتهایش، پایهای برای مکانیک کوانتومی فراهم کرد و به فهم رفتار اتمها کمک زیادی کرد.
خطوط طیف اتم هیدروژن
طیف هیدروژن به خطوط طیفی تابشهای منتشر شده از اتم هیدروژن گفته میشود. این خطوط طیفی بین نواحی فرابنفش و فروسرخ طیف الکترومغناطیسی قرار دارند و نتیجه انتقالات الکترونها از یک تراز انرژی به تراز دیگر هستند. این خطوط به شش سری تقسیم شده و به نام افرادی که آنها را کشف کردهاند نامگذاری شدهاند و مشخصه اتم هیدروژن محسوب میشوند. سریهای طیفی هیدروژن شامل سریهای لایمن، بالمر، پاشن، براکت، فوند و هامفری هستند. سریهای لایمن و بالمر به ترتیب در ناحیه فرابنفش و مرئی طیف قرار دارند، در حالی که سریهای پاشن، براکت، پفوند و هامفری در ناحیه فروسرخ طیف قرار میگیرند.
طیف نشری هیدروژن سادهترین طیف خطی را در میان تمام عناصر دارد و گستره وسیعی از طولموجها، از ناحیه فرابنفش تا فروسرخ، را پوشش میدهد. در میان این سریها، سری بالمر به دلیل وجود تعداد قابل توجهی از خطوط طیفی آن در ناحیه مرئی طیف الکترومغناطیسی، آسانترین سری برای مطالعه بوده است. در جدول زیر، دستهبندی سریهای مختلف در طیف اتم هیدروژن مشخص شده است.
| نام سری طیف | محدوده موج | طول موج بر حسب آنگستروم |
| سری لیمن | فرابنفش | ۹۲۰ تا ۱۲۰۰ |
| سری بالمر | نور مرئی | ۴۰۰۰ تا ۶۵۰۰ |
| سری پاشن | مادون قرمز | ۹۵۰۰ تا ۱۸۷۵۰ |
| سری براکت | مادون قرمز | ۱۹۴۵۰ تا ۴۰۵۰۰ |
| سری پفوند | مادون قرمز | ۳۷۸۰۰ تا ۷۵۰۰۰ |
| سری هامپفری | مادون قرمز | بیش از ۷۵۰۰۰ |
به دست آوردن خطوط طیفی هیدروژن
خطوط طیفی هیدروژن به وسیله طیف سنجی از گاز هیدروژن به دست میآید. لوله تخلیه هیدروژن یک لوله باریک است که حاوی گاز هیدروژن تحت فشار کم بوده و در دو سر آن الکترودهایی قرار دارد. اگر ولتاژ بالایی (حدود ۵۰۰۰ ولت) اعمال شود، لوله با یک درخشش صورتی روشن میدرخشد. اگر نور عبوری از لوله از یک منشور یا شبکه پراش عبور داده شود، به رنگهای مختلف خود تجزیه میشود. این تنها بخشی از طیف نشری هیدروژن است. بیشتر این طیف برای چشم غیرقابل دیدن است، زیرا در ناحیه فروسرخ یا فرابنفش طیف الکترومغناطیسی قرار دارد.
در تصویر، بخشی از لوله تخلیه هیدروژن در سمت چپ و سه خط واضحتر در ناحیه مرئی طیف در سمت راست نشان داده شده است. (لکهها، بهویژه در سمت چپ خط قرمز، ناشی از نقص در نحوه عکاسی بوده و قابل چشمپوشی هستند.)

یادگیری شیمی دانشگاهی با فرادرس
یکی از مهمترین کاربردهای علم شیمی، شناسایی و تشخیص مواد است. طی سالیان گذشته، روشهای متفاوت و دستگاههای گوناگونی برای این هدف اختراع شده است. طیف خطی نشری نیز یکی از پرکاربردترین روش های شناسایی و تشخیص مواد است زیرا هر عنصر طیف نشری خطی منحصر به فردی دارد. برای یادگیری روشهای شناسایی مواد باید با مباحثی چون روشهای دستگاهی، روشهای جداسازی، اجزای دستگاههای نوری، طیفهای اتمی و ... آشنا شوید. پیشنهاد میکنیم برای یادگیری بیشتر و بهتر در باره این مباحث و مفاهیم، به مجموعه فیلم آموزش شیمی از دروس دانشگاهی تا کاربردی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که لینک آنها در ادامه آمده است، می توانید به آموزشهای بیشتری در زمینه روشهای طیف سنجی دسترسی داشته باشید.
اهمیت سری بالمر در طیف هیدروژن
در این مطلب از مجله فرادرس آموختیم طیف هیدروژن و خصوصا سری بالمر در طیف هیدروژن یکی از مهمترین قدمها برای اثبات کوانتومی بودن ساختار الکترونی اتم بوده است. کشف سری بالمر در نهایت به کشف ۵ سری دیگر از سریهای طیف هیدروژن انجامید. یکی از مهمترین اهمیتهای سری بالمر، استفاده از آن در علوم اخترشناسی است. خطوط سری بالمر در بسیاری از اجرام آسمانی پدیدار شده است که این نشاندهنده این امر است که قسمت اعظمی از سیارات از عنصر هیدروژن تشکیل شدهاند.

همچنین، دو خط اول از سری بالمر در طیفهای دریافت شده از خورشید و اتمسفر اطراف آن دیده شدهاند. دستهبندی ستارگان بر اساس دمای سطح آنها بر اساس میزان انرژی و فرکانس خطوط طیفی آنها انجام میشود و سری بالمر در طیف هیدروژن نقشی مهم در تعیین این دستهبندیها دارد. به علاوه، از سری بالمر در تعیین و شناسایی ستارگان دوگانه، سیارات فراخورشیدی، ستارگان نوترونی و سیاهچالهها نیز استفاده میشود.