کریسپر چیست؟ – به زبان ساده
کریسپر در اصل سیستم ایمنی باکتریها و آرکیها است و به آنها کمک میکند که در برابر ویروسهای مهاجم از خود محافظت کنند. با ورود یک ویروس یا دیگر عوامل مهاجم به درون سلول باکتری، این سلول بخشی از DNA متجاوز را در درون ژنوم خود ادغام میکند و به این ترتیب قادر خواهد بود در صورت آلودگی مجدد به همان ویروس از خود محافظت کند. این فرآیند تا حدودی مشابه با سیستم ایمنی انسان است که برای پیشگیری از آلودگی مجدد با یک ویروس، سیستم ایمنی خاطره را میسازد و ما پس از یک بار مواجهه با عامل بیماریزا و تجربه بیماری، در آینده بیماری را با شدت اولین باری که بیمار شدیم، تجربه نخواهیم کرد.
- اجزای کلیدی و عملکرد سیستم کریسپر را یاد میگیرید.
- با طراحی، تولید و انتقال gRNA و آنزیم Cas9 آشنا میشوید.
- نحوه انجام تکنیکهای حذف، اضافه و تنظیم ژن با کریسپر را خواهید آموخت.
- توانایی ارزیابی محدودیتها، چالشهای فنی و استراتژیهای کاهش اثرات ناخواسته را بهدست میآورید.
- شناسایی روشهای نوین ویرایش پایه و پیشرفته ژنوم را یاد خواهید گرفت.
- کاربردهای بالینی، پژوهشی و بیوتکنولوژیک کریسپر را بررسی خواهید کرد.


در این مطلب از مجله فرادرس قصد شناخت کریسپر به عنوان سیستم ایمنی باکتریها و ابزاری برای ویرایش ژنوم را داریم و پس از آن به بررسی فواید کریسپر در مطالعات تحقیقاتی و درمان بیماریهای ژنتیکی میپردازیم. بنابراین با مطالعه این مطلب تا انتها با کریسپر و اجزای ساختاری آن آشنا میشویم، سپس یاد میگیریم که چه تغییراتی در این سیستم ایجاد شد تا بتوان از آن به عنوان ابزاری برای ویرایش ژنوم استفاده کرد. با وجود کارآیی بالای کریسپر در ویرایش ژنوم که این موضوع نیز مورد بحث قرار خواهد گرفت، این تکنولوژی پیشرفته محدودیتهایی نیز دارد که در بخشی مجزا به آنها خواهیم پرداخت.
کریسپر
واژه «کریسپر» (CRISPR) ریشه در نام تناوبهای خاصی در ژنوم میکروبهایی مانند باکتریها و آرکیها دارد که آنها را با عنوان «تناوبهای کوتاه معکوس فاصلهدار منظم خوشهای» (Clustered Interspaced Short Palindromic Repeats) میشناسیم. کریسپر در حقیقت سیستم ایمنی این جانداران است و از آنها در برابر ویروسهای مهاجم محافظت میکند.
در صورتی که قصد استفاده از فناوری کریسپر برای ویرایش ژن را دارید، پیشنهاد میدهیم از فیلم آموزش آشنایی با فناوری کریسپر برای اصلاح ژن فرادرس استفاده نمایید که این زمینه را به طور کامل مورد بحث قرار میدهد. برای دسترسی سادهتر به این آموزش، لینک آن در کادر زیر درج شده است.
با ورود یک ویروس مهاجم به درون سلول باکتریایی، باکتری بخشی از ژنوم ویروس را در ژنوم خود ادغام میکند. با رونویسی از روی این بخش از ژنوم، نوعی RNA تولید خواهد شد که که به آن «RNA راهنما» (Guide RNA) میگوییم. توالی RNA راهنما به کریسپر کمک میکند که در صورتی که ویروس دیگری با توالی ژنومی مشابه به باکتری حمله کرد، آن را شناسایی کند؛ زیرا توالی RNA راهنما مکمل با بخشی از ماده ژنتیکی ویروس است و با اتصال به آن به آنزیمهای نوکلئاز خاصی مانند CAS9 اطلاع میدهد که این قطعه DNA یا RNA متعلق به باکتری نیست و باید تجزیه شود. به این ترتیب باکتری تبدیل به ماشین همانندسازی ویروس نخواهد شد.
از کریسپر در دنیای زیستشناسی مولکولی به عنوان ابزار ویرایش ژنوم تمام سلولهای زنده استفاده میشود. این روش به دو جزء اصلی کریسپر، یعنی موارد زیر نیاز دارد.
- RNA راهنما
- Cas9
مکانیسم ویرایش ژنوم با استفاده از کریسپر دارای ۳ مرحله است.
- شناسایی
- شکست
- ترمیم
با وجود کاربرد کریسپر در درمان بیماریها به وسیله ویرایش ژنوم، مانعهایی نیز سر راه پیادهسازی روشهای مبتنی بر کریسپر در مقیاس بالینی وجود دارند که در ادامه به چند مورد از آنها اشاره میکنیم.
- ایمنیزایی
- سیستم تحویل کارآمد
- اثرات ناخواسته
- مسائل اخلاقی
کریسپر مخفف چیست؟
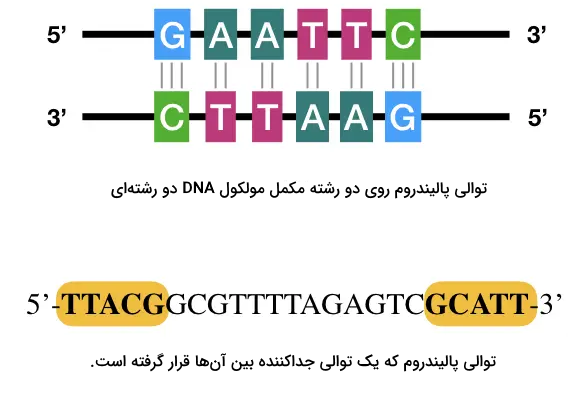
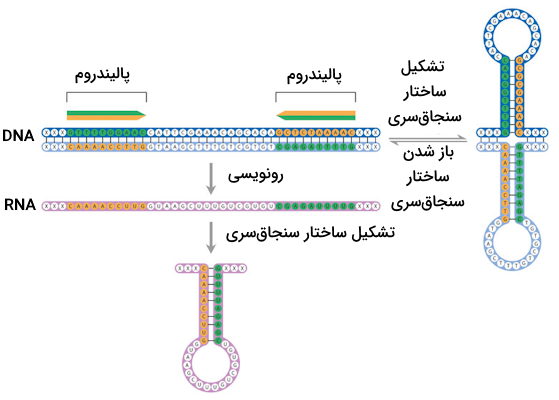
کریسپر مخفف «تناوبهای کوتاه پالیندروم فاصلهدار منظم خوشهای» (Clustered Interspaced Short Palindromic Repeats | CRISPR) است. توالیهای پالیندروم توالیهایی از اسیدهای نوکلئيک موجود روی DNA دو رشتهای هستند که یک ویژگی خاص دارند. تصور کنید که یک توالی را از جهت '۵ به '۳ بخوانیم و یادداشت کنیم، در صورتی که این توالی پالیندروم باشد، هنگام خوانش رشته مکمل از جهت '۵ به '۳ با همان توالی یا ترتیب نوکلئوتیدها مواجه خواهیم شد. برای درک بهتر توالیهای پالیندروم به تصویر زیر توجه کنید.
یادگیری ژنتیک مولکولی با فرادرس
ژنتیک مولکولی یکی از شاخههای زیستشناسی است که به مطالعه DNA موجودات زنده و فعالیتهای مولکولهای اطلاعاتی میپردازد. با توجه به پیچیدگیهای مباحث ژنتیک مولکولی نیاز است که پیش از بررسی مواردی پیشرفته مانند کریسپر با مفاهیم پایه مانند ساختار DNA، روشهای همانندسازی آن، انواع جهشها و غیره آشنایی داشته باشیم.
برای تسلط بر بخشهای مختلف ژنتیک مولکولی باید قدم به قدم پیش رفت و پس از آشنایی با مسائل اساسی به سراغ روشهای پیشرفته رفت که امروزه در حوزههای مختلف بیوتکنولوژی کاربرد دارند. با پیشرفت تکنولوژی ابزارهای مختلفی نیز طراحی شدهاند که مسیر تحقیقات مولکولی را کوتاهتر کردهاند، یادگیری این ابزارها و روشهای تحلیلی یکی از ضروریات دنیای بیوتکنولوژی حال حاضر است که بهترین روش یادگیری آنها نیز استفاده از فیلمهای آموزشی است.
در ادامه با تعدادی از فیلمهای آموزشی فرادرس آشنا میشویم که به ما در تسلط به مفاهیم پایه و یادگیری ابزارهای ژنتیک مولکولی کمک میکنند.
- فیلم آموزش جامع ژنتیک مولکولی فرادرس
- فیلم آموزش شبیه سازی روند کلونینگ و PCR با نرم افزار اسنپ ژن SnapGene فرادرس
- فیلم آموزش آنالیز توالی ژن با نرم افزارهای بیوانفورماتیک فرادرس
- فیلم آموزش طراحی پرایمر با نرم افزار الیگو Oligo فرادرس
کریسپر CAS 9 چیست؟
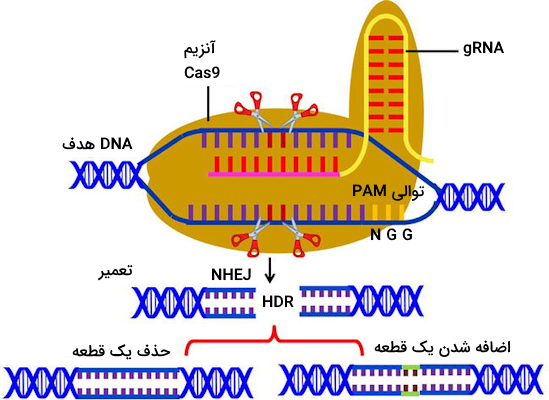
سیستم کریسپر-Cas9 ریشه در ایمنی تطبیقی باکتریها و آرکیها در برابر عوامل مهاجمی مانند ویروسها دارد. در این سیستم از نوکلئازهای Cas استفاده میشود که آنزیمهایی با قابلیت اتصال به DNA هستند. این نوکلئازها با اتصال به رشته DNA میتوانند «شکستهای دو رشتهای» (Double-Stranded Breaks | DSBs) ایجاد کنند.
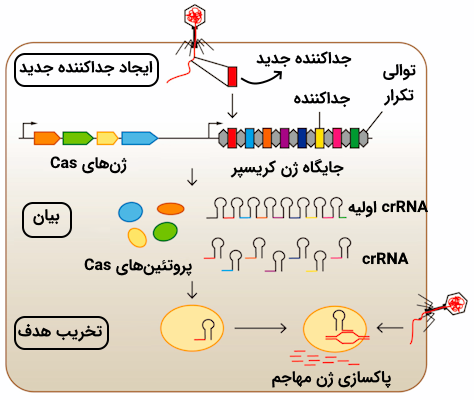
باکتریها زمانی که درگیر آلودگی ویروسی میشوند از توانایی این آنزیمها به منظور برش بخشی از DNA ویروس استفاده میکنند. به این قطعه DNA بریده شده توسط Cas «پروتوسپیسر» (Protospacer) یا «جداکننده» میگوییم. این قطعه به عنوان ایمنی خاطره در ژنوم باکتری، در کنار قطعاتی که از ویروسهای دیگر جدا شدهاند، ادغام میشود.
نکتهای که در زمان ادغام قطعات ویروسی در DNA باکتریایی وجود دارد این است که قطعات جدا شده از ویروسهای مختلف با فاصلهای خاص در کنار یکدیگر قرار میگیرند. در اصل توالیهای تکراری معکوسی در ژنوم باکتری وجود دارند که هر قطعه ویروسی بین آنها قرار داده میشود. برای درک بهتر اضافه شدن قطعات DNA ویروسی پیشنهاد میدهیم که به تصویر زیر توجه کنید.
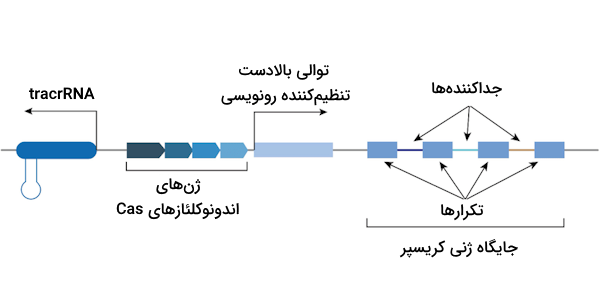
در صورت آلودگی مجدد باکتری با همان ویروس خاص، باکتری قادر است که ویروس را شناسایی کرده و به کمک آنزیم نوکلئازی Cas9 آن را نابود کند. فعالیت این آنزیم به دو عامل زیر وابسته است.
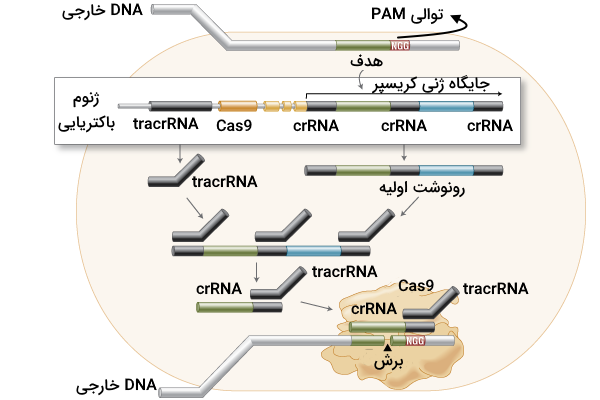
- CRISPR RNA یا crRNA: این RNA، مکمل قطعه پروتواسپیسر است.
- trans-activating CRISPR RNA یا tracrRNA: این مولکول به عنوان RNA پشتیبان فعالیت میکند.
این دو نوع مولکول RNA کمپلکسی را شکل میدهند که با عنوان «RNA راهنما» (gRNA) شناخته میشود. حالا که با gRNA و Cas9 آشنا شدیم باید گفت که Cas9 به عنوان یک قیچی عمل میکند که توسط gRNA هدایت میشود، بنابراین این دو مولکول در ایجاد سیستم ایمنی تطبیقی باکتریها با یکدیگر همکاری دارند.
پیش از ایجاد برش بر روی DNA آنزیم Cas9 به عنوان یک ابزار جستوجو فعالیت میکند که DNA ویروسی را برای پیدا کردن یک توالی خاص میگردد. این توالی که هدف Cas9 است را «Protospacer Adjacent Motif» یا «PAM» مینامیم. هنگامی که آنزیم موفق به شناسایی توالی PAM میشود، منطقه بالادست این نقطه را بررسی میکند. در صورتی که در توالی بالادست PAM بخشی را پیدا کند که مکمل با gRNA است، دو رشته DNA را برش میدهد و به این ترتیب DNA ویروسی از کار میافتد؛ دلیل این از کارافتادگی نیز این است که ویروسها قابلیت ترمیم DNA خود را ندارند.
تغییرات ایجاد شده در کریسپر-Cas9
دانشمندان پس از مطالعه ساختار و مکانیسم کریسپر-Cas9 در این سیستم تغییری ایجاد کردند که آنها را قادر میساخت تا از آن به منظور ایجاد برش در هر منطقهای از ژنوم موجودات استفاده کنند. در ادامه با این تغییر و کارکرد آن آشنا می شویم.
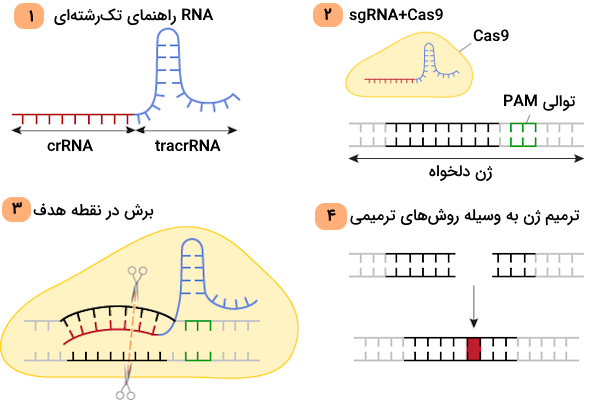
RNA راهنما بخشی از سیستم کریسپر-Cas9 است که محل برش را شناسایی میکند، بنابراین این کمپلکس را به نحوی تغییر دادند که یک RNA راهنمای تک رشتهای ایجاد شود، این RNA راهنمای جدید را با عنوان «RNA راهنمای تک رشتهای» (Single Guide RNA | sgRNA) میشناسیم. یکی از مهمترین مزایای تولید sgRNA این است که استفاده از آن برای دستکاریهای ژنتیکی ساده و مقرون به صرفه است.
در این روش پژوهشگران تنها یک sgRNA جدید میسازند و پس از آن Cas9 در ژنوم هدف برش ایجاد میکند. در این زمینه باید یک موضوع را همواره به یاد داشت، در توالی هدف باید PAM وجود داشته باشد وگرنه Cas9 به مشکل میخورد. با این توضیحات میتوان اینگونه نتیجهگیری کرد که روش ویرایش ژنی کریسپر-Cas9 دو مرحله اصلی دارد.
- ایجاد برش در دو رشته DNA
- استفاده از مسیرهای ترمیم DNA
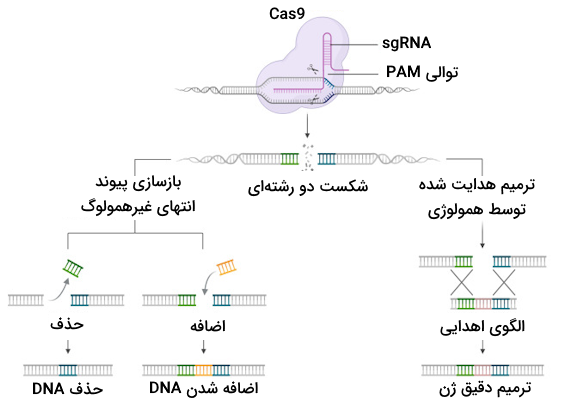
با وجود آنکه چندین مسیر متفاوت برای ترمیم DNA وجود دارد، دو مورد از آنها برای ویرایش ژن کاربرد دارند.
- «بازسازی پیوند انتهای غیرهمولوگ» (Non-Homologous End Joining | NHEJ): از این روش برای غیرفعالسازی ژنها استفاده میشود.
- «ترمیم هدایتشده توسط همولوژی» (Homology-Directed Repair | HDR): این روش در فرآیند اضافه کردن ژنهای جدید یا قطعات ژنتیکی کاربرد دارد.
در صورتی که تمایل به کسب اطلاعات کاملتر در مورد روشهای ترمیم DNA آسیب دیده دارید، پیشنهاد میکنیم مطلب «ترمیم دنا (DNA) – به زبان ساده» از مجله فرادرس را مطالعه کنید.
روشها و تکنیکهای کریسپر
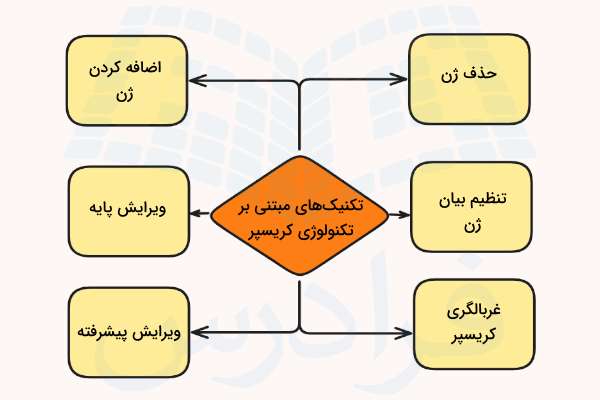
کریسپر یک روش بسیار قدرتمند برای ویرایش ژنوم است و کاربردهای بسیاری نیز دارد. در این بخش با روشهای متفاوت استفاده از کریسپر آشنا خواهیم شد که شامل موارد زیر هستند.
- «حذف ژن با استفاده از کریسپر» (CRISPR Gene Knockout)
- «اضافه کردن ژن با استفاده از کریسپر» (CRISPR Knock-in)
- تنظیم بیان ژن با استفاده از CRISPRa و CRISPRi
- «غربالگری کریسپر» (CRISPR Screens)
- «ویرایش پایه» (Base Editing)
- «ویرایش پیشرفته» (Prime Editing)
در مطالعات تحقیقاتی مختلف متناسب با نیازهای متفاوتی که وجود دارند از این روشها استفاده میشوند که نتایج گوناگونی نیز ایجاد میکنند، به همین دلیل در ادامه با جزئیات روند هر یک از آنها و اثراتی که بر ژنوم سلولها ایجاد میکنند آشنا میشویم.
حذف ژن با استفاده از کریسپر
در صورتی که CAS9 هر دو رشته را برش دهد، به احتمال زیاد ناحیه برش خورده با استفاده از روش ترمیمی «پیوند انتهایی غیر همولوگ» (NHEJ) ترمیم میشود، اما باید توجه داشت که این روش درصد خطای بالایی دارد و به طور معمول در طی آن یک یا تعدادی نوکلئوتید به DNA اضافه میشود یا تعدادی از نوکلئوتیدهای آن حذف میشوند که این واقعه را با عنوان «درج-حذف» (Insertion-Deletion | Indel) میشناسیم.
در صورتی که درج-حذف در ناحیه کدکننده ژنی اتفاق بیفتند، ممکن است چهارچوب خوانش ژن تغییر کند و به این ترتیب «جهش تغییر چهارچوب» (Frameshift Mutation) رخ دهد. جهش تغییر چهارچوب باعث غیرفعال شدن ژن میشود. این شرایط را با عنوان «حذف ژن» (Gene Knockout | KO) توصیف میکنیم.
یکی از راههایی که میتوان احتمال حذف ژن را بالا برد، استفاده از چندین RNA راهنما است که میتوانند محدوده ژنی مورد نظر را هدف قرار دهند، این روش محبوبیت بالایی دارد و در تحقیقات مختلف از آن استفاده میشود که در ادامه تعدادی از این حوزههای تحقیقاتی را معرفی میکنیم.
- «ژنومیکس عملکردی» (Functional Genomics)
- «آنالیز مسیر» (Pathway Analysis)
- «داروپژوهی و غربالگری» (Drug Discovery And Screening)
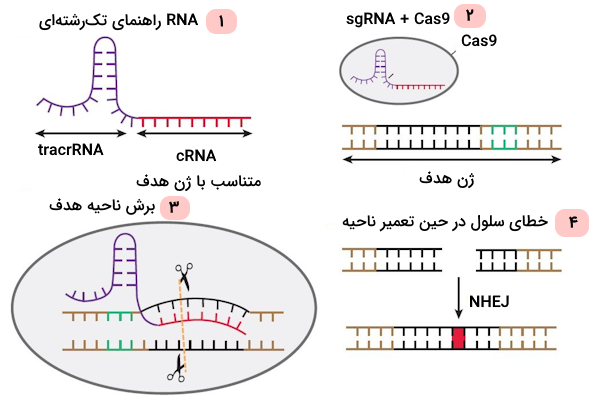
اضافه کردن ژن با استفاده از کریسپر
زمانی که Cas9 هر دو رشته DNA را برش میدهد، یک روش ترمیمی دیگر نیز وجود دارد که آن را «ترمیم هدایت شده توسط همولوژی» (HDR) مینامیم. این روش ترمیمی به پژوهشگران فرصت میدهد که یک قطعه DNA جدید یا یک ژن کامل را به DNA باکتری اضافه کنند. توجه داشته باشید که برای آن که با موفقیت ژنی را به DNA میزبان منتقل کنیم، باید ابتدا الگویی برای ترمیم DNA مشخص شود؛ زیرا در روش ترمیم همراستا با همولوژی از الگوی DNA برای سنتز مجدد آن استفاده میشود.
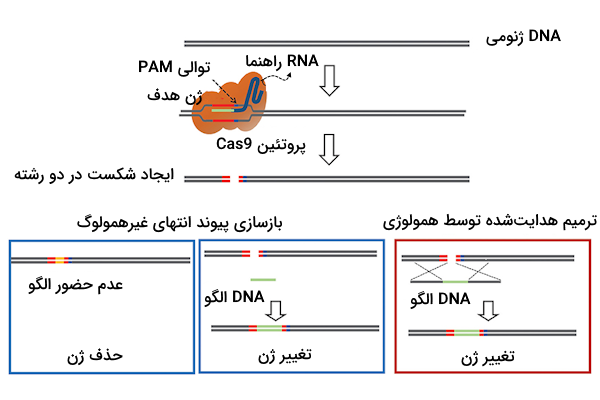
تنظیم بیان ژن با استفاده از کریسپر
در دو بخش قبل متوجه شدیم که از سیستم کریسپر-Cas9 میتوان برای حذف یا اضافه کردن ژن استفاده کرد، اما با ایجاد تغییرات اندکی میتوان از این روش برای تنظیم بیان ژنها نیز استفاده کرد. تنظیم بیان ژن با استفاده از کریسپر با دو هدف مختلف فعالسازی بیان ژن یا ممانعت از بیان ژن انجام میشود که هر روش را با نام مختص به خود میشناسیم.
- «فعالسازی با استفاده از کریسپر» (CRISPR Activation | CRISPRa): این روش برای افزایش بیان ژن مورد استفاده قرار میگیرد.
- «ایجاد تداخل با استفاده از کریسپر» (CRISPR Interference | CRISPRi): این روش برای کاهش بیان ژن مورد استفاده قرار میگیرد.
هر دو این روشها وابسته به استفاده از نوعی خاص از آنزیم Cas9 هستند که برای انجام اهداف موردنظر مهندسی شده است و آن را «Cas9 غیرفعال» (Dead Cas9| dCas9) مینامیم. Cas9 غیر فعال توانایی ایجاد برش روی DNA را ندارد، اما ویژگی متمایز آن این است که مولکولهای اثرگذار بر رونویسی را به همراه خود به سمت ژن هدف میبرد و به این ترتیب میتواند بیان آن ژن را تنظیم کند.
تنظیمکنندگان ژن در حوزههای مطالعاتی مختلفی ایفای نقش میکنند که در ادامه تعدادی از آنها را نام میبریم.
- زیستشناسی تکوینی
- بیماریهای عفونی
- بیماریهای پیشرونده
- ژنومیکس عملکردی
- غربالگری برای عناصر ژنتیکی موثر بر مقاومت دارویی
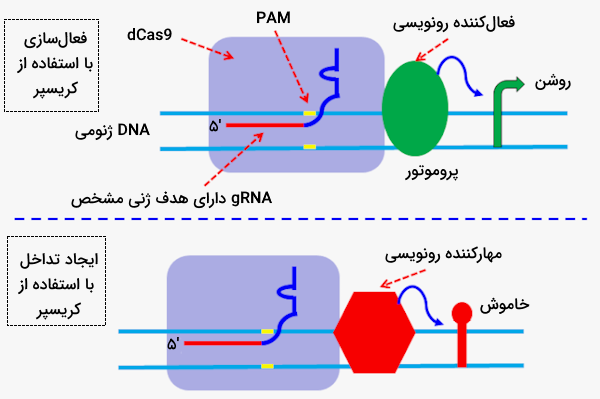
غربالگری کریسپر
فناوری کریسپر-cas9 این امکان را ایجاد کرده است که مطالعات غربالگری در زمینه تولید دارو در سطحی گسترده و با دقتی بالا انجام شوند، این فناوری در آسانتر شدن کشف ارتباط بین ژنوتیپ و فنوتیپ به ما کمک میکند. غربالگری کریسپر به طور معمول شامل مراحل زیر است.
- کتابخانهای بزرگ از sgRNAها تولید میشود که ژنهای مختلف را هدف قرار میدهند.
- یک رده سلولی خاص را در سطح گستردهای ویرایش میکنند.
- اثرات ویرایشهای انجام شده را در فنوتیپ سلولها تحلیل میکنند.
با حذف کردن چندین ژن در یک رده سلولی سالم، پژوهشگران میتوانند ژنهای بیماریزایی که در ایجاد بیماریهای مختلف نقش دارند را شناسایی کنند. حذف ژن در سلولهای بیمار کاربرد متفاوتی دارد، در این دسته از سلولها با حذف ژنها میتوان متوجه شد که هدف ایدهآل یک دارو چه ژنی است و باید به چه ژنهایی با هدف درمان بیماری حمله کرد.
غربالگری کریسپر نتایجی ارائه میدهد که نوسان زیادی بین دادهها وجود ندارد و احتمال کمتری برای از بین رفتن سلولهای هدف یا قابل مطالعه نبودن آنها در مقایسه با غربالگری RNAi وجود دارد. غربالگری RNAi روشی است که پیش از کریسپر برای کشف داروها استفاده میشد. با توجه به این نکات میتوان گفت که استفاده از روش حذف ژن به کمک کتابخانه sgRNA، روشی قابل اتکا برای شناسایی و تائید اهداف ژنی مناسب است.
ویرایش پایه و ویرایش پیشرفته
بر اساس کریسپر فناوریهای توسعهیافتهای ایجاد شدهاند که با دو مورد از آنها در این بخش آشنا میشویم.
- «ویرایش پایه» (Base Editing)
- «ویرایش پیشرفته» (Prime Editing)
این دو فناوری بر اساس اصول کریسپر طراحی شدهاند، اما بسیار دقیقتر از حالت طبیعی عمل میکنند، به عنوان مثال آنها میتوانند به دقت تغییرات تک نوکلئوتیدی ایجاد کنند. یکی از مهمترین نکاتی که در مورد این دو فناوری باید به آن اشاره کرد این است که ویرایش پایه و ویرایش پیشرفته بدون ایجاد برش در دو رشته DNA هدف، اثر خود را ایجاد میکنند.
ویرایش پایه
در ویرایش پایه از دو نوع خاص Cas9 استفاده میشود.
- «Cas9 غیرفعال» (dCas9): این آنزیم توانایی ایجاد برش در رشته DNA را ندارد.
- «Cas9 نیکاز» (nickase Cas9 | nCas9): این آنزیم میتواند «شکستهای تک رشتهای» (single-stranded breaks | SSBs) در مولکول DNA ایجاد کند.
با اتصال هر یک از این دو آنزیم به آنزیم تغییردهنده DNA، پژوهشگران قادر به تغییر نوکلئوتیدهای خاصی هستند که به عنوان اهداف خود مشخص کردهاند. اما این روش محدودیتهایی نیز دارد که یکی از آنها این است که نمیتوان برای تغییر هر نوکلئوتیدی از این روش استفاده کرد، در حقیقت ویرایش پایه تنها میتواند نوکلئوتیدهای خاصی را تغییر دهد که همین مسئله باعث به وجود آمدن فناوری ویرایش پیشرفته شد.
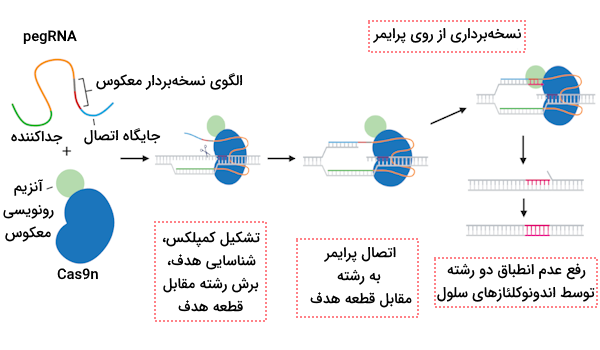
ویرایش پیشرفته
در ویرایش پیشرفته آنزیم nCas9 به دو جزء متصل میشود.
- آنزیم نسخهبرداری معکوس مهندسی شده
- «RNA راهنمای ویرایش پیشرفته» (prime Editing Guide RNA | pegRNA)
در بررسی ساختار pegRNA باید گفت که این RNA راهنمای خاص دارای دو بخش متفاوت است، یکی از این بخشها باعث میشود که RNA ناحیه هدف خود را پیدا کند و بخش دیگر حاوی نوکلئوتید یا نوکلئوتیدهای جایگزین دلخواهی است که قصد داریم برای ترمیم DNA پس از ایجاد شکست دو رشتهای مورد استفاده قرار بگیرند.
پس از آن که یک رشته با استفاده از روش ویرایش پیشرفته دچار تغییر شد، رشته مکمل نیز میتواند اصلاح شود. برای ویرایش رشته مکمل از یک RNA راهنما دیگر و آنزیم nCas9 استفاده میشود تا در این رشته برش ایجاد کنند و در گام بعد از رشته اصلاح شده به عنوان الگویی برای ترمیم رشته مکمل استفاده میشود.
کارایی روش ویرایش پیشرفته به حدی بالاست که طبق پیشبینیها ممکن است بتوانیم حدود ۸۹ درصد جهشهای ژنتیکی انسان را با استفاده از آن درمان کنیم.
جدول تفاوتهای ویرایش پایه و پیشرفته
در هنگام آشنایی با ویرایش پایه متوجه شدیم که محدودیتهای این روش ویرایشی باعث شکلگیری ویرایش پیشرفته شده است، بنابراین این دو روش شباهتهای زیادی با یکدیگر دارند اما به سبب تغییراتی که ایجاد شده است، ویرایش پیشرفته تفاوتهای چشمگیری نیز با ویرایش پایه دارد که در این بخش قصد داریم به آنها بپردازیم.
| ویرایش پیشرفته | ویرایش پایه |
| ایجاد یا حذف جهشها | ایجاد جهشهای جایگزینی |
| نرخ خطای پایین | |
| توانایی ایجاد هر چهار نوع جهش نقطهای از نوع تغییر نوکلئوتید پورینی با پیریمیدینی | قابل اعتماد، قابل پیشبینی و خروجی ژنتیکی کارآمد |
| توانایی ایجاد هر چهار نوع جهش نقطهای از نوع تغییر نوکلئوتید پورینی با پورینی و پیریمیدنی با پیریمیدینی | عدم نیاز به ترمیم وابسته به الگوی HDR |
| توانایی اضافه کردن نوکلئوتید تا ۴۵ جفت باز | ممانعت از شکست دو رشتهای DNA و سازماندهی مجدد ژنومی در مقیاس بزرگ |
| توانایی حذف نوکلوئوتید تا ۸۰ جفت باز |
اجزای مولکولی و ساختارهای مهم در کریسپر Cas9
سیستم کریسپر Cas9 را بر اساس ساختار و فعالیتهای پروتئینهای Cas میتوان به دو دسته تقسیم کرد.
- «دسته اول» (Class I): نوع یک، سه و چهار در این دسته جای میگیرند.
- «دسته دوم» (Class II): نوع دو، پنج و شش نیز در این دسته جای میگیرند.
سیستمهای دسته اول از کمپلکسهای پروتئین Cas تشکیل شده است که دارای چندین سابیونیت یا زیرواحد هستند، اما سیستمهای گروه دوم تنها از یک پروتئین Cas استفاده میکنند. با توجه به همین موضوع میتوان گفت که ساختار سیستمهای دسته دوم به نسبت دسته اول سادهتر است و همین موضوع باعث شده است که مطالعات بیشتری روی آنها صورت گرفته باشد و به سبب شناخته شدهتر بودن، برای انجام تحقیقات مهندسی ژنتیک نیزی محبوبتر هستند.
در بخش اول گفتیم که دو جزء اصلی کریسپر را میتوان RNA راهنما و Cas9 دانست، بنابراین در ادامه این بخش با این دو بیشتر آشنا میشویم، اما در حین بررسی سیستم کریسپر تنها این دو مولکول نیستند که باید آنها را شناخت. در مولکول DNA نیز توالیهایی هستند که ساختار آنها در عملکرد سیستم اثرگذار است، توالی PAM که در بخش کریسپر Cas9 از آن نام بردیم، یکی از همین توالیها است که در این بخش به معرفی آن نیز میپردازیم.
پروتئینهای Cas
پروتئینهای Cas آنزیمهایی با خاصیت اندوکلئازی هستند که انواع مختلفی از آنها در باکتریها آرکیها شناسایی شدهاند. مشهورترین پروتئین Cas که بیش از دیگر انواع این آنزیمها مورد مطالعه قرار گرفته، Cas9 است اما در هنگام طراحی آزمایشهایی که برای ویرایش ژنوم از تکنولوژی کریسپر استفاده میکنند، باید به سراغ مناسبترین نوع Cas رفت تا احتمال موفقیت ویرایش ژنوم افزایش یابد.
Cas9
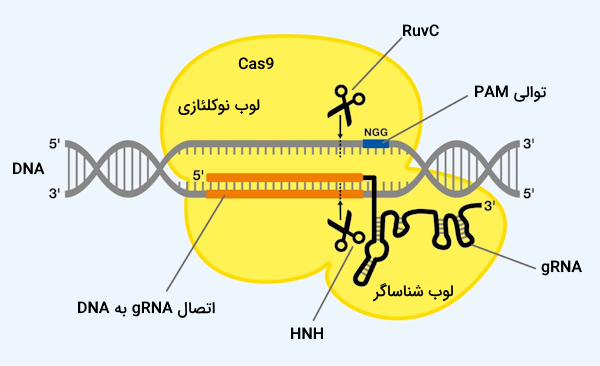
پروتئین Cas9 اولین نوع از پروتئينهای Cas است که کشف و شناخته شد، این آنزیم که در ساختار خود ۱۳۶۸ آمینواسید دارد، پروتئین بزرگی به حساب میآید که دارای چندین «دومین» (Domain) در ساختار خود است. Cas9 در حقیقت یک آنزیم با قدرت اندونوکلئازی است که میتواند در هر دو رشته توالی DNA دلخواه برش ایجاد کند و به همین دلیل به آن قیچی ژنتیکی نیز میگویند. آنزیم Cas9 دارای دو بخش اصلی است.
- لوب «شناساگر» (Recognition | REC): این لوب از دو دومین با نامهای «REC1» و «REC2» تشکیل شده است که مسئول اتصال به RNA راهنما هستند.
- لوب «نوکلئازی» (Nuclease | NUC): این لوب از سه دومین با نامهای «RuvC» ،«HNH» و «دومین تعامل کننده با PAM» تشکیل شده است. RuvC و HNH هر کدام مسئول برش دادن یکی از رشتههای DNA هستند ولی دومین تعامل کننده با PAM مسئولیت شناسایی توالی PAM و شروع فرآیند اتصال آنزیم به DNA را برعهده دارد.
RNA راهنما
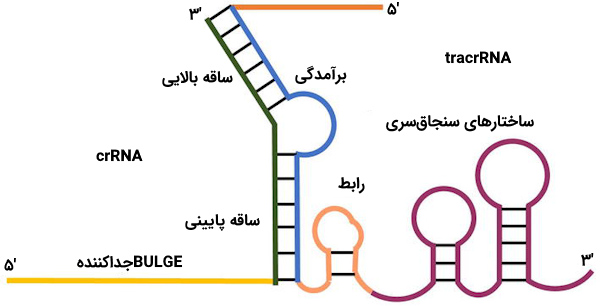
ساختار RNA راهنما نیز به دو بخش تقسیم میشود.
- CRISPR RNA | crRNA: این بخش حدود ۱۸ الی ۲۰ جفت باز طول دارد و وظیفه آن جفت شدن با DNA هدف است. در حقیقت در DNA هدف، توالی مکمل این بخش از RNA راهنما وجود دارد که crRNA میتواند با آن جفت شود.
- Trans-Activating CRISPR RNA | tracrRNA: این بخش رشتهای بلند است که دارای لوپهای فراوانی نیز هست. tracrRNA به عنوان محل اتصال Cas9 فعالیت میکند.
در پروکاریوتها، عملکرد RNA راهنما شناسایی DNA ویروسی است ولی زمانی که از کریسپر به عنوان ابزار ویرایش ژنوم استفاده میکنیم، میتوان این دو بخش را به یکدیگر متصل کرد و به طور مصنوعی در آزمایشگاه یک مولکول RNA تک رشتهای ساخت که به آن «RNA راهنمای تک رشتهای» (sgRNA) میگوییم. به کمک sgRNA و طراحی متفاوتی که متناسب با پروژه تحقیقاتی میتوان برای سنتز آن انجام داد، پژوهشگران قادر به هدف قرار دادن ژنهای دلخواه خود هستند.
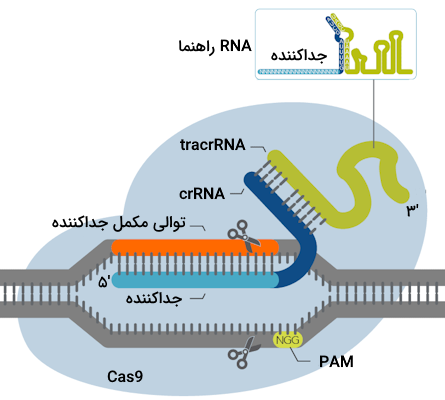
توالی PAM
تا اینجا به خوبی یاد گرفتیم که سیستم کریسپر Cas9 روی DNA هدف به دنبال توالی میگردد که مکمل crRNA است. به بخشی از crRNA که مکمل با DNA هدف است «جداکننده» (Spacer) میگوییم. آنزیم Cas9 برای آن که بتواند فعالیت خود را به درستی انجام دهد، علاوه بر شناسایی جداکننده به حضور توالی دیگری هم روی ژنوم مهاجم نیاز دارد که به آن «Protospacer Adjacent Motif» یا PAM میگوییم.
این توالی روی ژنوم خود باکتری وجود ندارد و همین موضوع میتواند به سیستم کریسپر کمک کند که DNA باکتری را از DNA ویروس یا پلاسمید مهاجم تفکیک کند. گونههای مختلف باکتریایی حساس به شناسایی توالیهای PAM متفاوتی هستند، زیرا ژنهای مربوط به Cas9 نیز در گونههای مختلف باکتریایی تفاوتهایی دارند.
PAM که طول آن به طور معمول بین ۲ تا ۶ نوکلئوتید است، در ناحیه پاییندست توالی هدف، روی رشتهای وجود دارد که مکمل با crRNA نیست. اهمیت این توالی کوتاه در این نکته است که اگر PAM وجود نداشته باشد، آنزیم Cas9 قادر به اتصال به DNA هدف یا ایجاد شکست دو رشتهای در ساختار آن نیست.
توالی جداکننده و توالی مکمل آن
در حین معرفی کریسپر به عنوان سیستم ایمنی تطبیقی باکتریها گفتیم که با ورود ژنوم بیگانه به درون سلول باکتریایی، باکتری بخشی از این ژنوم را جدا میکند و در جایگاه ژنی کریسپر که روی ژنوم خودش قرار دارد، وارد میکند. به این توالی جدا شده از ژنوم باکتریایی «جداکننده» (Spacer) گفته میشود که طول آن نیز به طور معمول در حدود ۲۰ نوکلئوتید است.
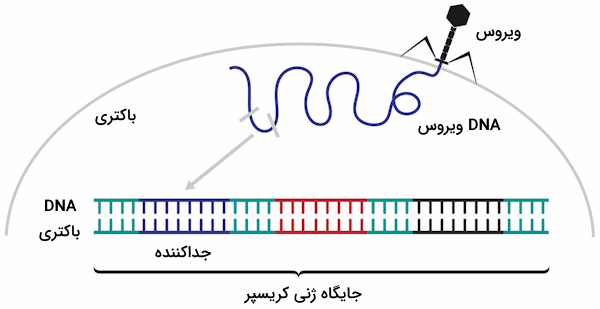
با ادغام توالی جداکننده در ژنوم، با هر بار رونویسی از جایگاه ژنی کریسپر از روی این توالی نیز رونویسی انجام میشود تا سلول از آن برای شناسایی ژنوم بیگانه استفاده بکند. رونویسی از جداکننده باعث میشود که RNA تولید شده مکمل با بخشی از توالی ژنوم بیگانه باشد که توالی نوکلئوتیدی آن مشابه با قطعه جداکننده ادغام شده در ژنوم باکتری است.
روند ویرایش ژنوم با استفاده از کریسپر
سیستم کریسپر Cas9 همانطور که در بخشهای قبل با اجزای مولکولی آن آشنا شدیم، فعالیت خود را به کمک آنزیمی با خاصیت نوکلئازی و نوعی RNA خاص انجام میدهد که هر کدام از آنها از بخشهای مختلفی تشکیل شدهاند. در ادامه به کمک یک جدول بخشهای مختلف Cas9 و RNA راهنما را به همراه وظایف آنها میشناسیم.
| اجزای مولکولی سیستم کریسپر Cas9 | اجزای ساختاری هر مولکول | وظایف هر جزء |
| Cas9 | یک لوب شناساگر (تشکیل شده از دومینهای REC1 و REC2) | مسئول شناسایی محل توالی هدف روی مولکول DNA مدنظر است. |
| یک لوب نوکلئازی (تشکیل شده از دومینهای RuvC ،HNH و PI) | HNH و RuvC مسئول ایجاد برش روی دو رشته DNA مکمل با RNA راهنما هستند. | |
| PI مسئول یافتن توالی PAM است. | ||
| RNA راهنما | crRNA | انتهای '۵ crRNA مکمل توالی هدف است. |
| انتهای '۳ crRNA کمپلکسی را با Cas9 و tracrRNA ایجاد میکند. | ||
| tracrRNA | این بخش به Cas9 متصل میشود. |
این اجزای مولکولی فعالیتی را بر عهده دارند که به طور طبیعی در پروکاریوتها یک سیستم ایمنی تطبیقی ایجاد میکند، اما ما میتوانیم برای ویرایش ژنهای هدف خود از مولکولها و روند کار این سیستم استفاده کنیم. به طور کلی استفاده از کریسپر Cas9 در آزمایشگاه را میتوان در چهار مرحله اصلی توضیح داد.
- انتخاب ژن هدف و اندونوکلئاز قابل استفاده
- طراحی gRNA برای هدف قرار دادن توالی PAM در نزدیکی ناحیه مدنظر
- انتقال gRNA به سلول دلخواه و بیان آن
- ایجاد برش در ژن توسط آنزیم اندونوکلئاز مورد استفاده
انتخاب ژن هدف و اندونوکلئاز قابل استفاده
انتخاب ژن هدف و نوع تغییری که قصد ایجاد آن را دارید، اولین مرحله از طراحی و اجرای یک آزمایش ویرایش ژنوم با استفاده از کریسپر است. پس از انتخاب ژن هدف باید توالی نوکلئوتیدی آن ژن را به دست بیاوریم، به همین منظور از پایگاههای دادههای ژنومی مانند NCBI و EMBL استفاده میکنیم. با توجه به اهمیت توالی PAM که باید کمی پیش از ناحیه مورد نظر وجود داشته باشد، علاوه بر توالی ژن بهتر است بخشی از توالی بالادست و پاییندست ژن را نیز انتخاب کنیم تا بررسی ژنومی کاملی از آن ناحیه داشته باشیم.
ما در این مطلب با آنزیم Cas9 به خوبی آشنا شدیم اما همانطور که در بخشهای قبل نیز مطرح شد، آنزیمهای اندونوکلئاز دیگری نیز وجود دارند که میتوانیم برای ویرایش ژنوم از آنها استفاده کنیم. انتخاب آنزیم مناسب باید بر اساس هدف آزمایش صورت گیرد، به عنوان مثال در صورتی که قصد حذف یک ژن یا از کار انداختن آن را داریم باید از آنزیمی استفاده کنیم که شاید برای آزمایشی که هدف آن اضافه کردن چند نوکلئوتید به ژنی خاص است، مناسب و کارآمد نباشد.
طراحی gRNA
طراحی gRNA فرآیندی است که باید قدم به قدم طی شود تا کمترین خطای ممکن در آزمایش نهایی مشاهده شود. برای طراحی gRNA مناسب ژن هدف میتوان از نرمافزارها خاصی استفاده کرد که در ادامه تعدادی از آنها را نام میبریم.
- «بنچلینگ» (Benchling)
- GenScript
- E-CRISP
- ATUM
- MIT’s CRISPR Design
در گام اول طراحی RNA راهنما، توالی ژن را در یکی از این نرمافزارهای بارگزاری میکنیم، سپس با استفاده از امکانات آنها gRNAهای مناسب برای توالی را به دست میآوریم. اما در انتخاب gRNA نهایی باید به حساسیتهای اندونوکلئاز انتخابی نیز توجه داشت؛ به عنوان مثال طول gRNA مناسب در هنگام استفاده از Cas9 حدود ۲۰ نوکلئوتید است.
در نرمافزار بنچلینگ پس از طراحی چند RNA راهنما، یکی از اطلاعاتی که در مورد آن RNA به شما داده میشود امتیازی است که gRNA در مورد حذف ژن یا اضافه کردن قطعهای به ژن دارد، یعنی عددی بین صفر تا ۱۰۰ به توالی طراحی شده نسبت داده میشود که به ما نشان میدهد این gRNA برای چنین هدفی مناسب هست یا خیر. در صورتی که این امتیاز برابر با ۱۰۰ باشد، میتوان نتیجه گرفت که از این gRNA میتوان برای حذف یک ژن یا اضافه کردن چند نوکلئوتید به توالی آن استفاده کرد.
در صورتی که امتیاز مطرح شده پایین باشد، میتوان نتیجه گرفت که توالی ژنی مورد نظر ما شباهت زیادی با توالیهای دیگر موجود در ژنوم دارد و همین مسئله باعث میشود که gRNA قابلیت اتصال به بخشهایی از ژنوم را داشته باشد که هدف ما نیستند، به این ترتیب کارآیی آزمایش طراحی شده به شدت کاهش مییابد و موفق به ویرایش ژنوم نخواهیم شد. در ادامه عواملی که در میزان کارآیی sgRNA نقش دارند را مورد به مورد معرفی میکنیم.
- محتوای سیتوزینها و گوانینهای موجود در sgRNA
- طول sgRNA
- ساختار ثانویه sgRNA
- توالی sgRNA
بررسی جاگذاری gRNA در وکتور بیان
پس از انتخاب gRNA دلخواه میتوان از قابلیت دیگر نرمافزارها استفاده کرد و نحوه جاگذاری gRNA در وکتور بیان را نیز بررسی کرد، به عنوان مثال در بنچلینگ میتوان بر روی گزینه «Assemble» کلیک کرد و به این ترتیب صفحهای جدید باز میشود که اطلاعات وکتورهای بیان متفاوت را در اختیار ما میگذارد. این اطلاعات از این جهت تنوع زیادی دارند که ارگانیسمهای متفاوت را با پلازمیدهای متفاوتی میتوان هدف قرار دارد. توالی آنزیم اندونوکلئاز نیز روی این وکتور بیان موجود است، بنابراین در انتخاب وکتور باید به نکاتی توجه داشت که تعدادی از آنها را در ادامه مطرح میکنیم.
- توالی آنزیم اندونوکئاز موجود روی وکتور
- مناسب بودن وکتور برای ورود به سلول هدف و بیان در آن
- امکان اضافه کردن توالی gRNA به وکتور
توالی gRNA را تنها میتوان به جایگاههای مشخصی از وکتور اضافه کرد که برای این کار نیز به «آنزیمهای اندونکلئاز محدودکننده» (Restriction Enzyme)خاصی نیاز داریم، به همین دلیل ابتدا با استفاده از نرمافزارها احتمال اضافه شدن RNA راهنما به وکتور را بررسی میکنیم. در صورتی که مشکلی برای این فرآیند پیشبینی نشد، میتوانیم به سراغ مرحله عملی برویم و RNA راهنما را بسازیم، سپس آن را در وکتور بیان جاگذاری کنیم.
روش دیگری برای تولید gRNA وجود دارد که در این روش نیازی به کلون کردن ژن gRNA و آنزیم در وکتور نداریم. در این روش ابتدا باید آنزیم RNA پلیمراز خاصی را به لولههای آزمایشگاهی که ژنهای gRNA و Cas9 در آنها موجود است اضافه کنیم و پس از تولید mRNA، این مولکولها را به درون سلول هدف منتقل کنیم، توجه کنید که در اینجا gRNA در قالب mRNA تولید میشود. این روش برای انتقال این مولکولها به سلولهایی که تقسیم نمیشوند یا انتقال مولکولهای مختلف به آنها دشوار است، کارآمدتر از استفاده از وکتور است.
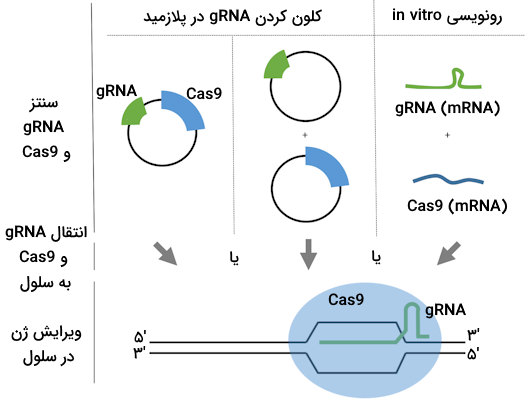
بیان gRNA در سلول دلخواه
بیان gRNA در سلول دلخواه نیازمند جاگذاری صحیح RNA راهنما درون وکتور بیان، ورود وکتور به سلول هدف و بیان صحیح آن است. در این مرحله ما به وکتوری «وکتور بیان» (Expression Vector) میگوییم که حاوی توالی gRNA و اندونوکلئاز مدنظر ما است.
برای اضافه شدن gRNA به وکتور باید از اندونوکلئاز محدودکننده مناسب استفاده کنیم که با ایجاد برش در وکتور بیان و gRNA، توالیهای DNA همپوشان یا چسبنده ایجاد میکند و به این ترتیب ادغام gRNA در وکتور بیان تسهیل میشود. برای انجام این بخش از آزمایش به ترکیبات دیگری نیز نیاز داریم که در ادامه با آنها آشنا میشویم.
- DNA لیگاز: این آنزیم مسئول تعمیر DNA پس از ادغام gRNA در وکتور بیان است.
- بافر: به بافر برای حفظ محیطی پایدار برای ایجاد تغییرات دلخواه در DNA نیاز داریم.
- تیوبهای پلاستیکی
- پیپتهای مختلف
در آمادهسازیهای این مرحله باید به موضوع دیگری نیز توجه نشان داد و آن دسترسی به سلول هدف است، برای انجام آزمایش باید سلول هدف را کشت بدهیم.
ایجاد برش در ژن
پس از تولید وکتور بیان که حالا میتوان گفت دارای توالی ژن آنزیم نوکلئاز و gRNA طراحی شده است، زمان بیان این وکتور درون سلولهای زنده رسیده است. انتقال وکتور بیان به درون سلولهای باکتریایی سادهتر از انتقال آن به سلولهای یوکاریوتی است، بنابراین سدی که در آن مرحله با آن روبهرو میشویم، نوع سلول هدف است که باید پروتکلهایی متناسب با آنها را دنبال کنیم.
پس از ورود وکتور بیان به درون سلولها، از ژنهای موجود روی این وکتور رونویسی میشود تا gRNA و mRNA مربوط به اندونوکلئاز ساخته شوند و سیستم کریسپر فعالیت خود در سلول را آغاز کند. برای مشاهده نتیجه فعالیت این مولکولها، نیاز است که مدتی سلولها در انکوباتور بمانند و کشت داده شوند تا کلنیهای سلولی به دست بیایند که میتوان آنها را غربالگری کرد. نتایج غربالگری سلولی به ما کیفیت فعالیت و میزان موفقیت سیستم کریسپر را نشان میدهد.
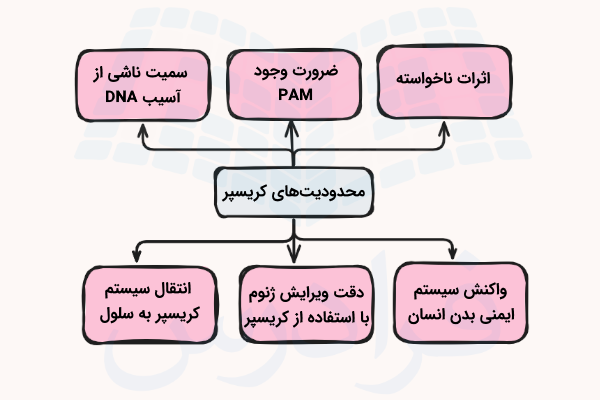
محدودیتهای کریسپر
ویرایش ژنوم با استفاده از تکنولوژی کریسپر نیز مانند هر روش دیگری با محدودیتهایی روبهرو است که در این بخش به آنها میپردازیم.
- اثرات ناخواسته
- ضرورت وجود PAM
- سمیت ناشی از آسیب DNA
- واکنش سیستم ایمنی انسانی
- دقت ویرایش ژن با استفاده از کریسپر
- رساندن سیستم کریسپر به سلول هدف
اثرات ناخواسته
نگرانی اصلی در هنگام استفاده از کریسپر Cas9 برای ژن درمانی از این موضوع نشات میگیرد که احتمال بالایی برای ایجاد «اثرات ناخواسته» (Off-Target Effects | OTEs) در باقی بخشهای ژنوم وجود دارد. برای کاهش خطرات ناشی از این موضوع تمرکز دانشمندان بر تولید Cas9 مهندسی شده و بهینهسازی RNA راهنما است. یکی از انواع Cas9 مهندسی شده، «Cas9 نیکاز» (Cas9 Nickase | Cas9n) است که شکستهای تکرشتهای در مولکول DNA ایجاد میکند. انواع دیگری از این آنزیم تولید شده است که به جهت آشنایی با آنها در ادامه تعدادی را نام میبریم.
- SpCas9-HF1
- evoCas9
- HiFiCas9
- Cas9_R63A/Q768A
برای بهینهسازی RNA راهنما راههای مختلفی وجود دارد، زیرا عوامل گوناگونی در تعیین اختصاصیت sgRNA نقش دارند. در ادامه تعدادی از نکاتی که میتوان در حین طراحی sgRNA مدنظر قرار داد را معرفی میکنیم.
- Seed Sequence: این قسمت از sgRNA بخشی از توالی است که در انتهای '۳ توالی جداکننده و در نزدیکی PAM قرار دارد، طول Seed Sequence حدود ۱۰ الی ۱۲ جفت باز است.
- محتوای GC: منظور از محتوای GC، نسبت بازهای گوانین و سیتوزین موجود در gRNA است که این موضوع توانایی اثرگذاری بر عملکرد sgRNA را دارد.
- اصلاحات انجام شده روی sgRNA: از جمله اصلاحاتی که میتوان روی این مولکول ایجاد کرد کوتاهسازی sgRNA از سمت انتهای '۵ است.
برای طراحی و بهینهسازی RNA راهنما میتوان از پلتفرمها و ابزارهایی که مخصوص این کار هستند استفاده کرد و به روند انجام آزمایشها سرعت بخشید.
ضرورت وجود PAM
محدودیت دیگری که در استفاده از تکنولوژی کریسپر برای ویرایش ژنوم وجود دارد این نکته است که باید در نزدیکی ناحیه هدف آنزیم، توالی PAM وجود داشته باشد. هر یک از آنزیمهای خانواده Cas توالی PAM به خصوصی را تشخیص میدهند که در حین استفاده از آنها باید به حضور آن توالی در ناحیه مدنظر خود توجه داشته باشیم.
به عنوان مثال Cas9 استخراج شده از استرپتوکوک پیوژنز که به آن SpCas9 میگوییم، یکی از آنزیمهای Cas محبوب در مطالعات مختلف است. توالی PAM شناسایی شده توسط این آنزیم از سمت '۵ به '۳ به صورت NGG است که در اینجا N میتواند هر نوع نوکلئوتیدی باشد. این آنزیم، پروتئینی به نسبت بزرگ به حساب میآید که همین موضوع باعث میشود بستهبندی و فرستادن آن به درون وکتور (Adeno-Associated Virus | AVV) دشوار باشد. وکتور AVV مورد استفادهترین وکتور برای ژن درمانی است.
Cas9 باکتری استافیلوکوک اورئوس که آن را با عنوان «SaCas9» میشناسیم، ارتولوگ کوچکتری است که میتوان آن را به سادگی در وکتور AVV جایگذاری کرد اما توالی PAM آن طولانیتر از SpCas9 است. این آنزیم باید در نزدیکی ناحیه هدف از سمت '۵ به '۳ توالی ژنوم مدنظر ما، یکی از دو توالی نوکلئوتیدی زیر را تشخیص دهد. توجه داشته باشید که برای خواندن در جهت مشخص شده توالی باید از چپ به راست خوانده شود.
- NNGRRT
- NNGRR
در این دو توالی منظور از حرف R این است که هر نوکلئوتید پورینی میتواند در این جایگاه قرار بگیرد. این محدودیت نیز با اعمال تغییراتی در SaCas9 تا حدودی برطرف شده است و میتوان از این آنزیم برای سلولهای انسانی استفاده کرد. در ادامه تعدادی از انواع SaCas9 مهندسی شده را به همراه PAM آنها معرفی میکنیم.
- KKH SaCas9: شناسایی توالی ۵′NNNRRT۳′
- SpCas9-NG: شناسایی توالی دو نوکلئوتیدی و ساده '۵′NG۳
- xCas9: این آنزیم سه توالی مختلف را به عنوان PAM شناسایی میکنند، NG، GAA و GAT
با مقایسه این انواع مختلف متوجه شدهاند که xCas9 در سلولهای انسانی کمترین میزان اثرات ناخواسته را ایجاد کرده است.
سمیت ناشی از آسیب DNA
ایجاد شکست در دو رشته DNA توسط سیستم کریسپر در اغلب موارد به جای ویرایش ژن هدف باعث میشود که سلول به سمت مرگ خودخواسته یا آپوپتوز برود. دیگر احتمالاتی که برای سلول با DNA آسیب دیده وجود دارد را در ادامه مطرح میکنیم.
- سلولهای بنیادی پرتوان: فعالسازی پروتئین p53 به هنگام تشخیص شکست دو رشتهای DNA در این سلولها به طور معمول باعث آپوپتوز سلول بنیادی میشود.
- بقای سلولهای سرطانی: موفقیت ویرایش ژنوم به وسیله کریسپر بیشتر در سلولهایی دیده میشود که پروتئین p53 در آنها سرکوب شده است، اما این موضوع میتواند منجر به بقای سلولهای سرطانی و آسیب به فرد شود.
- ایجاد تغییرات ناخواسته: حذف شدن بخشهای بزرگی از DNA که در حدود چندین کیلوباز باشند و ترمیمهایی که در پی آن اتفاق میافتند، در صورتی که ناخواسته باشند میتوانند در زمینه کاربردهای بالینی کریسپر خطراتی قابل توجه به حساب آیند.
برای رفع این دسته از مشکلات نیز پژوهشگران راهکارهای متفاوتی را ارائه کردهاند که بیشترین تمرکز این روشها بر اصلاح آنزیم Cas است. به عنوان مثال با استفاده از dCas9 میتوان بدون ایجاد شکست دو رشتهای DNA، بیان ژن را تغییر داد.
در بخش روشها و تکنیکهای کریسپر با دو روش ویرایش ژنومی با نامهای ویرایش پیشرفته و اولیه آشنا شدیم که هر دو روش به منظور ویرایش دقیق ژنها بهینهسازی شدهاند و با استفاده از آنها میتوان احتمال به راه افتادن مسیرهای آپوپتوزی ناشی از شکست دو رشتهای را کاهش داد.
واکنش سیستم ایمنی انسانی
علاوه بر محدودیتهای موجود در مورد سیستم کریسپر و اجزای آن، واکنش سیستم ایمنی بدن در مقابل کریسپر نیز باید بررسی شود؛ زیرا ممکن است سیستم ایمنی با ساخت آنتیبادیهایی علیه کریسپر به دفاع از بدن مشغول شود. بنابراین باید به کاهش حساسیت سیستم ایمنی به وکتورهای AAV و ایزومرهای Cas توجه ویژهای نشان داده شود.
دقت ویرایش ژن با استفاده از کریسپر
دقت ویرایش انجام شده در ژنهای هدف کریسپر از اهمیت بسیار زیادی برخوردار است. با وجود آن که سیستم ترمیمی HDR قادر به افزایش دقت ویرایش ژنوم است، کارآیی پایین آنها باعث میشود که نتوان در سطح بالینی به آنها اعتماد داشت؛ زیرا مسیر NHEJ روش اصلی ترمیم ژنوم در سلولهای انسانی است و برای به راه انداختن HDR باید ابتدا مسیر ترمیمی NHEJ را از کار انداخت.
یادگیری میکروبیولوژی با فرادرس
در این مطلب از مجله فرادرس با کریسپر آشنا شدیم که از باکتریها و آرکیها در برابر هجوم ویروسها محافظت میکند. باکتریها یکی از پنج قلمرو موجودات زنده هستند که گونههای زیادی را شامل میشود، مطالعه ساختار و فعالیتهای این گونهها پیچیدگیهای خاص خود را دارد اما با تسلط به نکات مشترک بین قلمرو باکتریها میتوان مسیر مطالعه هر گونه را آغاز کرد و اطلاعات مورد نیاز را به دست آورد؛ اما میکروبیولوژی تنها به مطالعه باکتریها محدود نمیشود.
میکروبها جاندارانی هستند که تنها به وسیله میکروسکوپ میتوان آنها را دید و گاهی مفید هستند در حالی که گاهی میتوانند مضر و بیماریزا باشند. استفاده از باکتریهای مفید در موارد صنعتی و حتی پزشکی از اهمیت بسیار زیادی برخوردار است که این موضوع نیز میتواند جهت مطالعات ما را مشخص کند. فرادرس با در نظر گرفتن تمام این نکات فیلمهای آموزشی متنوعی را تولید و منتشر کرده است که در ادامه تعدادی از آنها را معرفی میکنیم.
- فیلم آموزش میکروبیولوژی پزشکی فرادرس
- فیلم آموزش جامع میکروبیولوژی صنعتی فرادرس
- فیلم آموزش مبانی میکروبیولوژی زیست محیطی فرادرس
- فیلم آموزش جامع بیوتکنولوژی میکروبی فرادرس

کاربردهای تکنیک کریسپر
در چند سال اخیر کریسپر اثر چشمگیری بر تحقیقات علمی مرتبط با حوزههای بیوتکنولوژی و پزشکی داشته است، بنابراین در این بخش قصد آشنایی با کاربردهای کریسپر را داریم.
- سلول درمانی و ژن درمانی
- تشخیص بیماری
- کشاورزی
- انرژی زیستی
سلول درمانی و ژن درمانی
کریسپر با قابلیت غربالگری طیف وسیع از بیماریهای ژنتیکی، میتواند علوم پزشکی را متحول کند. از جمله این بیماریها میتوان به موارد زیر اشاره کرد.
- «بیماریهای زوال عصبی» (Neurodegenerative Disease)
- «اختلالات خونی» (Blood Disorders)
- «سرطان» (Cancer)
- «اختلالات بینایی» (Ocular Disorders)
در سال ۲۰۱۹ برای اولین بار سلول درمانی برای بیماران مبتلا به کمخونی داسیشکل با استفاده از تکنیک کریسپر انجام شد. این روش درمانی توانست هموگلوبینهای جنینی را بازیابی کند و به این ترتیب نیازی که به حضور نسخه عملکردی هموگلوبینهای بالغ وجود داشت، رفع شد. با استفاده از کریسپر، تحقیقاتی روی بیماریهایی که باعث تحلیل رفتن دستگاه عصبی میشوند نیز انجام شده است که نتایج امیدوارکنندهای داشته است.
با وجود نتایج مثبتی که دانشمندان با استفاده از کریسپر در زمینه بیماریهای مختلف به خصوص بیماریهای ژنتیکی به دست آوردهاند، باید گفت که مسیر طولانی تا استفاده از کامل از کریسپر به عنوان روش درمان در مقیاس بالینی داریم و تحقیقات در این زمینه ادامه دارد.
تشخیص بیماری
از تکنولوژی کریسپر میتوان برای تشخیص بعضی بیماریها نیز استفاده کرد؛ به عنوان مثال بیماریهای ویروسی مانند کووید ۱۹ را میتوان با استفاده از کریسپر به سادگی تشخیص داد.
کشاورزی
تکنولوژی ویرایش ژنوم پتانسیل زیادی در زمینه کشاورزی دارد و متخصصان پیشبینی میکنند مواد غذایی که با استفاده از کریسپر دچار اصلاحات ژنتیکی شدهاند تا چند سال آینده در دسترس خواهند بود. منظور از ویرایش ژنتیکی این است که میتوانیم گیاهان را در برابر مواردی مانند بیماریها و خشکسالی مقاوم سازیم.
انرژی زیستی
انرژی زیستی به عنوان یکی از بهترین جایگزینها برای سوختهای فسیلی شناخته میشوند اما موانع زیادی برای تولید سوختهای زیستی در مقیاسهای بزرگ وجود دارد. دانشمندان موفق به ایجاد جهشهایی چشمگیر در این زمینه با استفاده از کریسپر شدهاند. به عنوان مثال، حذف ژن چندین فاکتور رونویسی که تولید لیپیدها در جلبکها تحت کنترل خود دارند، به افزایش تولید لیپید مناسب برای بیودیزل منتهی شده است.
ویرایش ژن نیز میتواند باعث افزایش میزان تحمل شرایط دشوار توسط مخمرها در حین تولید سوختهای زیستی شود. علاوه بر این، ویرایش ژن میتواند کارآیی گونههای باکتریایی مناسب برای تولید بیواتانول را افزایش دهد.
جمعبندی
در این مطلب از مجله فرادرس با سیستم ایمنی تطبیقی باکتریها و آرکیها آشنا شدیم که با عنوان «کریسپر» شناخته میشود. شیوه فعالیت سیستم ایمنی تطبیقی باکتریها را میتوان در چند مرحله خلاصه کرد.
- ورود ژنوم بیگانه و شناسایی آن توسط سلول
- جداسازی قطعهای در حدود ۲۰ نوکلئوتید از ژنوم بیگانه
- ادغام قطعه جداکننده در ناحیه کریسپر موجود در ژنوم باکتری
- رونویسی از جایگاه ژنی کریسپر
- قطعه قطعه شدن RNA اولیه و ایجاد RNA راهنما
- آلودگی مجدد باکتری به ژنوم بیگانه
- اتصال RNA راهنما به ژن خارجی
- ایجاد برش روی ژنوم خارجی توسط اندونوکلئاز Cas
- بیاثر شدن ژن خارجی
پس از کشف این سیستم کریسپر که به باکتریها کمک میکرد در برابر ژنهای بیگانه مانند DNA باکتریوفاژها مقاوم باشند، پژوهشگران متوجه شدند که می توان از کریسپر برای ویرایش ژنوم بهره گرفت و به این ترتیب تکنولوژی ویرایش ژنوم با استفاده از سیستم کریسپر مورد توجه قرار گرفت و برای اهداف مختلفی مانند حذف ژنها، اضافه کردن قطعاتی به ژنها، تنظیم بیان ژنها، ویرایش توالی DNA و غیره مورد استفاده قرار گرفت.
استفاده از کریسپر به منظور ویرایش ژنوم متناسب با هدفی که دنبال میکنیم، روند متفاوتی دارد. در حقیقت گاهی قصد خاموش کردن یک ژن را داریم، بنابراین از آنزیمی استفاده میکنیم که قادر به ایجاد شکست DNA است، اما گاهی قصد ویرایش ژن را داریم و در این شرایط با طراحی gRNA الگویی برای ویرایش ژن طراحی میکنیم، از آنزیمی استفاده میکنیم که قابلیت برش دادن DNA را ندارد و به ساختار آن آنزیم رونویسی معکوس را نیز اضافه میکنیم، به این ترتیب پروتکل ویرایش ژن پیشرفته را دنبال میکنیم.













چقدر جامع و عالی نوشته بودید تشکر فراوان