بار موثر هسته چیست؟ – توضیح و نحوه محاسبه به زبان ساده
بار موثر هسته میزان بار مثبتی است که الکترونهای یک اتم از سمت هسته اتم احساس میکنند. اثر بار موثر هسته بر روی الکترونهای درونی اتم بیشتر از الکترونهای لایههای دورتر و الکترونهای ظرفیت است. هرچه تعداد الکترونهای موجود در لایههای الکترونی اطراف هسته بیشتر باشد، دافعه بین این الکترونها از مقدار بار موثر هسته اتم میکاهد. در این مطلب از مجله فرادرس میآموزیم بار موثر هسته چیست و چگونه محاسبه میشود.
- یاد میگیرید مفهوم بار موثر هسته را دقیق تعریف کنید.
- میآموزید بار موثر هسته را با فرمول و روش اسلیتر محاسبه کنید.
- نقش الکترونهای پوششی و اثر آنها بر Z_eff را بررسی میکنید.
- تغییرات بار موثر هسته را در دورهها و گروههای تناوبی تحلیل میکنید.
- ارتباط Z_eff با شعاع اتمی، انرژی یونش و ویژگیهای شیمیایی را تفسیر میکنید.
- بار موثر هسته را برای مقایسه ویژگی عناصر و یونها بهکار میبرید.


در ابتدای این مطلب میآموزیم بار موثر هسته چیست و اثر پوششی الکترونهای درونی چه تاثیری بر آن دارد. سپس فرمول و روش محاسبه بار موثر هسته را میآموزیم. پس از آن روش اسلیتر را برای محاسبه مقدار عددی بار موثر همراه با مثال و تمرین میآموزیم. همچنین سایر روشهای محاسبه بار موثر مانند روش هارتری و کلمانتی را معرفی میکنیم. سپس روند تغییر بار موثر هسته را در جدول تناوبی بررسی کرده و روش مقایسه آن را برای اتمها میآموزیم. در نهایت با مفهوم نفوذ الکترونی و کاربردهای بار موثر هسته آشنا میشویم. با مطالعه این مطلب تا انتها میتوانید با این پارامتر مهم و روش محاسبه آن آشنا شوید.
بار موثر هسته چیست؟
بار موثر هسته میزان بزرگی بار مثبتی است که در یک اتم چند الکترونی بر الکترونهای اتم وارد میشود. این پارامتر بیشتر برای الکترونهای لایه ظرفیت اتم محاسبه میشود. کلمه «موثر» در این مفهوم به این اشاره دارد که الکترونهای لایههای درونی اتم میزان اثر این بار مثبت هسته را بر الکترونهای لایههای دورتر اتم کاهش میدهند.
بار موثر هسته با علامت های و نمایش داده میشود. بار موثر هسته اتم همواره برای تمامی اتمها مقداری بین ۱ و عدد اتمی عنصر دارد.
تنها استثنا برای این مورد، اتم هیدروژن است که از یک پروتون و یک الکترون تشکیل شده است. در این اتم، الکترون دیگری برای ایجاد اثر پوششی وجود ندارد و تنها الکترون این اتم به شکلی کامل جاذبه هسته اتم را احساس میکند. به همین علت میزان بار موثر هسته برای اتم هیدروژن برابر عدد اتمی آن یعنی عدد ۱ است.
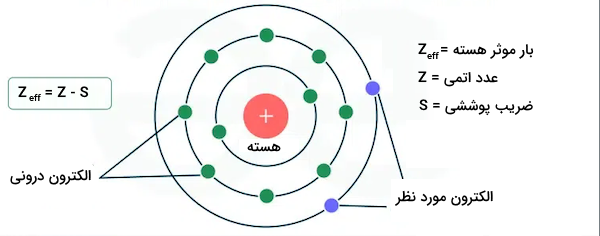
رابطه بار موثر هسته و قانون کولن
بر اساس قانون کولن، جذب شدن الکترونها به هسته اتم به سه پارامتر وابسته است. این پارامترها میزان بار مثبت پروتونها، میزان بار منفی الکترونها و فاصله بین الکترونها و پروتونها است. قانون کولن برای پیشبینی انرژی موجود در الکترون اتم هیدروژن به خوبی توجیه میشود. این قانون همچنین برای توجیه اتمهایی که مانند هیدروژن هستند نیز کاربرد دارد. اما این قانون برای بررسی انرژی اتمهایی با چند الکترون کاربرد ندارد.
قانون کولن بیان میکند که میزان نیروی بین دو ذره باردارد نسبتی از میزان بار ذره اول در میزان بار ذره دوم تقسیم بر مربع فاصله آنها است. میتوان این دو ذره را پروتون اتم با بار مثبت و الکترون اتم باشد. در نتیجه، فاصله این دو ذره برابر با شعاع اتمی یا شعاع یونی خواهد بود. قانون کولن به شکل زیر نوشته میشود.
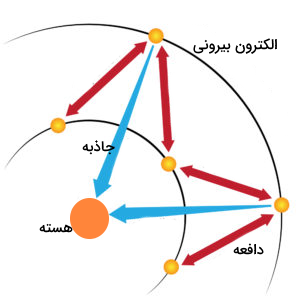
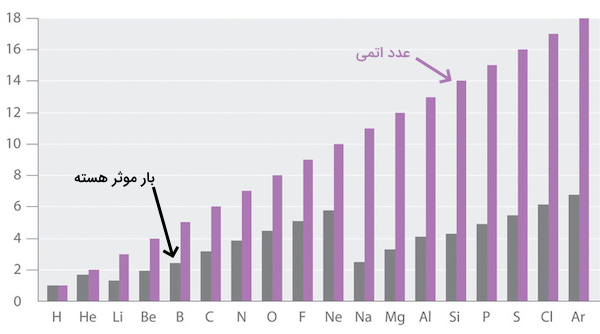
الکترونهای موجود در هر اتم با الکترونهای دیگر موجود در اتم و پروتونهای مثبت هسته برهمکنشهای الکترواستاتیکی دارند. هر الکترون در اتمی چند الکترونی، هم نیروی جاذبه حاصل از پروتونهای هسته و هم اثر دافعه سایر الکترونهای موجود در اتم را احساس میکند. وجود الکترونهای بیشتر در اتم و اثر دافعه آنها، اثر جاذبه پروتونهای هسته اتم را تا مقادیر مشخصی کاهش میدهد. هر الکترون موجود در اتم میزان انرژی جاذبه متفاوتی را از سمت هسته اتم احساس میکند. این میزان جاذبه بر اساس لایه الکترونی و سطح انرژی که الکترون در آن وجود دارد متفاوت است.
برای مثال، اتم لیتیوم دارای سه الکترون و سه پروتون است. این الکترونها میزان جاذبه یکسانی را از سمت پروتونهای موجود در هسته احساس نمیکنند. درعوض، هریک از الکترونها، میزان نیروی جاذبه مشخصی را که با نام بار موثر هسته اتم شناخته میشود احساس میکند. اولین الکترون این اتم، بار موثر هستهای برابر با ۲٫۶۹ را احساس میکند. الکترون دوم ۱٫۲۸ بار هسته اتم را احساس میکند. در مجموع، الکترونهای نزدیک به هسته، میزان بار مثبتی را احساس میکنند که با میزان بار پروتونها برابر نیست و از آن کمتر است. از طرفی، الکترونهای موجود در لایه ظرفیت، نیروی جاذبه هسته را بسیار کمتر از میزان بار پروتونها احساس میکنند.
مقادیر عددی بار موثر هسته اتم برای اوربیتالهای مختلف برخی از اتمها در جدول زیر ارائه شده است.
| اتم (عدد اتمی) | زیرلایه | مقادیر بار موثر هسته |
| هیدروژن (۱) | ۱ | |
| هلیوم (۲) | ۱٫۶۹ | |
| لیتیوم (۳) | ۱٫۲۸، ۲٫۶۹ | |
| برلیم (۴) | ۱٫۹۱، ۳٫۶۸ | |
| بور (۵) | ۲٫۴۲، ۲٫۵۸، ۴٫۶۸ | |
| فلوئور (۹) | ۵٫۱۰، ۵٫۱۳، ۸٫۶۵ | |
| سدیم (۱۱) | ۲٫۵۲، ۶٫۸۰، ۶٫۵۷، ۱۰٫۶۳ |
میزان بار موثر هسته در برخی از منابع با نام عدد اتمی موثر نیز شناخته میشود. تعریف دیگری برای میزان برار موثر هسته یا عدد اتمی موثر، میزان پروتونهایی است که یک الکترون در اتمی چند الکترونی میتواند ببیند. برای مثال، الکترون موجود در اولین لایه الکترونی و اوربیتال s اتم آهن را در نظر بگیرید. اتم آهن، ۲۶ پروتون در هسته خود دارد. اولین الکترون در اولین لایه الکترونی آن حدود ۲۵ پروتون را میبیند. مقداری از اثر پروتونها بر این الکترون به دلیل دافعه بین الکترونهای این اتم کاسته میشود.
یادگیری شیمی دبیرستان با فرادرس
یادگیری بار موثر هسته یکی از مفاهیم کلیدی در درک ویژگیهای عناصر و روندهای جدول تناوبی است. برای یادگیری این مفهوم ابتدا باید با مفاهیمی مانند هسته، پروتون، الکترون، لایههای الکترونی و اثر پوششی آشنا شوید. با شناخت این مفاهیم میتوانید درک کنید که چرا برخی عناصر شعاع کوچکتری دارند، انرژی یونش بیشتری نشان میدهند یا تمایل بیشتری به گرفتن الکترون دارند. پیشنهاد میکنیم برای یادگیری بهتر این مفاهیم به مجموعه فیلم آموزش دروس متوسطه دوم و کنکور فرادرس مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مباحث میپردازد.
همچنین با مراجعه به فیلمهای آموزش فرادرس که لینک آنها در ادامه اورده شده است میتوانید به آموزشهای بیشتری در زمینه بار موثر هسته دسترسی داشته باشید.
- فیلم آموزش شیمی ۱ پایه دهم فرادرس
- فیلم آموزش شیمی ۳ پایه دوازدهم فرادرس
- فیلم آموزش شیمی دبیرستان نکته و حل تست کنکور فرادرس
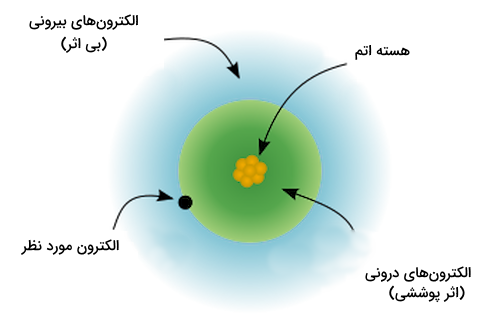
اثر پوششی الکترون درونی
برای درک بهتر اینکه بار موثر هسته چیست باید با اثر پوششی الکترونهای درونی اتم اشنا شویم. اثر پوششی الکترون درونی، اثر دافعه الکترونها بر میزان بار موثر هسته حس شده توسط آنها است. همچنین، الکترونهای لایههای درونی اتم از اثر مثبت بار هسته بر الکترونهای لایههای خارجی میکاهند.
در واقع تمامی الکترونهای یک اتم، یک میزان کشش را از سمت هسته حس نمیکنند. این پدیده به این علت است که در اتمی که چندین الکترون دارد، الکترونها در لایههای الکترونی با فواصلی مشخص از هسته اتم قرار گرفتهاند. برخی از الکترونها در لایههایی نزدیک به هسته اتم قرار دارند و برخی دورتر هستند. الکترونهای لایه ظرفیت، دورترین الکترونها نسبت به هسته اتم هستند و در آخرین لایه الکترونی ممکن قرار دارند.
الکترونهایی که در لایههای درونیتر الکترونی و نزدیکتر به هسته اتم هستند، الکترونهای موجود در لایههای بیرونیتر را دفع میکنند. این پدیده باعث میشود اثر با مثبت پروتونهای هسته اتم بر الکترونهای لایههای بیرونی کمتر شود. این پدیده با نام اثر پوششی شناخته میشود.
این اثر پوششی بین الکترونهای مختلف در لایههای متفاوت الکترونی به دلیل دافعه الکترواستاتیکی بین الکترونها به وجود میآید. اثر پوششی برای الکترونهای مختلف با استفاده از قانون اسلیتر محاسبه میشود. این قانون در قسمت بعد توضیح داده خواهد شد.
هرچه میزان گستردگی لایههای الکترونی در فضای اطراف هسته بیشتر باشد، میزان برهمکنش بین بارهای منفی الکترون و مثبت هسته کمتر میشود. همچنین، به علت تفاوت در شکل اوربیتالها، میتوان میزان اثر پوششی را برای اوربیتالها مقایسه کرد. میزان اثر پوششی اوربیتال s بیشتر از p، p بیشتر از d و d بیشتر از f است.
فرمول بار موثر هسته
در قسمت قبل آموختیم مفهوم بار موثر هسته چیست. برای محاسبه میزان بار موثر هسته بین دو ذره باردار باید دو پارامتر را بررسی کنیم. یکی از آنها عدد اتمی و دیگری ضریب پوششی الکترون است. بار موثر هسته از تفریق ضریب پوششی الکترون از عدد اتمی عنصر به دست میآید.
عدد اتمی میزان پروتونهای موجود در هسته اتم است که با علامت z نمایش داده میشود. ضریب پوششی الکترون پارامتی است که بر اثر دافعه بین الکترونها به دست میآید. در نهایت، میزان بار موثر هسته با استفاده از فرمول زیر به دست میآید.
در این فرمول () نمایش دهنده میزان بار موثر هسته اتم است. (Z) عدد اتمی است و () جمع ضرایب پوششی الکترونهای بین هسته و الکترونی است که میخواهیم میزان بار موثر هسته را روی آن به دست آوریم. میزان ضرایب پوششی را با حرف (S) نیز نمایش میدهند.
محاسبه بار موثر هسته
میزان بار موثر هسته میتواند با استفاده از روشهای متفاوتی محاسبه شود. یکی از شناختهترین روش های محاسبه بار موثر هسته اتم، روش اسلیتر است. اسلیتر مجموعهای از قوانین را برای محاسبه تقریبی میزان بار موثر هسته برای الکترونهای موجود در هر لایه الکترونی بیان کرد.
این قانونها بر اساس تعداد الکترونهای موجود در لایههای الکترونی مختلف استوار است. میزان بار موثر هسته را میتوان با استفاده یکی از روشهای اسلیتر، هارتری - فوک و کلمانتی - ریموند محاسبه کرد. این روشهای در قسمتهای بعدی بررسی میشوند.
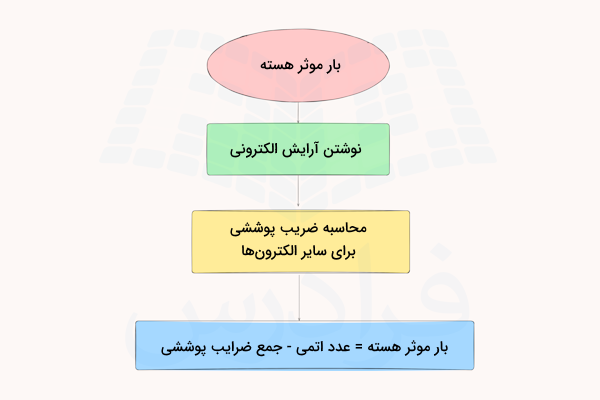
برای محاسبه میزان بار موثر هسته بیشتر از روش اسلیتر استفاده میشود. برای انجام این محاسبات باید مراحل زیر را انجام داد.
- نوشتن آرایش الکترونی عنصر
- مرتب کردن آرایش الکترونی بر اساس لایههای الکترونی (افزایش عدد کوانتومی اصلی n)
- پیدا کردن الکترون و زیرلایه مورد نظر
- صرف نظر از الکترونهای پس از الکترون مورد نظر
- صرف نظر از خود الکترون مورد نظر
- محاسبه مقادیر ضریب پوششی با استفاده از قوانین اسلیتر
- کم کردن مجموع مقادیر ضریب پوششی از عدد اتمی عنصر (تعداد پروتونهای هسته)
روش اسلیتر
روش اسلیتر مجموعهای از قوانین را برای محاسبه میزان بار موثر هسته اتم بیان میکند. در این روش، میزان ضریب پوششی الکترون برای هر الکترون با استفاده از عدد کوانتومی اصلی (n) و عدد کوانتومی فرعی (l) آن محاسبه میشود. این اعداد کوانتومی را میتوان با نوشتن آرایش الکترونی اتم و پیدا کردن الکترون مورد نظر به دست آورد. همچنین، نوع اوربیتال که از عدد کوانتومی فرعی به دست میآید در محسابه میزان بار موثر هسته اتم اثر گذار است. فرمول روش اسلیتر به شکل زیر است.
الکترونها در بر اساس میزان اعداد کوانتومی اصلی در لایههای الکترونی متفاوتی قرار گرفتهاند. عدد کوانتومی اصی در واقع نشاندهنده سطح انرژی الکترونها و لایه الکترونی آنها است. در هر سطح الکترونی، الکترونها در زیرلایههایی که بر اساس اعداد کوانتومی فرعی آنها تعیین میشود، قرار گرفتهاند. این عدد کوانتومی نشان دهنده شکل اوربیتالی است که الکترون در آن قرار گرفته است. قوانین روش اسلیتر در ادامه توضیح داده شده است.
برای محاسبه میزان بار موثر هسته اتم باید ابتدا آرایش الکترونی اتم را نوشته و سپس میزان بار موثر هسته را برای سایر الکترونهای موجود در آن لایه الکترونی و لایههای قبلی آن محاسبه کنیم. این قوانین بسته به موقعیت الکترون به دو دسته زیرلایه s و p و زیرلایه d و f تقسیم میشوند. در قسمت بعد میآموزیم روش محاسبه بار موثر هسته برای هر حالت چیست.
یکی از مهمترین قدمها در محاسبه بار موثر هسته اتمها، نوشتن آرایش الکترونی عناصر و پیدا کردن ظرفیت اتمها است. پیشنهاد میکنیم برای یادگیری بهتر این مبحث، فیلم آموزش «چگونه ظرفیت عناصر را بفهمیم» فرادرس را مشاهده کنید. لینک این آموزش در ادامه آورده شده ست.
زیرلایه s و p
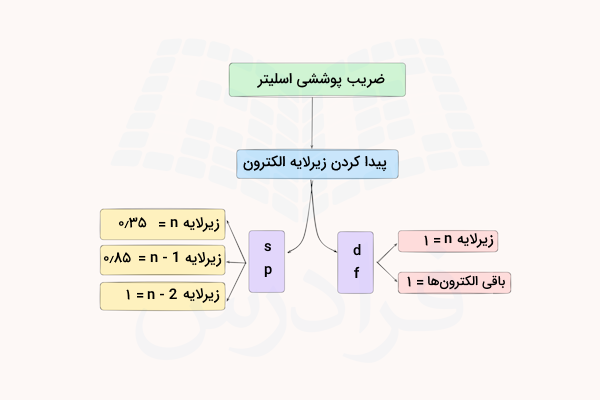
اگر الکترونی که میخواهیم میزان بار موثر هسته را برای آن حساب کنیم، در یکی از زیرلایههای s یا p باشد، میزان ضریب پوششی آن با قوانین زیر تعیین میشود.
قانون اول
الکترونهایی که با الکترون مورد نظر در یک گروه قرار دارند، ضریب پوششی الکترونی برابر با ۰٫۳۵ دارند. تنها استثنا در این قانون، گروه 1s است که این ثابت برای آن برابر با ۰٫۳۰ است. این بدین معنا است که الکترونهای موجود در یک لایه الکترونی، اثر بار موثر هسته را تا ۳۵ درصد برای یکدیگر کاهش میدهند.
الکترون مورد نظر در این شمارش محاسبه نمیشود. یعنی برای مثال اگر بخواهیم میزان بار موثر هسته را برای الکترونی در زیرلایه 3s محاسبه کنیم و این زیرلایه دارای دو الکترون باشد، میزان ضریب پوششی برای این الکترون برابر با ۱ الکترون به اندازه یک الکترون ضرب در عدد ۰٫۳۵ میشود.
قانون دوم
هر الکترون با عدد کوانتومی فرعی (n-1) که در زیرلایههای s و p قرار دارد، میزان ضریب پوششی الکترون برابر با ۰٫۸۵ دارد. این بدین معنی است که الکترونهای موجود در لایه قبلی الکترون مورد نظر، میان بار موثر هسته را تا ۸۵ درصد برای این الکترون کاهش میدهند.
برای مثال، اگر بخواهیم میزان بار موثر هسته را برای الکترونی موجود در لایه 3s محاسبه کنیم، ۶ الکترونی که قبل از آن در لایه دوم قرار دارند به اندازه ۶ ضربدر ۰٫۸۵ بار از اثر بار موثر هسته برای این الکترون را کاهش میدهند.
قانون سوم
هر الکترونی با عدد کوانتومی فرعی (n-2) که در زیرلایههای s و p قرار دارد. ضریب پوششی الکترون برابر با ۱٫۰۰ دارد. یعنی الکترونهای موجود در سومین لایه الکترونی قبل از الکترون مورد نظر و قبل از آن تقریبا یک بار کامل از بار موثر هسته را برای الکترون کاهش میدهند.
قانون چهارم
میزان بار موثر هسته برای الکترونهایی که در لایههای الکترونی بعد از الکترون مورد نظر قرار دارند برابر صفر در نظر گرفته میشود. این الکترونها اثری بر میزان باری که الکترون مورد نظر از سمت هسته احساس میکند ندارند.
زیرلایه d و f
اگر الکترونی که میخواهیم میزان بار موثر هسته را برای آن حساب کنیم، در یکی از زیرلایههای f یا d باشد، میزان ضریب پوششی آن با قوانین زیر تعیین میشود.
قانون اول
الکترونهای موجود در لایه الکترون مورد نظر، ضریب پوششی برابر با ۰٫۳۵ دارند. این بدین معنا است که الکترونهای موجود در یک لایه الکترونی، اثر بار موثر هسته را تا ۳۵ درصد برای یکدیگر کاهش میدهند.
قانون دوم
هر الکترونی با عدد کوانتومی فرعی (n-2) که در زیرلایههای بعد از d و f قرار دارد. ضریب پوششی الکترون برابر با ۱٫۰۰ دارد.
قانون سوم
میزان بار موثر هسته برای الکترونهایی که در لایههای الکترونی بعد از الکترون مورد نظر قرار دارند برابر صفر در نظر گرفته میشود. این الکترونها اثری بر میزان باری که الکترون مورد نظر از سمت هسته احساس میکند ندارند.
تصویر زیر، قوانین اسلیتر را برای لایههای الکترونی نشان میدهد.
جدول راهنما روش اسلیتر
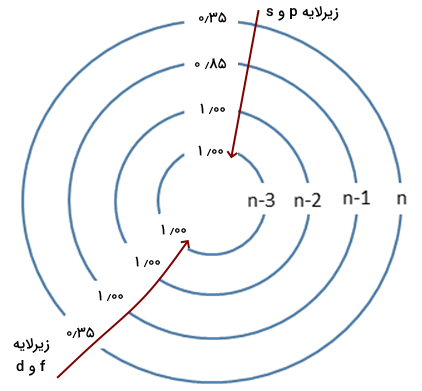
در قسمتهای قبل آموختیم بار موثر هسته چیست و به چه روشی محاسبه میشود. روش اسلیتر برای محاسبه بار موثر هسته در جدول زیر خلاصه شده است.
| گروه الکترونی | بار موثر هسته زیرلایههای ns و np | بار موثر هسته زیرلایههای nd و nf |
| الکترونهای موجود در لایه مشابه | ۰٫۳۵ | ۰٫۳۵ |
| الکترونهایی با عدد کوانتومی اصلی برابر n و عدد کوانتومی فرعی کمتر از l | - | ۱ |
| الکترونهایی با عدد کوانتومی اصلی کمتر از (n-1) | ۰٫۸۵ | ۱ |
| الکترونهایی با عدد کوانتومی فرعی برابر یا کمتر از (n-2) | ۱ | ۱ |
تصویر زیر، این قوانین را روی لایههای الکترونی مشخص میکند.
مثال
برای درک بهتر روش استفاده از این قوانین، میزان بار موثر هسته را برای الکترون ظرفیت اتم نئون با عدد اتمی ۱۰ و آرایش الکترونی بررسی میکنیم.
الکترون ظرفیت این اتم در لایه دوم الکترونی و زیرلایه p قرار دارد. برای محاسبه میزان بار موثر هسته ابتدا از لایه خود الکترون شروع میکنیم. لایه دوم الکترونی دارای ۷ الکترون دیگر است که هرکدام ۰٫۳۵ ضریب پوششی دارند. ۲ عدد الکترونهای زیرلایه اول نیز به دلیل اینکه در لایه بعدی قرار دارند به میزان ۰٫۸۵ بار از میزان بار موثر هسته کم میکنند. ابتدا میزان ضریب پوششی الکترون را برای این الکترونها محاسبه میکنیم.
در قسمت قبل آموختیم فرمول محاسبه بار موثر هسته چیست. برای محاسبه میزان بار موثر هسته، این مقدار را از عدد اتمی (بار پروتونهای هسته) کم میکنیم.
پس الکترونهای لایه ظرفیت اتم نئون مقدار ۵٫۸۵ بار از سمت هسته احساس میکنند.
مثال محاسبه بار موثر هسته با روش اسلیتر
در قسمت قبل آموختیم روش محاسبه بار موثر هسته چیست. برای درک بهتر روند محاسبه بار موثر هسته، به مثالهای زیر توجه کنید.
مثال ۱
میزان بار موثر هسته را برای الکترونهای زیرلایه 3d برای اتم روی محاسبه کنید.
پاسخ
اتم روی اتمی با ۳۰ الکترون و پروتون است. ابتدا آرایش الکترونی آن را مینویسیم.
برای محسابه میزان بار موثر هسته الکترونهای لایه 3d باید از الکترونهای موجود در لایههای بالاتر (4s) صرف نظر کنیم. زیرا طبق قانونهای اسلیتر این الکترونها اثری روی میزان بار موثر هسته الکترونهای لایه سوم ندارند.
حال ابتدا ضریب پوششی الکترون را برای الکترونهای زیرلایه 3d محاسبه میکنیم. ۹ الکترون دیگر موجود در این زیرلایه هریک ۰٫۳۵ بار از اثر پوششی کم میکنند. سایر الکترونهای موجود در زیرلایه 3s و 3p هرکدام مقدار ۰٫۸۵ بار از بار موثر هسته کم میکنند. باقی الکترونها نیز ۱ بار از بار موثر هسته کم میکنند. حال میزان ضریب پوششی الکترون را برای این الکترونها محاسبه میکنیم.
حال این عدد را از عدد اتمی روی که ۳۰ است کم میکنیم.
بنابراین، الکترونهای زیرلایه 3d به مقدار ۱۰٫۰۵ بار از بار مثبت پروتونهای هسته اتم روی را حس میکنند.
مثال ۲
میزان بار موثر هسته حس شده برای الکترونهای تمامی زیرلایههای اتم آهن محاسبه کنید.
پاسخ
اتم آهن اتمی با عدد اتمی ۲۶ و تعداد ۲۶ پروتون است. آرایش الکترونی این اتم به شکل زیر است.
برای محاسبه میزان بار موثر هسته اتم آن، زیرلایههای 1s، (2s, 2p)، (3s, 3p)، 3d، 4s را به شکلی جداگانه محاسبه میکنیم.
زیرلایه :
آخرین الکترون این زیرلایه، ۲۵ الکترون قبل از خود دارد که یکی در زیرلایه خود، ۱۴ الکترون در لایه سوم و باقی در لایههای قبل هستند. میزان ضریب پوششی الکترون برای آن به شکل زیر محاسبه میشود و سپس مقدار آن را از عدد اتمی آهن کم میکنیم.
زیرلایه
۵ الکترون دیگر در این زیرلایه قرار دارد، برای ۱۸ الکترون باقی مانده، ضریب پوششی الکترون برابر ۱ قرار گرفته میشود. (مراجعه به جدول راهنما قسمت قبل). میزان ضریب پوششی الکترون برای آن به شکل زیر محاسبه میشود و سپس مقدار آن را از عدد اتمی آهن کم میکنیم.
زیرلایههای و
۷ الکترون با ضریب پوششی الکترون ۰٫۳۵ در لایه سوم، ۸ الکترون در لایه دوم با ضریب ۰٫۸۵ و باقی الکترونها با ضریب ۱ قرار دارند. میزان ضریب پوششی الکترون برای آن به شکل زیر محاسبه میشود و سپس مقدار آن را از عدد اتمی آهن کم میکنیم.
زیرلایههای و
۷ الکترون در لایه دوم با ضریب ۰٫۳۵ و دو الکترون در لایه اول با ضریب ۰٫۸۵ قرار دارند.
زیرلایه 1s
همواره برای زیرلایه 1s مقدار ۰٫۳۰ از عدد اتمی کم میشود.
مثال ۳
محاسبه کنید میزان بار موثر هسته برای الکترون ظرفیت آنیون برم چیست.
پاسخ
برای محاسبه میزان بار موثر هسته برای اتم برم، ابتدا آرایش الکترونی آن را مینویسیم. آنیون برم، یک الکترون از اتم برم بیشتر دارد. پس آرایش الکترونی آن به شکل زیر خواهد بود.
الکترون ظرفیت آن در آخرین لایه الکترونی یعنی قرار دارد. ۷ الکترون در همان لایه با ضریب ۰٫۳۵ وجود دارند. ۱۸ الکترون در لایه سوم الکترونی این یون با ضریب پوششی الکترون ۰٫۸۵ هستند و باقی الکترونها ضریب پوششی الکترون ۱ میگیرند. با جمع ضرایب پوششی و کم کردن آن از عدد اتمی برم، میزان بار موثر هسته برای الکترون ظرفیت آن به دست میآید.
برای یادگیری بهتر این روش محاسبه، به تمرینهای زیر پاسخ دهید.
تمرین ۱
تمرین ۲
تمرین ۳
روش هارتری - فوک
یک روش تئوریک برای محاسبه بار موثر هسته، روش هارتری - فوک است. در این روش نیز میزان ضریب پوششی محاسبه شده و از مقدار عدد اتمی عنص کم میشود. داگلاس هارتری (Douglas Hartree) میزان بار موثر هسته را به شکل زیر معرفی کرد.
در این رابطه، میزان میزان شعاع اوربیتال برای اتم هیدروژن و میزان شعاع اوربیتال برای پیکربندی پروتون با بار هسته Z است. استفاده از این روش در محاسبات ساده در شیمی رایج نیست و بیشتر برای مطالعات فیزیک هستهای و اتمی کاربرد دارد.
روش کلمانتی - ریموند
روش اسلیتر میتواند به عونان روش خوبی برای درک و انجام محاسبات مربوط به بار موثر هسته اتم استفاده شود. هرچند، مقادیر دقیقتری که با استفاده از قوانین مکانیک کولانتومی به دست آمدهاند مقادیر دقیقتری دارند. یکی از این روشها روش کلمانتی - ریموند (Clementi-Raimondi) است. بیشتر مقادیر جداول مرجعی که برای میزان بار موثر هسته اتمها وجود دارد، بر اساس روش کلمانتی محاسبه شده اند.
تابعی به نام تابع میدان خودسازگار در روش کلمانتی برای اتمهایی با تعداد الکترون بین ۲ تا ۳۶ عدد اعمال شده است. اوربیتالهای استفاده شده در این روش مشابه روش اسلیتر هستند. با این روش، مقادیری برای ضریب پوششی اوربیتالهای 1s، 2s، 3s، 4s، 2p، 3p، 4p و 3d به دست آمدهاند. مقادیر به دست آمده در این روش ثابت میکنند که بر خلاف قوانین اسلیتر، اثر الکترونهای لایههای بعدی الکترون مورد نظر نیز در مقادیر ضریب پوششی تاثیر خواهند داشت و نمیتوان از آنها صرف نظر کرد. این مقادیر برای حالت پایه و برانگیخته مواد و یونهای مثبت آنها نیز بررسی شده است.
همچنین، کلمانتی و ریموند با بررسی اوربیتالهای 4s و 4p به این نتیجه رسیدند که مقادیر ثابت پوششی برای این اوربیتالها نمیتواند مشابه باشد. در واقع با آزمایشات آنها مشخص شد که به علت شکل اوربیتالها و تقارن اوربیتالهای آنها، مقدار ثابت پوششی اوربیتال 4s باید کمتر از میزان ثابت پوششی اوربیتال 4p باشد.
روند تغییر بار موثر هسته در جدول تناوبی
تا اینجا آموختیم بار موثر هسته چیست و چگونه محاسبه میشود. برای تشخیص ویژگیهای هر اتم نیاز است تا روندهای تناوبی تغییر پارامترهای مختلف را برای مواد مختلف در جدول تناوبی بیاموزیم. با یادگیری روند تغییر بار موثر هسته در جدول تناوبی، میتوانیم پارامترهایی مانند شعاع اتمی، انرژی یونش و الکترونگاتیوی مواد را باهم مقایسه کنیم.
شناخت روندهای تناوبی عناصر مختلف یکی از مهمترین قدمها برای یادگیری مفاهیمی مانند واکنشپذیری اتمها و ویژگیهای آنها است. پیشنهاد میکنیم برای یادگیری بهتر این روندها، مطلب «قانون دورهای عنصرها چیست» مجله فرادرس را مطالعه کنید. لینک این مطلب در ادامه آورده شده است.
روند تغییر بار موثر هسته در هر دوره
میزان بار موثر هسته اتم در هر دوره جدول تناوبی با افزایش تعداد پروتونها و الکترونها افزایش مییابد. با این وجود در هر دوره افزایش میزان بار هسته بیشتر از افزایش اثر پوششی الکترونهای درونی اتم است.
این پدیده به این دلیل است که الکترونهای اضافه شده به لایههای الکترونی یکسان اضافه میشود. در نتیجه، بار موثر هسته با افزوده شدن الکترونها به لایههای الکترونی بیرونی در هر دوره افزایش مییابد. در ادامه روند دقیق تر تغییر بار موثر هسته را در دورههای جدول تناوبی عناصر بررسی میکنیم.
دوره ۱ تا ۳
با حرکت در طول دوره های ۱ تا ۳ از چپ به راست، لایههای الکترونی در طول دوره ثابت باقی میمانند و الکترونهای لایه ظرفیت، زیرلایههای s و p را پر میکنند. در این دورهها، میزان بار موثر هسته به شکلی یکنواخت تغییر میکند. طبیعی است که با حرکت از یک دوره به دوره بعدی به علت اضافه شدن یک لایه الکترونی، میزان بار موثر هسته کاهش یابد. برای مثال، به اختلاف میزانن بار موثر هسته برای اتمهای نئون و سدیم در شکل زیر دقت کنید.
دوره ۵ و ۶
دوره ۵ و ۶ جدول تناوبی که شامل فلزات واسطه است، روندی پیچیدهتر دارد. در این عناصر زیرلایه d نیز یکی از زیرلایههایی است که توسط الکترونهای ظرفیت اشغال میشود. در طول این دوره با تغییر زیرلایهها، روند بار موثر هسته تغییر میکند. با حرکت در طول دوره، در گروه ۳ جدول مقداری افزایش میزان بار موثر هسته را داریم. این بدین علت است که زیرلایه d در حال پر شدن است. همچنین، در گروه ۱۳ جدول تناوبی، شماره لایه و زیرلایه الکترون ظرفیت تغییر میکند و به همین علت، بار موثر هسته کم میشود و سپس افزایش مییابد.
در مقایسه این گروه جدول تناوبی و گروه قبلی آن باید توجه داشته باشیم که در گروه ۱۲ جدول تناوبی الکترون ظرفیت زیرلایه 3d و 4d را پر میکند و در گروه ۱۳ جدول تناوبی الکترون ظرفیت زیرلایه 4p و 5p را پر میکند. برای مقایسه بهتر روند تغییر بار موثر هسته در این دورههای جدول تناوبی به تصویر زیر دقت کنید.
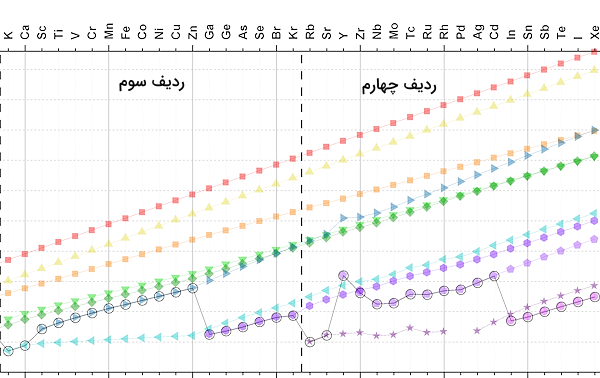
روند تغییر بار موثر هسته در هر گروه
بار موثر هسته با حرکت در راستای گروهها از بالا به پایین، مقدار خیلی کمی افزایش مییابد. این پدیده به این علت است که در هر گروه با حرکت از بالا به پایین به لایههای الکترونی و سطوح انرژی افزوده میشود. در نتیجه، الکترونهای افزوده شده به لایههای الکترونی بیرونی، به دلیل اثر پوششی الکترونهای درونی به اندازه کمتری بار موثر هسته اتم را احساس میکنند.
با وجود اینکه با حرکت در هر گروه از بالا به پایین به تعداد پروتونهای اتم افزوده میشود، اثر افزایش تعداد پروتونها و افزوده شدن لایههای الکترونی در مجموع به صورت روندی تقریبا افزایشی دیده میشود.
بیشترین و کمترین مقادیر بار موثر هسته
در قسمتهای قبل اموختیم بار موثر هسته چیست. میزان بار موثر هسته، میزان بار مثبتی است که هر الکترون از سمت هسته احساس میکند. بیشترین مقدار بار موثر هسته مربوط به اتمهایی است که بار مثبت هسته آنها زیاد و بار منفی الکترونهای آنها کم باشد مانند اتمهای هیدروژن و یون هلیوم. کمترین مقدار بار موثر هسته زمانی احساس میشود که میزان بار مثبت هسته کم و میزان بار منفی الکترونها و لایههای الکترونی زیاد باشد مانند یون پتاسیم.
بدیهی است که هرچه الکترونها به هسته اتم نزدیکتر باشند و اثر دافعه الکترونی و پوشش الکترونهای درونی برای الکترونهای دیگر کمتر باشد، میزان بار موثر هسته احساس شده برای الکترونها بیشتر خواهد بود.
بنابراین، در اتم هیدروژن که تنها از یک الکترون و یک پروتون تشکیل شده است، الکترون درونی برای ایجاد اثر پوششی وجود ندارد. همچنین، الکترون دیگری در لایه ظرفیت اتم هیدروژن وجود ندارد که اثر دافعه الکترونی ایجاد کند. پس تمامی بار مثبت پروتون بر تنها الکترون این اتم اثر میگذارد . میزان ضریب پوششی برای این اتم برابر صفر است.
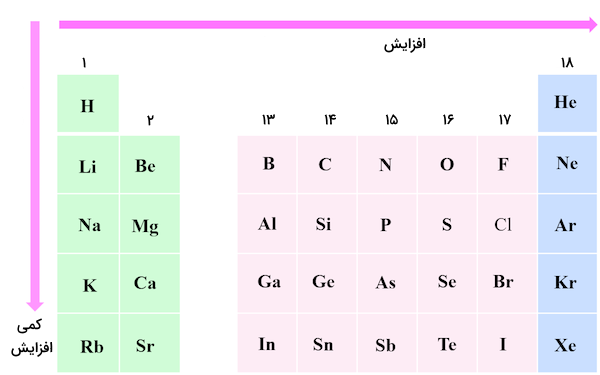
با این وجود، اگر بخواهیم میزان بار موثر هسته را تنها به صورت عددی و برای الکترونهای ظرفیت اتمهای جدول تناوبی مقایسه کنیم، باید بگوییم که از آنجا که میزان بار موثر هسته در هر ردیف افزایش و در هر گروه کمی افزایش مییابد، گوشه پایین و سمت راست جدول بیشترین مقادیر بار موثر هسته و گوشه بالا سمت چپ جدول، کمترین مقادیر بار موثر هسته را خواهد داشت.
مقایسه بار موثر هسته
در قسمتهای قبل آموختیم بار موثر هسته اتم چیست و با چه روندی تغییر میکند. برای مقایسه بار موثر هسته اتمهای مختلف باید چند نکته را در نظر بگیریم. در ادامه این نکات توضیح داده شدهاند.
- در اتمهایی با تعداد برابر الکترون، اتمی که پروتون بیشتری دارد، میزان بار موثر بیشتری نیز دارد.
- در اتمهایی که تعداد الکترون ظرفیت برابری دارند، اتمی که لایههای الکترونی بیشتری دارد، بار موثر هسته کمتری دارد.
- اثر افزوده شدن یک لایه الکترونی بسیار بیشتر از اثر افزوده شدن یک پروتون خواهد بود.
- الکترونهای یونهای منفی (آنیون) بار موثر کمتری نسبت به اتم خنثی خود احساس میکنند.
- الکترونهای یونهای مثبت (کاتیون) بار موثر بیشتری نسبت به اتم خنثی خود احساس میکنند.
با دانستن این قوانین، چند اتم را با محاسبه میزان بار موثر هسته اتم برای آنها مقایسه میکنیم. در مثال بعد، یون سدیم را با اتم سدیم مقایسه میکنیم. آرایش الکترونی اتم سدیم به شکل زیر است.
همچنین، آرایش الکترونی کاتیون سدیم به شکل زیر است و یک الکترون کمتر دارد.
تنها با مقایسه این دو آرایش الکترونی میتوانیم دریابیم که یک لایه الکترونی از لایههای اتم سدیم با تشکیل کاتیون از بین رفته است. این پدیده باعث افزایش اثر جاذبه هسته اتم بر الکترونهای باقیمانده و کوچکتر شدن شعاع یونی از شعاع اتمی میشود. حال برای اطمینان، میزان بار موثر هسته را برای این دو مورد به روش اسلیتر محاسبه میکنیم.
الکترون ظرفیت یون سدیم در لایه دوم الکترونی و زیرلایه p قرار دارد. ۷ الکترون دیگر در این لایه قرار دارند که ضریب ۰٫۳۵ میگیرند و دو الکترون لایه بعدی ضریب ۰٫۸۵ میگیرند. پس خواهیم داشت:
اتم سدیم ۱۱ الکترون دارد و الکترون ظرفیت آن در زیرلایه 3s قرار دارد. ۸ الکترون در لایه بعدی با ضریب ۰٫۸۵ دارد و ۲ الکترون با ضریب ۱ در لایه بعد از آن وجود دارد. پس خواهیم داشت:
پس مشاهده میکنیم که الکترون یون سدیم بسیار بیشتر از الکترون اتم سدیم، بار مثبت هسته اتم را حس میکند.
اثر بار موثر هسته اتم
تااینجا اموختیم بار موثر هسته چیست و با چه روندی تغییر میکند. بار موثر هسته میتواند بر بسیاری از پارامترهای مربوط به اتم اثر بگذارد. برای مثال، شعاع اتمی و انرژی یونش از مهمترین دارامترهایی هستند که با اثر بار موثر هسته اتم تغییر میکنند. در ادامه، میآموزیم روش تاثیرپذیری این پارامترها از بار موثر هسته چیست.
شعاع اتمی
با هرکت در هر دوره جدول تناوبی از چپ به راست، افزایش اثر بار موثر هسته، باعث کشیده شدن الکترونهای بیرونی به سمت هسته اتم شده و شعاع اتمی کاهش مییابد. اما با حرکت در هر گروه از بالا به پایین، به دلیل افزایش لایههای الکترونی و افزایش اثر پوششی الکترونهای درونی، الکترونهای بیرونی از هسته دور شده و شعاع اتمی در جدول تناوبی افزایش مییابد.
شعاع یونی
در یونها، میزان شعاع یونی تنها با میزان بار هسته سنجیده نمیشود. بلکه تعداد الکترونها و دافعه بین الکترونها نیز در بررسی شعاع یونی اثر دارد. با این وجود، بار موثر هسته همچنان نقشی مهم در تعیین شعاع یونی دارد. برای مثال، اضافه کردن یک الکترون به لایه بیرونی اتم و تولید یون منفی باعث کاهش میزان بار موثر هسته برای تمامی الکترونهای آن یون میشود و شعاع یونی افزایش مییابد.
انرژی یونش
با حرکت در هر دوره جدول تناوبی از چپ به راست، انرژی یونش به دلیل افزایش بار موثر هسته افزایش مییابد. این پدیده به این علت است که الکترونها بیشتر تحت اثر بار مثبت هسته هستند و جدا کردن آنها از اتم دشوارتر خواهد بود و انرژی بیشتری احتیاج دارد.
در هر گروه از جدول تناوبی با حرکت از بالا به پایین با افزایش شعاع اتمی و کاهش بار موثر هسته، الکترونها کمتر تحت اثر بار مثبت هسته هستند و جدا کردن آنها آسانتر است. به همین علت، میزان انرژی یونش کاهش مییابد.
الکترون خواهی
الکترون خواهی میزان انرژی آزاد شده از اتم هنگام اضافه کردن الکترون به آن است. روند تغییر میزان الکترون خواهی اتمها با میزان بار موثر هسته رابطهای مستقیم دارد و با افزایش میزان بار موثر هسته در دورههای جدول تناوبی، میزان الکترونخواهی آنها افزایش مییابد.
با افزایش میزان بار موثر هسته، اتم بیشتر الکترونها به خود جذب میکند و میزان انرژی آزاد شده از آن هنگام دریافت الکترون بیشتر خواهد بود.
رابطه بار موثر هسته و جاذبه هسته
در قسمتهای قبل توضیح دادیم که الکترونهای لایه ظرفیت اتمها، بار هسته کمتری را نسبت به الکترونهای درونی احساس میکنند. اثر جاذبه هسته بر الکترونهای مختلف متفاوت خواهد بود. یک رابطه اصلاح شده از قانون کولن وجود دارد که در آن میزان نیرو بر اساس بار موثر هسته اتم محاسبه میشود. این فرمول به شکل زیر نوشته میشود.
در این فرمول f نیروی هسته، z بار موثر هسته و r شعاع (فاصله الکترون تا هسته) است. این فرمول بیان میکند که اگر بتوانیم میزان بار موثر هسته را بر یک الکترون محاسبه کنیم، میتوانیم میزان نیروی جاذبه وارد شده از سمت هسته اتم بر الکترون را بیابیم.
جاذبه هسته بر الکترونهای اتم، اندازه شعاع اتمی یا شعاع یونی، الکترونخواهی و الکترونگاتیوی عنصر را مشخص میکند. هرچه میزان جاذبه هسته بر الکترونها بیشتر و میزان بار موثر هسته اتم بیشتر باشد، اتم کوچکتر خواهد بود و شعاع آن کمتر خواهد بود و انرژی یونش و الکترونگاتیوی و الکترونخواهی آن بیشتر میشود.
نفوذ الکترونی چیست؟
مفهوم نفوذ الکترونی بیان میکند که میزان مجاورت و نزدیکی هر الکترون با هسته اتم چقدر است. در یک اتم چند الکترونی، میزان نفوذ الکترونی با دانسیته الکترونی اطراف هسته اتم مرتبط است. الکترونها در اوربیتالهای مختلف، دانسیته متفاوتی دارند.
به بیان دیگر، نفوذ الکترونی به شماره لایه (عدد کوانتومی اصلی الکترون) و شکل اوربیتال (عدد کوانتومی فرعی الکترون) وابسته است. الکترونهایی که نفوذ بیشتری دارند، میتوانند به هسته اتم نزدیک تر شوند و برای سایر الکترونهای اتم که نفوذ کمتری دارند، اثر پوششی ایجاد کنند.
فرمولهای ارائه شده برای محاسبه میزان بار موثر هسته هست اتم، تخمین خوبی از مقدار واقعی آنها را به دست میآود. اما میزان واقعی بار موثر هسته اتم در هر اوربیتال تنها تابعی از تعداد الکترونهای موجود در هر لایه و زیرلایه نیست. در حقیقت، شکل اوربیتال و دانسیته الکترونی نیز در میزان بار موثر هسته حس شده از سمت الکترونها تاثیر دارد. به همین علت است که میزان بار موثر هسته برای الکترونهای ظرفیت هر اتم مقادیر متفاوتی با سایر اتمها دارد.
برای مثال، الکترونهای زیرلایه 1s دانسیته الکترونی بیشتری از الکترونهای موجود در زیرلایه 2p دارند. به همین علت، میزان نفوذ الکترونی الکترونهای موجود در این زیرلایه بیشتر است و میزان بار موثر هسته را برای الکترونهای موجود در زیرلایه 2p کم میکنند. اما، الکترونهای موجود در زیرلایه 2s میزان اثر پوششی کمتری را احساس میکنند زیرا به دلیل شکل اوربیتالهایشان و دانسیته الکترونی آنها میتوانند بیشتر به هسته اتم نزدیک شوند.
نمودار زیر، توابع حضور الکترونهای موجود در اوربیتالهای 1، 2s و 2p را به هسته اتم نشان میدهند. این نمودار با استفاده از رابطه شرودینگر و احتمال حضور الکترونها به دست آمده است.
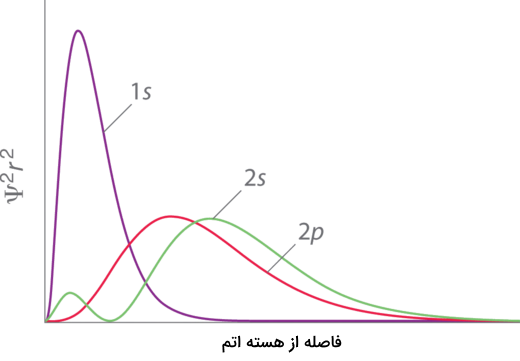
میزان نفوذ الکترونی در لایههای یکسان، به دلیل تفاوت در شکل اوربیتالها و دانسیته الکترونی آنها، برای اوربیتال s بیشتر از p و p بیشتر از d و f است.
در لایههای الکترونی مختلف (n)، میزان نفوذ الکترونی از ترتیب زیر پیروی میکند.
یادگیری شیمی دانشگاهی با فرادرس
یادگیری بار موثر هسته و درک تأثیر آن بر ویژگیهای اتمی یکی از مفاهیم اساسی در شیمی کوانتومی و روندهای تناوبی عناصر است. برای درک این مفهوم ابتدا باید با مباحثی مانند ساختار اتمی و آرایش الکترونی عناصر آشنا شوید. با شناخت این اصول، میتوانید تأثیر اثر پوششی و بار موثر هسته بر انرژی یونش را بررسی کنید. همچنین، درک الکترونخواهی عناصر به شما کمک میکند تا رفتار آنها را در واکنشهای شیمیایی تحلیل کنید. پیشنهاد میکنیم برای درک بهتر این مفاهیم به مجموعه فیلم آموزش شیمی از دروس دانشگاهی تا کاربردی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین، با مشاهده فیلمهای آموزش فرادرس که لینک آنها در ادامه آمده است، میتوانید به آموزشهای بیشتری در زمینه بار موثر هسته دسترسی داشته باشید.
- فیلم آموزش شیمی معدنی ۱ مرور و حل تست کنکور ارشد فرادرس
- فیلم آموزش شیمی معدنی ۲ جامع و کاربردی فرادرس
- فیلم آموزش شیمی معدنی ۱ مرور و حل تمرین فرادرس
کاربرد مفهوم بار موثر هسته چیست؟
در این مطلب از مجله فرادرس آموختیم بار موثر هسته چیست. بار موثر هسته اتم تنها یکی از پارامترهای اتم نیست. این کمیت، بسیاری از جنبههای فیزیکی و شیمیایی اتمها را توضیح میدهد. فهمیدن این موضوع که بار موثر هسته چیست، به ما در درک بسیاری از پدیدهها در حیطههای مختلف مانند فیزیک حالت جامد، اندازه اتمی، انرژی یونش، الکترون خواهی و غیره کمک میکند.
میزان بار موثر هسته به شکلی مستقیم بر شعاع اتمی و شعاع یونی تاثیر دارد. هرچه میز بار موثر هسته بیشتر باشد، الکترونها بیشتر به سمت هسته کشیده میشوند و اندازه شعاع اتمی و شعاع یونی کاهش مییابد.
میزان بار موثر هسته نقش مهمی در برآورد ساختار کریستالی بسیاری از مواد دارد. این پارامتر میتواند بر شکل کریستالها و شیوه به هم متصل شدن اتمهای آنها اثر بگذارد و شکلهایی مانند شبکه مکعبی وجه پر، مکعبی مرکز پر و شش گوشه فشرده را تشکیل دهد. همچنین، با تغییر دادن میزان بار موثر هسته اتمهای مختلف میتوان به ساختارهای آلوتروپ جدید دست یافت.
همچنین میزان بار موثر هسته بر واکنشپذیری مواد نیز اثر دارد. اتمهایی با بار موثر هسته کم، به راحتی الکترونهای خود را از دست میدهند و راحتتر کاتیون تشکیل میدهند. از طرف دیگر، اتمهایی با بار موثر هسته بالا، تمایل بیشتری برای دریافت الکترون و تولید آنیون دارند. در نتیجه، اتمهایی که میزان بار موثر هسته برای آنها خیلی کم یا خیلی زیاد است، واکنشپذیری بیشتری دارند.












