باتری چیست؟ – از صفر تا صد
چه پاسخی برای سوال باتری چیست دارید؟ آیا تا به حال تصور کردهاید که جهان امروزی، بدون باتری به چه شکل خواهد بود؟ تلفن همراه، لپتاپ، ماشینهای الکتریکی، ساعت، ماشینحساب، رادیو یا حتی ادوات پزشکی نظیر سمعک، ضربانساز قلب، ویلچرهای برقی و ... هیچکدام بدون باتریها قابل استفاده نیستند.


تصور دنیای بدون باتری مشکل و یا حتی شاید کسلکننده باشد. باتریهای مختلف با اندازه و ولتاژهای مختلف در هر زمانی که نیاز است میتوانند انرژی الکتریکی مورد نیاز ما را فوراً تامین کنند. اگر برایتان جالب است که با ساختار و فیزیک باتری و چگونگی تامین انرژی الکتریکی توسط آنها آشنا شوید و پاسخی مناسب برای پرسش باتری چیست بیاید، با ما در ادامه این مقاله همراه باشید تا با زبانی ساده به بررسی کامل باتریها بپردازیم.
باتری چیست ؟
به طور ساده میتوان باتری را سلول یا یک پَک شیمیایی (chemical power pack) تعریف کرد که در مواقع نیاز، میتواند انرژی شیمیایی را به به انرژی الکتریکی تبدیل کند. یک باتری با انجام واکنشهایی شیمیایی درون خود، انرژی شیمیایی موجود را به انرژی الکتریکی تبدیل میکند. باتری بسته به مشخصات ساختاری و نوع استفاده از آن، میتواند عمری بین چند ساعت تا چند هفته داشته باشد.
ساختار باتری
قسمت اصلی یک باتری که انرژی الکتریکی لازم را فراهم میکند، سلول (Cell) نام دارد. سلول باتری از ۳ جزء (دو الکترود و یک ماده شیمیایی به نام الکترولیت) تشکیل شده است. پیشنهاد میکنیم جهت آشنایی کامل با الکترولیتها، به مقاله «الکترولیت و هدایت الکتریکی — از صفر تا صد» مراجعه فرمایید.
جهت ایزوله کردن سلول از محیط بیرون و همچنین فراهم کردن ایمنی و راحتی استفاده، سلول درون یک بسته یا کِیس (case) خارجی (فلز یا پلاستیکی) قرار دارد. در این بسته خارجی دو الکترود با علامتهای + (قطب مثبت) و - (قطب منفی) وجود دارد که به دو الکترود داخلی سلول متصل هستند.
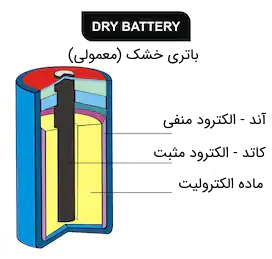
میتوان گفت که تفاوت یک باتری با سلول در این است که یک باتری میتواند از یک یا چندین سلول تشکیل شده باشد که بدین ترتیب ظرفیت و قدرت آنها به یکدیگر اضافه میشود. در این رابط، احتمالاً واژه باتری ۶ یا ۸ سلولی لپتاپ به گوشتان آشنا است.

هنگامی که دو الکترود باتری به یک مدار، به طور مثال یک لامپ ساده، متصل شوند، ماده شیمیایی درون سلول (الکترولیت) شروع به فعالیت میکند. در واقع این مواد طی واکنشهایی شیمیایی به آرامی به مواد دیگری تبدیل میشوند. میتوان گفت که طی واکنشهای شیمیایی خاصی که در الکترولیت اتفاق میافتد، یونهایی تشکیل و الکترونهایی آزاد میشوند.
الکترونهای آزاد شده میتوانند از سر قطب منفی در مدار شارش کرده و انرژی الکتریکی مورد نیاز مدار را تامین کنند. این روند تا زمانی که ماده الکترولیت به طور کامل دگرگون شود (به ماده دیگری تبدیل شود) ادامه پیدا میکند. در این صورت، حرکت یونها در الکترولیت و شارش الکترونها در مدار متوقف میشود.
چرا باتریها به دو ماده مختلف نیاز دارند؟
اگر دقت کرده باشید، دو الکترود باتری از دو ماده متفاوت ساخته شدهاند. در واقع رسانایی الکتریکی این دو ماده با یکدیگر متفاوت است. یکی از الکترودها تمایل به جذب الکترونها داشته و دیگری به راحتی الکترونها را عبور میدهد. بدیهی است که اگر هر دو الکترود جنس یکسانی داشتند، هیچ جریانی شارش پیدا نمیکرد. برای اینکه درک بهتری از این موضوع داشته باشیم، اجازه دهید نگاهی به تاریخچه الکتریسیته در سال 1792 میلادی داشته باشیم. در آن زمان «لوئیچی گالوانی» (Luigi Galvani) دریافت که میتواند به کمک پای قورباغه، الکتریسیته تولید کند.

گالوانی با اتصال (وارد کردن) دو الکترود به دو پای قورباغه مرده، توانست جریان الکتریسیته تولید کند. وی نام این الکتریسیته را برق حیوانات (animal electricity) نامید. اندکی بعد دانشمند هموطنش «الکساندر ولتا» (Alessandro Volta) دریافت که دو الکترود استفاده شده توسط گاوانی، جنسهای متفاوتی دارند. در اینجا بدن قورباغه حکم ماده الکترولیت را بین دو الکترود با جنس مختلف دارد. با گذشت زمان مشخص شد که هیچ چیز خاص و عجیبی در بدن قورباغه وجود نداشته و یک ماده شیمیایی مناسب و یا حتی یک لیمو میتواند به عنوان ماده الکترولیت استفاده شود.

اما از نقطه نظر علم شیمی چه چیزی باعث تفاوت در عملکرد الکترودها میشود؟ شاید از دوران دبیرستان با ویژگی الکترونگاتیوی آشنا باشید. الکترونگاتیوی پارامتری برای سنجش الکترون خواهی عناصر شیمیایی است. در واقع هرچه یک عنصر الکترونگاتیوتر باشد، تمایل آن برای جذب الکترون بیشتر است.
با اتصال دو فلز مختلف به مادهای الکترولیت و قرار دادن آن در یک مدار الکتریکی، شاهد شارش الکترونها (برقراری جریان الکتریکی) هستیم. در واقع یکی از فلزات که الکترونگاتیوتر است، تمایل به گرفتن الکترونهای فلز دیگر دارد. با این اوصاف اگر دو فلز، جنس یکسانی داشته باشند، هیچگونه جریانی در مدار برقرار نمیشود.
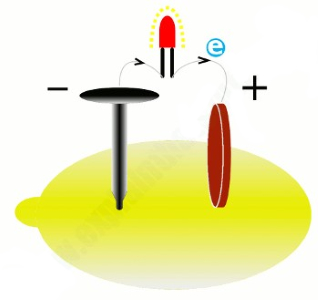
نگاهی عمیقتر به چگونگی عملکرد باتری

تصویر فوق را در نظر بگیرید. یک لامپ کوچک توسط یک سیم رسانا، توسط باتری روشن شده است. میتوانیم شماتیک تصویر فوق را به صورت زیر رسم کنیم:
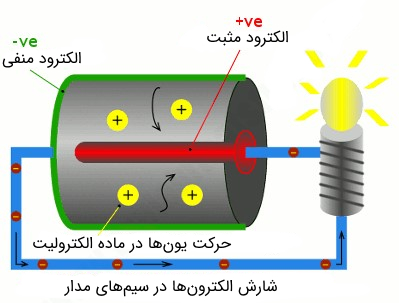
با توجه به شماتیک شکل فوق، یکی از پایههای لامپ به الکترود + باتری که بیشتر حجمش در سلول پنهان است، متصل شده است (قسمت قرمز رنگ). در اینجا قطب مثبت را کاتد مینامیم. بدنه خارجی باتری (پایین باتری) الکترود منفی است (قسمت سبز رنگ).
از آنجایی که معمولاً در اکثر علوم مختلف کاتد را قطب منفی و آند را قطب مثبت فرض میکنیم، جهت دوری از سردرگمی، پیشنهاد میکنیم که در مورد باتریها از واژههای قطب یا ترمینال مثبت و منفی برای الکترودهای آن استفاده کنید.
همانطور که در شکل (7) مشخص است، الکترودهای مثبت و منفی توسط ماده الکترولیت از یکدیگر جدا شدهاند. الکترولیت میتواند مایع و یا جامد باشد. در باتریهای معمولی، ماده الکترولیت، غالباً پودر خشک است.
به هنگام اتصال باتری در یک مدار الکتریکی، واکنشهای شیمیایی درون ماده الکترولیت و الکترودها آغاز شده که در نتیجه آن الکترونها و یونهای مثبتی تشکیل میشوند. الکترونهای تشکیل شده به سمت الکترود منفی میروند. با توجه به شماتیک فوق، یونهای مثبت درون الکترولیت جابهجا شده و الکترونها از طریق الکترود منفی و سیم رسانا در مدار شارش پیدا میکنند.
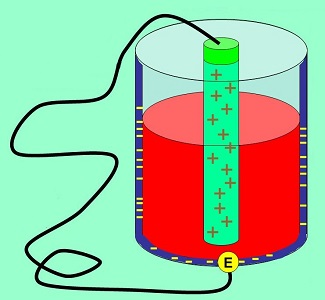
الکترونهای جریان یافته در مدار، به قطب یا الکترود مثبت وارد شده و از این طریق میتوانند جذب یونهای مثبت موجود در الکترولیت شوند. بدین ترتیب الکترون و یونها توسط واکنشهای شیمیایی که در الکترولیت رخ میدهد در جریان هستند. اینکه واکنش شیمیایی به چه شکل است، بستگی به جنس ماده الکترولیت و الکترودهای فلزی دارد. در بخش بعدی، به هنگام معرفی انواع باتری، به چندین ماده الکترولیت اشاره میکنیم. پرداختن به واکنشهای شیمیایی در اینجا خارج از هدف این مقاله است. اما به هر حال میتوان گفت که مکانیزم عملکرد تمامی باتریها به شرح فوق است.
از آنجایی که در ماده الکترولیت واکنشهای شیمیایی پیدرپی رخ میدهند، در نهایت تمامی ماده الکترولیت اولیه به ماده دیگری تبدیل شده و دیگر توانایی انجام تشکیل یونهای مورد نیاز را ندارد. بدین ترتیب به مرور زمان، ولتاژ باتری افت پیدا میکند. از آنجایی که ولتاژ یا به بیان دیگر اختلاف پتانسیل عامل حرکت بار الکتریکی است، با کاهش ولتاژ باتری، الکترونهای مورد نیاز جهت تامین انرژی ادوات الکتریکی در مدار شارش پیدا نمیکنند.
ممکن است برایتان سوال پیش آید که چرا الکترونها برای رفتن به قطب مثبت، مسیر کوتاهتر یعنی از طریق الکترولیت را انتخاب نمیکنند؟! برای پاسخ به این سوال نیازی به بررسی شیمیایی ساختار الکترولیت نیست. در واقع الکترولیت از نظر الکتریکی همانند عایقها بوده و مقاومت آن بالاست، در نتیجه همانند سدی در برابر عبور الکترونها عمل کرده و الکترونها به ناچار از مسیر بیرونی (سیم رسانا) جریان مییابند.
همانطور که متوجه شدید، جریان الکتریکی که در واقع همان شارش الکترونها است، از قطب منفی باتری بوده و به سمت قطب مثبت میرود. اما در فیزیک الکتریسیته و مهندسی برق، جهت جریان را به صورت قراردادی از قطب مثبت به قطب منفی در نظر میگیرند.
انواع باتری
باتریهای مختلفی در اشکال، ابعاد، ولتاژ و ظرفیتهای مختلف وجود دارند. به طور کلی تمامی باتریها را در دو دسته اولیه و ثانویه دستهبندی میکنند. جهت آشنایی بیشتر با انواع باتریها، پیشنهاد میکنیم تا نگاهی بر مقاله «انواع باتری — از صفر تا صد» داشته باشید. در این بخش تنها به معرفی باتریها میپردازیم. بررسی باتریهای معرفی شده از دیدگاه علم الکتروشیمی، خارج از حوصله این مقاله است.
منظور از باتریهای اولیه، باتریهایی هستند که تنها یک بار قابل استفاده بوده و پس از اتمام ظرفیت، کاربردی ندارند. البته مراکز خاصی وجود دارند که باتریهای مصرفی را بازیافت کرده تا برای محیط زیست خطری ایجاد نکنند. جهت آشنایی با بازیافت باتریها، به مقاله «باتری ها چرا و چگونه بازیافت می شوند؟» مراجعه فرمایید.
باتریهای ثانویه نیز باتریهایی هستند که پس از اتمام ظرفیت، قابلیت شارژ دوباره دارند. در واقع با قرار دادن آنها در خلاف جهت معمول در مدار (جریان عکس) میتوان آنها را دوباره شارژ کرد. در این صورت میتوان گفت که واکنشهای شیمیایی در ماده الکترولیت در جهت عکس انجام میشوند. البته توجه داشته باشید تعداد دفعات شارژ محدود بوده و پس از تعداد مشخصی عمل شارژ و دشارژ، باتری کارایی اولیه خود را از دست میدهد و دچار افت ولتاژ میشود. این امر به وضوح در باتری گوشیهای هوشمند دیده میشود.

باتریهای اولیه (یکبار مصرف - غیر قابل شارژ)
در نگاه اول ممکن است که باتریهای اولیه، نسبت با مدلهای ثانویه گرانقیمت و قدیمی به حساب آیند. اما مزیت عمده آنها این است که انرژی بیشتری در خود ذخیره میکنند و زمان دشارژ طولانیتری نسبت به ظرفیت مشابه در باتریهای ثانویه دارند. به طور مثال یکی از کاربردهای اصلی باتریهای اولیه، تامین انرژی ضربانسازهای قلب است که به مدت طولانی در بدن فرد دارای مشکل قلبی قرار میگیرد.
سه نوع اصلی از باتریهای اولیه به نامهای کربن-روی، قلیایی و لیتیومی وجود دارند. از آنجایی که هیچ مایعی در آنها وجود ندارد یا به عبارت دیگر، ماده الکترولیت آنها جامد است، اغلب به آنها سلولهای خشک گفته میشود.
باتری روی کربن (Zinc - Carbon)

میتوان گفت ارزانترین نمونه باتریهای اولیه که در زندگی روزمره از آنها استفاده میکنیم، باتریهای روی - کربن هستند. باتریهای یکبار مصرف روی - کربن حدود سال 1865 میلادی توسط مخترع فرانسوری «ژئورژ لکلانچ» (Georges Leclanché) اختراع شد. به همین دلیل بعضاً به این نوع باتریها، سلولهای لکلانچ نیز گفته میشود.

این نوع باتریها گرچه ارزان قیمت و برای کاربردهای معمولی مناسباند، اما ظرفیت و عمر زیادی نداشته و نیاز به تعویض سریع و زودهنگام دارند. باتری روی-کربن گزینهای مناسب جهت آموزش چگونگی عملکرد باتری، به شرح ذیل است:
الکترود مثبت از یک میله کربی ساخته شده که توسط پودری از جنس کربن و منگنز (IV) اکسید (manganese (IV) oxide) احاطه شده است. الکترود منفی نیز آلیاژی از جنس روی است. الکترولیت نیز ماده کلرید آمونیوم (ammonium chloride) است.

به هنگام قرارگرفتن باتری روی-کربن در مدار الکتریکی، واکنشهای متفاوتی در دو الکترود رخ میدهد. در الکترود منفی، روی به یونهای روی تبدیل شده و در نتیجه الکترونهای آزاد شده از طریق سیم شارش پیدا کرده و به سمت الکترود مثبت (میله کربنی) میروند. در الکترود مثبت نیز، منگنز (IV) اکسید طی واکنشی به منگنز (III) اکسید و آمونیاک تبدیل میشود.
باتری قلیایی (Alkaline)
باتریهای اولیه قلیایی نسبت به باتریهای روی-کربن ظرفیت و عمر بیشتری داشته که درنتیجه قیمتشان کمی بالاتر است. الکترود مثبت در این نوع باتریها از جنس منگنز اکسید (Manganese (IV) Oxide) و الکترود منفی از جنس روی (Zinc) ساخته شده است. الکترولیت نیز محلول قلیایی غلیط پتاسیوم هیدروکسید (Potassium Hydroxide) است. الکترولیت مذکور باعث ایجاد خارش و سوزش چشم، پوست و مشکلات تنفسی شود. لذا باید مراقب بود تا این ماده از باتری به بیرون نشت نکند.

در الکترود مثبت، منگنز (IV) اکسید طی واکنشی شیمیایی به یونهای منگنز (ّIII) اکسید و هیدروکسیل (Hydroxyl) تبدیل میشود. در الکترود منفی نیز، روی با یونهای هیدروکسیل واکنش داده که طی آن، چندین الکترون آزاد شده و از طریق سیم رسانا در مدار جریان مییابند.
باتری دکمهای (Button Battery)
باتریهایی با سلولهای دکمهای شکل که بیشتر به باتری ساعت یا سکهای معروف هستند، الکترودهایی مشابه باتریهای قلیایی دارند با این تفاوت که ماده الکترولیت آنها به جز مواد قلیایی، الکترولیتهای دیگر نیز میتواند باشد. الکترود منفی در این نوع باتریها در انواع مختلف از روی یا لیتیوم ساخته شده است. الکترود مثبت نیز در مدلهای مختلف از اکسید منگنز (manganese oxide)، اکسید نقره (silver oxide) یا اکسید مس (copper oxide) ساخته میشود.

مدلهایی از نوع این باتریها با الکترود مثبت اکسید جیوه (mercury oxide) نیز وجود دارد که امروزه به دلیل خطر جیوه برای سلامتی انسانها مورد استفاده قرار نمیگیرند.
باتریهای ثانویه (قابل شارژ)
تا قبل از همهگیر شدن تجهیزات الکترونیکی قابل حمل نظیر موبایل و لپتاپ، باتریهایی قابل شارژ، به دلیل دوام کم (زمان دشارژ پایین) از محبوبیت زیادی برخوردار نبودند. اغلب باتریهای قابل شارژ در دهه 1980 و 1990 باتریهای نیکل-کادمیوم (nickel-cadmium) و یا نیکل متال هیدرید (nickel-metal-hydride) بودند.
یکی از باتریهای قابل شارژ پر مصرف در آن دوران که همچنان نیز از آنها استفاده میشود، باتریهای قابل شارژ سرب - اسید (lead-acid) است که در خودروها از آنها استفاده میشود. در ادامه به معرفی برخی باتریهای قابل شارژ پر مصرف میپردازیم.
باتری سرب-اسید (Lead-Acid)
باتریهای سرب - اسید که به نام باتریهای ماشین در بازار موسوم هستند، غالباً از ۶ سول ۲ولت تشکیل شدهاند که در مجموع، ولتاژ دو سر این نوع باتریها ۱۲ ولت است. الکترود منفی در این نوع باتری از جنس فلزی سرب متخلخل (اسفنجی شکل) و الکترود مثبت آن از اکسید سرب (lead Dioxide) است. ماده الکترولیت نیز اسید سولفوریک (Sulfuric Acid) است.

به هنگام تخلیه (دشارژ) باتریهای سرب - اسید، هر دو الکترود با لایهای از سولفات سرب (Lead Sulfate) پوشانده شده و طی واکنشهایی، اسید سولفوریک به آب تبدیل میشود.
همانطور که بیان کردیم، اصلیترین کاربرد باتریهای سرب - اسید، تامین انرژی اولیه جهت روشن شدن موتور خودروها و روشنایی اتاق داخلی خودرو است. شارژ دوباره این باتری به وسیله دینام یا آلترناتور (Alternator) صورت میگیرد. از مشکلات این نوع باتریها میتوان به وزن زیاد و خطرناک بودن فلز سرب برای انسان و محیط زیست اشاره کرد.
باتری نیکل کادمیوم (Nickel-Cadmium)

باتریهای نیکل کادمیوم، به دلیل قیمت ارزانشان به طور عمده جایگزین باتریهای یکبار مصرف 1.5 ولتی در استفادههای عادی و روزمره شدهاند.
باتریهای نیکل کادمیوم توانایی صدها بار شارژ و دشارژ را دارند و در صورت استفاده مناسب میتوانند در چندین سال عمر مفید داشته باشند. در این نوع باتریها، الکترود مثبت از جنس nickel(III) oxide-hydroxide و الکترود منفی از جنس cadmium است. ماده الکترولیت نیز محلول قلیایی غلیط پتاسیوم هیدروکسید (Potassium Hydroxide) است.
باتریهای نیکل کادمیوم دارای اثری موسوم به اثر حافظه (memory effect) در شارژ و دشارژ هستند. این امر بدین معنی است که برای بهره بردن بیشتر از این نوع باتریها، ابتدا باید به طور کامل تخلیه (دشاٰرژ) شوند و سپس آنها را دوباره شارژ کرد.
یکی از مشکلات این باتریها خطرناک بودن فلز کادمیوم برای انسان و محیط زیست است.
باتری نیکل هیدرید فلز (Nickel Metal Hydride: NiMH)
باتریهای نیکل هیدرید فلزی به روشی مشابه باتریهای نیکل کادمیوم عمل میکنند. یکی از مزایای این نوع باتریها این است که دارای اثر حافظه کمتری نسبت با باتریهای نیکل کادمیوم هستند. همچنین نگرانیهای کمتری برای محیط زیست ایجاد میکنند.
کلمه فلز در عنوان این نوع باتریها به صورت عمومی به کار میرود. به عبارت دیگر، الکترود منفی این نوع باتریها میتواند جنسهای مختلفی داشته باشد. الکترود مثبت در باتریهای NiMH از جنس نیکل اکسی هیدروکسید (همانند باتریهای نیکل کادمیوم) و الکترود منفی آلیاژی است که جذب کننده هیدروژن باشد.

باتری لیتیوم یون (Lithium Ion)
باتریهای لیتیوم یون، در حال حاضر سریعترین نوع باتریهای قابل شارژ بوده که در طیف وسیعی از تجهیزات الکترونیکی نظیر موبایل استفاده میشوند.
در مقام مقایسه، باتریهای لیتیوم یون ظرفیتی دوبرابر نسبت به باتریهای قابل شارژ نیکل کادمیوم در ابعاد مشابه دارند. همچنین ولتاژ بالاتری داشته و سازگاری خوبی با محیط زیست دارند. باتریهای لیتیوم یون با استفاده مناسب میتوانند تا چند سال عمر مفید داشته باشند. البته بر حسب تجربه اکثر کاربران تلفنهای هوشمند، بازدهی مناسب باتریهای لیتیوم یون با استفاده روزمره بین ۲ تا ۳ سال است.

در باتریهای لیتیومی یون به هنگام دشارژ، یونهای لیتیوم از الکترود منفی به سمت الکترود مثبت میروند. در زمان شارژ نیز این روند در جهت عکس انجام میشود. اهمیت پیشرفت و بهبود این نوع باتریها آنقدر زیاد است که حتی جایزه نوبل شیمی سال 2019 را به خود اختصاص داد.












تشکر
ساده قابل فهم و پر مغز
خېلې عالي