باران اسیدی چیست و چگونه محیط زیست را ویران میکند؟
هر روز در اخبار، مقالات، کتب یا گفتوگوهای روزانه در مورد «باران اسیدی» (acid rain) میخوانیم یا میشنویم. اما باران اسیدی چیست؟ چگونه تشکیل میشود و چه اثراتی دارد؟ در این نوشته سعی خواهیم کرد به درک بهتری از این موارد برسیم.


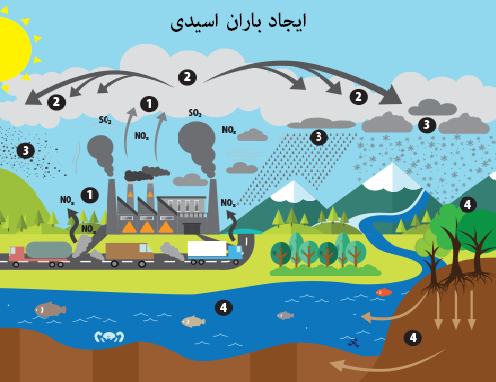
به هرگونه پایین آمدن مواد اسیدی همراه با باران، برف، مه، شبنم یا حتی ذرات جامد باران اسیدی گفته میشود. گرچه بهتر است در مطالب علمی از «بارش اسید» (acid precipitation) استفاده کرد. البته معادل فارسی این عبارت خیلی رایج نیست.
جالب است بدانید که باران تمیز در حد کمی به دلیل وجود دی اکسید کربن در هوا، اسیدی است؛ چراکه آب بعد از واکنش با این گاز، کربنیک اسید تولید میکند که البته اسید ضعیفی به شمار میرود. اما در هوای آلوده به دلیل وجود اکسیدهای نیتروژن و گوگرد یا سولفور، اسیدهای قویتری به وجود میآید. این اسیدها به ترتیب نیتریک اسید و سولفوریک اسید هستند. اصلیترین منبع تولید این آلودگیها را خودروها، تاسیسات صنعتی و نیروگاهها میدانند.
باران اسیدی اثرات مخربی روی جنگلها، آبهای شیرین و خاک دارد. این پدیده منجر به کشته شدن حشرات و تغییر صورت حیات موجودات آبزی میگردد. باران اسیدی سطح ساختمانها و مجسمهها را میخورد و برای سلامت انسان مضر است. البته در جهان امروز سعی شده با کنترل میزان خروج اکسیدهای نیتروژن و گوگرد تا حد امکان از این اثرات تخریبی جلوگیری شود.
پیشینه

«روبرت آنگوس اسمیت» (Robert Angus Smith) باران اسیدی را اولین بار در شهر منچستر انگلیس مشاهده کرد. او در سال ۱۸۵۲ رابطهی بین آلودگیهای هوا و این پدیده را توضیح داد. البته تا سال ۱۹۶۰ مطالعات جدید و موثری در این زمینه انجام نشد. «هارولد هاروی» (Harold Harvey) از کانادا اولین محققی بود که یک «دریاچهی مرده» (dead lake) را مورد بررسی قرار داد. در این دریاچه، تعداد بیشماری از ماهیها به دلیل نامعلومی میمردند.
در ایالات متحده آمریکا، چاپ مقالهای در نیویورک تایمز در رابطه با اثرات مخرب باران اسیدی روی جنگلهای نیوهمشایر توجهات عمومی را به خود جلب کرد. از انقلاب صنعتی تاکنون، انتشار اکسیدهای نیتروژن و گوگرد افزایش یافته است. صنایع شیمیایی، فلزی و نیروگاههایی که از سوخت فسیلی مخصوصا زغالسنگ استفاده میکنند، از دلایل اصلی انتشار اکسید سولفور هستند.
مواد شیمیایی اسیدی
مهمترین گازی که منجر به اسیدی شدن باران میگردد، سولفور دی اکسید (SO2) است. البته اهمیت اکسیدهای نیتروژن به دلیل کنترلهای سنگین اعمال شده روی انتشار اکسیدهای گوگرد، در حال بیشتر شدن است. تخمین زده میشود هر سال میزان ۷۰ میلیون تن SO2 از سوزاندن سوختهای فسیلی در صنایع، ۲.۸ میلیون تن از آتشسوزی در جنگلها / مراتع و در نهایت ۷ - ۸ میلیون تن در اثر فوران آتشفشانها به هوای اطراف وارد میشود.
فعالیتهای انسانی
بسیاری از ترکیبات گوگرد و نیتروژن به دلیل فعالیتهای انسانی تولید میشوند. این اقدامات شامل تولید برق، بهرهبرداری از کارخانهها و صنایع حملونقل میگردد. نیروگاههای زغالسنگسوز در میان آلودهترین صنایع جهان جای دارند. البته این نکته حائز اهمیت است که آلودگیها ممکن است صدها کیلومتر قبل از تبدیل به اسید جابهجا شوند.
در گذشته کارخانهها دودکشهای کوتاهی برای انتشار گازهای خروجی داشتند. اما امروزه متاسفانه تنها به دلیل حفظ محیط اطراف از آلودگی، از دودکشهای بلند استفاده میکنند. این آلودگیها با باد جابهجا میشوند و مناطق کوهستانی و جنگلی به دلیل بارش بیشتر، آسیب مخربتری میبینند.
مبانی شیمی
هنگامی که در آسمان ابر وجود دارد، واکنش SO2 با آب سریعتر به وقوع میپیوندد. این امر به دلیل آن است که واکنش در قطرات آب موجود در ابر بهتر صورت میگیرد.
pH
«پیاچ» (pH) - مخفف potential of hydrogen - یک کمیت لگاریتمی است که میزان اسیدی یا بازی بودن مواد را مشخص میکند. بیشتر آبزیان فقط در pH بین ۵ تا ۹ زنده میمانند. هرچه pH کمتر باشد، ماده یا محلول اسیدیتر و هر چه بیشتر باشد، محلول بازیتر است.
در علم شیمی به لگاریتم معکوس غلظت یونهای هیدروژن در یک محلول pH آن گفته میشود. این مقیاس از 0 تا 14 متغیر است و مقدار کمتر از ۷ را اسیدی و بیشتر از ۷ را «بازی یا قلیایی» (basic or alkaline) و محدوده ۷ را خنثی در نظر میگیرند.
آبکافت
SO2 در آب ابتدا حل میگردد و سپس مانند کربن دی اکسید در سلسلهای از واکنشهای تعادلی «آبکافت» (hydrolyzes) میشود. این واکنشها به شرح زیر است.
SO2 (g) + H2O ⇌ SO2·H2O
SO2·H2O ⇌ H+ + HSO3-
HSO3- ⇌ H+ + SO32-
اکسیداسیون
بسیاری از واکنشهای آبی گوگرد را از گوگرد چهار ظرفیتی به گوگرد شش ظرفیتی اکسید میکنند که منجر به تولید سولفوریک اسید میگردد. مهمترین واکنشهای اکسیدکننده عبارتند از واکنش با ازون، هیدروژن پرکسید و اکسیژن. البته این نکته را باید در نظر گرفت که با حضور ذرات آهن و منگنز در قطرات ابر، این واکنشها تسریع میشوند.
بارش اسید
بارش تر: «بارش تر» هنگامی به وقوع میپیوندد که نزولات آسمانی مانند باران و برف با خود اسید را به سطح زمین برسانند.
بارش خشک: بارش خشک اسیدی نیز ممکن است در غیاب باران و برف اتفاق بیفتد. این پدیده که مسئول ۲۰ - ۶۰ درصد بارشهای اسیدی است هنگامی اتفاق میافتد که ذرات و گازها روی زمین، گیاهان و سطوح دیگر بچسبند یا با آنها تماس پیدا کنند.
اثرات مخرب
در ادامه، به اثرات مخربی میپردازیم که بارانهای اسیدی به دنبال دارند.
آبهای سطحی و حیوانات آبزی
کاهش pH و حضور آلومینیوم در آبهای سطحی که هر دو نتیجه باران اسیدی است، به زندگی حیوانات آبزی مانند ماهیان صدمات جبرانناپذیری وارد میکند. در pH کمتر از پنج، ماهیها نمیتوانند از تخم بیرون بیایند و در آبهای اسیدیتر حتی ماهیان بزرگ میمیرند. همزمان با اسیدی شدن دریاچهها، تنوع زیستی کاهش مییابد.
خاک
زیست خاکی با باران اسیدی آسیب بسیاری میبیند. برخی از میکروبهای مناطق گرمسیری قادر به مصرف سریع اسیدها هستند؛ با این حال میکروبهای دیگر توانایی تحمل pH پایین را ندارند و کشته میشوند. باران اسیدی همچنین منجر به حل شدن بیش از اندازه مواد معدنی و باارزش غذایی در آب و ترک خاک محل میگردد که پوشش گیاهی را تضعیف میکند.
جنگلها و مراتع
این پدیده همچنین منجر به کاهش رشد درختان جنگلها، قهوهای شدن و افتادن برگها میشود. در شرایط حاد حتی امکان مرگ کامل بخشی از جنگل وجود دارد. البته مرگ درختان عموما اثر مستقیم باران اسیدی نیست. این فرآیند در ابتدا منجر به تضعیف پوشش گیاهی و افزایش آسیبپذیری آن در مقابل دیگر تهدیدات میگردد. جنگلهای کوهستانی در ارتفاع بالا بیشتر در معرض خطر هستند؛ چراکه ابرها و مهی که این درختان را احاطه کرده، حتی از باران اسیدیتر است.

البته در زمینهای کشاورزی برای جبران از دست رفتن مواد ارزشمند غذایی از انواع کودهای شیمیایی و حیوانی استفاده میکنند. در برخی زمینها حتی از سنگ آهک که در صورت حل شدن در آب خاصیت بازی دارد، برای پایدار کردن زمین در مقابل اسیدی شدن بهره میبرند. این روشها البته در پوششهای گیاهی طبیعی قابل انجام نیست.
سلامت انسان
برخی دانشمندان اثرات مخرب این پدیده بر سلامت انسان را بررسی کرده و اشاراتی نیز داشتهاند. با این حال هنوز هیچ کدام از این اثرات اثبات نشده است. البته ذرات ریز معلق در هوا که از گازهای سولفور دی اکسید و نیتروژن اکسید تشکیل میشوند، اثرات مخرب و ثابت شدهای روی سلامت تنفس انسان دارند.
اثرات مخرب دیگر

باران اسیدی همچنین برخی سطوح ساختمانهای قدیمی و مجسمههای تاریخی را از بین میبرد. این امر به دلیل واکنش دادن ترکیبات کلسیمی با اسیدسولفوریک است. برای نمونه کلسیم جزء اصلی تشکیل دهندهی آهک، گرانیت و .. است. سنگ قبور نیز میتواند مثال جالب دیگری از واکنش و تخریب به دلیل ریزش باران اسیدی باشد. اسید همچنین منجر به از بین رفتن سطوح محافظ تجهیزات فلزی و زنگ زدن آنها میگردد.
روشهای پیشگیری
اما شاید این پرسش مطرح باشد که چگونه میتوان از بارش بارانهای اسیدی پیشگیری کرد. به این منظور راهکارهایی وجود دارد که در ادامه به آنها پرداخته شده است.
تجهیزات فنی
در بسیاری از کشورها از نوعی فناوری به نام «گوگردزدایی از گاز» (flue gas desulfurization) یا به اختصار «FGD» برای گرفتن سولفور خروجی از دودکش کارخانههای زغالسنگسوز استفاده میشود.
یکی از نمونههای این روش استفاده از تجهیزی به نام «اسکرابر» (scrubber) است. اسکرابر نوعی برج است که گاز خروجی با یک فن به آن وارد و از سمت دیگر خارج میشود. در برج اسکرابر از آبآهک برای جذب سولفور دی اکسید گاز خروجی بهره میبرند. کلسیم کربنات موجود در آبآهک بعد از واکنش کلسیم کربنات تولید میکند که از نظر pH خنثی است و کاربردهای صنعتی دارد.
تفاهمنامههای بینالمللی
قراردادهای متعددی با در نظر گرفتن خطرات آلودگیهایی که میتوانند مسافت زیادی جابهجا شوند، بین کشورها وضع میشود. یکی از این نمونهها «پروتکل کاهش انتشار سولفور» (Sulphur Emissions Reduction Protocol) است.
گواهینامهی انتشار آلودگی
در این سیستم قانونگذاری، به اندازهی انتشار آلودگی، کارخانه یک گواهینامه دریافت میکند که به عنوان سرمایهی ثابت آن در نظر گرفته میشود. حال اگر بهرهبرداران کارخانه با استفاده از تجهیزات کنترل آلودگی یا تغییر فرایند آلودگی را کاهش دهند، میتوانند گواهینامهی خود را بفروشند. البته این روش، راه حلی انگیزشی برای کاهش آلودگی است.
اگر مطلب بالا برای شما مفید بوده است، احتمالاً آموزشهایی که در ادامه آمدهاند نیز برایتان کاربردی باشند.
- فیلتر هوای خودرو چگونه کار میکند؟ -- آشنایی اولیه
- معرفی بیوانرژی و کاربردهای آن -- به زبان ساده
- آموزش مقدمهای بر زیست سوختها
- آموزش پیلهای سوختی — مفاهیم و ساختار
- مجموعه آموزشهای دورس مهندسی شیمی
- مجموعه آموزشهای نرمافزارهای مهندسی شیمی
^^











