موازنه واکنش شیمیایی – به زبان ساده
در مطالب گذشته وبلاگ فرادرس در مورد واکنشهای شیمیایی و همچنین پیوندهای مختلف در شیمی صحبت کردیم. اما هریک از این پیوندها در نتیجه واکنشی است که پیشتر در طبیعت رخ داده است. در این مطلب قصد داریم تا نحوه نوشتن معادله شیمیایی را توضیح داده و نهایتا روش موازنه واکنش را بیان کنیم. همچنین میتوانید مطالب مربوط به موازنه در واکنش اکسایش و کاهش و واکنش اکسایش و کاهش آلی را نیز مطالعه کنید.
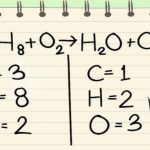
معادلات شیمیایی
همانگونه که در شکل زیر نیز نشان داده شده، حرارت دادن به ظرفی حاوی آمونیوم دیکرومات منجر به واکنشی میشود که تحت عنوان کوه آتشفشان آمونیوم دیکرومات شناخته میشود. چنین فرآیندی تولیدکننده نور، حرارت و کرومیوم اکسید سبزرنگ میشود. اما چگونه میتوان این واکنش را در قالب یک معادله نشان داد.

نحوه رخداد واکنشهای شیمیایی با استفاده از معادلات شیمیایی بیان میشوند. برای نمونه فرض کنید گاز هیدروژن () با گاز اکسیژن واکنش داده که این امر منجر به تولید آب () میشود. در این صورت معادله شیمیایی چنین واکنشی را میتوان مطابق با عبارت زیر بیان کرد:
$$ \color { white } {2 H _ 2 + O _ 2 \rightarrow 2 H _ 2 O } { 2 H _ 2 + O _ 2 \rightarrow 2 H _ 2 O } \color { white } { 2 H _ 2 + O _ 2 \rightarrow 2 H _ 2 O} $$
همانطور که در معادله فوق نیز مشاهده میکنید بهمنظور نشان دادن یک واکنش از علائم شیمیایی استفاده میشود. همچنین مواد سمت چپ معادله تحت عنوان واکنشدهندهها () و مواد سمت راست بهعنوان فرآوردهها () شناخته میشوند. معادله توصیف شده در بالا نیز مطابق با عبارت زیر بیان میشود.
توجه داشته باشید که در معادله فوق نشاندهنده واکنشدهندهها و نشاندهنده فرآوردهها است. البته معادله شیمیایی را میتوان با جزئیات بیشتری نیز بیان کرد. برای نمونه میتوان حالت هر واکنشدهنده یا فرآورده را درون پرانتز نوشته و بهصورت معادله زیر آن را بازنویسی کرد.
نشاندهنده گازی بودن مواد، ، مایع بودن و جامد بودن آنها را نشان میدهد.
موازنه واکنش
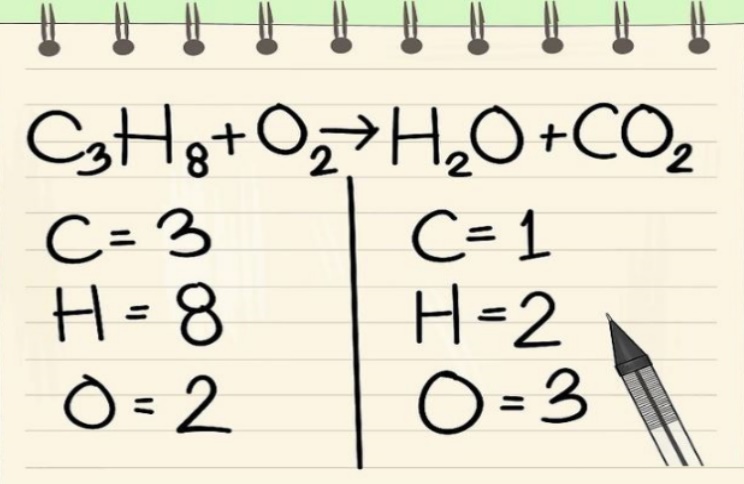
معمولا در هنگام معرفی یک معادله شیمیایی در اولین گام معادله مذکور موازنه نیست. موازنه نبودن به معنای آن است که تعداد اتمهای مربوط به هر عنصر در دو سمت معادله با هم برابر نیستند. برای تحلیل یک واکنش از بسیاری از جهات نیاز است تا در ابتدا موازنه واکنش را انجام دهید. برای نمونه معادله شیمیایی زیر را در نظر بگیرید که واکنش شیمیایی هپتان () را با اکسیژن نشان میدهد. این معادله را میتوان بهصورت زیر بیان کرد:
همانطور که مشاهده میکنید معادله فوق موازنه نیست. برای نمونه تعداد تمامی اتمهای کربن در سمت راست برابر با و در سمت چپ برابر با است. در حقیقت تعداد اتمهای واکنشدهنده با تعداد اتمهای فرآورده با هم برابر نیستند. جالب است بدانید که احتراق کامل هر هیدروکربن با مقداری کافی از اکسیژن منجر به تولید دیاکسید کربن و آب میشود.

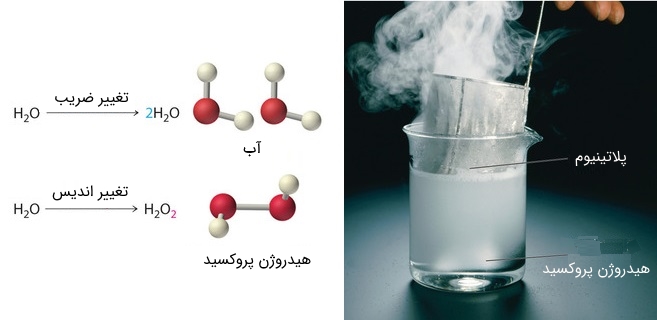
توجه داشته باشید که برای انجام موازنه نمیتوان نوع پیوندها را تغییر داد. در حقیقت نوع پیوندها با استفاده از اندیسهای قرار گرفته زیر اتمها تعیین میشوند. برای نمونه نشاندهنده مولکول آب است. برای نمونه میتوان گفت ۱ میلیارد مولکول در یک ظرف آب وجود دارد. اما اگر شما اندیسهای هریک از عناصر را تغییر دهید نوع مولکول را تغییر دادهاید. در شکل زیر دو حالت مختلف نشان داده شده که در یکی از آنها اندیس تغییر کرده و در دیگری تعداد مولکولها. در شکل زیر این تفاوت نشان داده شده است.
برای موازنه کردن یک معادله شیمیایی میتوانید مطابق با گامهای زیر به پیش بروید.
- در ابتدا پیچیدهترین ماده را شناسایی کنید.
- برای ماده انتخاب شده، عنصری را انتخاب کنید که تنها در واکنشدهندهها یا فرآوردهها ظاهر شده باشد. عنصر انتخاب شده را در طرفین معادله موازنه کنید.
- در مرحله بعد بارهای یونها را در طرفین موازنه کنید.
- اتمهای باقیمانده را موازنه کنید. معمولا این فرآیند با سادهترین ترکیب به پایان میرسد. اگر حتی یکی از ضرایب بدست آمده نیز بهصورت کسری هستند میتوانید طرفین معادله را در مخرج کسر ضرب کنید؛ با انجام این کار تمامی ضرایب صحیح شده و درک بهتری را از کل معادله بدست خواهید آورد.
- در گام آخر باید تعداد کل اتمها را در دو طرف معادله موازنه کنید. در حقیقت تعداد اتمهای تمامی عناصر باید در دو سمت معادله با هم برابر باشند.
به این روش موازنه، روش وارسی گفته میشود.
مثال ۱
در ادامه معادله سوختن هپتان ارائه شده است. این معادله را موازنه کنید.
همانطور که بیان شد در اولین گام باید پیچیدهترین ماده را شناسایی کرد. منظور از پیچیدهترین، ترکیبی است که بیشترین تعداد از اتمهای مختلف را دارد. در واکنش ارائه شده در بالا مولکول ، این حالت را دارد.
در گام بعد باید ضرایب دو سمت را به نحوی تنظیم کرد که تعداد هریک از عناصر، در دو سمت معادله با هم برابر باشند. همانطور که مشاهده میکنید تنها یک اتم کربن در سمت چپ وجود دارد. از این رو بهمنظور برابر کردن تعداد اتمهای آن، عدد را پشت دیاکسید کربن قرار میدهیم. با انجام این کار، معادله بهصورت زیر در میآید.
طبق روش ارائه شده در بالا، در گام بعدی باید بارهای یونها را در دو سمت موازنه کنیم اما همانطور که مشاهده میکنید در این معادله هیچیک از مواد دارای باری الکتریکی نیستند. در مرحله آخر نیز باید دیگر اتمهای باقیمانده را موازنه کرد. معادله فوق نشان میدهد که در سمت راست، اتم هیدروژن و در سمت چپ اتم از همین عنصر وجود دارد. بنابراین مولکول آب در سمت راست را در ضرب میکنیم. در این مرحله، معادله بهصورت زیر در میآید.
تاکنون اتمهای هیدروژن و کربن در دو سمت موازنه شدهاند. اما همانطور که میبینید اتم اکسیژن در سمت راست داریم و این در حالی است که تنها اتم از همین عنصر در سمت چپ قرار دارد. بدین منظور برای موازنه کردن اتم اکسیژن، مولکول آن را در ضرب میکنیم. در این صورت معادله فوق بهصورت زیر در میآید.
مرحله آخر را به خودتان واگذار میکنیم. در این مرحله باید تعداد تمامی اتمها را در طرفین معادله بدست آورید و از برابر بودن آنها اطمینان حاصل کنید.
مثال ۲
معمولا سوختهای فسیلی استفاده شده در وسایل نقلیه، از ترکیبات ایزواکتانها هستند. معادله احتراق آنها نیز (در حالت ایدهآل) بهصورت زیر است.
در این معادله نیز پیچیدهترین مولکول است. از این رو معادله شیمیایی مذکور در گام اول بهصورت زیر در میآید.
$$ \color { white } {2 H _ 2 + O _ 2 \rightarrow 2 H _ 2 O } { C _ 8 H _ { 18 } + O _ 2 \rightarrow 8 C O _ 2 + H _ 2 O } \color { white } { 2 H _ 2 + O _ 2 \rightarrow 2 H _ 2 O} $$
در مرحله بعد برای برابر کردن اتمهای هیدروژن نیز مولکول آب را در ضرب میکنیم.
همانطور که میبینید اتم اکسیژن کماکان در دو سمت معادله نابرابر است. بنابراین میتوان مولکول اکسیژن () را در ضرب و تعداد آنها را نیز در دو سمت برابر کرد. در نتیجه معادله بهصورت زیر در میآید.
معادله فوق اکنون از نظر تعداد اتمها در دو سمت با هم برابر است. اما پشت مولکول عدد یا همان است. در حقیقت نصف مقدار مولکول اکسیژن شاید زیاد معنیدار نباشد. از این رو میتوان با ضرب کردن کل معادله در ، کل اعداد صحیح میشود. در نتیجه شکل نهایی و صحیح معادله بهصورت زیر در میآید.
در نهایت نیز باید تعداد هریک از اتمها را در دو سمت معادله بدست آورد و برابری آنها را چک کرد. واکنش نشان داده شده در بالا دارای اتم کربن، اتم هیدروژن و اتم اکسیژن در سمت چپ بوده و همین اندازه اتم نیز در سمت راست قرار دارد. در مثال بعدی، واکنشی بهنسبت پیچیدهتر را بالانس خواهیم کرد.
مثال ۳
هیدروکسی آپاتیت معدنی با فسفریک اسید و آب واکنش داده و منجر به تولید میشود. فرمول شیمیایی این واکنش را نوشته و آن را موازنه کنید.
در ابتدا باید واکنشدهندهها و فرآوردهها را مشخص کرده و واکنش آنها را با هم بنویسیم. شکل کلی این معادله برابر است با:
در مرحله بعد باید پیچیدهترین ترکیب را در کل معادله بدست آورید. این ترکیب، است. عنصر کلسیم تنها عنصری است که هم در واکنشدهندهها و هم در فرآوردهها تنها در یک مولکول ظاهر شده است. در نتیجه با قرار دادن ضریب در پشت پیچیدهترین عنصر، معادله بهصورت زیر در میآید.
یکی از روشها بهمنظور تسریع فرآیند موازنه واکنش، استفاده از روش تعادلسازی یونهایی است که در ترکیبات واکنشدهنده و فرآورده ظاهر میشوند. بدین منظور باید بگوییم یون فسفات دارای بار منفی در سمت واکنشدهندهها و فرآوردهها است (). سادهترین راه برای بالانس کردن این یون استفاده از ضریب در سمت واکنشدهنده و پشت ترکیبِ است. در این صورت عدد از این یون در سمت راست و همین تعداد در سمت چپ قرار دارد. بنابراین معادله در این مرحله بهصورت زیر در میآید.
در مرحله آخر اکسیژن و هیدروژن نیز باید بهطور جداگانه بالانس شوند. در معادله فوق اتم هیدروژن در سمت راست قرار دارد. این در حالی است که تعداد اتمهای هیدروژن در سمت چپ نیز برابر با است. در نتیجه با قرار دادن عدد پشت مولکول آب میتوان تعداد اتمهای هیدروژن را نیز در سمت چپ برابر با کرد. نهایتا شکل موازنه شده معادله بهصورت زیر بدست میآید.
حال اگر تعداد اکسیژنها را در دو سمت محاسبه کنید خواهید دید که تعداد آنها در دو سمت برابر با است. از این رو میتوان گفت معادله بدست آمده در بالا نشاندهنده شکل نهایی این واکنش است.
در صورتیکه مطلب بالا برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشود:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای دروس رسمی دبیرستان
- آموزش جامع شیمی دبیرستان
- پیوند شیمیایی — به زبان ساده
- تعریف واکنش شیمیایی — به زبان ساده
آزمون موازنه واکنش شیمیایی
۱. برای تشخیص واکنشدهنده و فرآورده در یک معادله شیمیایی، کدام ویژگیهای ساختار معادله واکنش نقش اساسی دارند؟
قرارگیری مواد در سمت چپ و راست معادله
ترتیب الفبایی نماد عناصر
نوشتن نام مواد به صورت کامل
استفاده از اعداد اتمی عناصر
در معادله شیمیایی، واکنشدهندهها در سمت چپ و فرآوردهها در سمت راست نوشته میشوند. این ساختار مشخص میکند کدام مواد وارد واکنش میشوند و کدام مواد تولید میگردند.
۲. چرا هنگام نوشتن معادلات شیمیایی، برای هر ماده از نماد حالت مانند s یا l یا g استفاده میشود؟
این نمادها نوع یونهای شرکتکننده را نشان میدهند.
این نمادها نشاندهنده حالت فیزیکی مواد هستند.
برای اینکه نشان دهند واکنشدهندهها قبل از واکنش وجود دارند.
زیرا این نمادها تفاوت بین اتمهای یک عنصر را مشخص میکنند.
استفاده از نمادهای حالت مانند "s" برای جامد، "l" برای مایع و "g" برای گاز، سبب میشود که معادله شیمیایی به شکل دقیقتر و شفافتر نوع فاز هر ماده را نمایش دهد. این کار بر خوانایی و دقت علمی معادله تاثیر مثبت دارد و کمک میکند تا مخاطب بهسادگی متوجه شود هر ماده در چه حالتی وارد واکنش میشود و چه فرآوردهای به وجود میآید.
۳. در هنگام موازنه معادلات شیمیایی، چرا برای برقراری تساوی، ضرایب استوکیومتری را تغییر میدهیم و اندیسهای شیمیایی تغییر نمیکنند؟
تغییر ضرایب فقط تعداد مولکولها را بدون تغییر ماهیت ماده تغییر میدهد.
تغییر ضریب باعث تشکیل حالتهای جدید ماده میشود.
تغییر ضریب سادهتر است و ترکیب را پیچیده نمیکند.
افزودن اندیس به جای ضریب، فقط سرعت واکنش را بالا میبرد.
تغییر ضرایب باعث میشود تنها تعداد مولکولها یا واحدهای یک ماده در معادله تنظیم شود، اما ساختار شیمیایی و نوع ماده ثابت باقی میماند. در مقابل، تغییر اندیسهای شیمیایی ماهیت ماده را تعیین میکنند و تغییر انها به معنی تغییر کلی ماده و ایجاد ترکیب جدیدی است که با اصل موازنه واکنش شیمیایی ناسازگار است.
۴. در زمان اجرای عملی روش وارسی برای موازنه معادله شیمیایی، ترتیب صحیح مراحل زیر کدام است؟
شناسایی ماده پیچیدهتر، موازنه عناصر خاص، موازنه بار یونها، وارسی برابری مقادیر
شمارش اتمها، انتخاب ضرایب کسری، شناسایی ماده پیچیدهتر، بررسی نهایی
انتخاب حالت فاز، تنظیم اندیسها، شمارش اتمها، ضرب ضرایب در کل معادله
موازنه بار یونها، تنظیم ضرایب، شمارش هیدروژن و اکسیژن، شناسایی فرمول محصول
روش وارسی با شناسایی ماده پیچیدهتر آغاز میشود. پس از آن، عناصر خاص و پیچیده را موازنه میکنند، در مرحله بعد به موازنه بار یونها (در صورت وجود یون) میپردازند و در انتهای کار، با شمارش و وارسی همه اتمها و ارزیابی برابری مقدار آنها در دو سمت معادله، صحت موازنه را بررسی میکنند.
۵. در فرآیند موازنه واکنش شیمیایی اگر برای یک ماده ضریب کسری قرار داده شود، چه اقدامی باید صورت گیرد تا تمامی ضرایب معادله صحیح و عددی شوند و دلیل اصلی این کار چیست؟
تمام ضرایب معادله را در عددی مانند ۲ ضرب میکنیم تا همه ضرایب صحیح شوند و نسبت مواد حفظ شود.
فرقی ندارد؛ میتوان ضریب کسری را همانطور رها کرد چون ماهیت معادله تغییر نمیکند.
باید ضرایب کسری را حذف و فقط عدد یک قرار داد تا معادله کوتاهتر شود.
ضریب کسری را دور میزنیم و فقط ضرایب دیگر را تغییر میدهیم تا جمع بسته شود.
وقتی در یک معادله موازنه شده ضریب کسری ظاهر میشود، باید همه ضرایب را در یک عدد مناسب (مثلا ۲) ضرب کرد تا هیچ ضریبی کسری باقی نماند. این روش باعث میشود نسبت مواد در معادله حفظ شود و تمام ضرایب صحیح و قابل استفاده شوند.
۶. در واکنشهای معدنی پیچیده که یونهای چنداتمی دخیل هستند، کدام روش برای رسیدن به موازنه اتمهای تمام عناصر اصلی موثرتر است؟
افزودن آب بدون توجه به یونهای موجود
تنظیم ضرایب مطابق تعداد یونهای مشترک و سپس کنترل باقی عناصر
شروع با کوچکترین ضریب و تغییر اعداد اندیس مواد
تعیین ضرایب تنها براساس تعداد اتم اکسیژن
روش تنظیم ضرایب مطابق تعداد یونهای مشترک به شما امکان میدهد ابتدا متداولترین یونها مانند فسفات را به درستی موازنه کنید، سپس سراغ باقی عناصر مانند هیدروژن و اکسیژن بروید. تعیین ضرایب صرفا براساس اکسیژن باعث عدم دقت میشود، افزودن آب بدون ملاحظه یونها تعادل را به هم میزند و تغییر اعداد اندیس مواد ماهیت ماده را تغییر داده و درست نیست. تنها استفاده درست از ضرایب عددی برای یونها و بررسی نهایی دیگر عناصر، موازنه کامل را تضمین میکند.













امیدوارم این وبسایت یک مرجع جهانی بشه و به صورت روزافزون به آگاهی مردم کشورمون اضافه بکنه دمتون گرم
(حال اگر تعداد اکسیژنها را در دو سمت محاسبه کنید خواهید دید که تعداد آنها در دو سمت برابر با 41 است) برابر با 45 است
سلام و روز شما بهخیر؛
ممنونیم از دقت نظر شما دوست عزیز. متن بازبینی و اصلاح شد.
خوشحالیم که با مجله فرادرس همراه هستید.
این جمله اصلاح شود لطفا
” تاکنون اتمهای هیدروژن و اکسیژن در دو سمت موازنه شدهاند.” به جای اکسیژن باید بگید کربن
تشکر
با سلام؛
از ارائه بازخورد شما بسیار سپاسگزاریم. متن بازبینی و اصلاح شد.
با تشکر از همراهی شما با مجله فرادرس
عالی
خیلی ممنون 🙂❤️ خدا قوت🤝🏻
سلام . تشکر از توضیحات بسیار عالی شما
دستتون درد نکنه مطلب بسیار مفید و کمک کننده ای بود ??
اکسیژن در نهایت ٤٥تا
سلام دستتون درد نکنه خیلی ممنونم اجرتون با خدا خیلی خوب و مفید بود
آقا واقعاً دمتون گرم.
این مطلب واقعاً بهم کمک کرد و تونستم بهتر موازنه ها رو انجام بدم
نمیدونم چطور تشکر کنم، من این مبحث رو گیر کرده بودم، و متوجه نمیشدم…
کلاس ها هم مجازی بود و خیلی سخت بود درک کردنش…
کلیپ شما رو که دیدم خیلی راحت متوجه شدم…
ممنون استاد?❤
واقعا ممنونم نمیدونم چجور تشکر کنم
لطفا آموزشی هم راجع به ساختار الکترونی( electron configuration)و فرمول1s1 2s2 2p6 3s2 3p3
بزارید خیلی ممنون.
خیلی ممنون بخاطر این مطلب،بی نهایت سپاسگزارم
ببخشید من سوال داشتم توی قسمت های بالا برای کسری کردن ،چه زمان این کارو میکنیم ؟و از کجا بفهمیم اون کسر رو کدوم طرف قرار بدیم ؟ و اینکه چرا ضرب در بیست وپنج؟؟بطفا توضیح بدید من واقعا مشکل دارم???
در سمت راست 25 عدد از اون عنصر وجود داشت و در سمت چپ هم 2 عدد و برای موازنه کردن ضرب در 25/2 کرد و در آخر برای از بین بردن اعشاری بودن، معادله رو در مخرج اعشار ضرب کرد تا از کسری بودن هم خارج باشه!
سلام.
ممنون از زحمات.
توی مثال ۳ معادله رو اشتباه نوشتید
باسلام؛
از حسن توجه شما سپاسگزاریم.
متن اصلاح شد.
با تشکر