قانون شارل – به زبان ساده
قانون شارل که آن را با نام قانون حجمها نیز میشناسند، یک قانون آزمایشگاهی است که چگونگی انبساط گازها بر اثر گرما را بیان میکند. تعریف امروزی قانون شارل به صورت زیر است:


زمانی که فشار یک نمونه از گاز خشک، ثابت نگهداشته شود، دمای کلوین و حجم با یکدیگر نسبت مستقیم خواهند داشت. این ارتباط را میتوان به صورت زیر نوشت:
بنابراین خواهیم داشت:
یا
در رابطه بالا، ، دمای گاز بر اساس کلوین، حجم گاز و یک ثابت است. این قانون بیان میکند که چطور یک گاز با افزایش دما انبساط مییابد. به طور عکس، کاهش دما موجب کاهش حجم نیز خواهد بود. برای مقایسه یک ماده در دو حالت مختلف، این قانون را میتوان به شکل زیر بازنویسی کرد:
یا یا
منشاء قانون شارل
نام این قانون بر اساس زحمات ارزشمند دانشمند فرانسوی، ژاک شارل (Jacques Charles) انتخاب شده است. در حقیقت شارل هیچگاه کارهای آزمایشگاهی خود در این خصوص را به چاپ نرساند و اولین یا آخرین کسی هم نبود که این پدیده را کشف کرد.
در اصل، «آمونتوس» (Amontos) صد سال پیش از او همان آزمایشات را انجام داده بود و «ژوزف گیلوساک» (Joseph Gay-Lussac) در سال 1808 نتابج معتبری را در مقالات به چاپ رساند که حاکی از این بود که همه گازها از این قانون تبعیت میکنند.
علاوه بر این، ماکسول در سال 1860 بیان کرد که فضایی که یک گاز اشغال میکند، به طور خالص با حرکت مولکولهای آن مرتبط است. در یک شرایط معمول، مولکولهای گاز از یکدیگر فاصله دارند و این مولکولها آنقدر کوچک هستند که حجم آنها نادیده گرفته میشود.
آزمایش قانون شارل
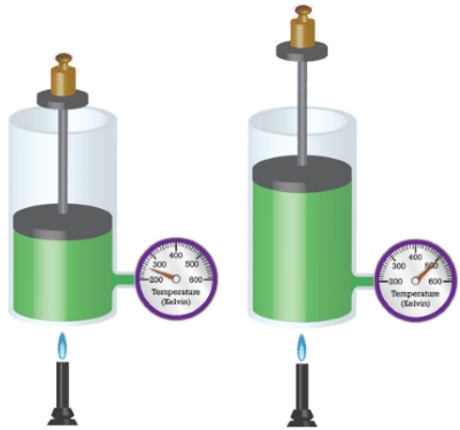
در داخل یک بالون هلیوم، تعداد اتم در هر ثانیه و با سرعتی معادل 1/6 کیلومتر بر ثانیه به دیواره بالن برخورد میکنند. سرعت و تعداد مولکولهایی که به دیوارههای ظرف برخورد میکنند، به دما وابسته هستند. این امر دلیلی است برای اینکه بفهمیم چرا گازهای گرمتر، حجم بیشتری اشغال میکنند. خوب است بدانید که چند مولکول با سرعت زیاد، حجم بیشتری را در مقایسه با مولکولهای با سرعت کم اشغال میکنند. اگر دمای کلوین یک محفظه گازی را دو برابر کنیم، تعداد برخوردهای آن به ازای سطح در هر ثانیه با توان دوم افزایش مییابند. در نتیجه، تاثیر نهایی به این صورت خواهد بود که اگر محفظه منبسط نشود، فشار دو برابر خواهد شد یا اینکه اگر بخواهیم فشار ثابت بماند، حجم محفظه دو برابر خواهد شد.
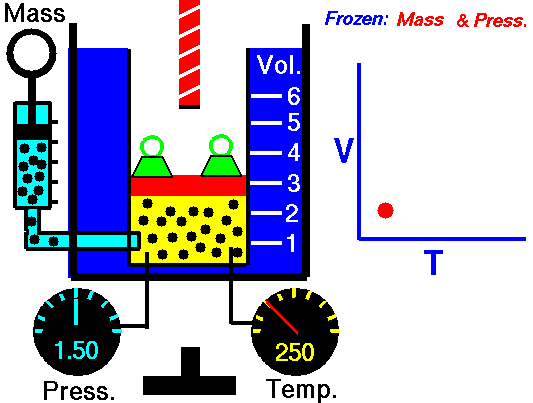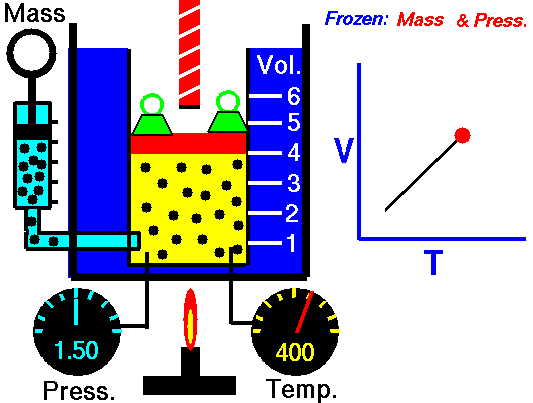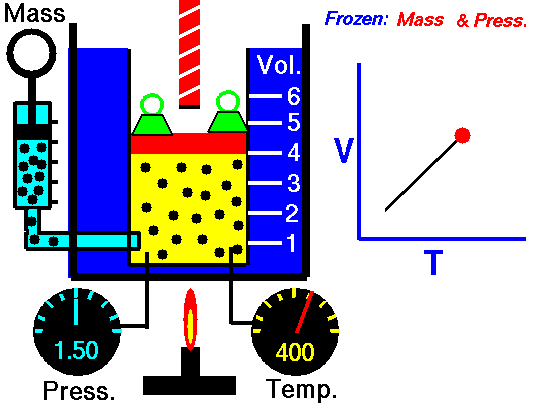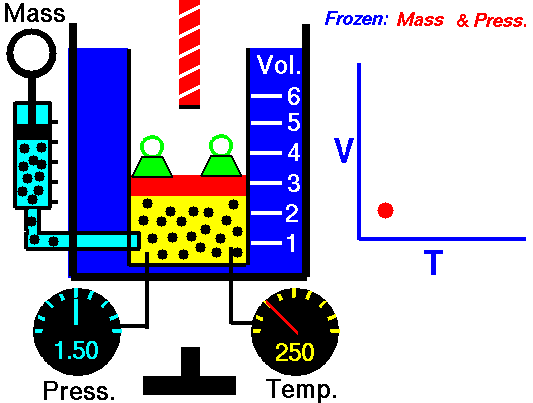
بنابراین به کمک قانون شارل میتوان توضیح داد که چرا هوای گرم، بالون را به طرف بالا میبرد یا اینکه چطور نمونهای از یک گاز را میتوان به عنوان یک دماسنج در نظر گرفت.
نمودار حجم-دما در قانون شارل
یکبار دیگر نگاهی به قانون شارل بیاندازیم. این قانون را میتوان به صورت زیر نشان داد:
با دقت در رابطه بالا در مییابیم که این رابطه، یک معادله با شیب خط ثابت است. در نتیجه، با رسم نمودار در برابر ، یک خط راست با شیبی برابر خواهیم داشت.
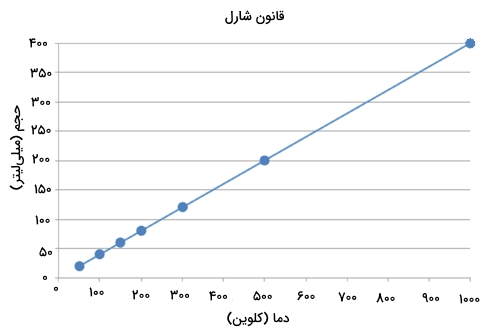
متوجه میشویم که این نمودار از مبدا گذر میکند که یعنی اگر دمای مطلق گاز به صفر برسد، حجم آن نیز به صفر میرسد. البته زمانی که یک گاز را به شدت سرد کنیم، قبل از اینکه حجم آن به صفر برسد، مولکلولهای گاز بر اثر تراکم به مایع تبدیل خواهند شد. این دما که در آن تغییرات فاز از گاز به مایع را داریم، برای گازهای مختلف، متغیر است. توجه داشته باشید که تمامی روابط ذکر شده برای قانون شارل را باید بر اساس دمای کلوین در نظر بگیرید و استفاده از این روابط با درجه سلسیوس عملی نیست.
مثال
بالونی را با حجم در دمای 22 درجه سانتیگراد پر کردهایم. سپس بالون را تا 71 درجه سلسیوس گرم میکنیم. حجم نهایی بالون را محاسبه کنید.
حل
ابتدا دادههای مساله فهرست میکنیم:
مساله، محاسبه حجم را از ما میخواهد. درنتیجه، با استفاده از قانون شارل و بازنویسی آن برای خواهیم داشت:
حال با جایگذاری مقادیر معلوم در رابطه، حجم جدید بالون را محاسبه میکنیم:
شایان ذکر است که همواره بعد از حل این قبیل از سوالات، نتایج خود را دوباره بررسی کنید. در حقیقت، میدانیم که با گرم کردن بالون، حجم نهایی باید بیشتر از حجم اولیه باشد. جواب سوال نیز این گفته ما را تایید میکند.
رابطه قانون شارل با نظریه جنبشی گازها
نظریه جنبشی گازها، خواص ماکروسکوپی گازها همچون فشار و حجم را به خواص میکروسکوپی مولکولهای سازنده گاز - بویژه جرم و سرعت مولکولها - مرتبط میکند. برای بدست آوردن قانون شارل از طریق نظریه جنبشی گازها، باید تعریفی میکروسکوپی از دما داشته باشیم. این مورد را میتوان به سادگی اینطور بیان کرد که دما با متوسط انرژی جنبشی مولکولهای گاز متناسب است. در نتیجه خواهیم داشت:
طبق این تعریف، نمایش قانون شارل نیز ساده میشود. انرژی جنبشی گاز ایدهآل، مقدار عبارت را با متوسط انرژی جنبشی طبق رابطه زیر مرتبط میکند:
لازم به ذکر است که در معادله بالا، ، عددی ثابت و برابر با تعداد کل مولکولهای گاز است.
کاربردهای قانون شارل
قانون شارل در زندگی روزمره ما کاربردهای زیادی دارد که به طور خلاصه در زیر به برخی از آنها اشاره خواهیم کرد:
بالون هلیومی
در یک بالون هلیومی یا حتی بادکنک معمولی، مشاهده میکنید که اگر بالون را در یک روز زمستانی، بیرون از منزل قرار دهید، به مرور از حجم بالون کاسته میشود. اما کافی است تا همان بالون یا بادکنک را دوباره به هوای گرم اتاق منتقل کنید، خواهید دید که حجم این بالون افزایش مییابد.

نانوایی
قانون شارل را در نانواییها نیز میتوان مشاهده کرد. میدانید که برای تهیه نان، نیاز به خمیرمایه یا خمیر ترش دارید. خمیرمایه سبب آزاد شدن حبابهای دیاکسید کربن میشود. این حبابهای کربن با افزایش دما در تنور نانوایی، افزایش حجم پیدا میکنند. این افزایش حجم در اثر افزایش دما حجیم شدن نان را به همراه خواهد داشت.

بالون هوای گرم
قانون شارل به خوبی نحوه کار بالون هوای گرم را توصیف میکند. همانطور که میدانید، قانون شارل به تعریف رابطه بین دما و حجم میپردازد. زمانی که گاز، گرم میشود، حجم آن افزایش پیدا میکند. به هنگام انبساط گاز، چگالی آن کمتر میشود و بالون را به هوا بلند میکند.

اسپری خوشبو کننده
اگر نگاهی به اسپریهای خوشبو کننده بیاندازید، خواهید دید که در کنار آنها نوشته شده است که به دور از نور آفتاب یا دمای زیاد نگهداری شود. دلیل این امر را حالا میتوان یافت. در دماهای زیاد، مولکولهای داخل قوطی منبسط و موجب تخریب محفظه قوطی خواهند شد.
تایر خودروها
به هنگام رانندگی، دمای لاستیکهای خودرو افزایش پیدا میکند. در اثر این افزایش دما و بر اساس قانون شارل، افزایش حجم لاستیک خواهیم داشت. به همین دلیل، در فصول سرد و گرم، این تغییرات سبب تغییر حجم در باد لاستیکهای خودرو میشود.
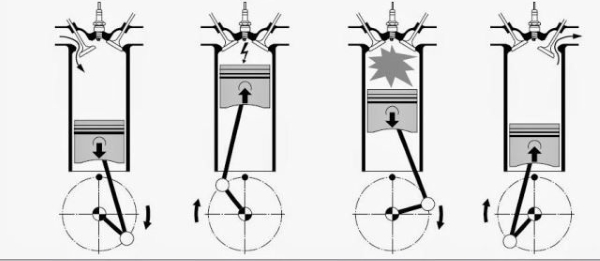
موتور اتومبیل
موتورهای خودروهای سواری نیز بر اساس قانون شارل کار میکنند. در این موتورها، در ابتدای جرقه شمع، گازها تحت دمای بسیار بالایی قرار دارند. افزایش دما سبب افزایش حجم گازها میشود. با ادامه این روند، نیروی وارد بر سیلندر و پیستون افزایش پیدا میکند. این افزایش حجم موجب حرکت دورانی میللنگ خواهد بود.
اگر این مطلب برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای مهندسی شیمی
- آموزش نظریه اتم ها در مولکول ها با نرم افزار محاسباتی AIM2000
- قانون بویل — به زبان ساده
- حجم مولی — به زبان ساده
^^












