حالت های ماده – به زبان ساده
در این مقاله از مجله فرادرس در نظر داریم تا با زبانی ساده به معرفی حالت های ماده (States of Matter) بپردازیم. احتمالاً سه کلمه جامد، مایع و گاز را زیاد شنیده باشید. این سه کلمه حالت های ماده را بیان میکنند. همانطور که از کلمه «حالت» برمیآید، جنس و ماهیت ماده تغییری نکرده و تنها حالت آن متناسب با شرایط محیطی تغییر میکند. به طور مثال، برف و یخ، آب و ابر حالتهای مختلف مولکول آب هستند. ماهیت یخ، آب و ابر همگی یکسان و ساخته شده از اتمهای هیدروژن و اکسیژن است.
- میاموزید انواع حالت ماده چیست.
- با خواص و ویژگیهای مواد جامد، مایع و گاز آشنا میشوید.
- میآموزید انواع تبدیل حالت های ماده چیست.
- یاد میگیرید حالت چهارم ماده (پلاسما) چیست و چه خواصی دارد.
- با مفهوم نظریه جنبشی به شکلی کامل آشنا میشوید.
- میتوانید تشخیص دهید مفهوم دمای صفر مطلق چیست.


در ادامه این مطلب از مجله فرادرس با ما همراه باشید تا کمی بیشتر به بررسی حالت های ماده بپردازیم. لازم به ذکر است که سطح این مقاله عمومی بوده و سعی بر این داشتهایم تا از به کار بردن اصطلاحات خاص و سطح بالا اجتناب کنیم.
حالت های ماده چیست؟
به صورت کلی، برای ماده ۴ حالت جامد، مایع، گاز و پلاسما تعریف شده است. هر یک از این حالتها ویژگیهای خاصی دارند که در ادامه بررسی میشود. به نظر شما چه چیزی باعث میشود که ماده در حالتهای مختلفی وجود داشته باشد؟ اگر پاسختان تنها دما (درجه حرارت) است، باید بگوییم که عواملی بیش از دما در حالت های ماده تاثیر گذار هستند.
حالتهای مختلف ماده و برخی از مثال های آنها به شرح زیر هستند.
- جامد: مانند یخ، شکر، نمک، اشیا فلزی و ...
- مایع: مانند آب، شیر، باران، آبمیوه، عسل و ...
- گاز: مانند هوا، بخار آب، گاز کربن دی اکسید و ...
- پلاسما: مانند پلاسمای خورشید
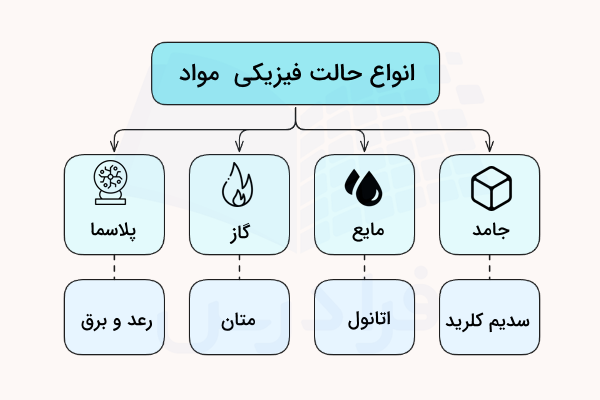
جامد چیست؟
در مواد جامد (Solids)، اتمها به طور نسبتاً محکمی با یکدیگر پیوند برقرار کردهاند. مواد جامد، حالت و موقعیت خود را حفظ کرده و برای نگهداری آنها نیازی به ظرف نیست. دقت داشته باشید که قدرت پیوند در مواد جامد مختلف نیز با یکدیگر متفاوت است. در اینجا منظور از پیوند محکم، این است که اتمها به راحتی از یکدیگر جدا نمیشوند و یک ساختار منسجم را پدید میآورند.
به طور مثال آهن و ژله (پاستیلی یا خمیری) هر دو جامد هستند، اما با اعمال نیرو به جسمی ژلهای میتوان فرم آن را آسانتر از آهن تغییر داد. قدرت پیوند بین اتمها یکی از مهمترین پارامترهایی است که حالت ماده را مشخص میکند.
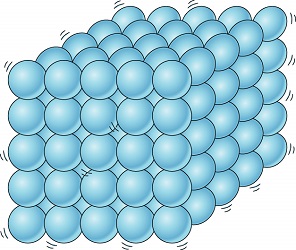
مایع چیست؟
در مایعات (Liquids)، اتمها به طور تصادفی کنار یکدیگر قرار گرفتهاند، پیوندهای بین اتمی ضعیف بوده و اتمها به راحتی میتوانند از کنار یکدیگر عبور کنند و با اتمی دیگر پیوند (ضعیف) برقرار کنند. دلیل اینکه مایعات شکل خاصی نداشته و منسجم نیستند، همین امر است. مایعات به راحتی شکل ظرفی که در آن قرار دارند را به خود میگیرند.
دادن حرارت به یک جسم جامد، باعث میشود که انرژی لازم جهت شکستن پیوندهای بین اتمها فراهم شود و در نتیجه از یکدیگر جدا شوند. در این صورت ماده جامد به مایع تبدیل میشود. توجه داشته باشید که میزان حرارت داده شده به جسم باید به حدی باشد که دمای جسم به دمای ذوب خود نزدیک شود. بدیهی است که دمای ذوب مواد جامد بر اساس ساختار اتمیها با یکدیگر متفاوت است.
بدیهی است که گرفتن گرما از مایعات، یعنی کاهش دمای آنها باعث میشود که اتمها آزادی عمل خود را از دست داده و پیوندهای قویتری با یکدیگر برقرار کنند. کاهش دمای مایعات تا نقطه انجماد، باعث تبدیل حالت آنها به جامد میشود.
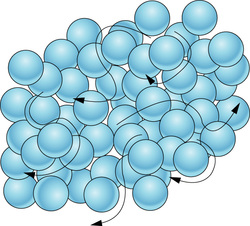
گاز چیست؟
حال اگر به مایعات گرما دهیم، یعنی دمای آنها را تا نقطه جوش بالا ببریم، انرژی لازم جهت جدا شدن کامل اتمها از یکدیگر فراهم میشود. در این صورت حالت ماده از مایع به گاز (Gas) تبدیل میشود. اتمها و مولکولها در حالت گازی، به صورت تصادفی قرار گرفته و نیروی بسیار ضعیفی بین آنها برقرار است.
در واقع در یک گاز، اتمها آزادانه به هر سمتی حرکت میکنند. به عبارت دیگر، اتمها حرکتی کاتورهای دارند. اگر گازها را تحت فشار خیلی زیاد نگه دارید یا بتوانید دمای آنها را یکباره پایین بیاورید، اتمهای آنها میتوانند دوباره با یکدیگر پیوند تشکیل دهند و در نتیجه تبدیل به مایع یا جامد شوند.
تبدیل حالت های ماده
همانطور که در بخش قبل اشاره کردیم، با تغییر فشار و دما میتوان به حالت های مختلف ماده دست پیدا کرد. البته به طور طبیعی فشار هوا روی کره زمین تغییرات چشمگیری (البته نه برای موجودات زنده!) نداشته و در نتیجه نمیتواند همانند دما روی حالت های ماده اثر بگذارد. دما در اتمسفر کره زمین به طور گستردهای تغییر میکند. بسیاری از مواد که مهمترین آنها آب است، در این گسترده دمایی میتوانند در سه حالت جامد، مایع و گاز وجود داشته باشند (با فرض فشار اتمسفر).
برای آنکه بتوانید حالتهای مختلف یک ماده را پدید بیاورید، نیاز است تا تغییرات شدیدتری در دما و فشار ایجاد کنید. به عبارت دیگر به طور طبیعی در شرایط آب و هوایی کره زمین شما نمیتوانید مواد نظیر آب را در ۳ حالت گاز، مایع و یا جامد یکباره داشته باشید. مگر اینکه با صرف کار به آنها انرژی بدهید یا انرژی بگیرید.
به طور مثال اگر به ظرف حاوی آب گرما دهیم رفته رفته شروع به تبخیر شدن میکند. توجه داشته باشید که دمای جوش و انجماد مواد، دمای ثابتی نبوده و در فشارهای مختلف تغییر میکند. به طور مثال ممکن است که آب در مکانی که فشار هوا کمتر است، در دمای ۹۸ درجه سانتیگراد به جوش آید. لازم به ذکر است که دمای ۱۰۰ درجه سانتیگراد که عموماً آن را نقطه جوش استاندارد آب میدانند، در فشار هوای نزدیک سطح دریا () به عنوان یک استاندارد تعیین شده است.
همچنین به یاد داشته باشید عمل تبخیر تنها در دمای جوش رخ نمیدهد. به طور مثال اگر دقت کرده باشید، در حمام آب گرم با دمایی بین ۴۰ تا ۶۰ درجه نیز بخار آب موجود است. دلیل این امر این است که مولکولهای سطحی آب میتوانند با انرژی کمتری پیوندشان را با سایر مولکول قطع کرده و از آب جدا شوند. روند تبخیر در نقطه جوش با بالاترین سرعت ممکن اتفاق میافتد.
در شکل زیر طرحواره تبدیل حالت های ماده به یکدیگر آمده است. لازم به ذکر است که برخی منابع عبارت تغییر فاز را به جای عبارت تغییر حالت به کار میبرند.
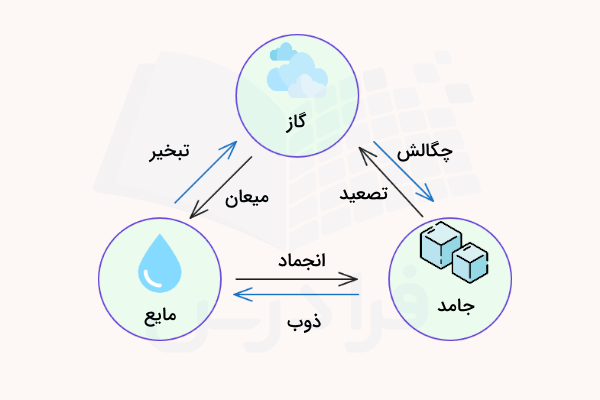
شکل فوق را میتوان به صورت زیر خلاصه کرد:
- ذوب (Melting): تبدیل حالت جامد به مایع
- انجماد (Freezing): تبدیل حالت مایع به جامد
- تبخیر (Evaporation): تبدیل حالت مایع به گاز
- میعان (Condensation): تبدیل حالت گاز به مایع
- تصعید (Sublimation): تبدیل حالت جامد به گاز
- چگالش (Deposition): تبدیل حالت گاز به جامد
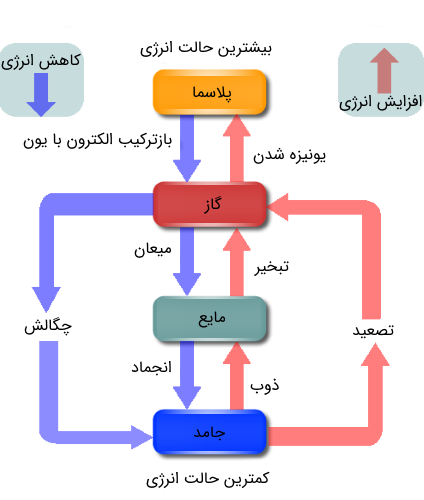
حالت چهارم ماده: پلاسما
شاید شنیده باشید که حالت های ماده تنها جامد، مایع و گاز نبوده و حالت دیگری موسوم به حالت چهارم ماده یا پلاسما وجود دارد. دیدیم که با دادن انرژی (گرما) میتوانیم جامد را به مایع و مایع را گاز تبدیل کنیم. حال اگر به دادن انرژی ادامه دهیم چه اتفاقی میافتد؟
با افزایش دمای یگ گاز، الکترونهای اتمهای آن میتوانند انرژی لازم جهت جدا شدن از اتمها را به دست آورده و در نتیجه از قید هسته رها شوند. در این صورت اتمهای گاز تبدیل به یونهای مثبت میشوند. به اتمی که تعداد الکترونهایش کمتر از تعداد پروتونهای هسته آن باشد، یون مثبت گفته میشود. همچنین اگر اتمی، الکترونی اضافی داشته باشد، به آن یون منفی میگویند. به بیانی ساده، مخلوطی از یونهای مثبت و الکترونها را پلاسما میگویند. در واقع برخی مراجع برای گازهای یونیزه شده، به این علت که دارای خواص متفاوتی با گازها هستند، عبارت حالت چهارم ماده یا پلاسما را به کار میبرند. جهت آشنایی بیشتر با پلاسما به مقاله «پلاسما در فیزیک — به زبان ساده» مراجعه فرمایید. پلاسما به صورت مصنوعی غالباً از گازهای نجیب تهیه میشود.
نظریه جنبشی
یکی از راههای درک و بررسی حالت های ماده (نظیر جامد، مایع، گاز و حتی پلاسما)، بررسی مقدار انرژی موجود در آنها است. یک بادکنک پر شده از گاز نظیر هلیوم (نوعی گاز نجیب) را در نظر بگیرید. مولکولهای گاز درون بادکنک مدام در حال حرکت و برخورد با یکدیگر هستند. دقت داشته باشید که میتوان دیواره بادکنک را در حال تعادل در نظر گرفت؛ چرا که نیرویی که مولکولهای گاز به دیواره داخلی وارد میکنند، با نیرویی که مولکولهای هوا به دیواره خارجی وارد میکنند، برابر است. به عبارت دیگر میتوان گفت که فشار گاز داخل بادکنک با فشار هوای بیرون در تعادل است.
بیان کردیم که مولکولهای گاز مدام در حال حرکت و جنب و جوش هستند. بدیهی است که این مولکولها هم جرم دارند و هم سرعت، در نتیجه دارای انرژی جنبشی هستند. حال رفته رفته بادکنک را گرم میکنیم. با این کار، مولکولهای گاز انرژی گرمایی را جذب کرده و انرژیشان بیشتر میشود. در نتیجه سرعت حرکتشان بیشتر شده و در نتیجه فشار بیشتری به دیوارههای داخلی بادکنک وارد میکنند. با این کار بادکنک منبسط میشود. در جهت عکس نیز، با قرار دادن یک بادکنک پر از گاز یا هوا در محیطی سرد، میتوانید آن را کمی منقبض کنید، چرا که انرژی مولکولها کاهش یافته و در نتیجه انرژی جنبشی و سرعت حرکت آنها کاهش مییابد.
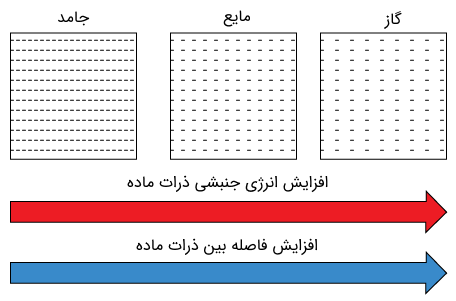
درک و بررسی چگونگی رفتار مواد جامد، مایع، گاز و پلاسما از نقطه نظر گرمایی به نظریه جنبشی ماده (Kinetic Theory of Matter) موسوم است. لازم به ذکر است که نظریه جنبشی در علمی جامعتر به نام فیزیک آماری بررسی و فرمولبندی میشود.
مفهوم صفر مطلق
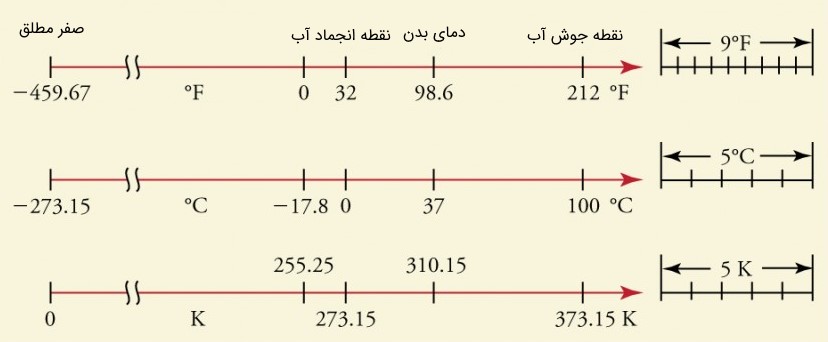
صفر مطلق، پایینترین دمای ممکن است که میتواند وود داشته باشد. این دما حد ترمودینامیکی صفر کلوین را تعین کرده و مقدار آن با ۲۷۳٫۱۵- درجه سانتی گراد برابر است. در این دما، مقدار جنبش اتمی به پایینترین مقدار خود رسیده و مقدار آنتروپی (مقدار بینظمی در یک سیستم) نیز به حداقل مقدار خود میرسد. اتمهای تمامی مواد مدام در حال حرکت هستند. حتی در مواد جامد نیز، اتمها کمی حرکت دارند. البته بهتر است بگوییم که اتمها در مواد جامد حول نقطهای ثابت در ساختار شبکهای نوسان میکنند. حرکت و جنبوجوش اتمها و در نتیجه مولکولها تابعی از دما و انرژیشان است. بیان کردیم که با دادن گرما جنبوجوش بیشتر شده و در نتیجه حرکت مولکولهای ماده سریعتر انجام میشود. همچنین با گرفتن گرما و کاهش دما، جنبوجوش اتمها و مولکولها کاهش پیدا میکند. حال اگر به فرآیند سرد کردن ادامه دهیم، چه اتفاقی میافتد؟ آیا امکان دارد تا اتمها از حرکت و نوسان باز بایستند؟
از نقطه نظر تئوری این امر امکانپذیر است. فیزیک آماری بیان میکند که اگر دمای جسمی به عدد منفی 273.15 درجه سانتیگراد (سلسیوس) برسد، اتمهای تشکیل دهنده آن ماده، هیچ حرکت یا نوسانی نخواهند داشت. این عدد به صفر مطلق معروف است. صفر مطلق کمترین دمایی است که یک جسم میتواند داشته باشد. البته تا به امروز دمای هیچ مادهای به این مقدار نرسیده است. در حال حاضر سردترین مواد روی کره زمین، ابررسانا هستند که در شرایط خاص آزمایشگاهی میتوانند به دماهایی نزدیک به صفر کلوین برسند. یکی از سردترین مواد موجود در کره زمین، ابررسانای استفاده شده در کامپیوتر کوانتومی شرکت D-Wave است که دمای آن است.

لازم به ذکر است که عدد منفی 273.15 درجه سانتیگراد، صفر مقیاس کلوین است. به عبارت دیگر به صفر مقیاس کلوین، صفر مطلق گفته میشود. جهت آشنایی با واحدهای سنجش پارامتر دما، به مقاله «تبدیل واحد دما — به زبان ساده» مراجعه فرمایید.
در صورتی که مطلب بالا برای شما مفید بوده است، آموزشهای زیر از سایت و مجله فرادرس نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای فیزیک
- آموزش شیمی عمومی
- مجموعه آموزشهای شیمی
- تعریف گرما و دما در ترمودینامیک — به زبان ساده
- معادله شرودینگر -- به زبان ساده
- میزر (Maser) چیست؟ — به زبان ساده
^^
آزمون حالت های ماده
۱. کدام یک از ویژگیهای زیر نشاندهنده تفاوت ساختاری جامد و مایع در سطح مولکولی است؟
مولکولهای هر دو در ظرف شکل خود را حفظ میکنند.
در مایع اتمها جای ثابت و مشخصی دارند.
اتمها در جامد با پیوند قوی کنار هم قرار دارند.
پیوند بین مولکولها در هر دو بسیار قوی است.
در حالت جامد، اتمها با پیوند نسبتا قوی در موقعیتی ثابت و نزدیک به هم قرار دارند و همین باعث شکل معین جامد میشود. در مایع پیوندها ضعیفتر هستند و مولکولها آزادی حرکت و تغییر مکان دارند، پس فقط مایع شکل ظرف را میگیرد. در مایع پیوندها ضعیف هستند. پیوندهای بسیار قوی بین مولکولها مخصوص حالت جامد است.
۲. اگر بر روی یک ماده مایع، فشار را کاهش و همزمان دما را افزایش دهیم، معمولا چه تغییری در حالت آن رخ میدهد و دلیل علمی این پدیده چیست؟
ماده مایع به دلیل یونیزاسیون کامل، به حالت پلاسما میرود.
ماده مایع ساختار خود را حفظ میکند چون فشار و دما همزمان تغییر میکند.
ماده مایع به حالت گاز تبدیل میشود زیرا پیوندهای مولکولی قویتر میگردد.
ماده مایع به حالت گاز تغییر مییابد چون آزادی حرکت مولکولها بیشتر میشود.
وقتی دما افزایش یابد و فشار کاهش یابد، انرژی حرکت مولکولهای مایع بیشتر شده و آزادانهتر حرکت میکنند، بنابراین مایع به حالت گاز تبدیل میشود. خلاف آن، با کاهش دما یا افزایش فشار، گاز میتواند دوباره به مایع یا جامد برگردد.
۳. زمانی که آب قبل از رسیدن به نقطه جوش به تدریج بخار شود، این فرآیند فیزیکی چه نام دارد و عامل اصلی آن چیست؟
تقطیر به خاطر فشار بالا
چگالش به علت کاهش فشار
ذوب شدن به علت افزایش دما
تبخیر آهسته به دلیل حرکت آزاد مولکولها
در شرایطی که آب پیش از رسیدن به نقطه جوش به بخار تبدیل شود، این پدیده «تبخیر آهسته» است. این فرآیند به دلیل حرکت آزاد برخی مولکولهای سطحی آب و دریافت انرژی کافی برای غلبه بر نیروهای جاذبه مولکولی در دماهای پایینتر از نقطه جوش رخ میدهد.
۴. در صورت یونیزه شدن شدید اتمهای یک گاز و تبدیل آن به پلاسما، تفاوت اصلی ساختار مولکولی پلاسما نسبت به گاز معمولی چیست؟
در پلاسما مولکولها نزدیکتر به هم قرار دارند.
در پلاسما مولکولها فقط انرژی بیشتری دارند اما شکلشان تغییر نمیکند.
در پلاسما مولکولها به شکل جامد فشرده میشوند.
در پلاسما مولکولها به یون و الکترون آزاد تجزیه میشوند.
زمانی که یک گاز مقدار زیادی انرژی دریافت کند، اتمهای آن دچار یونیزاسیون شده و به یون مثبت و الکترون آزاد تجزیه میشوند. این وضعیت را پلاسما مینامند و ویژگی ساختاری اصلی آن وجود ذرات باردار (یون و الکترون آزاد) است. بر خلاف این، در گاز معمولی مولکولها یونیزه نشدهاند و عمدتا خنثیاند.
۵. بر اساس نظریه جنبشی ماده، افزایش دما چه اثری بر رفتار مولکولهای گاز و فشار و حجم آن دارد؟
افزایش دما موجب کاهش سرعت مولکولها و کاهش فشار گاز میشود.
افزایش دما فقط حجم گاز را کم میکند و هیچ اثری بر فشار ندارد.
افزایش دما باعث افزایش سرعت حرکت مولکولها و بالا رفتن فشار و انبساط حجم گاز میشود.
افزایش دما فقط باعث ثابت ماندن فشار و کاهش حجم میشود.
طبق نظریه جنبشی ماده، هنگام افزایش دما مولکولهای گاز انرژی جنبشی بیشتری پیدا میکنند و با سرعت بالاتری حرکت میکنند. این افزایش سرعت باعث میشود تعداد برخوردهای مولکولها با دیواره ظرف بیشتر و محکمتر شود که در نتیجه فشار بیشتر میگردد و معمولا گاز منبسط میشود.












سلام ممنون از مقاله عالیتون. ببخشید یه سوال داشتم:
کدام حالت ماده در جهان بیشتر است؟
پلاسما
سپاس فراوان
خیلی خوب بود تدریستون
عالی بود ممنون
ببخشید یه سوال داشتم
کدام مورد به ترتیب سه حالت جامد، مایع و گاز مولکول در طبیعت است؟
۱) یخ، آب،و بهار آب
۲) رطوبت هوا، مه چیه
۳) یخ، برف، وتگرگ
۴) آب، نم خاک، یخ