انواع باتری – از صفر تا صد
در گذشته، تنها راه تولید انرژی قابل حمل، استفاده از بخار یا سوخت بود. پس از اختراع باتری، زندگی راحتتر از قبل شد. امروزه، همه به دنبال دستگاههای قابل حمل هستند تا کارهای روزانه خود را آسانتر انجام دهند. در این صورت، باتریها قادر به رفع نیاز تولید انرژی در کاربردهای قابل حمل هستند. شاید باتریها نسبتاً کوچک و کند به نظر بیایند، اما همین باتریهای میتوانند به یک نیروگاه کوچک تبدیل شوند. ایده تولید نیروی قابل حمل چیز جدیدی نیست و حتی انسان ماقبل تاریخ نیز با استفاده از هیزم و سوختها آن را تولید میکرد. میتوان گفت که باتریها یک روش فوری برای تولید نیرو هستند. در این آموزش، انواع باتری ها را معرفی خواهیم کرد.


انواع گوناگونی از باتریها در بازار عرضه میشود. همه این باتریها بر اساس تبدیل انرژی شیمیایی به انرژی الکتریکی کار میکنند. در ادامه، درباره انواع باتریها، طرز کار و کاربرد آنها بحث خواهیم کرد اما قبل از آن ابتدا نگاهی به تاریخچه باتریها میاندازیم.

تاریخچه باتریها
در سال 1800 میلادی، آلساندرو ولتا (Alessandro Volta) دریافت که هنگام استفاده از یک مایع خاص به عنوان رسانا، میتوان به صورت مداوم برق تولید کرد. این کشف منجر به ساخت نخستین پیل ولتایی یعنی باتری شد. اختراع باتری توسط ولتا، عصر جدیدی را برای آزمایش باتری آغاز کرد. تعدادی از دانشمندان برای ساخت باتریها آزمایشهای گوناگونی را انجام دادند. اما تعداد کمی از آنها توانستند به نتیجه برسند. آلساندرو ولتا و جان فردریک دانیل (John Frederic Daniell) دو دانشمندی بودند که به ترتیب پیلهای ولتایی و دانیل را ساختند.
پیل ولتایی
پیل ولتایی برای تولید انرژی الکتریکی از واکنش شیمیایی استفاده میکند. آند و کاتد مخالف یکدیگر ساخته میشوند. در آند اکسایش و در کاتد کاهش روی میدهد. برای تکمیل مدار، پل نمکی در بین آنها ایجاد میشود. بخشهایی که در آن اکسایش و کاهش صورت میگیرد، نیمسلول نامیده میشوند. برای هدایت جریان الکترونها نیز از یک مدار خارجی استفاده میشود.
پیل ولتایی که توسط ولتا ابداع شد، خیلی قابل حمل نبود و معایب بسیار زیادی داشت. پس از آن، پیل دانیل که توسط جان فردریک دانیل طراحی شد، محبوب گشت.
پیل دانیل
پس از اختراع پیل ولتایی، پیل دانیل به عنوان منبعی از الکتریسیته معروف شد. در این نوع پیل، یک ظرف به دو قسمت تقسیم میشود. این شکاف توسط یک غشای نفوذپذیر نسبت به یونها ایجاد میگردد. در یکی از قسمتها، الکترودِ روی در محلول سولفاتِ روی و در قسمت دیگر، الکترود مس در محلول سولفات مس فرو برده میشود. این پیل تا زمانی که سولفات مس یا روی را مصرف میکند، قادر به تولید جریان است. جان دانسر (John Dancer) این آزمایش را ادامه داد و اولین باتری با طراحی متخلخل (پرمنفذ) را ابداع کرد.
در سال 1859، باتری سرب-اسید توسط گاستون پلانته (Gaston Plante) اختراع شد. این باتری به دلیل اینکه قابلیت شارژ شدن داشت، مورد توجه مردم قرار گرفت. طراحی ساده این باتری، امکان شارژ مجدد را به وسیله معکوس کردن شارش جریان به باتری میدهد. این باتری هنوز هم در بسیاری از کاربردها مانند باتریهای اتومبیل، وسایل نقلیه موتوری و غیره مورد استفاده قرار میگیرد. علاوه بر این، باتری لکلانشه (Leclanche Battery) با طراحی خشک و بدون هیچ گونه الکترولیت مایعی توسط کارل گسنر (Carl Gessner) اختراع شد. شکل زیر این باتری را نشان میدهد.

این اختراع، استفاده از باتری را بسیار آسان کرد، زیرا مشکل سرریز شدن و جهت استفاده در این نوع باتری وجود نداشت. علاوه بر این، باتری نیکل-کادمیوم ابداع شد که یک باتری قلیایی شناخته میشد. در دهه 1970، بیشتر باتریهای لیتیومی اختراع شدند تا در وسایل قابل حمل مورد استفاده قرار گیرند.
شیمی عمومی باتری
یک باتری دارای سه لایهی کاتد، آند و جداکننده است. لایه منفی باتری، آند و لایه مثبت آن، کاتد نامیده میشود.
هنگامی که یک بار الکتریکی به باتری اضافه شود، جریان از آند به کاتد شارش مییابد. به طور مشابه، هنگامی که شارژر باتری را وصل کنیم، جریان در جهت مخالف یعنی از کاتد به آند شروع به شارش میکند.
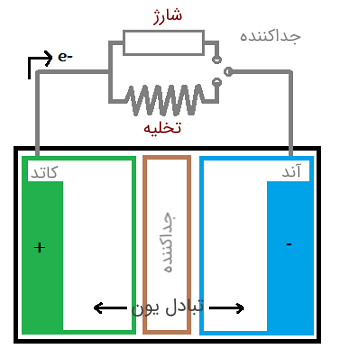
هر باتری بر اساس یک واکنش شیمیایی، یعنی واکنش اکسایش-کاهش کار میکند. این واکنش بین کاتد و آند و از طریق جداکننده (الکترولیت) رخ میدهد. در نتیجه، یک الکترود به علت واکنش اکسایش به صورت منفی باردار میشود. این الکترود، کاتد نام دارد. الکترود دیگر به علت واکنش کاهش به صورت مثبت باردار میشود که آن را آند مینامند. هنگامی که دو نوع فلز مختلف در محلول الکترولیت یکسانی فرو برده شوند، یکی از الکترودها الکترون میگیرد و دیگری الکترون از دست میدهد.
در نتیجه، یکی از فلزها الکترون میگیرد و دیگری الکترون از دست خواهد داد. این اختلاف در تراکم الکترون دو فلز، بین فلزها اختلاف پتانسیل الکتریکی ایجاد میکند. این اختلاف پتانسیل میتواند به عنوان منبع ولتاژ در هر وسیله الکتریکی استفاده شود. یونها فقط از طریق جداکننده جریان مییابند و جداکننده تمام حرکات از آند به کاتد را مسدود میکند. بنابراین، تنها راه دریافت جریان خارجی، از طریق پایانههای باتری است.
شکل زیر چند نماد مربوط به باتریها را نشان میدهد.
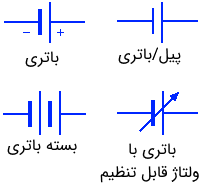
انواع باتری
باتریها معمولاً در وسایل خانگی و برای کاربردهای صنعتی مورد استفاده قرار میگیرند. هر باتری برای هدف مشخصی طراحی میشود و براساس نیاز مورد نظر میتواند مورد استفاده قرار گیرد. عمدتاً دو نوع باتری وجود دارد: پیلهای اولیه و ثانویه. هر چند، باتریها را میتوان به چهار دسته اصلی یعنی پیل اولیه، پیل ثانویه، پیل سوختی و پیل یدک نیز دستهبندی کرد.
پیل اولیه (باتریهای غیر قابل شارژ)
باتریهای غیر قابل شارژ به عنوان باتریهای اولیه یا پیل اولیه شناخته میشوند. باتریهای اولیه، آنهایی هستند که وقتی انرژی ذخیره شده آنها یک بار به طور کامل استفاده میشود، نمیتوان دوباره از آنها استفاده کرد. این باتریها توسط هیچ منبع خارجی نمیتوانند مجدداً انرژی ذخیره کنند. به همین دلیل است که پیلهای اولیه را باتریهای یک بار مصرف مینامند.

عامل اصلی کاهش طول عمر باتریهای اولیه این است که در طول استفاده، قطبیده میشوند. برای طولانی کردن عمر باتریها با کاهش اثر قطبش، از واقطبیدگی شیمیایی استفاده میشود؛ یعنی اکسید کردن هیدروژن با آب به وسیله اضافه کردن عامل اکسیدکننده به پیل. به عنوان مثال، در پیل روی-کربن و لکلانشه از منگنز دی اکسید و در پیل بانسن (Bunsen) و گرو (Grove) از نیتریک اسید استفاده میشود.
چند کاربرد پیلهای اولیه به صورت زیر است:
- ساعت و اسباببازیها
- وسایل خانگی کوچک
- رایانههای شخصی
- اینورترها و چراغهای قابل حمل ضروری
انواع باتری های غیر قابل شارژ عبارتند از:
- باتری روی-کربن
- قلیایی
- پیلهای لیتیومی
- پیلهای نقره اکسید
- پیلهای روی-هوا
باتری روی-کربن
باتریهای روی-کربن نخستین باتریهای خشک تجاری هستند که نیروی خیلی کمی را تأمین میکنند و به عنوان پیل خشک شناخته میشوند. یک میله کربنی در باتری قرار میگیرد که جریان را از الکترود دی اکسید منگنز جذب میکند. این امر میتواند ۱٫۵ ولت DC تولید کند. این نوع باتریها در چراغ قوه، رادیو و ساعت دیواری مورد استفاده قرار میگیرند.
باتری آلکالین
باتری آلکالین نیز یک باتری سلولی خشک است که از آند روی و کاتد دی اکسید منگنز تشکیل شده است. باتری آلکالین با قوطی فولادی بسته شده و قسمت بیرونی بخش داخلی با دی اکسید منگنز پر شده است. الکترولیت روی و هیدروکسید پتاسیم در مرکز باتری وجود دارد. باتریهای آلکالین نسبت به سایر باتریها چگالی بالاتری دارند. این باتریها معمولاً در پخشکنندههای صوتی، رادیو و چراغ قوهها استفاده میشوند.

باتری لیتیومی
باتریهای پیل لیتیومی (Lithium Cell) به شکل سکهای یا دکمهای به بازار عرضه میشوند. این باتریها مقدار ولتاژ بیشتری (۳ ولت) نسبت به باتریهای روی، قلیایی و منگنز تولید میکنند. پیلهای لیتیومی کوچکتر و سبکتر هستند و طول عمر بیشتری دارند (تقریباً 10 سال). مقاومت داخلی این باتریها بالا بوده و قابل شارژ نیستند. متداولترین پیل سکهای مورد استفاده در تعدادی از وسایل الکترونیکی، CR2032 است که مقدار ولتاژ خروجی آن ۳ ولت است.
باتری نقره اکسید
باتریهای نقره اکسید (Silver Oxide)، باتریهایی کمتوان با ظرفیت بالا هستند. ظاهر این باتریها شبیه پیلهای جیوهای است و نیرو محرکه الکتریکی (EMF) آنها بیشتر از ۱٫۵ ولت است. کاتد این باتری از نقره اکسید و الکترولیت موجود در داخل آن از پتاسیم یا سدیم هیدروکسید ساخته میشود. از آنجایی که فلز نقره گران است، این باتری کاربردهای خیلی محدودی دارد.
پیلهای نقره اکسید ویژگیهای بسیار خوبی دارند که عبارتند از:
- آببندی منحصر به فرد ساختار این باتری باعث میشود که در برابر نشت کردن بسیار مقاوم باشد.
- ولتاژ خروجی ثابت داده شده توسط باتری برای تخلیه پایدار مفید است.
- استفاده از آنتیاکسیدانها به چگالی انرژی بالا در باتری کمک میکند.
از کاربردهای پیل نقره اکسید میتوان به موارد زیر اشاره کرد؟
- دستگاههای IOT
- ساعتهای الکتریکی
- ابزار دقیق
- وسایل پزشکی
باتری روی-هوا
باتری روی-هوا (Zinc Air) در مدت 5 دقیقه درست پس از باز شدن به ولتاژهای عملکرد کامل میرسد. این باتریها از نوع باتریهای اولیه با طراحی قابل شارژ هستند. مقدار اکسیژن موجود در هوا به عنوان جرم فعال باتری عمل میکند. در این باتری، کاتد یک بدنه پرمنفذ است که از کربن ساخته شده و به هوا دسترسی دارد. ولتاژ خروجی این پیل ۱٫۶۵ ولت است. در حین تخلیه، تودهای از ذرات روی، آند پرمنفذی را تشکیل میدهد که با الکترولیت اشباع شده است. اکسیژن موجود در هوا با یون هیدروکسیل واکنش داده که منجر به تولید زینکات میشود. زینکات نیز روی اکسید و آب را تولید میکند که به الکترولیت باز میگردد.
پیل ثانویه (باتریهای قابل شارژ)
باتریهای قابل شارژ به عنوان پیل ثانویه شناخته میشوند. این نوع باتریها را میتوان با وصل کردن به شارژ، بارها و بارها مورد استفاده قرار داد و قبل از اینکه نیاز به تعویض باتری باشد، استفادههای متعددی از آن کرد. هزینه اولیه باتریهای قابل شارژ معمولاً بیشتر از باتریهای یک بار مصرف است، اما مجموع هزینه مالکیت و اثر زیست محیطی این باتریها کمتر است، زیرا میتوان قبل از نیاز به تعویض، آنها را چندین بار به صورت ارزان مجدداً شارژ کرد.
این باتریها در موارد زیر مورد استفاده قرار میگیرند:
- دستبندهای سلامتی و ساعتهای هوشمند
- کاربردهای نظامی و زیردریاییها
- دوربینها و ضربانسازهای مصنوعی
باتریهای ثانویه یا قابل شارژ انواع مختلفی دارند که عبارتند از:
- سرب-اسید
- لیتیوم-یون (Li-ion)
- نیکل-هیدرید فلز (Ni-MH)
- نیکل-کادمیوم (Ni-Cd)
باتری سرب-اسید
سرب-اسید (Lead Acid) یک نمونه خیلی رایج از باتریهای قابل شارژ است. معمولاً برای ذخیره انرژی خورشیدی از این باتریها استفاده میشود، زیرا کیفیت باتریهای سرب-اسید، آنها را از سایر باتریها متمایز میسازد. این باتریها جریان زیادی تولید میکنند و در اتومبیلها مورد استفاده قرار میگیرند. هنگامی که باتری از کار میافتد، میتوان آن را بازیافت کرد. در واقع، حدود 93 درصد سرب باتری برای بازیافت دوباره مورد استفاده قرار میگیرد تا باتریهای سرب-اسید جدید ساخته شوند.

باتری لیتیوم-یون
از آنجایی که این باتریها چگالی توان بالایی دارند، معمولاً در الکترونیک از آنها استفاده میشود. این باتریها میتوانند 150 وات-ساعت انرژی را در یک کیلوگرم از جرم خود ذخیره کنند. هنگام تخلیه، یونهای لیتیوم از الکترود منفی به سمت الکترود مثبت و در جهت مخالف حرکت میکنند. توجه داشته باشید که داغ شدن باتری میتواند منجر به آسیبدیدگی و آتش گرفتن آن شود.

باتری نیکل-هیدرید فلز
ماده این باتریها میانفلزی است. این نوع باتریها طول عمر خوب و ظرفیت جریان بالایی دارند و میتوانند 100 وات-ساعت انرژی را در یک کیلوگرم ذخیره کنند. همچنین، از نظر حرارتی نسبت به باتریهای لیتیوم-یون مقاومترند. خود-تخلیه این باتریها نسبت به سایر باتریها بالاتر است.

باتری نیکل-کادمیوم
در باتری قابل شارژ نیکل-کادمیوم، از نیکل اکسید هیدروکسید و کادمیوم فلزی به عنوان الکترود استفاده میشود. این باتری هنگامی که مورد استفاده قرار نمیگیرد، قادر است ولتاژ و شارژ الکتریکی را نگه دارد و از این نظر مفید است. ایراد اصلی باتری نیکل-کادمیوم که ممکن است بعداً باعث پایین آمدن ظرفیت باتری شود این است که اگر باتریِ دارای شارژِ اندک دوباره شارژ شود، ممکن است نقطه شارژ مجدد در حافظه باتری نگه داشته شود. این اتفاق باعث میشود که هنگام رسیدن شارژ باتری به آن نقطه، ولتاژ افت پیدا کند.

تحویل ظرفیت نامی در نرخ تخلیه کامل و داشتن چرخه طول عمر خوب در درجه حرارت پایین از جمله مزیتهای باتری نیکل-کادمیوم است.
تفاوت پیلهای اولیه و ثانویه
از نظر مشخصات، پیلهای اولیه مقاومت داخلی بالا، ظرفیت بالاتر و طراحی کوچکتری دارند. در حالی که پیلهای ثانویه دارای مقاومت داخلی پایین، واکنشهای شیمیایی برگشتپذیر و طراحی پیچیدهای هستند.
از دیدگاه طراحی، پیلهای اولیه معمولاً خشک هستند؛ یعنی مایعی ندارند و پر از خمیری هستند که به یونهای داخل باتری اجازه حرکت میدهد. به همین دلیل است که پیلهای اولیه در برابر نشت کردن مقاوم هستند. اما پیلهای ثانویه از نمک مایع یا مذاب ساخته میشوند.
در جدول زیر، به طور خلاصه، تفاوت بین پیلهای اولیه و ثانویه و مزایا و معایب آنها ذکر شده است.
| پیلهای اولیه | پیلهای ثانویه |
| به دلیل سبک بودن و طراحی کوچک برای وسایل قابل حمل مناسب هستند. | برای وسایل قابل حمل مناسب نیستند. |
| نگهداری خوب شارژ | پایین بودن نگهداری شارژ |
| برای کاربردهای هزینهبر مناسب نیستند. | برای پشتیبانی و کاربردهای هزینهبر بسیار توصیه میشوند. |
| محدود به کاربردهای خاص | به دلیل تنوع بسیار، دارای طیف وسیعی از کاربردها هستند. |
| هزینه اولیه کم | هزینه اولیه زیاد |
پیل یدک
باتریهای یدک (Reserve Battery) به عنوان باتری اضطراری (Stand-by Battery) نیز شناخته میشوند. الکترولیت این باتریها در حالت جامد تا زمان رسیدن به نقطه ذوب، غیرفعال میماند. به محض رسیدن به نقطه ذوب، هدایت یونی شروع و باتری فعال میشود.
انواع باتری های یدک عبارتند از:
- باتریهای فعال شده با آب
- باتریهای فعال شده با حرارت
- باتریهای فعال شده الکترولیتی
- باتریهای فعال شده با گاز
این باتریها در موارد زیر مورد استفاده قرار میگیرند:
- دستگاههای سنجش زمان و فشار
- باتریهای اتومبیل و سایر وسایل نقلیه
- سیستمهای تسلیحاتی
پیل سوختی
در این دسته از باتریها، مواد فعال از منبع خارجی تغذیه میشوند. پیلهای سوختی تا زمانی که مواد فعال با الکترودها تغذیه شوند، قادر به تولید انرژی الکتریکی هستند. غشای تبادل پروتون از گاز هیدروژن و اکسیژن به عنوان سوخت استفاده میکند. واکنش در داخل پیل صورت میگیرد و نتیجه آن تولید آب، الکتریسیته و حرارت است. اجزای اصلی پیلهای سوختی عبارتند از: آند، کاتد، الکترولیت و کاتالیزگر.
مزایای پیل سوختی عبارتند از:
- فرایند تبدیل مستقیم انرژی پتانسیل شیمیایی به انرژی الکتریکی از گلوگاه حرارتی جلوگیری میکند.
- این پیل به علت نداشتن اجزای متحرک، مناسب و بسیار مطمئن است.
- به علت تولید هیدروژن به روشی سازگار با محیط زیست، در مقایسه با سایر پیلها آسیب نسبتاً کمتری به محیط زیست میرساند.
از کاربردهای پیل سوختی نیز میتوان به موارد زیر اشاره کرد:
- این نوع پیل بیشتر در حمل و نقل از جمله در اتومبیلها، اتوبوسها و سایر وسایل نقلیه موتوری مورد استفاده قرار میگیرد.
- پیل سوختی غالباً به عنوان پشتیبان برای تولید الکتریسیته هنگام قطع برق به کار میرود.
مزایا و معایب باتریها
استفاده از باتری نسبت به سایر منابع توان مزیتهای زیر را به همراه دارد:
- ظرفیت انرژی خاص: ظرفیت ذخیره انرژی باتری در مقایسه با سوخت فسیلی خیلی کمتر است. اما باتریها در مقایسه با موتورهای حرارتی ظرفیت تحویل انرژی مؤثرتری دارند.
- پهنای باند توان: باتریها به دلیل پهنای باند توان بالا میتوانند بارهای کوچک و بزرگ را به طور مؤثرتری کنترل کنند.
- پاسخگویی: باتریها قادر به تحویل توان در مدت زمان کوتاه هستند؛ بدین معنی که مانند موتورهای احتراقی نیازی به گرمایش ندارند.
- محیط زیست: استفاده از باتریها آسان است و تقریباً گرمای زیادی تولید نمیکنند. اکثر باتریها مانند سایر موتورهای سوختی سر و صدا ایجاد نمیکنند.
- نصب: امروزه، باتریهای آببندی شده را میتوان تقریباً در هر موقعیتی به کار برد. این باتریها مقاومت خوبی در برابر ضربه و لرزش دارند.
از معایب باتریها نیز میتوان به موارد زیر اشاره کرد:
- زمان شارژ: هرگاه باتریهایی که از نوع باتریهای اولیه هستند، تخلیه شوند، ساعتها طول میکشد تا مجدداً برای استفاده شارژ شوند. اما در مورد استفاده از سوختها که چند دقیقه زمان میبرد، اینگونه نیست.
- هزینه کارکرد: هزینه و وزن باتریهای بزرگ، آنها را برای وسایل نقلیه بزرگ و استفاده مطمئن غیرعملی میکند.
- ظرفیت ذخیره انرژی: ظرفیت ذخیره انرژی باتریها در مقایسه با سوختهای فسیلی کمتر است.
انتخاب باتری مناسب بر اساس مصرف
انتخاب باتری مناسب بر اساس استفادهای که از آن میکنیم، برای جلوگیری از آسیب دیدن وسایل بسیار مهم است. هنگام انتخاب باتری مناسب باید به نکاتی توجه کنیم که در اینجا به برخی از آنها اشاره میکنیم.
اولیه یا ثانویه: این یکی از مهمترین عوامل در انتخاب نوع باتری مناسب برای وسایل است. میتوان از باتری اولیه برای مصارف موردی و در وسایل در دسترس مانند اسباببازیها و غیره استفاده کرد. اما اگر از وسیلهای برای مدت زمان طولانی استفاده میشود، باتریهای قابل شارژ یا ثانویه مناسبتر خواهند بود.
محدوده دمایی: انتخاب باتری مناسب با دمای مناسب به شما کمک میکند تا خطر گریز حرارتی کاهش یابد. باتریهای لیتیوم-یون میتوانند در محدوده دمایی 20 تا 45 درجه سلسیوس شارژ شوند. شارژ بیش از حد، دمای بالا هنگام شارژ و اتصال کوتاه ممکن است منجر به انفجار باتریها شود و در نهایت به وسیله صدمه بزند.
دوام: دوام باتری بیشتر به دو عامل بستگی دارد: طول عمر شارژ و طول عمر کل. علاوه بر این، عوامل فیزیکی باتری نیز بر طول عمر آن تأثیر خواهد گذاشت.
چگالی انرژی: مقدار کل انرژی ذخیره شده در باتری در واحد حجم، چگالی انرژی نامیده میشود. چگالی انرژی، پایداری باتری را تعیین میکند. به عبارت دیگر، مشخص میکند که دوام باتری تا شارژ مجدد بعدی چقدر است.
ایمنی: انتخاب باتری باید بر اساس دمای عملکرد آن باشد. بعضی مواقع، دمای باتری از حد فراتر میرود و ممکن است به اجزای وسیله آسیب بزند. همچنین، در صورتی که دمای وسیله بیش از حد بالا باشد، ممکن است کارایی آن کاهش یابد.
سایر مواردی که باید هنگام خرید باتری به آنها توجه کرد، عبارتند از:
- شیمی پیل
- قابلیت حمل
- اندازه و شکل فیزیکی
- قیمت
- قابلیت اطمینان
باتری وسیله نقلیه الکتریکی
باتریهای وسیله نقلیه الکتریکی (Electrical Vehicle) یا EV برای تأمین توان در دوره زمانی مداوم طراحی میشوند. سهم این باتریها در بازار در حال افزایش است، زیرا ماهیتی سازگار با محیط زیست دارند و قابل اطمینان هستند.

متداولترین باتریها در اتومبیلهای مدرن، باتری لیتیوم-یون و لیتیوم-پلیمر است. این پیلها در قالب ماژول نصب میشوند. به عبارت دیگر، برای ساختن یک جعبه، یک نوع باتری نصب میشود. برای مثال، در اتومبیل الکتریکی BMW تعداد ۹۶ پیل نصب میشود. تعدادی از پیلها در چارچوبی قرار داده میشوند که از باتریها در برابر لرزش و گرمای خارجی محافظت میکند. ترکیبی از پیلها را ماژول مینامند. تعدادی از این نوع ماژولها، جعبه خنککننده و سیستم مدیریت باتری به صورت یک جعبه با هم ترکیب میشوند.
در وسایل نقلیه الکتریکی از دو نوع باتری لیتیوم-یون استفاده میشود: اکسید فلز و فسفات. در وسایل نقلیه همچون اتومبیلها، باتریهای لیتیوم-یون از نظر خطر شیمیایی و راحتی ایمنتر هستند.
ساختار باتریهای EV
در حال حاضر، اتومبیلهای الکتریکی به کمک باتریهای لیتیومی حرکت میکنند. ولتاژ نرمال یک پیل لیتیومی ۳٫۷ ولت است، اما وسیله نقلیه الکتریکی به 300 ولت نیاز دارد. برای رسیدن به این مقدار ولتاژ و جریان، پیلهای لیتیومی را به صورت سری و موازی ترکیب میکنند. ترکیب این نوع پیلهای لیتیومی را ماژول مینامند. ماژولها همراه با یک سیستم مدیریت باتری (BMS) در ارتباط هستند تا از آنها حفاظت کند. شکل زیر ماژولهای پیل لیتیومی نیسان لیف را نشان میدهد که برای رسیدن به ولتاژ مورد نیاز ساخته شدهاند.

لازم است هنگام استفاده از باتریهای وسیله نقلیه الکتریکی، نکات زیر در نظر گرفته شوند:
- نباید اجازه داد باتری به ولتاژ کمتر از ولتاژ قطع (که تخلیه اضافه نیز نامیده میشود) برسد.
- بیشترین بازده تنها زمانی حاصل میشود که مقادیر جریان پایینتر باشد.
- باتریهای EV دارای مقدار نامی برحسب KWh (کیلو وات ساعت) هستند که مشخص میکند باتری وسیله نقلیه چقدر کار خواهد کرد.
- همیشه مقداری خودتخلیه از طرف باتریها وجود دارد.
- سیستم مدیریت باتری کمک میکند تا مقدار شارژ باقیمانده در باتری را بدانیم.
در صورتی که مباحث بیان شده برای شما مفید بوده و میخواهید درباره موضوعات مرتبط، مطالب بیشتری یاد بگیرید، پیشنهاد میکنیم به آموزشهای زیر مراجعه کنید:
- محاسبه قیمت برق از روی قبض — به زبان ساده
- مولتی متر و روش استفاده از آن — به زبان ساده
- سیستم شارژ خودرو — به زبان ساده
^^












با سلام- باتری اولیه موزر شارژی 1/2 ولت 600 میلی آمپر ساعت است . میخواهم بدانم میتوانم از باتری با میلی آمپر بالاتر مثلا” 1100 یا 2500 استفاده کنم. مشکلی برای آرمیچر ایجاد نمیکند. ممنونم
سلام.خیر.بنده استفاده کردم و قدرت و ساعت کاکرد موزر بیشتر میشه ،حتی تا ۳۰۰۰ هزار میلی آمپرهم میتونی استفاده کنی.
خیلی عالی
از همین واس تحقیقم مینویسم
عالی
بدترین توضیحات و اشتباه ترین آموزشی بود که میتونست باشه، عکس برای باتری های غیرقابل شارژ گذاشته در حالیکه عکس مربوط به باتری های قابل شارژ هست و باتری وسط کاملا این موضوع رو ثابت میکنه.. پیل ثانویه برای وسایل قابل حمل نیست؟ اونوقت باتری گوشی و لپ تاپ شما پیل اولیه است؟؟؟ این چه آموزشی بود آخه !! واقعا که.. آموزش اشتباه نذارید لطفا
سلام.
تصویر مذکور یک تصویر عمومی از باتریهاست که در آن باتری غیرقابل شارژ نیز وجود دارد. برای جلوگیری از سوء برداشت این تصویر را اصلاح کردیم. در مورد پیل ثانویه نیز اگر دقت کنید نگفتهایم که در وسایل قابل حمل استفاده نمیشود؛ بلکه بیان شده که در مقایسه با پیلهای اولیه دارای ویژگیهایی است که معمولاً در این موارد پیشنهاد نمیشود. البته که انتخاب نوع باتری تابع موارد زیادی است و نمیتوان یک حکم کلی برای آنها صادر کرد. لپتاپ نیز یکی از چندین و چند وسیله قابل حمل است که انتخاب باتری آن تابع ویژگیهایش است. هدف از بیان ویژگیهای باتریها، ارائه مزیتها و معایب نسبی است، اما انتخاب آنها در کاربردهای عملی تابع عوامل زیادی است. نکته دیگری که باید به آن توجه داشت، پیشرفت سریع باتریهاست که ممکن است معایب آنها را برطرف کند. در پایان، اگر ایراد علمی خاصی به متن وارد میدانید، با کمال میل خوشحال خواهیم شد آن را بررسی کرده و در صورت نیاز اصلاحات لازم را انجام دهیم.
از اینکه با مجله فرادرس همراه هستید، خوشحالیم.
سلام خیلی ممنون بابت این مقاله ی عالیتون و خسته نباشید.
عالی