سلول دانز چیست و چطور کار می کند؟ – به زبان ساده
سلول دانز نوع خاصی از سلول الکترولیتی است که برای استخراج سدیم با استفاده از سدیم کلرید مذاب طراحی شده است. در این سلول، سدیم کلرید با کلسیم کلرید با نسبت جرمی ۲ به ۳ ترکیب شده و در دمای ۶۰۰ درجه سانتیگراد کار میکند. آند این سلول گرافیت و کاتد آن آهن است. جریان الکتریکی مورد نیاز برای شروع فرآیند برقکافت از منبع خارجی تامین شده و و گاز کلر جمع شده روی آند از سیستم خارج میشود. در این مطلب از مجله فرادرس میآموزیم سلول دانز چیست و چطور کار میکند.
- میآموزید سلول دانز چیست و اجزای اصلی تشکیلدهنده آن کدامند.
- یاد میگیرید اساس کار سلول دانز چگونه است و اجزای آن چگونه طراحی میشوند.
- با ساختار کلی سلول دانز و نقش دمای کار آن آشنا میشوید.
- میتوانید الکترودها و دیافراگم سلول دانز و عملکرد هرکدام را تشخیص دهید.
- دلایل و کاربرد استفاده از کلسیم کلرید در سلول دانز را میآموزید.
- واکنش برقکافت سدیم کلرید، تاریخچه، مزایا و معایب سلول دانز را بررسی میکنید.
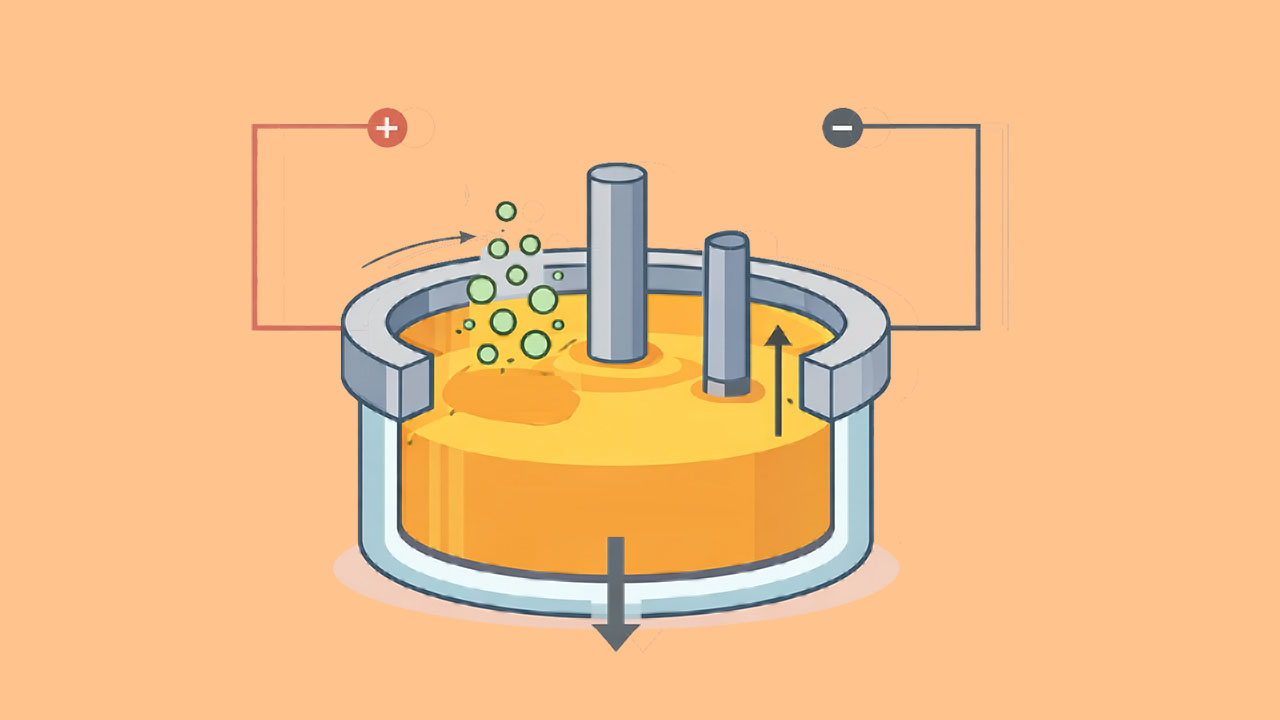
در ابتدای این مطلب میموزیم سلول دانز چیست و از چه اجزایی تشکیل شده است.سپس اساس کار سلول دانز را آ«وخته و طراحی اجزای آن را بررسی میکنیم. در ادامه، ساختار سلول دانز و دمای آن را ضرح داده و الکترودها و دیافراگم آن را تشریح میکنیم. در نهایت به بررسی نقش کلسیم کلرید، واکنش برقکافت سدیم کلرید و تاریخچه و مزایا و معایب این سلول میپردازیم. با مطالعه این مطلب تا انتها میتوانید به شکلی کامل بیاموزید سلول دانز چیست.
سلول دانز چیست؟
سلول دانز یک سلول الکتروشیمیایی از نوع الکترولیتی است. این سلول، مانند سایر پیلهای الکتروشیمیایی از محلول الکترولیت، آند، کاتد و منبع تغذیه تشکیل شده است. ساختار کلی این سلول از یک محفظه استیل مستطیلی تشکیل شده است که درون آن پوششی از جنس آجر نسوز وجود دارد.
کاتد در این سلول از جنس گرافیت است و در قسمت میانی سلول قرار دارد. آند سلول دانز حلقهای از جنس فلز آهن است که دور کاتد قرار گرفته است. آند و کاتد سلول دانز به وسیله یک سیلندر گازی استوانهای فولادی از هم جدا میشوند تا فلز سدیم و گاز کلر با هم مخلوط نشوند. شمای کلی سلول دانز در تصویر زیر آورده شده است.
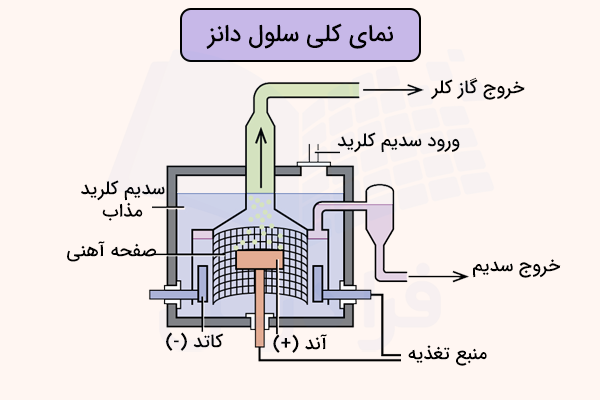
همچنین، یک سرپوش تخلیه بالای آند برای تخلیه گاز کلر در سلول غوطهور است. محلول الکترولیت سلول دانز، سدیم کارید مذاب است تا یونها بتوانند به راحتی حرکت کنند. همچنین، مقداری کلسیم کلرید (که میتواند با باریم کلرید یا استرانسیم کلرید جایگزین یا ترکیب شود) نیز به الکترولیت سلول دانز افزوده میشود. این مواد افزوده شده برای پایین آوردن دمای ذوب الکترولیت است. زیرا سدیم کلرید در شرایط عادی در دمای ۸۰۱ درجه سانتیگراد ذوب میشود اما در این شرایط در سلول دانز، دمای ذوب آن تا ۶۰۰ درجه سانتیگراد پایین میآید.
اساس کار سلول دانز چیست؟
در قسمت قبل آموختیم سلول دانز چیست. سلول دانز یک سلول الکترولیتی است که برای تولید تجاری فلز سدیم با استفاده از فرآیند الکترولیز (برقکافت) سدیم کلرید مذاب انجام میشود. در این فرآیند، گاز کلر نیز به عنوان یک فرآورده جانبی تولید و جمع آوری میشود. این فرآیند در سلول دانز، سدیم کلرید را به عناصر سازنده آن (سدیم و کلر) تجزیه میکند. بدین صورت که سدیم مایع بر روی کاتد گرافیتی و گاز کلر بر روی آند آهنی جمعآوری میشود.
اگر تا این قسمت از مطلب را مطالعه کردهاید، با سلول دانز و اساس کار آن آشنا شدهاید. در ادامه این مطلب نیز به بررسی بیشتر این سلول میپردازیم.
پیشنهاد میکنیم برای مطالعه بیشتر این نوع مطالب و دسترسی همیشگی و رایگان به آنها در موبایل خود، اپلیکیشن رایگان مجله فرادرس را نصب کنید تا همیشه به این مطالب مجله فرادرس دسترسی داشته باشید.
برای نصب اپلیکیشن رایگان مجله فرادرس، کلیک کنید.
این سلول به عنوان یکی از فرآیندهای کلیدی برای تولید سدیم با خلوص بالا به شمار آمده و در کاربردهایی مانند سنتز شیمیایی و متالورژی کاربرد دارد.
یادگیری شیمی دوازدهم با فرادرس
برای درک بهتر این موضوع که سلول دانز چیست، ابتدا باید با مفاهیمی چون حلالها، نقطه ذوب و جوش، واکنش اکسایش و کاهش و موازنه آن، سلول الکتروشیمیایی، تعیین عدد اکسایش و خوردگی فلزات آشنا شوید. پیشنهاد میکنیم برای درک بهتر این مفاهیم به مجموعه فیلم آموزش دروس پایه دوازدهم فرادرس، بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین با مشاهده فیلمهای آموزش فرادرس که لینک آنها در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه سلول دانز دسترسی داشته باشید.
- فیلم آموزش فیزیک پایه دوازدهم فرادرس
- فیلم آموزش شیمی ۱ پایه دهم فرادرس
- فیلم آموزش الکتروشیمی کاربردی جامع و با مفاهیم کلیدی فرادرس
طراحی سلول دانز
طراحی سلول دانز برای عملکرد در دماهای بالا و الکترولیز انجام شده است. محفظه فولادی مستطیلی آن با مواد نسوز داخل آن میتوانند الکترولیت مذاب داخل سلول که دمایی حدود ۶۰۰ درجه سانتیگراد دارند را به راحتی نگه داشته و نسوزند. همچنین،لوله (هود) تخلیه در بالای سلول برای خروج ایمن گازهای کلر طرحی شده است. همچنین، حلقه جمعآوری کننده آهنی، سدیمهای کمتر چگال را جمع میکند.
در انجام فرآیند برق کافت، یک منبع تغذیه خارجی، جریانی در حدود ۷ تا ۸ ولت با جریان ۲۵ تا ۴۰ کیلو آمپر را به سلول وارد میکند تا واکنشهای غیر خودبهخودی انرژی لازم برای انجام شدن را داشته باشند. در کاتد، یونهای سدیم کاهش یافته و به فلز سدیم مذاب خنثی تبدیل میشوند. در آند، یونهای کلرید اکسایش یافته و به گاز دو اتمی کلر تبدیل میشوند. در واکنش کلی اکسایش کاهش سلول دانز، ۲ مول سدیم کلرید مذاب به ۲ مول سدیم مذاب و ۱ مول گاز کلر تجزیه میشود.
این فلز و گاز جدا شده به دلیل طراحی خاص سلول دانز، از یکدیگر جداگانه نگهداری میشوند.
ساختار سلول دانز
ساختار سلول دانز یک مستطیل فولادی است که امکان انجام الکترولیز در دمایی بسیار بالا را فراهم میکند. همچنین، وجود لایههای نسوز در داخل این سلول نیز به انجام ایمن این واکنش الکترولیز کمک میکنند. مدلهای تجاری سلول دانز با جریانی حدود ۲۵ تا ۴۰ کیلوآمپر کار میکنند و امکان تولید و استخراج در مقیاسهای بالا و تجاری را فراهم میکنند. ابعاد سلول دانز استفاده شده در صنایع مختلف بسته به تولید کننده آن متفاوت است.
اما در بیشتر این سلولها، ارتفاع سلول حدود ۲٫۸ متر بوده و الکترودهای داخلی شامل آند مرکزی و کاتد سیلندری اطراف آن هستند. پیشنهاد میکنیم برای درک بهتر ساختار این سلول و اجزای آن، فیلم آموزش الکتروشیمی در شیمی پایه دوازدهم فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
دمای سلول دانز
برای پایداری دمای انجام فرآیند برقکافت سدیم کلرید مذاب معمولا یک حرارت خارجی به سلول اعمال میشود تا دمای واکنش به صورت پیوسته حدود ۶۰۰ تا ۷۰۰ درجه سانتیگراد باقی بماند. این مدیریت دمایی برای عملکرد صحیح سلول حیاتی است و ذوب اولیه سدیم کلرید معمولا پیش از حرارتدهی مستمر سلول و با استفاده از حرارت الکتریکی انجام میشود.
الکترود سلول دانز
در قسمتهای قبل آموختیم اجزای اصلی سلول دانز چیست. الکترودهای این سلول از اجزای اصلی آن هستند. الکترود آند یک قطعه گرافیت است که در میانه و مرکز سلول قرار میگیرد. این الکترود مثبت به صورت عمودی در پایه سلول قرار میگیرد تا در حین انجام فرآیند الکترولیز، جریانی یکنواخت را تامین کند.
در سلولهایی در مقیاس صنعتی، چندین آند گرافیتی به این شکل در سلول قرار میگیرند. این آندها معمولا به شکل جفت الکترودهایی قرار داده میشوند تا کارایی و توانایی سلول در حین یکنواخت بودن جریان الکترولیز تامین شود.
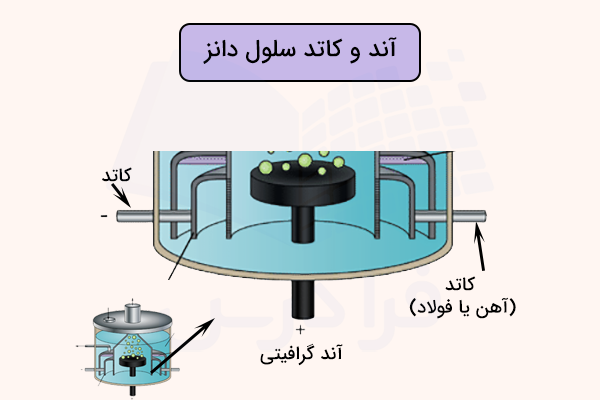
در اطراف هر آند در سلول دانز، یک کاتد از جنس فلز آهن یا فولاد به شکل حلقوی قرار میگیرد. این فلز به عنوان الکترود منفی عمل کرده و به صورت متحدالمرکز آند را احاطه میکند. این طراحی اجازه میدهد که فلز سدیم جدا شده روی کاتد جمع آوری شود. فلز سدیم جدا شده به دلیل چگالی کمتر به سطحهای بالاتر درون سلول رفته و جنس آهنی یا فلزی این الکترود پایداری مناسبی را در دمای بالای سلول تامین میکند.
دیافراگم سلول دانز
بین آند و کاتد در سلول دانز، یک دیواره جدا کننده (دیافراگم قرار دارد که معمولا از جنس توری آهنی با سیلندر مشبک سیمی است. این دیواره به صورت فیزیکی الکترودها را از هم جدا میکند و از تماس مستقیم محصولات الکترولیز (گاز کلر و فلز سدیم) جلوگیری میکند. ساختار متخلخل این دیواره اجازه میدهد که یونهای سدیم () از قسمت آند به کاتد مهاجرت کرده و الکترولیز انجام شود.
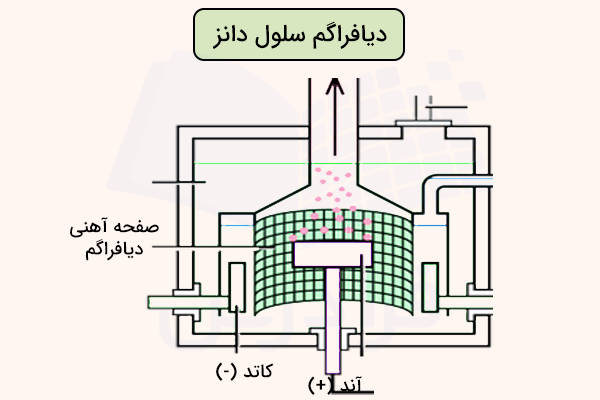
همچنین این این دیواره از پخش شدن محصولات گازی و مایع و ترکیب دوباره آنها جلوگیری میکند. این جداسازی برای انجام یک برقکافت ایمن و مناسب حیاتی است و به کمک آن میتوان محصولات الکترولیز را بدون خطرات یک واکنش شدید و انفجاری، جمعآوری کرد.
محلول الکترولیت سلول دانز
محلول الکترولیت در سلول دانز به صورت عمده از سدیم کلرید مذاب تشکیل شده که دمای ذوبی حدود ۸۰۱ درجه سانتیگراد دارد. برای پایین آوردن دمای ذوب سدیم کلرید در این سلول و کاهش انرژی مورد نیاز انجام فرآیند، کلسیم کلرید به محلول الکترولیت اضافه میشود. این ماده معمولا با نسبت ۳ به ۲ نسبت به سدیم کلرید افزوده میشود. در نتیجه، دمای ذوب سدیم کلرید تا دمای ۵۸۰ تا ۶۰۰ درجه سانتی گراد پایین میآید.
فرمولاسیونها و روشهای مختلف ممکن است نسبتهای کمی متفاوت (برای مثال ۴۲ درصد سدیم کلرید و ۵۸ درصد کلسیم کلرید) را به کار ببرند. مقدار بسیار کمی از برخی افزودنیها مانند باریم کلرید برای عملکرد بهتر در برخی از فرآیندهای خاص به محلول الکترولیت افزوده میشود.
آماده سازی محلول الکترولیت
آماده سازی محلول الکترولیت سلول دانز با دیهیدراسیون نمکها و جداسازی مولکولهای آب آنها آغاز میشود. به دلیل اینکه وجود مولکولهای آب در فرآیند الکترولیز میتواند باعث تولید اسید کلریدریک شود و باعث خوردگی اجزا و الکترودها شود. همچنین وجود اسید کلریدریک در این سلول میتواند باعث کاهش کارایی سیستم و خطر انجام واکنشهای انفجاری شود. برای مثال، دیهیدراتاسیون کلسیم کلرید با حرارت دادن آن در دماهای بالای ۵۰۳ کلوین انجام میشود.
نقش کلسیم کلرید در سلول دانز
در قسمتهای قبل آموختیم الکترولیت سلول دانز چیست. در سلول دانز، محلول الکترولیت معمولا از سدیم کلرید مذاب، کلسیم کلرید و برخی از افزودنیها تشکیل میشود. حدود ۶۰ درصد جرم محلول الکترولیت را کلسیم کلرید تشکیل میدهد. باقی مواد افزودهشده نمکهای دیگری از کلرید یا فلوئورید برای فرمولاسیونهای خاص هستند.
کلسیم کلرید مقدار دمای ذوب سدیم کلرید را از ۸۰۱ درجه سانتیگراد تا بین ۵۰۰ تا ۶۰۰ درجه سانتیگراد پایین میآورد. این کار باعث بهینهشدن مقدار انرژی مورد نیاز سلول با پایین آوردن دما میشود. همچنین، افزودن کلسیم کلرید باعث افزایش رسانایی الکتریکی محلول شده و نمک ذوب شده را در برابر تجزیه شدن محافظت میکند. یونهای کلسیم به دلیل پایینتر بودن پتانسیل استاندارد کاهش آنها نسبت به سدیم، کاهش نمییابند و اختلالی در سیستم سلول ایجاد نخواهند کرد.
سایر نمکهای افزوده شده
از میانه قرن بیستم، نمکهای دیگری مانند باریم کلرید، استرانسیم کلرید و ... با درصد جرمی ۱۰ تا ۲۰ درصد برای افزایش پایداری، هدایت الکتریکی و بهبود جریان به محلول اضافه میشوند. این مواد میتوانند از تجزیههای همزمان دیگر مواد به صورت ناخواسته جلوگیری کنند. مقادیر کمی از سدیم فلوئورید میتواند میزان بازده جریان را افزایش داده و از ایجاد شدن مه سدیم کلریدی طی انجام الکترولیز جلوگیری کند.
این بهبودها معمولا یا جایگزین کردن بخشی از کلسیم کلرید محلول انجام شده و میتوانند دمای ذوب سدیم کلرید را نیز تا دمایی حدود ۵۵۰ تا ۵۸۰ درجه سانتیگراد پایین آورند و از آلودگی محصول سدیم فلزی جلوگیری کنند. در نتیجه، استفاده از مخلوط سدیم کلرید و کلسیم کلرید به عنوان اساس محلول الکترولیت سلول دانز در بسیاری از فرآیندهای صنعتی باقی مانده است.
نیم واکنش اکسایش و کاهش در سلول دانز
در سلول دانز، واکنش کاتدی در کاتد (الکترود آهن یا فولاد) انجام میشود. در این واکنش یونهای سدیم موجود در الکترولیت کاهش مییابند و سدیم فلزی را تشکیل میدهند. نیم واکنش کاهش سلول دانز به شکل زیر است.
این کاهش به دلیل میزان پتانسیل استاندارد الکترود سدیم (۲٫۷۱- ولت) بر سایر کاهشهای کاتیونها ارجحیت دارد و انجام میشود. در آند گرافیت، اکسیداسیون یونهای کلرید باعث تولید گاز کلر میشود. نیم واکنش اکسایش سلول دانز به شکل زیر است.
در نهایت، با موازنه این واکنشها، درمییابیم واکنش کلی اکسایش و کاهش سلول دانز و واکنش برقکافت سدیم کلرید مذاب به شکل زیر است.
مقدار پتانسیل استاندارد کاهش واکنش برگشت نیم واکنش بالا برابر با ۱٫۳۶+ ولت است و این پدیده باعث میشود کلر در غیبت مولکولهای آب اکسید شود. مقدار پتانسیل الکترود سلول دانز چیزی حدود ۴٫۰۷ ولت به دست میآید اما در واقعیت این فرآیند نیاز به ولتاژ بین ۷ تا ۸ ولت دارد. این اختلاف عمدتا به این دلیل است که در واکنش عملی، در آند که گاز کلر در حال تشکیل است، مقدار انرژی فعالسازی را بالا برده و تولید حبابهای گاز بر روی سطح الکترود را مشکل میسازد.
واکنش برقکافت سدیم کلرید مذاب
واکنش الکتروشیمیایی کلی برقکافت سدیم کرید در سلول دانز، شامل تجزیه سدیم کلرید مذاب به سدیم و کلر است. در این واکنش به ازای هر دو مول سدیم کلرید مایع، ۲ مول سدیم فلزی مایع و ۱ مول گاز کلر تولید میشود. واکنش برقکافت سدیم کلرید مذاب به شکل زیر است.
این واکنش در دمایی حدود ۶۰۰ درجه سانتیگراد رخ میدهد تا سدیم کلرید به صورت مذاب باقی مانده و سدیم فلزی مایع و کلر به فرم گاز بماند. مقدار تئوری حداقل ولتاژ مورد نیاز برای شروع این واکنش غیر خودبهخودی، با استفاده از اختلاف پتانسیل استاندارد کاهش سدیم و کلر به دست آمده و برابر ۴٫۰۷ ولت است.
با این حال مقدار ولتاژ مورد نیاز واقعی سلول دانز برابر با ۷ تا ۸ ولت است. این ولتاژ برلای غلبه بر مقاومت الکتریکی الکترولیت و الکترودها، فعالسازی اضافه ولتاژ، گرادیان غلظت و انرژی مورد نیاز برای عملکرد در دمای بالا اعمال میشود. این فرایند بازده جریانی حدود ۸۰ تا ۹۰ درصد برای تولید سدیم دارد. این بدین معنی است که حدود ۸۰ تا ۹۰ درصد جریان الکتریکی اعمال شده منجر به جداسازی سدیم از سدیم کلرید میشود.
برقکافت چیست؟
برقکافت (الکترولیز) فرآیندی شیمیایی است که به صورت غیر خودبخودی انجام میشود. در این فرآیند، یک محلول الکترولیت به اجزای سازنده خود یا ترکیبات سادهتر تجزیه میشود. این فرآیند در یک سلول الکتروشیمیایی الکترولیتی و با اعمال نیروی الکتریکی خارجی انجام میشود. در این فرآیند، آند سلول دچار اکسایش شده و واکنش کاهش در کاتد انجام میگیرد.
الکترولیز کاربردهای بسیار زیادی در صنایع مختلف دارد. از برقکافت آب برای تولید هیدروژن و اکسیژن استفاده میشود. تولید تجاری محصولاتی مانند کلر، فلز سدیم، استخراج آلومینیوم و خالصسازی الکتریکی فلز مس با استفاده از فرایند برقکافت انجام میشود. پیشنهاد میکنیم برای درک بهتر فرآیندهای مشابه الکترولیز به وسیله سلول الکترولیتی، مطلب عنصر آلومینیوم و فرآیند هال مجله فرادرس را مطالعه کنید.
برقکافت سدیم کلرید محلول
سدیم کلرید محلول، سدیم کلریدی است که در آب حل شده باشد. در صورت وجود مولکولهای آب در سیستم الکتروشیمیایی برقکافت سدیم کلرید میتواند به تولید واکنشهای جانبی بیانجامد که میتواند واکنش را انفجاری کرده و میزان بازده را نیز کاهش دهد.
در سلول دانز به دلیل عدم وجود مولکولهای آب، از تولید اکسیژن و واکنشهای اکسیداسیون موادی بجز سدیم جلوگیری میکند. فرآیند برقکافت سدیم کلرید مذاب در سلول دانز با آماده سازی الکترولیت سدیم کلرید - کلسیم کلرید آغاز شده و با اعمال ولتاژ مناسب و رسیدن به دمای ۶۰۰ درجه ادامه پیدا میکند.
مراحل برقکافت با سلول دانز
در این سلول، ابتدا سدیم کلرید جامد تا حدود ۶ اینچ پایینتر از بالای کاتد پر میشود تا فرآیند ذوب و الکترولیز آغاز شود. گرمادهی اولیه با استفاده از منبع حرارت خارجی انجام میشود. برای مثال، اعمال شعله استیلن در بالای فلز کاتد بدون تماس مستقیم با بسته نمک جامد و گرم کردن آن تا دمای قرمز شدن انجام میشود. در برخی از موارد ممکن است از گرمکنندههای الکتریکی با شعله برای رسیدن به دمای مورد نیاز سلول استفاده شود.

با انجام گرمادهی اولیه، الکترولیت ذوب شده با استفاده از دهانه سلول به درون سلول ریخته میشود. بدین ترتیب یک استخر الکترولیتی بین آند و کاتد را پر میکند. همچنین باید از وجود هرگونه آب یا رطوبت به داخل این سلول جلوگیری شود. آند ممکن است با استفاده از پوشش بخار تا دمای ۸۰ تا ۱۵۰ درجه سانتیگراد گرم شود تا گرادیانتهای دما به حداقل مقدار خود برسند. انجام این مرحله انتخابی است.
با قرار گرفتن الکترولیت مذاب در جای خود، فرایند الکترولیز با اعمال جریان ۱۶ هزار آمپری آغاز شده و به تدریج تا ۳۰ تا ۴۰ هزار آمپر بالا میرود. این فرایند حدود ۵ دقیقه طول میکشد. این فرآیند از ایجاد شوک حرارتی به الکترودها، دیافراگم و لایههای سلول جلوگیری میکند.
سلولهای دانز مدرن معمولا با جریان ۲۵ تا ۴۰ کیلو آمپری و ولتاژ ۷ تا ۸ ولت کار میکنند. در طی این فرآیند، سدیم فلزی بر روی کاتد آهنی جمع شده و جمع آوری میشوند. فلز سدیم به دلیل کم بودن چگالی آن (۰٫۸۱ گرم بر سانتیمتر مکعب) بر روی محلول الکترولیت قرار میگرد و بر روی کاتد جمع میشود. این فلز سپس سرد و قالبگیری میشود تا ذخیره و جابجا شود.
این فرآیند حدود ۱۰ تا ۱۲ کیلو وات ساعت انرژی به ازای هر کیلوگرم سدیم تولید شده نیاز دارد. در آند گرافیتی، گاز کلر تشکیل شده، توسط اکسایش یونهای کلر تشکیل میشود. این گاز سپس به سمت بالا هدایت شده و سرد میشود تا رطوبتهای احتمالی آن گرفته شود. سپس خشک شده و ناخالصیهای آن استخراج میشود و برای جمع آوری به بیرون سلول هدایت میشود. این فرآیند اطمینان حاصل میکند که کلر استخراج شده از این روش برای استفادههای صنعتی و سنتز شیمیایی مناسب باشد.
تاریخچه سلول دانز
سلول دانز در سال ۱۹۲۲ میلادی توسط جیمز کلوید دانز، شیمیدان آمریکایی اختراع شد. این اختراع در نتیجه تحقیقات برای پاسخ به نیاز تولید فلز سدیم در حجم تجاری و با درصد خلوص بالا انجام گرفت. پیش از اختراع سلول دانز، سدیم با استفاده از روشهایی مانند روش کالستنر تولید میشد. در این روش، سدیم هیدروکسید مایع در دمایی پایینتر الکترولیز شده و انرژی بسیار بیشتری را مصرف میکرد. همچنین، این روش با مشکلاتی مانند خوردگی آند و خلوص پایین فرآوردههای جانبی همراه بود.
دانز با طراحی سلول دانز توانست واکنش را در دمایی بسیار پایینتر انجام داده و همچنین از انجام واکنش در محیطی به دور از رطوبت و آلودگی پرهیز کند. بدین ترتیب توانست کلر و سدیم را با درصد خلوص بسیار بالایی استخراج کند.
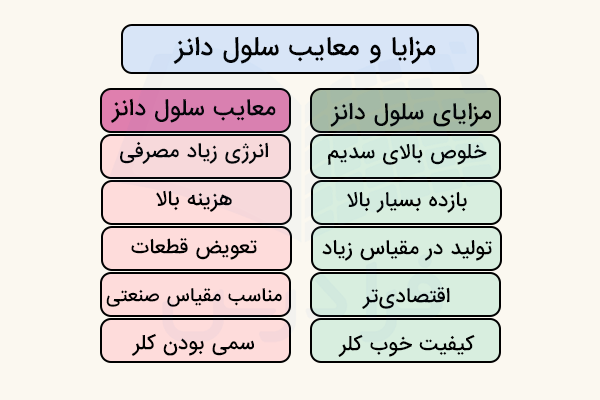
مزایا و محدودیتهای سلول دانز
سلول دانز مزایای زیادی مانند امکان استخراج مداوم فلز سدیم در حجم بالا را دارد. اما این روش با محدودیتها و خطراتی مانند مسمومیت ناشی از کلر نیز همراه است. در ادامه مزایا و محدودیتهای این روش را بررسی میکنیم.
مزایا
سلول دانز فلز سدیم را با خلوصی بالای ۹۹ درصد تولید میکند. وجود سدیم کلرید مذاب در این فرآیند باعث خلوص بالای سدیم شده و از بروز واکنشهای جانبی جلوگیری میکند. همچنین بر خلاف سدیم کلرید محلول، در این سلول امکان تشکیل هیدروژن در کاتد که باعث بازگشت سدیم و کاهش بازده میشود وجود ندارد.
سلول دانز برای تولیدات در مقیاس زیاد و صنعتی طراحی شده است و از این طریق در سال ۲۰۲۳ حدود ۱۰۰ هزار تن متریک سدیم کلرید از این روش تولید شده است. این میزان کارایی بالا به دلیل مناسب بودن جنس سلول، امکان انجام فرآیند بدون وقفه و حضور نداشتن موانع در انجام فرآیند است.
از نظر اقتصادی، سلول دانز برای هر کیلوگرم سدیم تولیدی حدود ۱۰ کیلو وات ساعت انرژی مصرف میکند. این مقدار نسبت به روشهای کم بازدهی مانند روش کاستنر بسیار به صرفه است. همچنین سلول دانز امکان تولید گاز کلر با کیفیت مناسبی را به صورت همزمان تامین میکند که باعث صرفه اقتصادی بیشتر این سلول میشود.
محدودیت ها
سلول دانز در ولتاژ نسبتا بالایی (۷ تا ۸ ولت) و دمای بالای ۶۰۰ درجه سانتیگراد کار میکند. این باعث میشود که انرژی مورد نیاز این روش حدود ۱۰۰ هزار کیلو وات ساعت باشد. با وجود اینکه این روش نسبت به سایر روشها به صرفه تر است، هزینه زیادی را برای انجام نیاز دارد.
یکی از مهمترین محدودیتهای برقکافت سدیم کلرید مذاب با سلول دانز، تجهیزاتی هستند که به صورت دورهای نیاز به تعویض شدن دارند. برای مثال، توری مشبک دیافراگم باید هر ۲ تا ۳ ماه عوض شود. این تعویض به دلیل ایجاد رسوب دندریت کلسیم است که باعث ایجاد اتصال کوتاه میشود. آندهای گرافیتی نیز به مرور زمان دچار خوردگی شده و نیاز به تعویض دارند. همچنین این فرایند برای تولیدات کوچک و آزمایشگاهی مناسب نیست. زیرا این سلول برای عملکرد خوب باید به صورت مداوم و بدون خاموش شدن کار کند. در صورت خاموش کردن بیش از چند ساعت سلول دانز، ممکن است به دستگاه آسیب وارد کند.
از دیگر محدودیتهای سلول دانز، ریسک واکنشهای انفجاری و خطرناک است. زیرا سدیم مایع و داغ به شدت نسبت به آب و هوا واکنش پذیر بوده و میتواند واکنشهای انفجاری و شدید انجام دهد. همچنین، گاز کلر آزاد شده از کاتد و استخراج شده از سلول به شدت سمی بوده و خطرات مواد سمی را با خود به همراه دارد. به همین دلیل کار کردن با آن نیازمند رعایت کامل نکات ایمنی برای جلوگیری از تماس یا انتشار گاز کلر را دارد.
کاهش این خطرات با ایجاد یک اتمسفر نیتروژن بیاثر انجام میشود تا سدیم روی سدیم پوشانده شده و از واکنشهای انفجاری ناخواسته جلوگیری شود. همچنین، استفاده از محفظههای استیل پوشانده شده با آجر نسوز برای کنترل دما و استفاده از سیستمهای کنترل از راه دور میتواند خطرات را کاهش دهد.












