باسیل گرم مثبت اسپوردار و بدون اسپور – به زبان ساده
گونههای باسیلوس شامل انواع باسیل گرم مثبت تشکیل دهنده اندوسپور و میلهای شکل هستند که در همه جا در محیط وجود دارند. اکثریت قریب به اتفاق این باکتریها ارگانیسمهای غیر بیماریزا هستند که در خاک، هوا، گرد و غبار و بقایای ساختمانها یافت میشوند. در این مطلب به بررسی انواع باسیل گرم مثبت ، ویژگیهای آنها و اسپور دار و بدون اسپور بودن آنها میپردازیم.
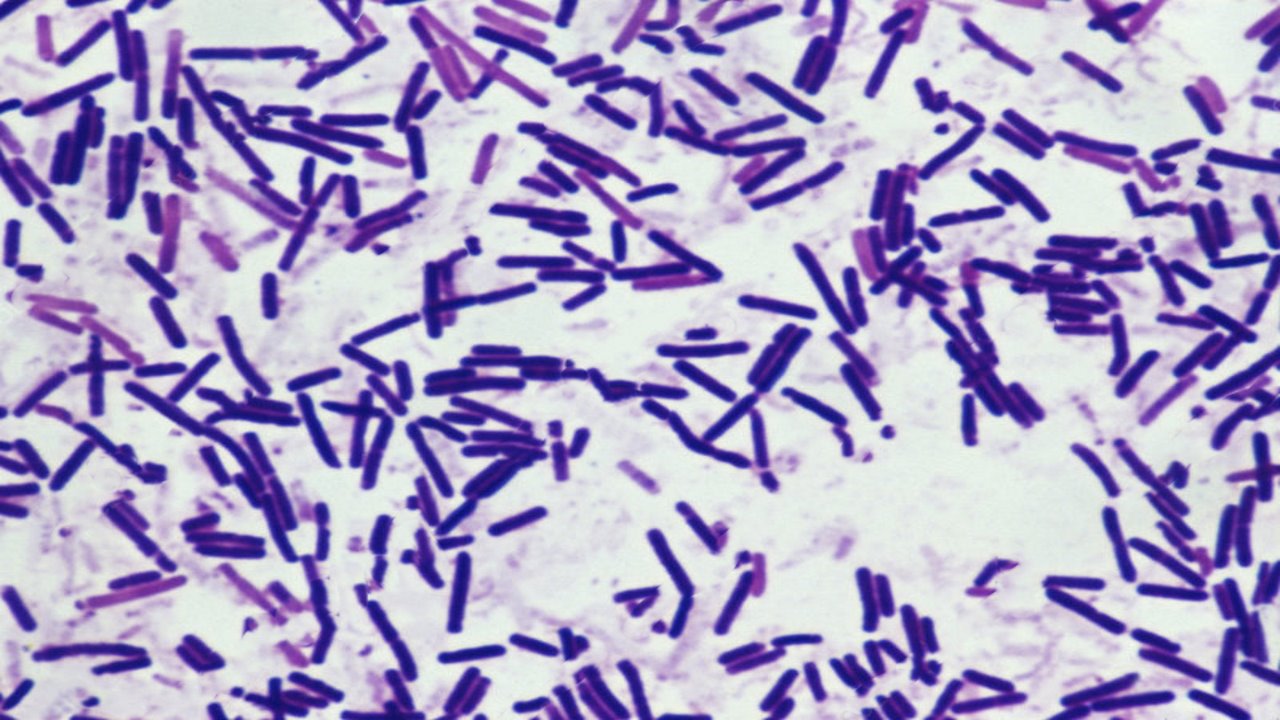
باسیل گرم مثبت چیست؟
همه باکتریها ممکن است به عنوان یکی از سه شکل اصلی کره (کوکسی)، میله (باسیل) و مارپیچ (اسپیروکتس) طبقه بندی شوند. باکتریهای گرم مثبت ممکن است کوکسی یا باسیل باشند. باسیلهای گرم مثبت باعث عفونتهای خاصی از جمله سیاه زخم، دیفتری، عفونتهای انتروکوکی، لیستریوز و غیره میشوند. باکتریهای گرم مثبت به طور فزایندهای در برابر آنتی بیوتیکها مقاوم میشوند.
باسیل گرم مثبت یک گروه ناهمگن از باکتریها، هم اسپوروژن (اسپوردار) و هم غیر اسپوروژن (غیر اسپور دار) هستند. میلههای اسپوروژن هوازی گرم مثبت جنس باسیلوس را تشکیل میدهند. این شامل گونههای بسیاری است که مهمترین آنها از نظر پزشکی و دامپزشکی «باسیلوس آنتراسیس» (Bacillus anthracis)، عامل سیاه زخم است.
این ارگانیسم در خاک وجود دارد و میتواند پوست حیوانات را که منبع معمول عفونت در انسان است، آلوده کند. همچنین از آن به عنوان نوعی بیوتروریسم استفاده شده است. یا باسیلوس سرئوس میتواند باعث ایجاد انواع مختلفی از عفونتها از جمله عفونتهای پوست و بافت نرم و عفونتهای سیستمیک شود. لیستریا مونوسیتوژنز یک باسیل هوازی غیر اسپوردار گرم مثبت است که یک عامل بیماری زای مهم در نوزادان، افراد مسن و افرادی با نقص ایمنی ناشی از سلول است که در آنها باعث ایجاد باکتریمی و مننژیت میشود. کورینه باکتریوم دیفتریا نوع دیگری باسیل گرم مثبت است که باعث دیفتری میشود و از طریق گلو (محل اصلی حمل و عفونت) توسط قطرات پخش میشود. همانطور که بیان شد باسیلهای گرم مثبت از لحاظ دارا بودن اسپور به دو نوع باسیل گرم مثبت اسپور دار و باسیل گرم مثبت فاقد اسپور تقسیم بندی میشوند که در ادامه بیشتر به آنها پرداخته ایم.
باسیل گرم مثبت اسپور دار
باسیلهای گرم مثبت اسپور ساز گونههای باسیلوس و کلستریدیوم هستند. این باسیلها در همه جا وجود دارند و به دلیل تشکیل اسپور میتوانند سالها در محیط زیست زنده بمانند. این باکتریها شامل گونههای باسیلوس هوازی و گونههای کلستریدیوم بی هوازی هستند. باکتریهای گرم مثبت بنفش یا آبی در زیر میکروسکوپ ظاهر میشوند زیرا رنگ بنفش کریستالی ثابت شده با غلیظ ید در پوشش بیرونی آنها باقی میماند. دلیل اصلی این امر دیواره سلولی ضخیمی است که باکتریهای گرم مثبت دارند. دیواره سلولی آنها دارای یک لایه ضخیم از زنجیرههای پپتیدوگلیکان است که توسط آنزیم DD-transpeptidase به هم متصل میشوند. اندوسپورها ساختارهایی هستند که نشان دهنده مرحله خفته در برخی از باکتریها هستند. باسیلهای گرم مثبت سازنده اندوسپور شامل گونههای باسیلوس و کلستریدیوم هستند که در ادامه بیشتر به آنها میپردازیم.
باسیلوس آنتراسیس چیست؟
«باسیلوس آنتراسیس» (B. anthracis) یک باکتری گرم مثبت و میلهای شکل است که باعث سیاه زخم، بیماری مهلک برای دامها و گهگاه انسانها میشود. این تنها پاتوژن دائمی (اجباری) در جنس Bacillus است. عفونت آن نوعی بیماری مشترک بین انسان و حیوان است، زیرا از حیوان به انسان منتقل میشود. در سال 1876 توسط یک پزشک آلمانی روبرت کخ کشف شد و اولین باکتری بود که به صورت تجربی به عنوان عامل بیماری زا نشان داده شد.
این کشف همچنین اولین شواهد علمی برای نظریه میکروب بیماریها بود. اندازه باسیلوس آنتراسیس حدود 3 تا 5 میکرومتر طول و 1 تا 1/2 میکرومتر عرض دارد و دارای ژنومی حاوی 5،227،293 جفت باز در یک DNA حلقوی واحد است. دارای دو پلاسمید DNA خارج کلروموسی pXO1 و pXO2 است که مسئول بیماری زایی هستند.
این یک لایه محافظ به نام اندوسپور تشکیل میدهد که توسط آن میتواند سالها غیر فعال بماند و ناگهان در شرایط محیطی مناسب عفونی میشود. به دلیل انعطاف پذیری اندوسپور، این باکتری یکی از محبوب ترین سلاحهای بیولوژیکی است. کپسول پروتئینی (پلی - دی - گاما - گلوتامیک اسید) کلید فرار از پاسخ ایمنی است. با استفاده از دو پروتئین سیدروفور ترشحی، IsdX1 و IsdX2، از هِم پروتئین خون پروتئین تغذیه میکند. عفونت باسیلوس آنتراسیس درمان نشده معمولاً کشنده است. عفونت با ضایعه التهابی، سیاه و نکروتیک (اسکار) نشان داده میشود.
زخمها معمولاً در صورت، گردن، بازوها یا دستها ظاهر میشوند. علائم کشنده شامل تب شبه آنفولانزا، ناراحتی در قفسه سینه، دیافورز و بدن درد است. اولین واکسن حیوانات علیه سیاه زخم توسط شیمیدان فرانسوی لوئیس پاستور در سال 1881 ساخته شد. واکسنهای مختلف حیوانات و انسان در حال حاضر در دسترس است. عفونت را میتوان با آنتی بیوتیکهای رایج مانند پنی سیلینها، کینولونها و تتراسایکلینها درمان کرد.
بیماری زایی باسیلوس آنتراسیس
باسیلوس آنتراسیس دارای یک کپسول آنتی فاگوسیتیک (جلوگیری کننده از بلعیده شدن توسط فاگوسیتها) است که برای شدت بیماریزایی آن کاملا ضروری است. این ارگانیسم همچنین سه اگزوتوکسین با کد پلاسمید تولید میکند:
- فاکتور ادم، یک آدنیلات سیکلاز وابسته به کالمودولین که باعث افزایش cAMP داخل سلولی میشود و مسئول ادم شدید است که معمولاً در عفونتهای باسیلوس آنتراسیس دیده میشود.
- سم کشندهای که مسئول ایجاد نکروز بافتی و آنتی ژن محافظ است، به دلیل استفاده از آن در تولید واکسنهای محافظ سیاه زخم، که واسطه ورود فاکتور ادم و سم کشنده به سلول است، نامگذاری شده است.
علائم باسیلوس آنتراسیس
علائم بیماری سیاه زخم بستگی به نوع عفونت دارد و از 1 روز تا بیش از 2 ماه طول میکشد تا ظاهر شود. همه انواع سیاه زخم میتوانند در صورت عدم درمان، در سراسر بدن پخش شده و باعث بیماری شدید و حتی مرگ شوند. چهار شکل بیماری سیاه زخم انسانی بر اساس درگاه ورود آنها شناخته میشود.
- پوستی، شایع ترین حالت است و باعث ضایعه موضعی، التهابی، سیاه و نکروتیک (اسکار) میشود. اغلب این زخم روی صورت، گردن، بازوها یا دستها ظاهر میشود. گسترش آن میتواند طی 1 تا 7 روز پس از قرار گرفتن در معرض عامل بیماری رخ دهد.
- استنشاق، یک فرم نادر اما بسیار کشنده، با علائم شبیه آنفولانزا، ناراحتی در قفسه سینه، دیافورز (تعریق بیش از حد) و بدن درد مشخص میشود. توسعه بیماری معمولاً یک هفته پس از مواجهه رخ میدهد، اما میتواند تا دو ماه به طول انجامد.
- دستگاه گوارش، یک نوع نادر اما کشنده (باعث مرگ 25 درصدی می شود)، ناشی از بلعیدن هاگ است. علائم آن عبارتند از: تب و لرز، تورم گردن، بلع دردناک، گرفتگی صدا، تهوع و استفراغ (به ویژه استفراغ خونی)، اسهال، سرخ شدن و قرمزی چشم و تورم شکم.
- تزریق، علائم شبیه علائم سیاه زخم پوستی است اما سیاه زخم تزریقی میتواند سریعتر در بدن پخش شود و تشخیص و درمان آن در مقایسه با سیاه زخم پوستی دشوارتر است. علائم شامل تب، لرز، گروهی از برجستگیهای کوچک یا تاولهایی است که ممکن است خارش داشته باشد و در محل تزریق دارو ظاهر شود. زخمی بدون درد با مرکز سیاه که پس از تاول یا برجستگی ظاهر میشود. علاوه بر این تورم در اطراف زخم، آبسههای عمیق زیر پوست یا ماهیچه محل تزریق دارو مشاهده میشود.
پیشگیری و درمان
تعدادی واکسن سیاه زخم برای استفاده پیشگیرانه در دام و انسان ساخته شده است. واکسن جذب سیاه زخم (AVA) ممکن است در برابر سیاه زخم پوستی و استنشاق محافظت کند. با این حال، این واکسن فقط برای بزرگسالان در معرض خطر قبل از قرار گرفتن در معرض سیاه زخم استفاده میشود و برای استفاده پس از تماس تایید نشده است. عفونتهای باسیلوس آنتراسیس را میتوان با آنتی بیوتیکهای بتا - لاکتام مانند پنی سیلین و سایر داروهای ضد باکتریهای گرم مثبت درمان کرد. باسیلوس آنتراسیس مقاوم به پنی سیلین را میتوان با فلوروکینولونها مانند سیپروفلوکساسین یا آنتی بیوتیکهای تتراسایکلین مانند داکسی سایکلین درمان کرد.
باسیلوس سرئوس
«باسیلوس سرئوس» (B. cereus) یک باکتری گرم مثبت، میلهای، بی هوازی، متحرک، بتا همولیتیک، اسپور ساز است که معمولاً در خاک و غذا یافت میشود. برخی از سویهها برای انسان مضر هستند و باعث بیماریهای ناشی از غذا میشوند، در حالی که سویههای دیگر میتوانند به عنوان پروبیوتیک برای حیوانات مفید باشند. باسیلوس سرئوس مسئول تعداد کمی از بیماریهای ناشی از غذا (2 تا 5) است که باعث تهوع شدید، استفراغ و اسهال میشود.
بیماری زایی باسیلوس سرئوس
بیماریهای ناشی از غذای باسیلوس به دلیل زنده ماندن اندوسپورهای باکتریایی زمانی رخ میدهد که غذای آلوده پخته نشده یا ناکافی پخته شده باشد. دمای پخت کمتر یا مساوی 100 درجه سانتیگراد به برخی از اسپورهای باسیلوس سرئوس اجازه زنده ماندن میدهد. این مشکل زمانی که مواد غذایی در یخچال نامناسب قرار میگیرند تشدید شده و باعث میشود اندوسپورها جوانه بزنند. غذاهای پخته شده که نه برای مصرف فوری و نه برای خنک شدن سریع و سرد شدن باید در دمای زیر 10 درجه سانتیگراد یا بالای 50 درجه سانتیگراد نگهداری شوند. جوانه زنی اسپورها و رشد عموما بین 10 تا 50 درجه سانتیگراد اتفاق میافتد، هر چند برخی از سویهها میتوانند در دمای پایین رشد کنند. رشد باکتریایی منجر به تولید انتروتوکسینها میشود که یکی از آنها در برابر حرارت و اسیدها بسیار مقاوم است (سطح pH بین 2 تا 11). خوردن منجر به دو نوع بیماری میشود: سندرم اسهال و استفراغ (استفراغ).
- نوع اسهال با طیف وسیعی از غذاها همراه است، 8 تا 16 ساعت زمان نهفتن دارد و با اسهال و درد دستگاه گوارش همراه است. انتروتوکسین را میتوان پس از حرارت دادن در دمای 56 درجه سانتیگراد به مدت 5 دقیقه غیر فعال کرد، اما اینکه آیا وجود آن در غذا باعث ایجاد علائم میشود، مشخص نیست، زیرا در آنزیمهای معده تجزیه میشود. تولید بعدی آن با زنده ماندن اسپورهای باسیلوس سرئوس در روده کوچک ممکن است علت بیماری باشد.
- شکل استفراغ معمولاً ناشی از برنج پخته شده در مدت زمان و درجه حرارت ناکافی برای از بین بردن اسپورهای موجود ایجاد شده و سپس در یخچال نامناسب نگهداری میشود. این میتواند یک سم، سرئولید تولید کند، که با گرم شدن بعدی غیرفعال نمیشود. این فرم 1 تا 5 ساعت پس از مصرف منجر به تهوع و استفراغ میشود. تمایز آن از سایر مسمومیتهای کوتاه مدت ناشی از مواد غذایی باکتریایی مانند استافیلوکوکوس اورئوس میتواند مشکل باشد. سم استفراغ میتواند 121 درجه سانتیگراد را به مدت 90 دقیقه تحمل کند.
باسیلوس سرئوس همچنین به عنوان عامل عفونتهای مزمن پوستی شناخته میشود، هرچند حالت تهاجمی کمتری نسبت به التهاب فاشیای نکروزان دارد. این باسیل گرم مثبت همچنین میتواند باعث کراتیت شود. از آنجا که باسیلوس سرئوس در محیط همه جا حضور دارد، اقدامات کنترل باید بر جلوگیری از رشد باسیلوس سرئوس و تشکیل سم استفراغ در غذا متمرکز شود. اطمینان حاصل کنید که غذا در دمای بالای 60 درجه سانتیگراد پخته یا در دمای زیر 4 درجه سانتیگراد در یخچال نگهداری میشود. غذاهای پخته شده را خنک کنید که بلافاصله در دمای کمتر از 4 درجه سانتی گراد در مدت کمتر از 6 ساعت مصرف شوند. هنگام گرم کردن غذا، اطمینان حاصل کنید که درجه حرارت حداقل به 74 درجه سانتی گراد میرسد.
تشخیص و درمان باسیلوس سرئوس
مسمومیت غذایی ناشی از باسیلوس سرئوس را میتوان با جداسازی این باکتری در نمونههای غذا، مدفوع یا استفراغ تأیید کرد. محیطهای مختلفی برای کشت این عامل بیماری زا در دسترس است. کیتهای تجاری نیز برای تشخیص انتروتوکسین اسهالی در دسترس هستند، اما این مورد در مورد سم استفراغ صدق نمیکند. اکثر افراد بدون درمان بهبود مییابند. در صورت شدت اسهال یا استفراغ تجویز مایعات توصیه میشود. آنتی بیوتیکها تجویز نمیشوند زیرا علائم ناشی از سموم هستند و نه باکتریها.
باسیل گرم مثبت کلستریدیوم تتانی
«کلستریدیوم تتانی» (C. tetani) یک باسیل گرم مثبت اسپوردار معمولی خاک و عامل ایجاد کزاز است. سلولهای رویشی کلستریدیوم تتانی معمولاً به شکل میلهای و تا 2/5 میکرومتر طول دارند، اما هنگام تشکیل اسپور بزرگ شده و به شکل راکت یا چوبک تنیس در میآیند. اسپورهای کلستریدیوم تتانی بسیار مقاوم هستند و میتوانند در خاک یا دستگاه گوارش حیوانات یافت شوند.
درگاه ورودی معمولاً محل زخم است (به عنوان مثال، جایی که ناخن در پا نفوذ میکند)، اما اسپورها میتوانند در حین تزریق زیرجلدی، تکنیکی که معتادان برای تزریق مواد مخدر به پوست استفاده میکنند نیز وارد شوند. جوانه زنی اسپورها با بافت نکروزه و خونرسانی ضعیف در زخم مطلوب است. کزاز نوزادان، که در آن ارگانیسم از طریق ناف آلوده یا زخم ختنه وارد میشود، یک مشکل عمده در برخی از کشورهای در حال توسعه است.
بیماری زایی کلستریدیوم تتانی
سم تتانوس (tetanospasmin) یک اگزوتوکسین است که توسط سلولهای رویشی در محل زخم تولید میشود. این سم پلی پپتیدی به صورت درون آکسونال (رتروگراد) به سیستم عصبی مرکزی منتقل میشود، جایی که به گیرندههای گانگلیوزید متصل میشود و انتشار واسطههای بازدارنده (مانند گلایسین و گاما آمینو بوتیریک اسید یا GABA) را در سیناپسهای نخاعی مسدود میکند. سم تتانوس و سم بوتولینوم از جمله سمی ترین مواد شناخته شده هستند. آنها پروتئازهایی هستند که پروتئینهای دخیل در واسطه را جدا میکنند. سم کزاز یک نوع آنتی ژنی دارد، برخلاف سم بوتولینوم که دارای هشت نوع است. بنابراین تنها یک نوع آنتی ژنی توکسوئید کزاز در واکسن علیه کزاز وجود دارد. کزاز با اسپاسم شدید عضلانی (فلج اسپاستیک، تتانی) مشخص میشود.
ویژگیهای بالینی خاص شامل قفسه سینه (تریسموس) به دلیل انقباض سفت و سخت عضلات فک است که از باز شدن دهان جلوگیری میکند. یک گریماس (کج شدگی دهان) مشخص که به عنوان «ریسوس ساردونیکوس» (risus sardonicus) و انعکاسهای شدید آن شناخته میشود. توجه داشته باشید که در کزاز، فلج اسپاستیک (انقباضات قوی عضلانی) رخ میدهد، در حالی که در بوتولیسم، فلج شل (انقباضات عضلانی ضعیف) رخ میدهد.
تشخیص و درمان کلستریدیوم تتانی
هیچ تشخیص میکروبیولوژیکی یا سرولوژیکی برای آن وجود ندارد و موجودات زنده به ندرت از محل زخم جدا میشوند. کلستریدیوم تتانی یک اسپور انتهایی (یعنی یک اسپور در انتهای میله) تولید میکند. این به ارگانیسم ظاهر مشخصی از راکت تنیس میدهد. گلوبولین ایمنی کزاز (آنتی توکسین کزاز) برای خنثی سازی سم استفاده میشود. نقش آنتی بیوتیکها نامشخص است. در صورت استفاده از آنتی بیوتیکها میتوان مترونیدازول یا پنی سیلین G تجویز کرد. راه هوایی کافی باید حفظ شده و از تنفس حمایت شود. بنزودیازپینها (به عنوان مثال، دیازپام) باید برای جلوگیری از اسپاسم تجویز شوند.

باسیل گرم مثبت کلستریدیوم بوتولینوم
«کلستریدیوم بوتولینوم» (Clostridium botulinum) یک باکتری گرم مثبت، میلهای، بی هوازی، اسپور ساز و متحرک با قابلیت تولید نوروتوکسین بوتولینوم است. سم بوتولینوم میتواند باعث بوتولیسم شود یک بیماری فلج شدید شل در انسان و سایر حیوانات و قوی ترین سمی است که توسط بشر شناخته شده است.
بوتولیسم یک بیماری نادر اما جدی است که توسط سمی ایجاد میشود و به اعصاب بدن حمله میکند و باعث مشکل در تنفس، فلج عضلات و حتی مرگ میشود. این سم توسط باکتری کلستریدیوم بوتولینوم و گاهی کلستریدیوم بوتیریکوم و کلستریدیوم باراتی ساخته میشود. این باکتریها میتوانند سم را در غذا، زخمها و روده نوزادان تولید کنند. باکتریهایی که سم بوتولینوم را تولید میکنند به طور طبیعی در بسیاری از نقاط یافت میشوند، اما به ندرت اتفاق میافتد که آنها باعث بیماری افراد شوند. این باکتریها اسپورهایی ایجاد میکنند که مانند پوششهای محافظ عمل میکنند.
اسپورها به باکتریها برای زنده ماندن در محیط حتی در شرایط شدید کمک میکنند. اسپورها معمولاً باعث بیماری افراد نمیشوند، حتی زمانی که آنها خورده میشوند. اما تحت شرایط خاصی، این هاگها میتوانند رشد کرده و یکی از کشنده ترین سموم شناخته شده را ایجاد کنند. شرایطی که در آن هاگها میتوانند رشد کنند و سم تولید کنند عبارتند از:
- محیط کم اکسیژن یا بدون اکسیژن (بی هوازی)
- اسید کم
- قند کم
- نمک کم
- محدوده دمایی مشخص
- مقدار مشخصی آب
به عنوان مثال، غذاهای کنسرو شده، نگهداری شده یا تخمیر شده در خانه میتوانند شرایط مناسبی را برای رشد اسپورها و تولید سم بوتولینوم فراهم کنند. وقتی افراد این غذاها را بخورند، اگر به سرعت درمان مناسب را دریافت نکنند، ممکن است به شدت بیمار شوند یا حتی بمیرند. حالتهای مختلفی از بوتولیسم وجود دارد که در ادامه بررسی میکنیم.
- اگر اسپور باکتریها وارد روده نوزاد شوند، بوتولیسم نوزاد ممکن است رخ دهد. اسپورها رشد کرده و سم تولید میکنند که باعث بیماری میشود.
- اگر اسپور باکتریها وارد زخم شده و سم ایجاد کنند، بوتولیسم زخم ممکن است رخ دهد. افرادی که دارو تزریق میکنند شانس بیشتری برای ابتلا به بوتولیسم زخم دارند. بوتولیسم زخم نیز در افراد پس از آسیب دیدگی مانند تصادف با موتورسیکلت یا جراحی ایجاد شده است.
- بوتولیسم غذایی میتواند با خوردن غذاهای آلوده به سم بوتولینوم اتفاق بیفتد. منابع رایج بوتولیسم ناشی از غذا، غذاهای خانگی هستند که به طور نامناسب در کنسرو، نگهداری یا تخمیر قرار گرفته اند. اگرچه غیر معمول است، اما غذاهای خریداری شده از فروشگاه نیز میتوانند به سم بوتولینوم آلوده شوند.
- اگر سم بوتولینوم زیاد به دلایل زیبایی مانند چین و چروک یا دلایل پزشکی مانند سردردهای میگرنی تزریق شود، بوتولیسم یاتروژنیک (مشکلات ناشی از عوارض درمان) ممکن است رخ دهد.
- تاکسمیای روده بزرگسالان (همچنین به عنوان همزیستی در روده بزرگسالان شناخته میشود) یک نوع بوتولیسم بسیار نادر است که میتواند در صورت ورود اسپور باکتری به روده بزرگسالان، رشد و تولید سم (مشابه بوتولیسم نوزاد) رخ دهد.
انواع سم کلستریدیوم بوتولینوم
تولید نوروتوکسین ویژگی منحصر به فرد این گونه است. هشت نوع سم شناسایی شده است که یک حرف (A - H) به آن اختصاص داده شده است، که چندین نوع از آنها میتوانند باعث ایجاد بیماری در انسان شوند. آنها در برابر تجزیه آنزیمهای موجود در دستگاه گوارش مقاوم هستند. این باعث میشود که سموم بلعیده شده از رودهها وارد جریان خون شوند. با این حال، همه انواع سم بوتولینوم با حرارت دادن به دمای 100 درجه سانتیگراد به مدت 15 دقیقه (900 ثانیه) به سرعت از بین میروند. سم بوتولینوم، یکی از سمی ترین مواد بیولوژیکی شناخته شده، یک نوروتوکسین است که توسط باسیل گرم مثبت کلستریدیوم بوتولینوم تولید میشود.
کلستریدیوم بوتولینوم هشت اگزوتوکسین قابل تشخیص از نظر ژنتیکی (A ، B ، C1 ، C2 ، D ، E ، F و G) را توسعه میدهد. اکثر سویهها یک نوع نوروتوکسین تولید میکنند، اما گونههایی که چندین سم تولید میکنند شرح داده شده است. کلستریدیوم بوتولینوم تولیدکننده انواع سم B و F از موارد بوتولیسم انسانی در نیومکزیکو و کالیفرنیا جدا شده است. نوع سم Bf تعیین شده است زیرا سم نوع B بیش از نوع F یافت شده است. به طور مشابه، سویههای تولید کننده سموم Ab و Af گزارش شده است.
فقط سم بوتولینوم A ، B ، E ، F و H باعث ایجاد بیماری در انسان میشود. انواع A ، B و E با بیماریهای منتقله از غذا مرتبط هستند، در حالی که نوع E به طور خاص با محصولات ماهی مرتبط است. نوع C در پرندگان گردن لایمر ایجاد میکند و نوع D باعث بوتولیسم در سایر پستانداران میشود. هیچ بیماری با نوع G در ارتباط نیست. استاندارد طلایی برای تعیین نوع سم سنجش زیستی موش است، اما ژنهای انواع A ، B ، E و F را میتوان با استفاده از روش PCR کمی به آسانی متمایز کرد. از آنجا که هنوز هیچ آنتی توکسینی برای نوع H در دسترس نیست، در سال 2013 کشف شد و تا کنون مرگبارترین آن است.

جداسازی کلستریدیوم بوتولینوم در آزمایشگاه
در آزمایشگاه، کلستریدیوم بوتولینوم معمولاً در محیط رشد تریپتوز سولفیت سیکلوسرین (TSC) در محیط بی هوازی با اکسیژن کمتر از 2 درصد جدا میشود. این را میتوان با چندین کیت تجاری که از واکنش شیمیایی برای جایگزینی O2 با CO2 استفاده میکنند، بدست آورد. کلستریدیوم بوتولینوم یک میکروارگانیسم لیپاز مثبت است که بین pH 4/8 تا 7/0 رشد میکند و نمیتواند از لاکتوز به عنوان منبع کربن اولیه استفاده کند، ویژگیهایی که برای شناسایی بیوشیمیایی مهم است.
علائم کلستریدیوم بوتولینوم
علائم و نشانههای بوتولیسم ممکن است شامل موارد زیر باشد:
- مشکل در بلع
- ضعف عضلانی
- دید دوگانه
- افتادگی پلکها
- تاری دید
- لکنت زبان
- مشکل در تنفس
- مشکل در حرکت دادن چشمها
علائم و نشانههای احتمالی در بوتولیسم غذایی نیز ممکن است شامل موارد زیر باشد:
- استفراغ
- حالت تهوع
- دل درد
- اسهال
علائم و نشانههای یک نوزاد ممکن است شامل موارد زیر باشد:
- یبوست
- غذا خوردن نامناسب
- افتادگی پلکها
- مردمکهایی که در واکنش به نور کند عمل میکنند
- چهره کوچکتر از حالت معمول نشان میدهد
- گریه ضعیفی که متفاوت از حالت معمول به نظر میرسد
- دشواری تنفس
افراد مبتلا به بوتولیسم ممکن است همه این علائم را همزمان نداشته باشند. همه علائم ناشی از فلج عضلانی ناشی از سم است. در صورت عدم درمان، بیماری ممکن است پیشرفت کند و علائم ممکن است بدتر شوند و باعث فلج کامل برخی از انواع ماهیچهها، از جمله عضلات مورد استفاده در تنفس و بازوها، ساق پا و تنه شود (قسمتی از بدن از گردن تا ناحیه لگن، تاب گشت). در بوتولیسم ناشی از غذا، علائم به طور کلی 18 تا 36 ساعت پس از خوردن غذای آلوده شروع میشود. اگر شما یا کسی که میشناسید علائم بیماری بوتولیسم را دارید، فوراً به پزشک خود مراجعه کنید یا به اورژانس بروید.
تشخیص و درمان بوتولیسم
پزشک از شما سؤالاتی میپرسد و شما را معاینه میکند تا علت علائم را دریابد. با این حال، این سرنخها معمولاً برای تشخیص پزشک شما کافی نیستند زیرا برخی علائم بوتولیسم در بیماریهای دیگر مانند سندرم Guillain - Barré، مننژیت، میاستنی گراویس، سکته مغزی و حتی مصرف بیش از حد مواد افیونی نیز مشاهده میشود. ممکن است پزشک برای تشخیص نیاز به انجام آزمایشاتی داشته باشد. برخی از این آزمایشها عبارتند از:
- اسکن مغز
- معاینه مایع نخاعی
- آزمایش عملکرد اعصاب و ماهیچهها (مطالعه هدایت عصبی و الکترومیوگرافی)
- آزمایش کشش میاستنی گراویس
اگر این آزمایشات نشان ندهد که چه چیزی باعث بیماری شما میشود، پزشک ممکن است آزمایشاتی را برای یافتن سم یا باکتریهایی که باعث بوتولیسم میشوند، تجویز کند. این آزمایشات تنها راهی است که به طور قطعی میتوانید بوتولیسم را تشخیص دهید. ممکن است چندین روز طول بکشد تا نتایج آزمایشات خود را از آزمایشگاه دریافت کنید. اگر پزشک مشکوک به بیماری بوتولیسم است، میتوانید بلافاصله درمان را شروع کنید.
بوتولیسم ناشی از سمی است که به اعصاب بدن حمله میکند و باعث مشکل در تنفس، فلج عضلات و حتی مرگ میشود. پزشکان بوتولیسم را با دارویی به نام آنتی توکسین درمان میکنند که مانع از ایجاد این سم میشود. آنتی توکسین آسیبی را که سم قبلاً وارد کرده است درمان نمیکند. بسته به شدت علائم شما، ممکن است لازم باشد هفتهها یا حتی ماهها در بیمارستان بمانید تا اینکه به اندازه کافی خوب باشید و به خانه بروید. اگر بیماری شما شدید است، ممکن است مشکلات تنفسی داشته باشید.
اگر سم، عضلات درگیر در تنفس را فلج کند، حتی ممکن است دچار نارسایی تنفسی شوید. اگر این اتفاق بیفتد، ممکن است پزشک شما را روی دستگاه تنفس قرار دهد تا بتوانید به تنهایی نفس بکشید. فلج ناشی از سم معمولاً به آرامی بهبود مییابد. مراقبتهای پزشکی و پرستاری که در بیمارستان دریافت میکنید به بهبود شما کمک میکند. افراد مبتلا به بوتولیسم زخم گاهی برای برداشتن منبع باکتری به جراحی نیاز دارند و ممکن است نیاز به مصرف آنتی بیوتیک داشته باشند.
کلستریدیوم پرفرنژس
باکتری «کلستریدیوم پرفرنژس» (Clostridium perfringens) یک باسیل گرم مثبت بیماریزا، بی هوازی و تشکیل دهنده اسپور از جنس کلستریدیوم است. کلستریدیوم پرفرنژس همیشه در طبیعت وجود دارد و میتوان آن را به عنوان یک جزء طبیعی از گیاهان در حال پوسیدگی، رسوبات دریایی، دستگاه روده انسان و سایر مهره داران، حشرات و خاک یافت. این باسیل گرم مثبت یکی از شایع ترین علل بیماریهای ناشی از غذا (مسمومیت غذایی) است. کلستریدیوم پرفرنژس را میتوان در گوشت و مرغ خام، در روده حیوانات و در محیط یافت.
این باکتریها اسپور ایجاد میکنند که مانند پوششهای محافظتی عمل کرده که به زنده ماندن باکتریها کمک میکند. تحت شرایط خاص، مانند زمانی که غذا در دمای نا امن نگهداری میشود، کلستریدیوم پرفرنژس میتواند رشد کرده و تکثیر شود. منابع متداول عفونت این باسیل گرم مثبت عبارتند از گوشت، مرغ، سبزیجات و سایر غذاها که در دستههای بزرگ پخته شده و در دمای نامطمئن نگهداری میشوند.
شیوع بیماری در مکانهایی که به گروههای زیادی از مردم خدمات رسانی میکنند، مانند بیمارستانها، کافه تریاهای مدارس، زندانها و خانههای سالمندان و در مراسم با غذای آماده، رخ میدهد. بسیاری از شیوعهای کلستریدیوم پرفرنژس با غذاهایی که معمولاً در تعطیلات سرو میشود، مانند بوقلمون و گوشت گاو ارتباط دارد. هر کسی میتواند از کلستریدیوم پرفرنژس مسمومیت غذایی دریافت کند. کودکان خردسال و بزرگسالان در معرض خطر بیشتری برای بیماریهای شدید هستند.
علائم و درمان کلستریدیوم پرفرنژس
اکثر افراد مبتلا به عفونت کلستریدیوم پرفرنژس در عرض 6 تا 24 ساعت پس از خوردن غذای آلوده دچار اسهال و گرفتگی معده میشوند. این بیماری معمولاً به طور ناگهانی شروع میشود و کمتر از 24 ساعت طول میکشد. اسهال میتواند باعث کم آبی بدن شود، بنابراین نوشیدن مایعات فراوان بسیار مهم است. این عفونت معمولاً باعث تب یا استفراغ نمیشود و نمیتواند از فردی به فرد دیگر منتقل شود. عفونت زمانی تأیید میشود که آزمایش آزمایشگاهی باکتریها یا سم آنها را در نمونه مدفوع تشخیص دهد یا باکتریها در غذاهای مرتبط با بیماری یافت شوند. با این حال، آزمایشگاههای بالینی به طور معمول عفونت کلستریدیوم پرفرنژس را آزمایش نمیکنند و آزمایشگاههای بهداشت عمومی معمولاً فقط در مواردی که علت مشکوک به شیوع بیماری باشد، آن را آزمایش میکنند. اکثر افراد بدون درمان آنتی بیوتیکی از عفونت کلستریدیوم پرفرنژس بهبود مییابند. تا زمانی که اسهال ادامه دارد، بیماران باید مایعات اضافی بنوشند.
باسیل گرم مثبت کلستریدیوئید دیفیسیل
«کلستریدیوئید دیفیسیل» (C. difficile) باسیل گرم مثبت اسپورساز است. سلولهای رویشی آن میلهای شکل، پلئومورف هستند و بصورت زوج یا زنجیرهای کوتاه ایجاد میشوند. در زیر میکروسکوپ، آنها به عنوان سلولهای بلند، نامنظم (اغلب به شکل چوب طبل یا دوک شکل) ظاهر میشوند که در انتهای آنها برآمدگی دارد. تحت رنگ آمیزی گرم، سلولهای کلستریدیوئید دیفیسیل گرم مثبت هستند و در دمای بدن انسان در غیاب اکسیژن رشد مطلوبی را بر آگار خون نشان میدهند. کلستریدیوئید دیفیسیل کاتالاز و سوپراکسید دیسموتاز منفی است و دو نوع سم تولید میکند: انتروتوکسین A و سیتوتوکسین B، که انتقال سیگنال اسکلت اسکلتی در میزبان را مختل میکند. در شرایط استرس، باکتریها اسپورهایی تولید میکنند که قادر به تحمل شرایط شدید هستند که باکتریهای فعال نمیتوانند تحمل کنند.
اگرچه کلستریدیوئید دیفیسیل عموماً به عنوان عفونت بیمارستانی و عامل بیماری زای مرتبط با آنتی بیوتیک شناخته میشود، اما حداکثر یک سوم عفونتها را میتوان از طریق انتقال از فرد آلوده در بیمارستانها تشخیص داد و تنها تعداد کمی از آنتی بیوتیکها مستقیماً با افزایش خطر ابتلا به عفونت (CDI)، یعنی کلیندامایسین، فلوروکینولونها و سفالوسپورینها ارتباط دارند. اکثر عفونتها در خارج از بیمارستان ایجاد میشوند و اکثر آنتی بیوتیکها در مقایسه با بسیاری از عوامل خطر غیر آنتی بیوتیکی، مانند مسمومیت غذایی یا سوء مصرف ملین خطر عفونت را افزایش میدهند. به نظر میرسد افرادی که سابقه اختلالات گوارشی ندارند ناقل بدون علامت باشند. تصور میشود که این حاملها مخزن اصلی عفونت باشند.
بیماری زایی کلستریدیوم دیفیسیل
سویههای بیماری زای کلستریدیوم دیفیسیل چندین سم تولید میکنند. بهترین مشخصهها عبارتند از: انتروتوکسین و سیتوتوکسین، که هر دو ممکن است اسهال و التهاب را در بیماران مبتلا ایجاد کنند. اسهال ممکن است از چند روز با از دست دادن مایع روده گرفته تا کولیت شبه غشایی تهدید کننده زندگی، که با التهاب شدید روده بزرگ و تشکیل شبه غشاها در سطح مخاط روده همراه است، متغیر باشد. سموم A و B گلوکوزیل ترانسفرازها هستند که خانواده Rho GTPases را هدف گرفته و غیر فعال میکنند. سم B (سیتوتوکسین) با مکانیسم مرتبط با کاهش ADP ریبوزیلاسیون پروتئینهای Rho متصل به GTP با جرم مولکولی کم باعث دپلیمریزاسیون اکتین میشود. سم دوتایی (AB) نیز وجود دارد، اما نقش آن در بیماری به طور کامل مشخص نیست. فاکتورهای حدت اضافی شامل فاکتور چسبندگی است که اتصال سلولهای کولون انسان و هیالورونیداز را واسطه میکند.
این باکتری همچنین ماده شیمیایی پاراکرزول را تولید میکند که مانع از رشد میکروبهای دیگر در مجاورت آن میشود و به آن اجازه میدهد تا ریزاندامگان طبیعی روده انسان را برتری دهد. درمان آنتی بیوتیکی عفونتهای این باسیل گرم مثبت ممکن است به دلیل مقاومت آنتی بیوتیکی و عوامل فیزیولوژیکی باکتری (تشکیل اسپور، اثرات محافظتی pseudomembrane) دشوار باشد. مقاومت در برابر آنتی بیوتیکهای دیگر مانند مترونیدازول، اولین انتخاب داروی ضد میکروبی هنگام درمان CDI، در 12 درصد جدا شدههای بالینی مشاهده شده است، مقاومتهای متنوعتر و قویتر همچنان در جمعیت این باسیل گرم مثبت تکامل مییابد و تلاش برای درمان موثر را بیشتر پیچیده میکند. علائم عفونت این باسیل گرم مثبت عبارتند از: اسهال (حداقل سه بار دفع مدفوع در روز)، کم آبی بدن، درد شکمی که میتواند شدید باشد، از دست دادن اشتها و تهوع.
درمان کلستریدیوم دیفیسیل
بیمارانی که با شروع علائم با آنتی بیوتیک درمان میشوند، در صورت امکان باید مصرف آنها را متوقف کنند. این شکست در درمان آنتی بیوتیکی گاهی اوقات میتواند منجر به رفع خود به خود علائم شود. بیمارانی که به قطع آنتی بیوتیکهای طیف وسیع پاسخ نمیدهند، باید با آنتی بیوتیکهایی که قادر به کشتن اسپورهای C. difficile هستند، تحت درمان قرار گیرند. عفونتهای اولیه معمولاً با وانکومایسین، با دوز معمول 125 میلی گرم هر 6 ساعت درمان میشوند. رژیم ونکومایسین جایگزین استفاده از مترونیدازول به دلیل اثربخشی بیشتر، مشخصات ایمنی و نرخ عود کمتر شده است. در بیمارانی که نمیتوانند ونکومایسین را تحمل کنند، فیداکسومایسین یک گزینه قابل قبول با اثربخشی مشابه و حتی میزان عود کمتر از ونکومایسین است. در موارد CDI شایع، درمان کمکی با مترونیدازول تزریقی به همراه ونکومایسین خوراکی یا فیداکسومیسین پیشنهاد میشود.
حدود 20 درصد از بیمارانی که درمان عفونت اولیه را با مترونیدازول یا ونکومایسین با موفقیت انجام میدهند، عود خواهند کرد. بخشی از این بیماران عود مجدد عفونت را تجربه میکنند. اولین عود بیماری این باسیل گرم مثبت معمولاً با همان آنتی بیوتیک مورد استفاده برای درمان عفونت اولیه، درمان میشود. هرگونه عفونت بعدی نباید با مترونیدازول درمان شود. گاهی اوقات، یک دوره استاندارد 10 روزه ونکومایسین خوراکی جواب نمیدهد. در این موارد، مخروط وانکومایسین درمان ترجیحی است. بسته به شدت عفونت، بیماران دوزهای ونکومایسین را طی 3 ماه کاهش میدهند. هر عود بعدی کلستریدیوم دیفیسیل شدیدتر از عفونتهای قبلی است. درمان طولانی مدت با مخروط وانکومایسین با پروبیوتیکها، به ویژه Saccharomyces boulardii، با میزان موفقیت بیشتری همراه است.
پس از سه بار عود، بیماران ممکن است با فیداکسومایسین خوراکی، آنتی بیوتیک با طیف باریک تحت درمان قرار گیرند. دوز معمول 200 میلی گرم دو بار در روز به صورت خوراکی به مدت 10 روز است. در نظر گرفته میشود که فیداکسومیسین برای CDI شدید نسبت به ونکومایسین برتر است. بیمارانی که به درمان آنتی بیوتیکی سنتی پاسخ نمیدهند ممکن است واجد شرایط پیوند میکروبیوتای مدفوع (FMT) باشند. ارائه دهندگان مراقبتهای بهداشتی میتوانند مدفوع را از یک فرد سالم به روده بزرگ بیمار مبتلا به CDI مکرر منتقل کنند. این فرایند موفق ترین درمان CDI شدید با نرخ درمان در حدود 93 است. میزان عود CDI در بیماران تحت درمان با FMT به طور کلی پایین است، حدود 19 درصد، که در درمان موارد مزمن CDI بسیار مؤثر است.
باسیل گرم مثبت بدون اسپور
باسیلهای گرم مثبت بدون اسپور گروه متفاوتی از باکتریهای هوازی و بی هوازی هستند. این باکتریها که شامل انواع مختلفی مانند کورینه باکتریوم، لیستریا و گونههای مختلف لاکتوباسیل بوده فاقد توانایی تولید اسپور هستند که در ادامه به آنها بیشتر میپردازیم.
باسیل گرم مثبت کورینه باکتریوم دیفتریا چیست؟
کورینه باکتریوم دیفتریا (Corynebacterium diphtheriae) یک باسیل گرم مثبت بدون حرکت، بدون کپسول، بدون اسپور و دارای محتوای GC بالا است. از نظر میکروسکوپی، کورینهباکتریها دارای انتهای چوبی هستند و مورفولوژی مشخصی به شکل V نشان میدهند. علاوه بر کورینه باکتریوم دیفتریا، دو گونه کورینهباکتری دیگر میتوانند سم دیفتری تولید کنند و بنابراین باعث دیفتری نیز میشوند. توانایی ایجاد دیفتری بستگی به توانایی ارگانیسم در تولید سم دیفتری دارد.
بیماری زایی کورینه باکتریوم دیفتریا
کورینه باکتریوم دیفتریا عامل اصلی ایجاد کننده دیفتری است. این بیماری عمدتا در مناطق گرمسیری و کشورهای توسعه نیافته رخ میدهد، اما شناخته شده است و در سراسر جهان ظاهر میشود. افراد دارای نقص ایمنی، بزرگسالان ضعیف واکسینه شده و کودکان واکسینه نشده بیشترین خطر ابتلا به دیفتری را دارند. در طول دوره معمول بیماری، تنها ناحیه بدن آسیب دیده دستگاه تنفسی فوقانی است. یک پوشش ضخیم و خاکستری در نازوفارنکس جمع شده و تنفس و بلع را دشوارتر میکند. این بیماری حداقل دو هفته پس از ناپدید شدن علائم مسری باقی میماند، اما مشخص شده است که تا یک ماه ادامه دارد. شایع ترین راههای ورود کورینه باکتریوم دیفتریا بینی، لوزهها و گلو است. افرادی که از این بیماری رنج میبرند ممکن است گلو درد، ضعف، تب و تورم غدد را تجربه کنند. روش انتقال، تماس فرد به فرد از طریق قطرات تنفسی (به عنوان مثال، سرفه یا عطسه) و حالت کمتر متداول، با لمس زخمهای باز یا سطوح آلوده است.
در صورت عدم درمان، سم دیفتری ممکن است وارد جریان خون شود و باعث آسیب به کلیهها، اعصاب و قلب شود. عوارض بسیار نادر شامل خفگی و فلج جزئی است. اگزوتوکسین این باسیل گرم مثبت بدون اسپور در خون جذب میشود که به نوبه خود سلولهای قلب، کلیه و عصب را با انسداد سنتز پروتئین از بین میبرد. سویههای سمی در افراد مستعد میتوانند با تکثیر و ترشح سم دیفتری در ضایعات پوستی یا نازوفارنکس باعث بیماری شوند. ضایعه دیفتریتی اغلب توسط یک غشای کاذب متشکل از فیبرین، سلولهای باکتریایی و سلولهای التهابی پوشانده میشود. دیفتری را میتوان با دارو درمان کرد. اما در مراحل پیشرفته، دیفتری میتواند به قلب، کلیهها و سیستم عصبی شما آسیب برساند. حتی با درمان، دیفتری به ویژه در کودکان میتواند کشنده باشد.

علائم ابتلا به کورینه باکتریوم دیفتریا
علائم و نشانههای دیفتری معمولاً دو تا پنج روز پس از عفونت فرد شروع میشود. در برخی از افراد، عفونت با باکتریهای ایجاد کننده دیفتری تنها باعث یک بیماری خفیف میشود یا اصلاً هیچ علامت و نشانه مشخصی ندارد. افرادی که از بیماری خود بی خبر هستند به عنوان ناقل دیفتری شناخته میشوند. آنها ناقل نامیده میشوند زیرا میتوانند عفونت را بدون بیماری خود منتقل کنند. علائم و نشانهها ممکن است شامل موارد زیر باشد:
- غشای ضخیم و خاکستری گلو و لوزههای فرد را میپوشاند.
- گلو درد و گرفتگی صدا
- غدد متورم (بزرگ شدن غدد لنفاوی) در گردن
- مشکل در تنفس عادی یا تنفس سریع
- ترشحات بینی
- تب و لرز
- خستگی
نوع دوم دیفتری میتواند پوست را تحت تأثیر قرار دهد و باعث ایجاد درد، قرمزی و تورم مشابه سایر عفونتهای باکتریایی پوست شود. زخمهای پوشیده از غشای خاکستری نیز ممکن است دیفتری پوست باشد. این بیماری در آب و هوای گرمسیری شایعتر است. ممکن است به ویژه در افرادی که بهداشت ضعیفی دارند و در شرایط شلوغ زندگی میکنند اتفاق بیفتد.

علل و فاکتورهای خطر ایجاد کننده دیفتری
دیفتری توسط باکتری باسیل گرم مثبت کورینه باکتریوم دیفتریا ایجاد میشود. این باکتری معمولاً روی یا در نزدیکی سطح گلو یا پوست تکثیر میشود. کورینه باکتریوم دیفتریا از طریق موارد زیر وارد بدن میشود:
- قطرات هوا وقتی عطسه یا سرفه فرد آلوده که قطرات آلوده را آزاد میکند، افراد نزدیک ممکن است کورینه باکتریوم دیفتریا را استنشاق کنند. دیفتری به راحتی از این طریق به ویژه در شرایط شلوغ پخش میشود.
- وسایل شخصی یا خانگی آلوده. برخی اوقات افراد از دست زدن به وسایل فرد آلوده مانند دستمال کاغذی یا حولههای دست، که ممکن است به باکتری آلوده باشد، دچار دیفتری میشوند.
- افرادی که توسط باکتری دیفتری آلوده شده اند و تحت درمان قرار نگرفته اند میتوانند افرادی را که واکسن دیفتری دریافت نکرده اند، حتی اگر هیچ علائمی از خود نشان ندادند را آلوده کنند.
افرادی که بیشتر در معرض ابتلا به دیفتری هستند عبارتند از:
- کودکان و بزرگسالانی که واکسیناسیون مرتب ندارند.
- افرادی که در شرایط شلوغ یا غیربهداشتی زندگی میکنند.
- هر کسی که به منطقهای سفر میکند که عفونت دیفتری در آن شایعتر است.
دیفتری هنوز در کشورهای در حال توسعه که نرخ واکسیناسیون پایین است شایع است. در مناطقی که واکسیناسیون دیفتری استاندارد است، این بیماری عمدتا تهدیدی برای افرادی است که واکسینه نشده اند و به مسافرتهای بین المللی میپردازند یا با افرادی از کشورهای کمتر توسعه یافته تماس دارند.
پیشگیری و درمان ابتلا به کورینه باکتریوم دیفتریا
قبل از آنتی بیوتیکها، دیفتری یک بیماری شایع در کودکان خردسال بود. امروزه این بیماری نه تنها با واکسن قابل درمان است بلکه قابل پیشگیری است. واکسن دیفتری معمولاً با واکسنهای ضد کزاز و سیاه سرفه (سیاه سرفه) ترکیب میشود. واکسن سه در یک با نام واکسن دیفتری، کزاز و سیاه سرفه شناخته میشود. آخرین نسخه این واکسن با نام واکسن DTaP برای کودکان و واکسن Tdap برای نوجوانان و بزرگسالان شناخته میشود. واکسن دیفتری، کزاز و سیاه سرفه یکی از واکسیناسیونهای دوران کودکی است که پزشکان در دوران نوزادی توصیه میکنند. واکسیناسیون شامل یک سری پنج تزریقی معمولاً در بازو یا ران است که در سنین دوماهگی، چهرماهگی، شش ماهگی، پانزده تا هجده ماهگی و چهار تا شش سالگی به کودکان داده میشود. در برخی از کودکان ممکن است تب خفیف، سرگیجه، خواب آلودگی یا حساسیت را در محل تزریق پس از واکسن DTaP به عنوان عوارض پس از واکسن زدن تجربه کنند.
پس از سری اولیه واکسیناسیون در دوران کودکی، افراد نیاز به تزریق واکسن دیفتری دارند تا در حفظ ایمنی کمک کند به این دلیل که ایمنی در برابر دیفتری با گذشت زمان از بین میرود. کودکانی که قبل از 7 سالگی تمام واکسیناسیونهای توصیه شده را دریافت کرده اند، باید اولین تزریق تقویت کننده خود را در حدود 11 یا 12 سالگی انجام دهند. تزریق تقویت کننده بعدی 10 سال بعد توصیه میشود، سپس در فواصل 10 ساله تکرار میشود. اگر به منطقهای که دیفتری رایج است سفر میکنید، دُز تقویت کننده واکسن بسیار مهم است.
باسیل گرم مثبت لیستریا مونوسیتوژنز
«لیستریا مونوسیتوژنز» (L. monocytogenes) گونهای از باکتریهای بیماریزا است که باعث عفونت لیستریوز میشود. این یک باکتری بی هوازی اختیاری است که میتواند در حضور یا عدم وجود اکسیژن زنده بماند. این باسیل گرم مثبت میتواند درون سلولهای میزبان رشد کرده و تکثیر شود و یکی از خطرناک ترین عوامل بیماریزا است.
20 تا 30 درصد از عفونتهای لیستریوزیس ناشی از غذا در افراد پرخطر ممکن است کشنده باشند. توانایی آن برای رشد در دماهای زیر 0 درجه سانتیگراد اجازه تکثیر در دمای معمولی یخچال را میدهد و توانایی آن را برای فرار از کنترل در غذاهای انسانی بسیار افزایش میدهد. از طریق تاژک در دمای 30 درجه سانتیگراد و کمتر حرکت میکند، اما معمولاً در دمای 37 درجه سانتیگراد نیست.
به دلیل بیماری زایی مکرر، ایجاد کننده مننژیت در نوزادان (به صورت واژینال) است و به مادران باردار اغلب توصیه میشود از پنیرهای نرم مانند بری، کممبرت و فتا که ممکن است آلوده باشند و اجازه رشد لیستریا مونوسیتوژنز را بدهند استفاده نکنند. این سومین علت شایع مننژیت در نوزادان است. لیستریا مونوسیتوژنز میتواند مغز، غشای نخاع یا گردش خون میزبان را از طریق خوردن غذاهای آلوده مانند لبنیات غیر پاستوریزه یا غذاهای خام آلوده کند. این سومین علت شایع مننژیت در نوزادان است. تخمین زده میشود که سالانه 1600 نفر به لیستریوز مبتلا شده و حدود 260 نفر میمیرند.
بررسی آزمایشگاهی لیستریا
آزمون آنتون در شناسایی لیستریا مونوسیتوژنز استفاده میشود. تلقیح کشت به کیسه ملتحمه خرگوش یا خوکچه هندی باعث ایجاد قوز قرنیه شدید در عرض 24 ساعت میشود. گونههای لیستریا در محیطهایی مانند مولر - هینتون آگار رشد میکنند. اگر کشتهای اولیه بر روی آگار حاوی خون گوسفند انجام شود، شناسایی افزایش مییابد، زیرا منطقه کوچک مشخص همولیز را میتوان در اطراف و زیر کلنیها مشاهده کرد. اگر بافت قبل از تلقیح در محیط باکتریولوژیکی چند روز در دمای 4 درجه سانتیگراد نگه داشته شود، میتوان ایزوله سازی را افزایش داد. این ارگانیسم یک بی هوای اختیاری است و کاتالاز مثبت و متحرک است. لیستریا هنگام تخمیر انواع کربوهیدراتها اسید تولید میکند، اما گاز تولید نمیکند. تحرک در دمای اتاق و تولید همولیزین یافتههای اولیهای هستند که به تمایز لیستریا از کورینباکتریوم کمک میکند.
علائم لیستریوز
بسته به فرد و قسمتی از بدن مبتلا، لیستریوز میتواند علائم مختلفی را ایجاد کند. لیستریا میتواند تب و اسهال مشابه سایر میکروبهای منتقله از غذا را ایجاد کند، اما این نوع عفونت لیستریا به ندرت تشخیص داده میشود. علائم در افراد مبتلا به لیستریوز تهاجمی، به این معنی که باکتری به خارج از روده گسترش یافته است، بستگی به باردار بودن فرد دارد.
- زنان باردار: زنان باردار معمولاً فقط تب و سایر علائم شبه آنفولانزا مانند خستگی و دردهای عضلانی را تجربه میکنند. با این حال، عفونت در دوران بارداری میتواند منجر به سقط جنین، مرده زایی، زایمان زودرس یا عفونت تهدید کننده زندگی نوزاد شود.
- افراد غیر از زنان باردار: علائم میتواند شامل سردرد، سفتی گردن، گیجی، از دست دادن تعادل و تشنج علاوه بر تب و دردهای عضلانی باشد.
افراد مبتلا به لیستریوز مهاجم معمولاً علائم را 1 تا 4 هفته پس از خوردن غذای آلوده به لیستریا گزارش میدهند. برخی از افراد علائم را 70 روز پس از قرار گرفتن در معرض یا همان روز مواجهه گزارش کرده اند.
تشخیص و درمان لیستریوز
لیستریوز معمولاً هنگامی تشخیص داده میشود که یک کشت باکتریایی (نوعی آزمایش آزمایشگاهی) لیستریا مونوسیتوژنز را از بافت یا مایع بدن مانند خون، مایع نخاعی یا جفت رشد دهد. هنگامی که مننژیت لیستریک رخ میدهد، مرگ و میر کلی ممکن است به 70، از 50 درصد سپسیس و در عفونتهای حاملگی یا نوزادان به بیش از 80 درصد برسد. در عفونتهای دوران بارداری، مادر معمولاً زنده میماند. گزارش موفقیت آمیز بودن درمان با پنی سیلین یا آمپی سیلین وجود دارد. «تریمتوپریم سولفامتازول» (Trimethoprim - sulfamethoxazole) در بیماران حساس به پنی سیلین مؤثر نشان داده شده است. یک باکتریوفاژ، لیستریا فاژ P100، به عنوان افزودنی غذایی برای کنترل لیستریا مونوسیتوژنز پیشنهاد شده است.
درمانهای باکتریوفاژ توسط چندین شرکت توسعه یافته است. EBI Safety Food و Intralytix هر دو دارای محصولات مناسب برای درمان باکتری هستند. اداره غذا و داروی ایالات متحده (FDA) یک کوکتل از شش باکتریوفاژ از Intralytix و یک محصول فاژ یک نوع از EBI Food Safety طراحی کرد که لیستریا مونوسیتوژنز را از بین میبرد. موارد استفاده به طور بالقوه شامل پاشیدن آن بر روی میوهها و گوشتهای آماده مصرف مانند ژامبون خرد شده و بوقلمون است.
کاربردهای لیستریا مونوسیتوژنز
از آنجا که لیستریا مونوسیتوژنز یک باکتری درون سلولی است، برخی مطالعات از این باکتری به عنوان ناقل برای انتقال ژنها در شرایط آزمایشگاهی استفاده کرده اند. یکی از نمونههای موفقیت آمیز استفاده از لیستریا مونوسیتوژنز در فن آوریهای انتقال in vitro، ارائه ژن درمانی برای موارد فیبروز کیستیک است. لیستریا مونوسیتوژنز به عنوان ایمونوتراپی سرطان برای انواع مختلف سرطان در حال بررسی است. واکسن سرطان لیستریا مونوسیتوژنز، ADXS11-001، به عنوان یک درمان احتمالی برای سرطان دهانه رحم در دست توسعه است.
لاکتوباسیلوس
لاکتوباسیلوس یک جنس از بی هوازیهای گرم مثبت تحمل کننده هوا یا باکتریهای میکروآئروفیلیک، میلهای و بدون اسپور است. گونههای لاکتوباسیلوس جزء مهمی از میکروبیوتای انسان و حیوان را در تعدادی از نقاط بدن مانند سیستم گوارش و دستگاه تناسلی زن تشکیل میدهند. در زنان با اجداد اروپایی، گونههای لاکتوباسیلوس به طور معمول بخش عمدهای از ریزاندامگان واژن هستند.
لاکتوباسیلوس در میکروبیوتای واژن و روده بیوفیلم ایجاد میکند، که به آنها اجازه میدهد در شرایط سخت محیطی باقی بمانند و جمعیت زیادی را حفظ کنند. لاکتوباسیلوس رابطه متقابل با بدن انسان را نشان میدهد، زیرا از میزبان در برابر تهاجم احتمالی عوامل بیماری زا محافظت میکند و به نوبه خود، میزبان منبع مواد مغذی را فراهم میکند.
گونههای این باسیل گرم مثبت از جمله شایع ترین پروبیوتیکهایی هستند که در غذاها مانند ماست یافت میشوند و کاربرد آنها در حفظ رفاه انسان متفاوت است، زیرا میتواند به درمان اسهال، عفونتهای واژن و اختلالات پوستی مانند اگزما کمک کند. Lactobacillaceae تنها خانواده باکتریهای اسید لاکتیک (LAB) هستند که شامل ارگانیسمهای هموفرمانتیو و هتروفرمانتیو میباشند. در Lactobacillaceae، متابولیسم هموفرمانتاتیو یا هتروفرمانتیو با همه گونههای یک جنس مشترک است. جنس لاکتوباسیلوس در حال حاضر دارای 44 گونه است که با میزبان مهره دار یا حشرات سازگار است.
نقش لاکتوباسیلوس در بدن انسان
دستگاه تناسلی زن یکی از محلهای اصلی همزیستی میکروبیوتای انسان است و رابطه بین ترکیب این باکتریها و سلامت انسان مورد توجه است و با تسلط یک گونه تنها با رفاه عمومی و نتایج خوب در بارداری ارتباط دارد. در حدود 70 درصد از زنان، گونه لاکتوباسیلوس غالب است، اگرچه مشخص شده است که بین زنان آمریکایی اروپایی و آفریقایی متفاوت است، اما گروه دوم تمایل به داشتن میکروبیوتای واژن متنوعتر دارد. تفاوتهای مشابهی نیز در مقایسه بین زنان بلژیکی و تانزانیایی مشخص شده است. خانواده این باسیل گرم مثبت پراکسید هیدروژن تولید میکنند که مانع از رشد و شدت بیماری زایی قارچی کاندیدا آلبیکنز در شرایط in vitro و in vivo میشود. مطالعات آزمایشگاهی همچنین نشان داده است که لاکتوباسیلها از طریق تولید اسیدهای آلی و متابولیتهای خاص، بیماری زایی C. albicans را کاهش میدهند.
هم وجود متابولیتها مانند سدیم بوتیرات و هم کاهش pH محیط ناشی از اسیدهای آلی باعث کاهش رشد هیفها در کاندیدا آلبیکنز میشود که بیماری زایی آن را کاهش میدهد. لاکتوباسیلها همچنین با کاهش تشکیل بیوفیلم کاندیدا آلبیکنز، بیماری زایی آن را کاهش میدهند. تشکیل بیوفیلم هم به دلیل رقابت با لاکتوباسیلها و هم ایجاد بیوفیلمهای معیوب که با کاهش رشد هیفا که قبلاً ذکر شد مرتبط است، کاهش مییابد. از سوی دیگر، پس از درمان آنتی بیوتیکی، برخی از گونههای کاندیدا میتوانند رشد مجدد لاکتوباسیلها را در محلهای بدن که در آن زندگی میکنند، مانند دستگاه گوارش سرکوب کنند.
گونههای این باسیل گرم مثبت علاوه بر اثرات آن بر کاندیدا آلبیکنز همچنین با سایر عوامل بیماریزا تعامل دارد. به عنوان مثال، Limosilactobacillus reuteri (قبلاً Lactobacillus reuteri) نمیتواند با استفاده از گلیسرول برای تولید ماده ضد میکروبی به نام روترین، رشد بسیاری از گونههای مختلف باکتریایی را مهار کند. مثال دیگر Ligilactobacillus salivarius (Lactobacillus salivarius سابق) است که از طریق تولید سالیواریسین B، یک باکتریوسین، با بسیاری از عوامل بیماریزا در تعامل است.
نقش لاکتوباسیل ها در سلامت دهان و دندان
برخی از لاکتوباسیلها با مواردی از پوسیدگی دندان (حفره) همراه بوده اند. اسید لاکتیک میتواند باعث خوردگی دندانها شود و تعداد لاکتوباسیلوسها در بزاق سالهاست که به عنوان آزمایش پوسیدگی مورد استفاده قرار میگیرد. لاکتوباسیلها به طور مشخص باعث پیشرفت ضایعات پوسیدگی موجود به ویژه ضایعات پوسیدگی کرونال میشوند. با این حال، این موضوع پیچیده است، زیرا مطالعات اخیر نشان میدهد پروبیوتیکها میتوانند به لاکتوباسیلهای مفید اجازه دهند که محلهایی را روی دندانها قرار دهند و از به وجود آمدن عوامل بیماریزا استرپتوکوکی جلوگیری کرده و باعث پوسیدگی دندان شوند.
تحقیقات علمی لاکتوباسیلها در رابطه با سلامت دهان و دندان یک حوزه جدید است و تنها چند مطالعه و نتیجه منتشر شده است. برخی مطالعات شواهدی از برخی لاکتوباسیلها ارائه کرده اند که میتوانند پروبیوتیک برای سلامت دهان و دندان باشند. برخی از گونهها، اما نه همه، شواهدی را در دفاع از پوسیدگی دندان نشان میدهند. با توجه به این مطالعات، استفاده از چنین پروبیوتیکهایی در آدامسها و پاستیلها مورد استفاده قرار گرفته است. همچنین شواهدی از برخی لاکتوباسیلها وجود دارد که در دفاع از بیماریهای پریودنتال مانند التهاب لثه و پریودنتیت مفید است.
لاکتوباسیلوس ها در پروبیوتیک
باکتریهای تخمیر کننده مانند باکتریهای اسید لاکتیک (LAB) پراکسید هیدروژن تولید میکنند که از خود در برابر سمیت اکسیژن محافظت میکند. تجمع پراکسید هیدروژن در محیط رشد و اثرات متضاد آن بر روی استافیلوکوکوس اورئوس و سودوموناس، توسط محققان نشان داده شده است. از آغاز قرن بیستم، کشتهای LAB به عنوان کشتهای اولیه برای ایجاد غذاهای تخمیر شده استفاده میشدند. الی متچنیکوف در سال 1908 برای کار خود در LAB برنده جایزه نوبل شد. لاکتوباسیلها همراه با سایر پروبیوتیکها در موارد سندرم روده تحریک پذیر (IBS) تجویز میشوند، اگرچه میزان اثربخشی آن هنوز نامشخص است.
پروبیوتیکها به درمان IBS با بازگشت هموستاز هنگامی که میکروبیوتای روده سطوح بالایی از باکتریهای فرصت طلب را تجربه کرده، کمک میکند. علاوه بر این، لاکتوباسیلها میتوانند به عنوان پروبیوتیک در موارد عفونت توسط باکتری هلیکوباکتر پیلوری ایجاد کننده زخم تجویز شوند. هلیکوباکتر پیلوری با سرطان ارتباط دارد و مقاومت آنتی بیوتیکی مانع موفقیت درمانهای ریشه کن فعلی مبتنی بر آنتی بیوتیک میشود. هنگامی که لاکتوباسیلهای پروبیوتیک همراه با درمان به عنوان یک داروی کمکی تجویز میشوند، اثربخشی آن به میزان قابل توجهی افزایش مییابد و عوارض جانبی ممکن است کاهش یابد.
همچنین، گونههای این باسیل گرم مثبت برای کمک به کنترل عفونتهای دستگاه تناسلی و واژن، مانند واژینوز باکتریایی (BV) استفاده میشوند. لاکتوباسیلها باکتریوسینها را برای سرکوب رشد بیماریزا باکتریهای خاص و همچنین اسید لاکتیک و H2O2 (پراکسید هیدروژن) تولید میکنند. اسید لاکتیک pH واژن را به حدود 4/5 یا کمتر کاهش میدهد و بقای سایر باکتریها را با مشکل مواجه میکند و H2O2 میکروبیوتای طبیعی باکتریایی و pH طبیعی واژن را بازسازی میکند.
در کودکان، لاکتوباسیلها مانند Lacticaseibacillus rhamnosus به دلیل سایتوکاینهای ضدالتهابی ترشح شده توسط این باکتری پروبیوتیک، با کاهش اگزمای آتوپیک، که به عنوان درماتیت نیز شناخته میشود، مرتبط هستند. علاوه بر این، لاکتوباسیلها با سایر موجودات پروبیوتیک موجود در شیر رسیده و ماست با افزایش تعداد LgA (+) به تقویت ایمنی در روده مخاطی در انسان کمک میکنند.
لاکتوباسیلوس در تولید غذا
لاکتوباسیلها بیشتر باکتریهای اسید لاکتیک را تخمیر میکنند و به عنوان کشتهای اولیه در صنعت برای تخمیر کنترل شده در تولید شراب، ماست، پنیر، کلم ترش، ترشی، آبجو، کیمچی، کاکائو، کفیر و سایر غذاهای تخمیر شده و همچنین خوراک حیوانات و اصلاح خاک بوکاشی استفاده میشوند. گونههای لاکتوباسیلوس در تخمیر ماست، پنیر و خمیر ترش غالب هستند. فعالیت ضد باکتریایی و ضد قارچی لاکتوباسیلها متکی به تولید باکتریوسینها و ترکیبات با وزن مولکولی کم است که این میکروارگانیسمها را مهار میکند. نان ترش خود به خود، با استفاده از باکتریهای موجود در آرد، یا با استفاده از خمیر مایه، که یک کشت همزیستی مخمر و باکتریهای اسید لاکتیک است که در محیط آب و آرد رشد میکنند، تهیه میشود. اعضای این باسیل گرم مثبت قندها را به اسید لاکتیک تبدیل میکنند، که pH محیط آنها را کاهش میدهد و باعث ایجاد ترشی در ارتباط با ماست، کلم ترش و غیره میشود.
در بسیاری از فرایندهای ترشی سنتی، سبزیجات در آب نمک غوطه ور میشوند و لاکتوباسیلهای مقاوم به نمک از قندهای طبیعی موجود در سبزیجات تغذیه میکنند. مخلوط حاصل از نمک و اسید لاکتیک یک محیط خصمانه برای میکروبهای دیگر مانند قارچها است و بنابراین سبزیجات حفظ میشوند و برای مدت طولانی خوراکی باقی میمانند. لاکتوباسیلها، به ویژه پدیوکوکها و L. brevis، برخی از رایجترین ارگانیسمهای فساد آبجو هستند.

































