مبانی باتری – بخش دوم: اجزای تشکیلدهنده و نحوه عملکرد باتری
در قسمت اول به معرفی تاریخچه اختراع باتری پرداختیم. در ادامه مبحث باتریها، در این پست به اجزای تشکیلدهنده و نحوه عملکرد باتری می پردازیم.

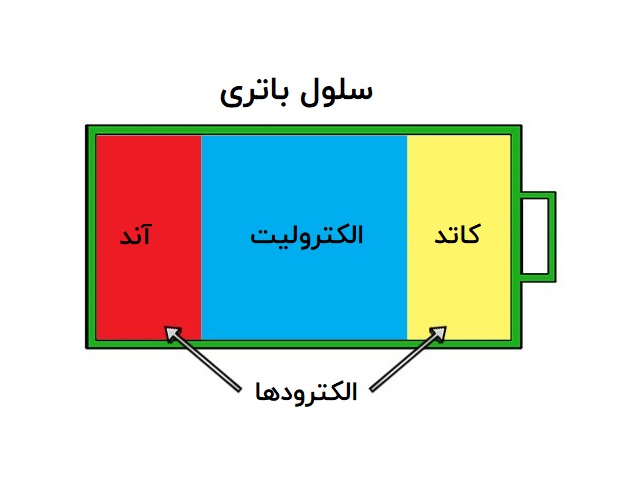
اجزای تشکیلدهنده باتری
باتریها از سه مؤلفه اصلی تشکیل شدهاند: یک آند، یک کاتد و یک الکترولیت. اغلب از یک جداکننده برای جلوگیری از اتصال آند و کاتد استفاده میشود (اگر الکترولیت برای این کار کافی و مناسب نباشد). باتریها، به منظور نگه داشتن این اجزا کنار یکدیگر، از نوعی پوشش استفاده میکنند.

اکثر باتریها به سه بخش تقسیم نمیشوند اما ایده کارکرد آنها بر اساس همین سه بخش است.
آند و کاتد، نوعی از الکترود هستند. الکترودها، رساناهایی هستند که الکتریسیته از طریق آنها وارد یک جز مدار شده و ا از آن خارج میشود.
آند
الکترونها در یک مدار متصل به یک وسیله، از آند خارج میشوند. «جریان» قراردادی به سمت داخل آند است.

در باتریها، آند به عنوان قطب منفی (-) علامتگذاری میشود
در یک باتری، واکنش شیمیایی بین آند و الکترولیت، الکترونها را درون کاتد جمع میکند. این الکترونها تمایل به حرکت به سمت کاتد را دارند اما وجود الکترولیت یا جداکننده، این اجازه را به آنها نمیدهد.
کاتد
الکترونها در یک مدار متصل به یک وسیله، به کاتد وارد میشوند. «جریان» قراردادی به سمت خارج کاتد است.

در باتریها، کاتد به عنوان قطب مثبت (+) علامتگذاری میشود
در باتریها، واکنش شیمیایی در درون با اطراف کاتد از الکترونهای تولیدشده در آند استفاده میکند. تنها راه رسیدن الکترونها به کاتد از طریق مدار خارج از باتری است.
الکترولیت
الکترولیت مادهای به صورت مایع یا ژل است. این ماده، قابلیت انتقال یونها بین واکنشهای رخداده در آند و کاتد را دارد. الکترولیت از جریان الکترون بین آند و کاتد نیز جلوگیری میکند. این کار باعث میشود که الکترونها در مدار خارجی راحتتر جریان داشته باشند (جریان الکترون درون الکترولیت سختتر است).

در صورت گرم شدن بیش از حد باتریهای آلکالین و یا قرارگیری آنها در ولتاژ معکوس، الکترولیت و پتاسیم هیدروکسید آنها نشت میکند
الکترولیت در عملکرد باتری بسیار مهم و حیاتی است. به دلیل عدم عبور الکترونها از درون الکترولیت، آنها مجبور به حرکت از طریق رسانای الکتریکی (مدار) متصل به آند و کاتد میشوند.
جداکننده
جداکنندهها، مواد متخلخلی هستند که از اتصال آند و کاتد (اتصال کوتاه در درون باتری) به یکدیگر جلوگیری میکنند. مادهی سازنده جداکنندهها متفاوت است. پنبه، نایلون، پلیاستر، مقوا و لایههای پلیمر مصنوعی از موادی هستند که در ساخت جداکنندهها استفاده میشوند. جداکنندهها با هیچ یک از اجزای آند، کاتد و یا الکترولیت واکنش نمیدهند.
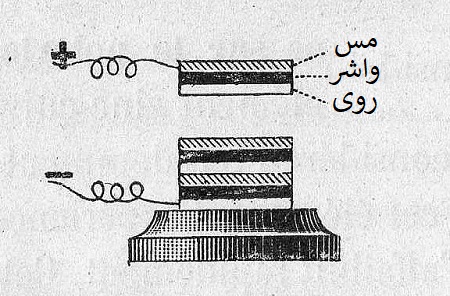
پیل ولتایی برای جدا نگه داشتن الکترودها (آند و کاتد)، از پارچه یا مقوا (جداکننده) خیسانده شده در آبنمک (الکترولیت) استفاده میکرد
یونهای درون الکترولیت میتوانند به صورت بار مثبت و بار منفی شارژ شوند و در اندازههای مختلف وارد شوند. امکان تولید جداکنندههای مخصوص با قابلیت عبور برخی از یونها و جلوگیری از عبور برخی دیگر نیز وجود دارد.
محفظه یا پوشش باتری
بیشتر باتریها نیاز به روشی برای نگه داشتن اجزای مختلفشان کنار یکدیگر دارند. پوششها، تنها ساختارهای مکانیکی با هدف نگه داشتن اجزای داخلی باتری هستند.

یک باطری روی-اسید با پوشش پلاستیکی
پوششهای باتری را میتوان تقریباً با هر چیزی ساخت. پلاستیک، فولاد، کیسههای ورقهای پلیمر نرم و غیره، موادی هستند که در ساخت پوشش باتریها مورداستفاده قرار میگیرند. برخی از باتریها از پوشش فلز رسانای متصل به یکی از الکترودها استفاده میکنند. در باتریهای آلکالین معمولی «AA»، پوشش فلزی به کاتد متصل است.
نحوه عملکرد باتری
باتریها برای عملکرد، معمولاً نیاز به چندین واکنش شیمیایی دارند. حداقل یک واکنش در درون یا اطراف آند و یک یا چند واکنش در درون یا اطراف کاتد رخ میدهد.
در همه موارد، واکنش بخش آند، الکترونهای اضافی تولید میکند (به این واکنش، «اکسیداسیون» گفته میشود) و واکنش بخش کاتد از الکترونهای اضافی استفاده میکند (به این فرآیند «کاهش» گفته میشود).
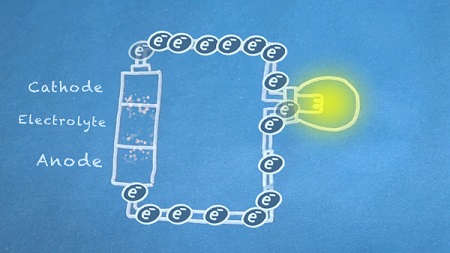
هنگام بسته شدن کلید، مدار کامل میشود، الکترونها از آند به سمت کاتد جریان مییابد. این الکترونها، واکنشهای شیمیایی آند و کاتد را فعال میکنند.
اساساً، نوع خاصی از واکنش شیمیایی (واکنش اکسایش کاهش) به دو بخش مجزا تقسیم میشوند. واکنش اکسایش-کاهش، زمانی اتفاق میافتد که الکترونها بین مواد شیمیایی جابجا میشوند. حرکت الکترونها در درون این واکنش را برای جریان به خارج از باتری و تأمین نیروی مدار قابلکنترل است.
اکسیداسیون آند
اولین بخش واکنش اکسیداسون-کاهش یعنی اکسیداسیون، بین الکترولیت و آند رخ میدهد. این مرحله، باعث تولید الکترون (e-) میشود.
در برخی از واکنشهای اکسیداسیون، مانند اکسیداسیون در باتری لیتیوم-یون، یون تولید میشود. در ترکیبات شیمیایی دیگر، مانند اکسیداسیون در باتری آلکالین، یون مصرف میشود. در هر دو مورد، یونها میتوانند به راحتی از درون الکترولیت عبور کنند (در صورتی که الکترونها نمیتوانند).
کاهش کاتد
بخش دیگر واکنش اکسیداسیون-کاهش، یعنی کاهش، اطراف یا درون کاتد رخ میدهد. الکترونهای تولیدشده توسط واکنش اکسیداسیون، در حین واکنش کاهش مصرف میشوند.
در برخی موارد، مانند باتریهای لتیوم-یون، یونهای مثبت تولیدشده در واکنش اکسیداسیون، در واکنش کاهش مصرف میشوند. در موارد دیگر، مانند باتریهای آلکالین، یونهای منفی، در واکنش کاهش تولید میشوند.
جریان الکترون
در اکثر باتریها، برخی از واکنشها (یا همه واکنشها) حتی در زمان متصل نبودن باتری به مدار نیز رخ میدهند. این واکنشها در عمر مفید باتری تأثیر دارند.
در بیشتر موارد، واکنشها تنها زمانی با نیروی کامل رخ میدهد که مدار هدایت الکتریکی بین آند و کاتد کامل شده باشد. هر چه مقاومت کمتری بین آند و کاتد باشد، الکترونهای بیشتری جریان یافته و واکنشهای شیمیایی با سرعت بیشتری رخ میدهند.

اتصال کوتاه در باتری (حتی به صورت اتفاقی) میتواند خطرناک باشد. باتریهای لیتیوم-یون در هنگام اتصال کوتاه، بیش از حد گرم شده یا حتی دود کرده و آتش میگیرند.
با عبور دادن الکترونها به درون اجزای الکتریکی مختلف (بار الکتریکی یا امپدانس)، کارهای مفید و بهدردبخوری قابل انجام است. در تصویر متحرک اول این بخش، از الکترونهای متحرک برای روشن کردن یک لامپ حبابی استفاده شده است.
باتری مرده (تمامشده)
مواد شیمیایی درون باتریها، در نهایت به وضعیت تعادل خواهند رسید. در این وضعیت، مواد شیمیایی تمایلی به واکنش دادن ندارند. در نتیجه، جریان الکتریکی بیشتری توسط باتری تولید نخواهد شد. در این مرحله، باتری «مرده» یا «تمامشده» در نظر گرفته میشود.
باید باتریهای اولیه را پس از تمام شدن دور انداخت. باتریها ثانویه یا سلولهای ثانویه قابلیت شارژ مجدد دارند. شارژ این باتریها، با معکوس کردن جریان الکتریکی درون باتری صورت میگیرد. شارژ مجدد زمانی اتفاق میافتد که مواد شیمیایی مجموعهای دیگر از واکنشها را برای برگرداندن باتری به وضعیت اصلی انجام میدهند. در بخش سوم و نهایی پست «معرفی باتری»، به توضیح اصطلاحات رایج مرتبط با این منبع انرژی قابلحمل و کاربردهای آن می پردازیم.
مطالب مرتبط:
مبانی باتری --- بخش اول (تاریخچه اختراع باتری)
مبانی باتری --- بخش سوم (اصطلاحات رایج و موارد استفاده باتری)












