یکای جرم اتمی (amu) — به زبان ساده
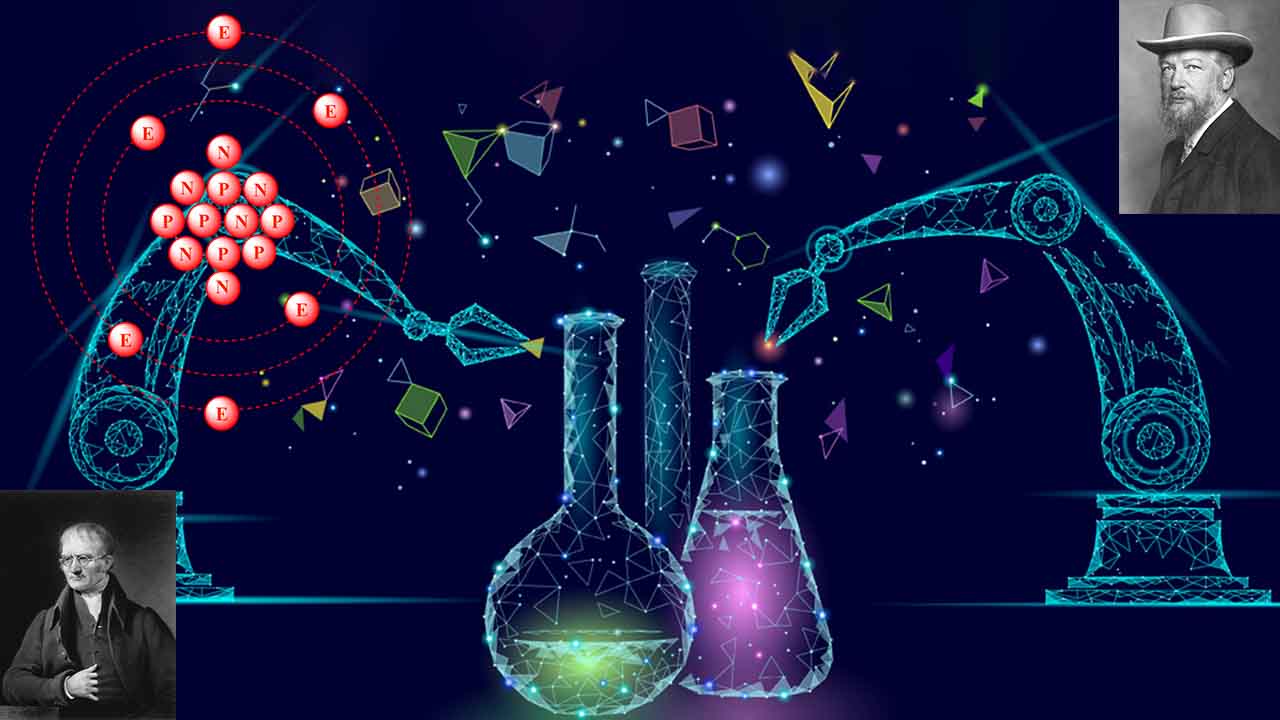
در شیمی، یکای جرم اتمی (amu)، ثابتی فیزیکی و برابر با ۱/۱۲ جرم اتم کربن ۱۲ است. از واحد جرم اتمی به منظور توصیف جرمهای اتمی و مولکولی استفاده میشود. زمانی که جرمها را بر اساس یکای جرم اتمی ذکر کنیم، به مجموع تعداد پروتونها و نوترونها در هسته اتم اشاره داریم. در این شمارش، جرم الکترونها آنقدر ناچیز است که میتوان از آن صرف نظر کرد. نماد این اتم را «u» و «Da» در نظر گرفتهاند که نماد دوم موسوم به «دالتون» (Dalton) است.
مقدمه
اتمهای منفرد، جرم بسیار کمی دارند. به کمک دستگاههای جدیدی همچون طیفسنج جرمی، امکان اندازهگیری چنین جرمهایی را داریم. به طور مثال، یک اتم اکسیژن ۱۶، جرمی برابر با $$2.66 \times 10^{-23}$$ گرم دارد. همانطور که میبینید، با وجود اینکه دستگاههای جدید، توانایی اندازهگیری چنین جرمهای کمی را دارند اما نیاز به واحدهای بهتری (به غیر از گرم) داریم تا بتوانیم این جرمها را سادهتر بیان کنیم.
از اینرو، دانشمندان تصمیم گرفتند که از هسته اتم کربن ۱۲ به عنوان مرجعی استاندارد برای این کار استفاده و از این طریق، امکان مقایسه جرم اتمها با یکدیگر را فراهم کنند. طبق تعریف، یک اتم از کربن ۱۲، جرمی معادل با ۱۲ یکای جرم اتمی یعنی $$12 amu$$ دارد.
تعریف یکای جرم اتمی
با توجه به موارد ذکر شده در بالا، یکای جرم اتمی به صورت جرمی معادل ۱/۱۲ جرم یک اتم کربن ۱۲ تعریف میشود. جرم هر ایزوتوپ از هر عنصر را نیز نسبت به جرم اتم کربن ۱۲ توصیف میکنند. به طور مثال، یک اتم هلیوم ۴، جرمی برابر با $$4.0026 amu$$ دارد. جرم گوگرد ۳۲ نیز برابر با $$31.972 \ amu$$ خواهد بود.
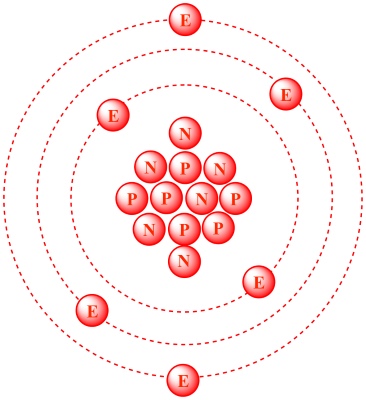
اتم کربن ۱۲، دارای ۶ پروتون و ۶ نوترون در هسته خود است. از آنجایی که هسته اتم، به طور تقریبی کل جرم اتم را تشکیل میدهد، یک پروتون یا یک نوترون به تنهایی، دارای جرمی برابر $$1 amu$$ خواهد بود. با این وجود، همانطور که در خصوص هلیوم و گوگرد دیدیم، جرم اتمها، اعداد صحیحی را تشکیل نمیدهند زیرا جرم یک اتم، به میزان بسیار کمی متاثر از برهمکنشهای ذرات با هسته است و این تاثیر را میتوان حاصل جرم کم الکترونها نیز به شمار آورد.
تاریخچه یکای جرم اتمی
در سال ۱۸۰۳، این جان دالتون بود که روشی برای توصیف جرم اتمی به صورت نسبی ارائه داد. او برای این کار از هیدروژن ۱ (پروتیوم) استفاده کرد. «ویلهلم اوستوالد» (Wilhelm Ostwald) پیشنهاد داد که اگر به جای هیدروژن، از ۱/۱۶ جرم اکسیژن استفاده کنیم، نتایج بهتری بدست میآوریم. با کشف و تعریف ایزوتوپ در سال 1912 و همچنین، شناسایی ایزوتوپهای اکسیژن در سال ۱۹۲۹، تعریف پیشنهادی استوالد دچار چالش شد زیرا برخی از دانشمندان، یکای جرم اتمی را بر اساس ایزوتوپ اکسیژن ۱۶ بکار میگرفتند و برخی دیگر، فراوانی طبیعی اکسیژن را مد نظر قرار میدادند.
بنابراین، در سال 1961، تصمیم بر آن شد که از اتم کربن ۱۲ به عنوان اساس واحد جرم اتمی استفاده شود. برای واحد جدید، نماد «u» را در نظر گرفتند تا جایگزین amu شود. علاوه بر این، برخی از دانشمندان نیز برای یکای جرم اتمی نام «دالتون» (Dalton) را در نظر گرفتند. با این وجود، بهرهگیری از نمادهای «u» و «Da» به طور جهانی مورد قبول قرار نگرفت. بسیاری از دانشمندان از amu استفاده کردند با این تفاوت که آنرا به جای اکسیژن ۱۶، بر اساس کربن ۱۲ مورد استفاده قرار دادند. در حال حاضر، مقادیری که با «u»، «amu»، «AMU» و «Da» بیان میشوند، همگی به یک عدد اشاره دارند.

تفاوت جرم اتمی و عدد جرمی
به طور معمول، زمانیکه دانش آموزان و دانشجویان به یادگیری عناصر و جدول تناوبی و مطالب مرتبط با آن میپردازند، وجود واحدهای مختلف برای جرم ممکن است قدری گمراه کننده باشد. در ادامه مطلب قصد داریم به تفاوت جرم اتمی و عدد جرمی بپردازیم چراکه بین عبارات «جرم اتمی» (Atomic Mass) و «عدد جرمی» (Mass Number) تفاوتهایی وجود دارد.
جرم اتمی به میانگین وزنی جرم یک اتم از یک عنصر بر اساس فراوانی نسبی ایزوتوپهای طبیعی آن عنصر میگویند. عدد جرمی اما به تعداد کل پروتونها و نوترونها در هسته یک اتم اطلاق میشود.
مثال جرم اتمی و عدد جرمی
عنصر هیدروژن، ۳ ایزوتوپ طبیعی به صورت $$^1 H $$ و $$^2 H $$ و $$^3 H $$ دارد و برای هر ایزوتوپ نیز عدد جرمی متفاوتی ذکر میشود. $$^1 H $$ شامل ۱ پروتون و عدد جرمی آن برابر با ۱ است. به همین ترتیب، $$^2 H $$، یک پروتون و یک نوترون دارد و عدد جرمی برابر با ۲ خواهد داشت. $$^3 H $$، یک پروتون و ۲ نوترون دارد که عدد جرمی برابر ۳ برای آن ذکر میشود. خوب است بدانید ۹۹/۹۸ درصد از هیدروژن اطراف ما به صورت $$^1 H $$ وجود دارد. با ترکیب این ۳ ایزوتوپ، به جرم اتمی هیدروژن، برابر با $$1.00784 \ g/mol$$ میرسیم.

تفاوت عدد اتمی و عدد جرمی
مشکل دیگری که برخی از دانشآموزان با آن روبرو هستند، درک مفاهیم عدد اتمی و عدد جرمی است. در بسیاری از موارد، عدد اتمی با عدد جرمی اشتباه گرفته میشود. عدد جرمی، مجموع پروتونها و نوترونها در یک اتم است درحالیکه عدد اتمی، تنها تعداد پروتونها را مشخص میکند. عدد اتمی را همواره در جدول تناوبی در کنار نام عنصر یافت میکنید زیرا به کمک این عدد، محل آن در جدول مشخص میشود.
عدد اتمی و عدد جرمی، تنها زمانی با یکدیگر برابر هستند که مشغول بررسی ایزوتوپ پروتیم از هیدروژن باشیم زیرا این ایزوتوپ، تنها شامل یک پروتون است. هنگامی که اتمها را به طور کلی بررسی میکنید به یاد داشته باشید که عدد اتمی هیچگاه تغییر نمیکند اما با توجه به اینکه ایزوتوپهای مختلفی داریم، عدد جرمی متفاوتی نیز خواهیم داشت.











سلام. یه سوال داشتم. ایا این جمله درسته؟… اتمی وجود نداره که جرم اتمی اش از 1amu کمتر باشه.
سلام
ممنون از توضیحات منظم حضرت عالی
سوال: کربن ۶ به تعداد ۶ پروتون و ۶ نوترون دارد (عدد جرمی برابر ۱۲ است)و ۱واحد amu معادل ۱/۱۲ کربن ۱۲ است پس چرا جرم ۱واحد amu کمی کمتر جرم یک نوترون و حتی کمی کمتر از جرم یک پروتون است؟
سلام و روز شما بهخیر؛
۱ واحد amu درواقع ۱/۱۲ اتم کربن است. همانطور که میدانید در هسته اتم پروتونها و نوترونها با نیروی زیادی در کنار یکدیگر قرار میگیرند که باعث آزاد شدن مقداری انرژی میشود. در اینصورت جرم ۱ واحد amu از جرم یک پروتون و یک نوترون بهصورت مستقل کمی کمتر است. درواقع جرم پروتون و نوترون به میزان بسیار کمی از ۱ واحد amu بیشتر است.
خوشحالیم که با مجله فرادرس همراه هستید.
سلام ممنون بابت مطالب خوبتون
میشه درمورد عدد آووگادرو و طریقه بدست اومدنش هم توضیحی بدید؟
با سلام؛
برای پاسخ به این سؤال پیشنهاد میکنیم مطلب «عدد آووگادرو — به زبان ساده» را مطالعه کنید.
با تشکر از همراهی شما با مجله فرادرس
سلام ممنون خیلی خوب بود . فقط یه سوال، چجوری نسبت به ایزوتوپ کربن 12 میان amu را حساب میکنن؟ مثلا برای هلیوم چجوری فهمیدن میشه 4.0026؟؟؟ممنون
باسلام.
ببخید ی سوال دارم .چرا نسبت جرم اتمی ۱/۱۲کربن است چرا مثلا ۱/۱۴نشده؟ممنون میشم جوابمو بدید
با سلام؛
این موضوع در مقدمه توضیح داده شده است.
با تشکر
با سلام؛
از شما بابت مطالعه این مطلب سپاسگزاریم. به طور کلی $$1 amu=1.66956\times 10^{-24}$$ و از طرفی جرم اتم هلیوم برابر با $$6.641\times 10^{-24} g$$ است. بنابراین برای اینکه جرم اتم هلیم را بر حسب amu محاسبه کنیم طبق قانون استوکیومتری یا یک تناسب ساده باید جرم اتم هلیوم (بر حسب گرم) بر مقدار ۱ amu تقسیم کنیم. با تقسیم این دو عدد پاسخ به صورت تقریبی برابر ۴ خواهد بود که amu واحد آن است. یعنی جرم اتم هلیوم برابر ۴ amu است.
با تشکر
لطفا جواب بدید سوالمو
هیدروژن چند پیوند اشتراکی انجام میده
سلام ببخشید میشه بگید چطوری فهمیدند جرم ۲۰۰۰ الکترون برابره با یک amu ؟
و چطوری جرم ذرات زیر اتمی رو بر حسب amu حساب میکنن؟
با سلام؛
برای پاسخ به این سوال پیشنهاد میکنیم مطلب «پیوند کووالانسی — به زبان ساده» را مطالعه کنید.
با تشکر
خیلی خوب و کامل بود ممنون
سلام. این مطلب خیلی به من کمک کرد. واقعاً سپاسگزارم
ببخشید چرا گفتن یک دوازدهم کربن دوازده چرا نگفتن یک بیست و چهارم یا هر عدد دیگه ای؟
سلام وقت بخیر
ایا جایی برای مطرح کردن سوال شیمی هم وجود داره
با سلام؛
از شما بابت مطالعه این مطلب سپاسگزاریم. همانطور که در بخش تاریخچه یکای اتمی هم ذکر شده، از اتمهای دیگری نیز به همین منظور استفاده شده است اما با توجه به فراوانی کربن و اینکه در بیش از ۹۰ درصد موارد، با تعداد پروتون و نوترون وجود دارد، از این اتم به همین منظور استفاده کردهاند.
با تشکر
سلام. خسته نباشید. واقعا متن عالی بود. ممنون.
سلام وقت بخیر
ایا جایی برای مطرح کردن سوال شیمی هم وجود داره