پیوند داتیو — به زبان ساده
یک پیوند داتیو (پیوند کووالانسی داتیو)، نوعی پیوند کووالانسی به شمار میآید که در آن، هر دو الکترون از یک اتم به اشتراک گذاشته میشوند. در پیوند کووالانسی، پیوند بین دو اتم با اشتراکگذاری الکترونها بوجود میآید اما پیوند داتیو به پیوند کووالانسی بین دو اتمی میگویند که اشتراکگذاری الکترونها توسط یک اتم انجام بگیرد. به پیوند داتیو، پیوند دوقطبی نیز میگویند. در ادامه این مطلب، با بررسی واکنشهای مختلف، مثالهایی از پیوند داتیو ارائه میکنیم.
تعریف پیوند داتیو
پیوند داتیو که به آن، پیوند کووالانسی کوئوردینانسی نیز میگویند، نوعی پیوند شیمیایی محسوب میشود که یکی از اتمها برای تشکیل پیوند، جفتالکترون ناپیوندی خود را به اشتراک بگذارد. در حقیقت، در پیوند داتیو تنها یک اتم، الکترونهای خود را در پیوند شرکت میدهد و اتم دیگر، الکترونی را برای اشتراک فراهم نمیکند. به اتمی که الکترون را فراهم میکند، «دهنده» (Donor) و به اتم دیگر، «پذیرنده» (Acceptor) میگویند.
واکنش بین آمونیاک و هیدروژن کلرید
گازهای آمونیاک و هیدروژن کلرید، هردو گازهایی بیرنگ هستند که در اثر واکنش این دو گاز، دودهای جامد و سفیدرنگ به نام آمونیوم کلرید تشکیل میشود. واکنش این گازها در زیر آورده شده است:
$${N H 3 (g) + H C l (g) \rightarrow N H 4 Cl (s)}$$
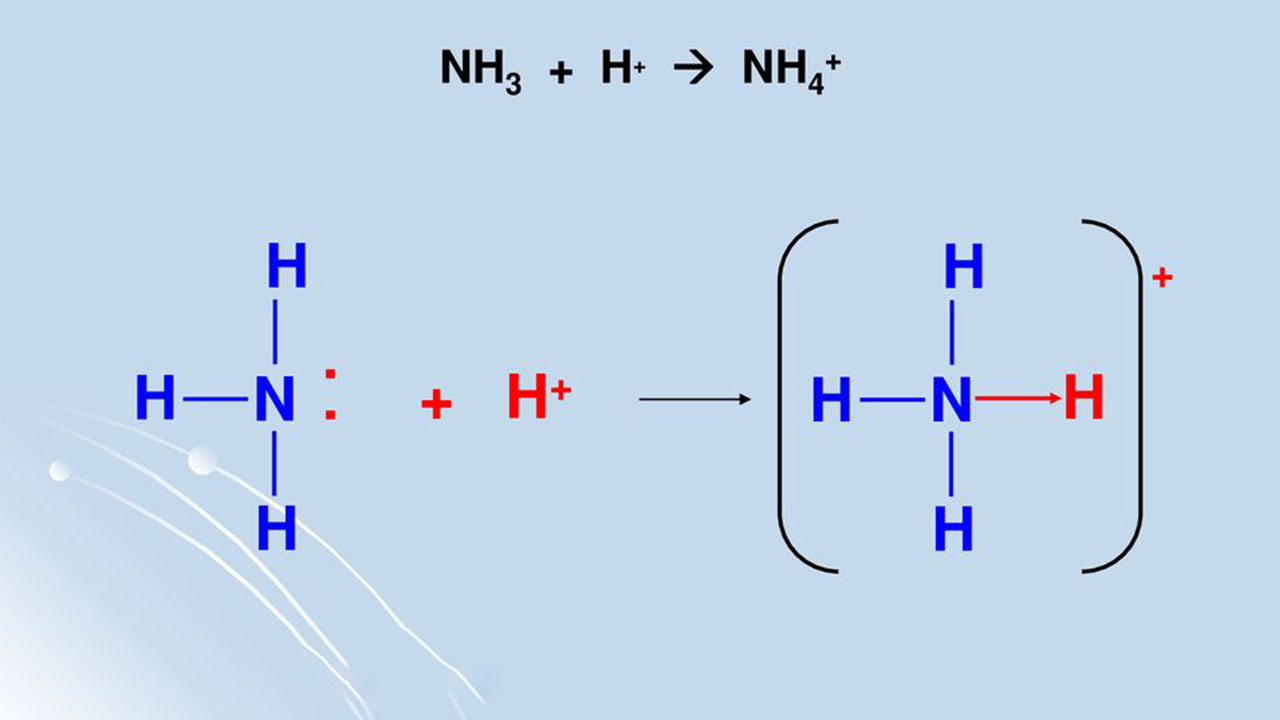
با انتقال یون هیدروژن (پروتون) از مولکول هیدروژن کلرید به طرف جفتالکترون ناپیوندی در مولکول آمونیاک، یون آمونیوم $$(N H _ 4 ^ +)$$ تشکیل میشود.
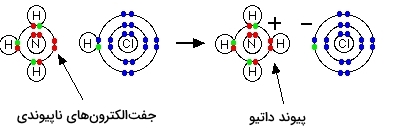
زمانی که یون آمونیوم تشکیل شود، هیدروژن چهارم به کمک یک پیوند داتیو کووالانسی متصل میشود چراکه تنها، هسته هیدروژن از کلر به نیتروژن منتقل شده است. زمانیکه یون آمونیوم تشکیل شد، نمیتوان پیوند داتیو تشکیل شده را با پیوند کووالانسی معمولی از یکدیگر تشخیص داد. با وجود اینکه الکترونها را به شکل متفاوتی در دیاگرام یون نشان میدهند اما در واقعیت، تفاوتی بین این پیوندها وجود ندارد.
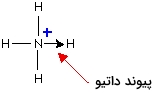
در یک دیاگرام ساده، پیوند داتیو را با یک فلش (پیکان) نشان میدهند. جهت این فلش از سمت اتمِ دهنده جفتالکترون به طرف اتم پذیرنده است.
مثال انحلال گاز HCl در آب برای تولید هیدروکلریک اسید
در این فرآیند، واکنشی مشابه قبل روی میدهد. یک یون هیدروژن $$(H ^ +)$$ از کلر به طرف یکی از جفتالکترونهای ناپیوندی اتم اکسیژن حرکت میکند که واکنش آنرا در تصویر زیر مشاهده میکنید.
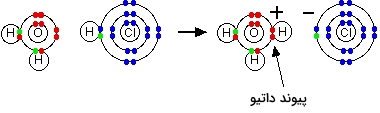
$$H _ 2 O + H C l \rightarrow H _ 3 O ^+ + C l^- $$
به یون $$H _ 3 O ^ +$$ به طور معمول، یون هیدرونیوم میگویند. در متون پایه شیمی، خاصه در اسیدها، زمانیکه در رابطه با یونهای هیدروژن صحبت میکنیم، به یون هیدرونیوم اشاره داریم. اگر یون هیدروژن را به صورت $$H_ 3 O ^ + (aq)$$ بنویسیم، نماد (aq) به مولکولِ آبی اشاره دارد که یون هیدروژن به آن متصل شده است.
وقتی این یون با مادهای همچون یک باز واکنش دهد، یون هیدروژن، دوباره از مولکول آب جدا خواهد شد. البته بعد از تشکیل پیوند داتیو باید این نکته را در نظر داشت که تمامی هیدروژنهای متصل به اکسیژن، کاملا با یکدیگر معادل هستند و به هنگام شکست پیوند بین یون هیدروژن، این شکست میتواند در هر یک از اتمها صورت بگیرد.
واکنش بین آمونیاک و بور تری فلوئورید
بور تریفلوئورید با فرمول $$B F _ 3$$، ترکیبی است که در اطراف اتم بور، ساختار گاز نجیب دیده نمیشود. اتم بور، تنها یک جفتالکترون در سطوح پیوندی خود دارد. $$B F _ 3$$ را به عنوان مولکولی فقیر از الکترون میشناسند و برای غلبه بر این کمبود الکترون، از جفتالکترون ناپیوندی نیتروژن در مولکول آمونیاک کمک میگیرند. پیوند حاصل نیز از نوع پیوند داتیو خواهد بود.
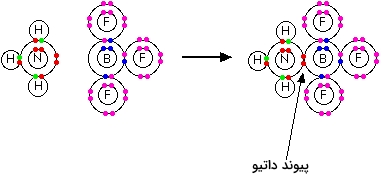
برای سادهتر نشان دادن این نوع پیوند نیز همانطور که گفته شد، میتوان از فلشها یا علائم مثبت و منفی همچون تصویر زیر استفاده کرد.

در تصویر سمت راست، شکل دیگری از نمایش پیوند داتیو را مشاهده میکنید. با توجه به این که جفتالکترون از نیتروژن به طرف بور حرکت کرده، بار روی اتم نیتروژن مثبت و بار روی اتم بور، منفی شده است. البته استفاده از فلش، راه سادهتری برای نمایش پیوند داتیو خواهد بود.
ساختار آلومینیوم کلرید در پیوند داتیو
آلومینیوم کلرید در دمای 180 درجه سانتیگراد، تصعید میشود. اگر این ماده، شامل یون بود، به دلیل جاذبه بالای بین یونهای مثبت و منفی، نقطه ذوب و جوش بسیار بالایی داشت. به همین دلیل، هنگامی که تصعید با دمایی پایین داشته باشیم، نوع پیوند باید از نوع کووالانسی باشد. در تصویر زیر، الکترونهای لایه ظرفیت به کمک نقطههای رنگی مشخص شدهاند.
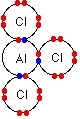
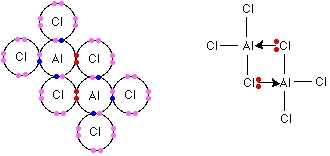
آلومینیوم کلرید $$(Al Cl _3)$$ نیز همچون $$B F _3$$، فقیر از الکترون است. با توجه به اینکه آلومینیوم و بور، هر دو در یک گروه از جدول تناوبی قرار دارند، انتظار میرود که پیوند این دو ترکیب نیز همانند یکدیگر باشند.
اندازهگیریهای «جرم فرمولی نسبی» (Relative Formula Mass) آلومینیوم کلرید که فرمول آن به هنگام تصعید به صورت $$Al Cl _ 3$$ نیست و به صورت یک دیمر (دو مولکول در کنار یکدیگر) وجود دارد. پیوند بین این دو مولکول از نوع پیوند داتیو ذکر میشود که در آن از جفتالکترونهای ناپیوندی اتم کلر استفاده شده است. در اثر برهمکنش دو مولکولی و تشکیل دو پیوند داتیو، انرژی آزاد میشود. بنابراین، دیمر حاصل، به لحاظ انرژی، پایداری بیشتری نسبت به هریک از مولکولهای $$Al Cl _ 3$$ دارد.
پیوند بین یونهای فلزی آبدار (هیدراته)
مولکولهای آب به شدت به یونهای موجود در محلول، جذب میشوند و در اطراف آنها، خوشههایی را تشکیل میدهند. در بیشتر مواقع، بویژه در تمامی یونهای مثبت فلزی، این جاذبهها به قدری قوی هستند که سبب ایجاد پیوند میشوند. به یونهایی که مولکول آب به آنها متصل شده است، یونهای آبدار (هیدراته) میگویند.
با وجود اینکه آلومینیوم کلرید، یک ترکیب کووالانسی به شمار میآید، با حل شدن در آب، یونهایی را به تولید میرساند. در این شرایط، شش مولکول آب با آلومینیوم برای تولید یونی با فرمول $$\mathrm {A l } \left (\mathrm {H}_{2} \mathrm {O} \right)_ {6}^{3+}$$ پیوند تشکیل میدهند. این نوع از پیوند نیز نوعی پیوند داتیو به شمار میآید که در آن از جفتالکترونهای ناپیوندی مولکولهای آب استفاده شده است.
آرایش الکترونی آلومینیوم به صورت زیر است:
$$\begin {equation}1 s ^{2} 2 s ^{2} 2 p ^{6} 3 s ^{2} 3 p _ {}^ {1} \end {equation}$$
با تشکیل یون $$Al ^ {3+}$$ و از دست دادن ۳ الکترون، آرایش الکترونی یون آلومینیوم به صورت زیر خواهد بود:
$$\begin {equation}1 s ^{2} 2 s ^{2} 2 p ^{6} \end {equation}$$
این امر بدان معنی است که در این یون، اوربیتالهای $$3s$$، سه اوربیتال $$3p$$ و دو اوربیتال $$3d$$، خالی هستند که در اثر هیبرید شدن (هیبریداسیون)، شش اوربیتال جدید با انرژیهای یکسان به تولید میرسند.
ممکن است این سوال برای شما پیش بیاید که چرا شش اوربیتال انتخاب شدهاند به طور مثال، ۴ یا ۸ اوربیتال نداریم. برای پاسخ به این سوال باید بگوییم عدد ۶، بیشترین تعداد مولکول آبی است که میتواند در اطراف یون آلومینیوم قرار بگیرد. با تشکیل بیشترین تعداد پیوند ممکن و آزاد شدن انرژی، آلومینیوم به پایدارترین حالت خود میرسد.
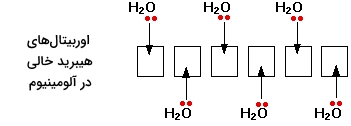
در تصویر بالا، تنها یک جفتالکترون ناپیوندی در هر مولکول آب، نشان داده شده است. سایر جفتالکترونهای ناپیوندی، در خلاف جهت نشان داده شده قرار دارند و بنابراین، در پیوند شرکت نمیکنند. یون حاصل، شکلی همچون تصویر زیر خواهد داشت:
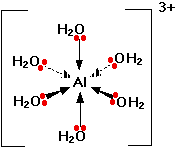
به دلیل حرکت الکترونها به طرف مرکز یون، بار $$3+$$، دیگر به تنهایی بر روی اتم آلومینیم قرار ندارد بلکه بر روی کل یون، پخش شده است. از آنجایی که آلومینیوم در ترکیب بالا، ۶ پیوند ایجاد میکند، «عدد کوردیناسیون» (Coordination Number) در آلومینیوم برابر با ۶ خواهد بود. به عبارت دیگر، تعداد پیوند داتیو تشکیل شده توسط یون فلزی مرکزی، عدد کوردیناسیون میگویند.
مثالهایی از پیوند داتیو
در ادامه، پیوندها در مولکولهای مونو اکسید کربن و نیتریک اسید را محاسبه میکنیم.
مونو اکسید کربن
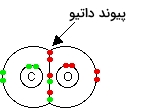
پیوندها در مونو اکسید کربن $$CO$$ را میتوان به صورت دو پیوند کووالانسی بین کربن و اکسیژن بعلاوه یک پیوند داتیو به کمک جفتالکترون ناپیوندی در اکسیژن توصیف کرد.
نیتریک اسید
در نیتریک اسید $$(HNO_3)$$، یکی از اتمهای اکسیژن توسط پیوند داتیو و با استفاده از جفتالکترون ناپیوندی در اتم نیتروژن، به آن متصل شده است.
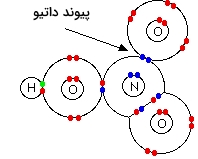
در حقیقت، ساختار تصویر بالا کمی گمراه کننده است زیرا اینطور نشان میدهد که دو اتم اکسیژن در سمت راست دیاگرام، با شکلهای مختلفی به نیتروژن متصل شدهاند. طول پیوند و قدرت هریک، با دیگری برابر است و بنابراین، آرایش الکترونی در هر دو نیز باید یکسان باشد.
جمعبندی
در این آموزش به بررسی پیوند داتیو یا پیوند کوردینانسی (کوئوردیناسی) پرداختیم. این پیوند از جمله پیوندهای کووالانسی به شمار میآید با این تفاوت که اشتراکگذاری الکترونها، تنها توسط یک اتم صورت میگیرد. دیدیم که برای نمایش این نوع از پیوند، از یک فلش (پیکان) استفاده میکنند. پیوند داتیو را در بین ترکیبات مختلف از جمله واکنش بین آمونیک و هیدروژن کلرید، آمونیاک و $$BF_3$$ و پیوندهای بین یونهای فلزی هیدراته بررسی کردیم. در پایان نیز، پیوندهای داتیو در $$CO$$ و $$HNO_3$$ را بررسی کردیم.











سلام
ممنون از توضیحات شما ، فقط یک سوال دارم :
چه زمانی پیوند داتیو شکل می گیرد و نشانه تشخیص آن چیست ؟
با سلام؛
به طور معمول برای تشکیل پیوند داتیو، ابتدا باید یکی از دو اتم حداقل یک جفت الکترون جفتنشده داشته باشد. پیوندهای داتیو به طور معمول (نه همیشه) زمانی تشکیل میشوندکه یونهای فلزی با لیگاند پیوند تشکیل دهند.
با تشکر از همراهی شما با مجله فرادرس
خیلی خیلی ممنون. دستتون درد نکنه
سلام
ممنون
اگه میشه برای این قسمت یه فیلم آموزشی بسازید
عالی بود
من هیچی از پیوند داتیو نمی دونستم، صرفا چون CO رو تو شیمی دبیرستان داربم خواستم ببینم ساختار لوویسش چجوری میشه
با این مقاله کاملا متوجه شدم
ممنون از نگارنده