واکنش جانشینی دوگانه چیست؟ — به زبان ساده

در زمانهای قدیم یکی از روشهای مرسوم تجارت، مبادله کالا به کالا بود که در این روش دو کالا با هم تعویض میشدند. این روش در علم شیمی به «واکنش جانشینی دوگانه» (Double Replacement Reaction) شباهت بسیاری دارد زیرا در این واکنش شیمیایی، یونها با هم تعویض میشوند و محصول جدیدی را بوجود میآورند. واکنش جانشینی دوگانه نوعی از «واکنش جابجایی» (Metathesis Reaction) به شمار میرود و به همین خاطر نام دیگر آن واکنش جابجایی دوگانه است. در این مطلب یاد میگیرید واکنش جانشینی دوگانه چیست و با ذکر مثالهایی از آن با این نوع واکنش بیشتر آشنا میشوید.
واکنش جانشینی دوگانه چیست ؟
زمانیکه دو ترکیب یونی محلول در آب با هم وارد واکنش میشوند تبادل یا تعویض یونی رخ میدهد و ترکیبات جدیدی را به وجود میآورند. به این واکنش «واکنش جانشینی دوگانه» میگویند. ممکن است که عدهای تصور کنند جای یونهای مثبت و منفی با یکدیگر جابهجا میشوند در حالیکه کاملا این تصور اشتباه است. زیرا در این صورت فراوردهها همان ترکیبات اولیه خواهند بود. بنابراین در این واکنش، تبادل یونهای مثبت (کاتیونها) با هم یا تبادل یونهای منفی (آنیونها) نیز با هم صورت میگیرد. واکنش زیر مربوط به الگوی کلی یک واکنش جانشینی دوگانه است.
-A+ B- + C+ D- → A+ D- + C+B
معمولا در محلولها واکنش جانشینی دوگانه رخ میدهد که در بیشتر مواقع حلال، آب است. در این واکنش شیمیایی، واکنشدهندهها و فرآوردهها معمولا ترکیبات یونی هستند. البته این بدان معنا نیست که ترکیبات دیگر نمیتوانند در این واکنش شرکت کنند. به عنوان مثال اسیدها و بازها ازجمله مواد شیمیایی هستند که میتوانند در واکنش جابجایی دوگانه شرکت داشته باشند.
واکنش جابجایی دوگانه
همانطور که اشاره کردیم واکنش جابجایی دوگانه نام دیگر واکنش جانشینی دوگانه است که ترکیباتی با پیوندهای یونی یا گاهی کووالانسی با هم ترکیب میشوند. در اثر این ترکیب، یونها با هم جابجا و محصولات یا همان فراوردههای جدیدی تولید میشوند. توجه داشته باشید که در واکنش جابجایی دوگانه معمولا نوع پیوند شیمیایی در فرآوردهها تغییر نمیکند. به این معنا که پیوند بین فرآوردهها همان پیوند شیمیایی بین واکنشدهندهها خواهد بود.
نحوه تشخیص واکنش جانشینی دوگانه چیست ؟
برای اینکه بدانید راه تشخیص واکنش جانشینی دوگانه چیست باید به خوبی به واکنشدهندهها و فراوردهها و همچنین حالت فیزیکی آنها دقت کنید. زیرا با توجه به این نکات میتوانید از جابجایی یا عدم جابجایی یونها با هم وتشکیل یا عدم تشکیل ترکیب جدید اطمینان حاصل کنید. به عنوان مثال اگر در یک واکنش شیمیایی مشاهده کردید که واکنشدهندهها در حالت محلول بودند و یکی از فراوردهها در حالت جامد بود شک نکنید که این واکنش نمونهای از واکنش جابجایی دوگانه است. زیرا در واکنش جابجایی دوگانه اغلب رسوبات جامد تشکیل میشوند.
آزمایش واکنش جانشینی دوگانه
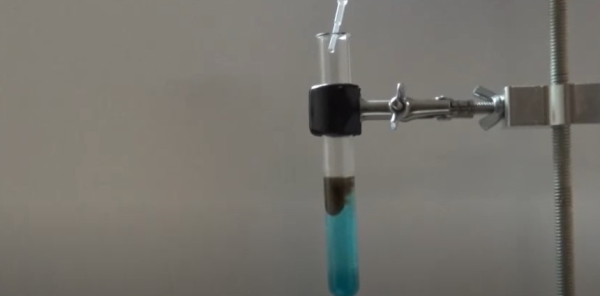
برای اینکه مفهوم واکنش جانشینی دوگانه را بهتر درک کنید در این قسمت یک آزمایش را به صورت تئوری شرح می دهیم که میتوانید آن را در آزمایشگاه مدرسه یا دانشگاه زیر نظر مسئول آزمایشگاه انجام دهید. مواد اولیه این آزمایش، سولفات مس ($$CuSO_4$$) و سدیم سولفید ($$Na_2S$$) هستند. در ابتدا برای ساختن محلول سولفات مس، ۰/۵ گرم از آن را با ترازو وزن و در ۵ سیسی آب حل میکنیم تا یک محلول با رنگ آبی روشن بدست آید.
سپس محلول ۰/۱ مولار سدیم سولفید را نیز جداگانه میسازیم و بعد از آمادهسازی این محلول چند قطره از آن را به آرامی به محلول فوق مانند تصویر زیر اضافه میکنیم. در پایان شاهد یک رسوب سیاهرنگ خواهیم بود که این رسوب همان مس (II) سولفید است.
واکنش زیر مربوط به واکنش جانشینی دوگانه آزمایش فوق است.
$$CuSO_4 (aq) + Na_2S(aq)\rightarrow CuS(s)+Na_2 SO_4(aq)$$
انواع واکنش جانشینی دوگانه چیست ؟
واکنشهای جانشینی دوگانه را میتوان به چند دسته ازجمله واکنشهای تبادل یونی، آلکیلاسیون، واکنش خنثیشدن یا خنثیسازی، واکنشهای کربنات - اسید، واکنشهای رسوبی تقسیم کرد. اما در طبقهبندی شیمی سه گروه زیر رایجترین تقسیمبندی برای انواع واکنشهای جانشینی دوگانه به شمار میروند. بنابراین واکنش جانشینی دوگانه براساس حالتهای ماده فرآورده به سه دسته زیر تقسیم میشوند.
- تشکیل رسوب (واکنشهای رسوبی)
- تشکیل گاز
- تشکیل ترکیبات مولکولی (واکنشهای خنثیسازی)
واکنش تشکیل رسوب
واکنش تشکیل رسوب یا واکنشهای رسوبی واکنشهایی هستند که طی فرایند جانشینی دوگانه، رسوب تشکیل میدهند. به عبارتی زمانیکه دو ترکیب یونی محلول در آب با هم واکنش میدهند ترکیب یونی جدیدی تشکیل میشود که در آب انحلالناپذیر است. به این ترکیب جدید، رسوب و به حلال و سایر ترکیبات محلول در آب «مایع شناور» یا (Supernatant) میگویند.
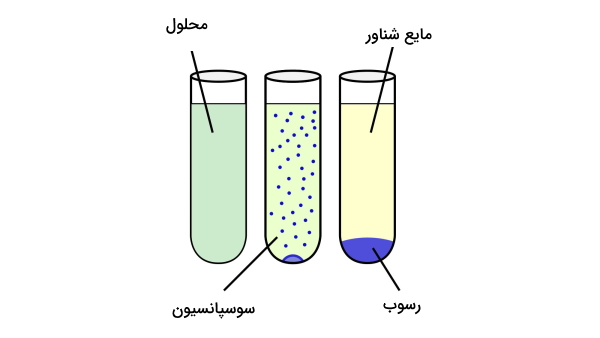
رسوب ممکن است در محلول به صورت سوسپانسیون باشد همچنین میتواند توسط سانتریفیوژ، جداسازی یا بهوسیله فیلتراسیون از فاز مایع جدا شود. زمانی فرایند تشکیل رسوب رخ میدهد که دو ترکیب یونی بر اساس قوانین انحلال در هم حل شوند.
نمکهای فلز قلیایی، نمکهای شامل کاتیونهای آمونیوم، نمکهای استات، پرکلرات، نیتراتها، کلریدها، برومیدها، یدیدها، کلسیم، استرانسیم، باریم سولفید، سولفات و هیدروکسیدها همگی انحلالپذیرند. به غیر از این ترکیبات، سایر نمکها در آب انحلالناپذیرند. لازم به ذکر است که واکنشهای رسوبی در هر دو واکنش جانشینی یگانه و دوگانه رخ میدهند.
توجه داشته باشید که همه ترکیبات یونی در حین واکنش با هم رسوب تشکیل نمیدهند. همچنین ممکن است که برخی از رسوبات تحت شرایط خاصی تشکیل شوند. به همین دلیل در تشکیل یا عدم تشکیل رسوبات یک سری از فاکتورهای شیمیایی نقش دارند که برخی از آنها عبارتند از:
- دما: کاهش یا افزایش دما در حین ترکیب مواد شیمیایی میتواند در تشکیل یا عدم تشکیل رسوب نقش داشته باشد. با افزایش دما حین واکنش، قدرت انحلالپذیری ترکیبات یونی در آب افزایش پیدا میکند. در نتیجه احتمال تشکیل رسوب نیز بیشتر خواهد شد.
- پی اچ (pH): اسیدی یا بازی بودن محلول نیز در تشکیل یا عدم تشکیل رسوب میتواند نقش داشته باشد.
- غلظت واکنشدهندهها:مقدار غلظت کاتیون و آنیونها برای تشکیل یا عدم تشکیل رسوب فاکتور مهمی است.

بنابراین نتیجه می گیریم که اگر تمامی یونهای شرکتکننده در واکنش انحلالپذیر باشند، رسوبی تشکیل نخواهد شد.
کاربرد واکنشهای رسوبی
به کمک رسوب ناشی از ترکیب دو محلول، میتوان یونهای یک محلول مجهول را شناسایی کرد. هنگام آمادهسازی و ایزوله کردن یک ترکیب، واکنشهای رسوبی نیز میتوانند مورد استفاده قرار بگیرند.
خواص رسوب حاصل از واکنش جانشینی دوگانه
رسوب، جامد بلوری یونی است که بر اساس نوع واکنش دهنده(ها) میتواند رنگی یا بدون رنگ باشد. معمولا نمک فلزات واسطه در دو حالت جامد و محلول، ترکیب های رنگی تشکیل میدهند. به همین دلیل رسوبات حاوی فلزات واسطه اغلب رنگی هستند. در تصویر زیر رسوبهای رنگی با رنگهای خارق العادهای آورده شده است که در اثر واکنش دو ترکیب یونی محلول در آب تشکیل شدهاند.

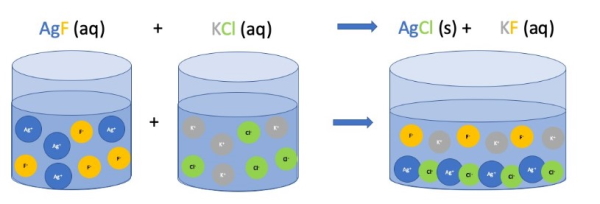
به عنوان مثال واکنش بین نقره نیترات و پتاسیم کلرید یک نوع واکنش جانشینی دوگانه است که در اثر واکنش، رسوب سفیدرنگ نقره کلرید را به وجود میآورند. واکنش مولکولی تشکیل رسوب نقره کلرید به صورت زیر است.
$$AgNO_{3}(aq) + KCl(aq) \rightarrow AgCl(s) + KNO_{3}(aq)$$
توجه داشته باشید که بهتر است معادله واکنش جانشینی دوگانه را به صورت یونهای محلول نوشته شود که به آن معادله واکنش کامل یونی میگویند. بنابراین واکنش کامل یونی واکنش فوق به صورت زیر است.
$$Ag^{+}(aq) +NO_{3}^{-}(aq) + k^{+}(aq)+ cl^{-}(aq)\rightarrow AgCl(s) + K^{+}(aq)+ NO_{3}^{-} (aq)$$
همانطور که در واکنش بالا می بینید رسوب واکنش، نقره کلرید است که در آب حل نمیشود. لازم به ذکر است که شیوه دیگری برای نوشتن واکنش تشکیل رسوب، معادله یونی خنثی است. در این نوع معادله یونهایی که در تشکیل رسوب نقشی ندارند از واکنش حذف میشوند و به این یونها، یونهای تماشاچی می گویند. دلیل این امر آن است که آنها در واکنش تشکیل رسوب شرکت ندارند و صرفا نظارهگر واکنش هستند. در مورد واکنش فوق، معادله یا واکنش یونی خنثی به صورت زیر خواهد بود:
$$Ag^{+}(aq) + Cl^{-}(aq) \rightarrow AgCl (s)$$

به طور کلی معادله واکنش جابجایی دوگانه به سه صورت مولکولی، کامل یونی و خنثی یونی نوشته میشود.
توجه کنید که رسوب صرفا تنها از ترکیب دو واکنشدهنده ثابت تشکیل نمیشود. به این معنا که ممکن است ترکیب محلولهای دیگری با هم نیز همان رسوب را بهوجود بیاورند. در این حالت رنگ رسوب تغییر نمیکند زیرا ترکیب رسوب ثابت است. به عنوان مثال، رسوب نقره کلرید را که در واکنش قبلی از ترکیب نقره نیترات و سدیم کلرید بدست آمد میتوان از ترکیب دو محلول سدیم کلرید و پتاسیم نیترات نیز بدست آورد. دقت داشته باشید که رسوب نقره کلرید همانطور که توضیح دادیم همچنان سفیدرنگ خواهد بود.
واکنش تشکیل رسوب نقره کلرید از ترکیب سدیم کلرید و پتاسیم نیترات در زیر آورده شده است.
$$NaCl(aq) + AgNO_{3}(aq) \rightarrow AgCl(s) + NaNo_{3}(aq)$$
واکنش تشکیل ترکیبات مولکولی
واکنش خنثی شدن یا خنثیسازی یکی از انواع واکنش جانشینی دوگانه است که محصول آن، ترکیبات مولکولی یا همان نمک بدون بار است. واکنش خنثی شدن زمانی رخ میدهد که اسیدها و بازها با هم ترکیب شوند. در اثر واکنش اسید و باز در حضور آب به عنوان حلال یک نمک و آب بوجود میآید. زمانی که یکی از واکنشدهندهها اسید یا باز بسیار قوی باشد معمولا مسیر پیشرفت واکنش به سمت راست (واکنش رفت) خواهد بود.
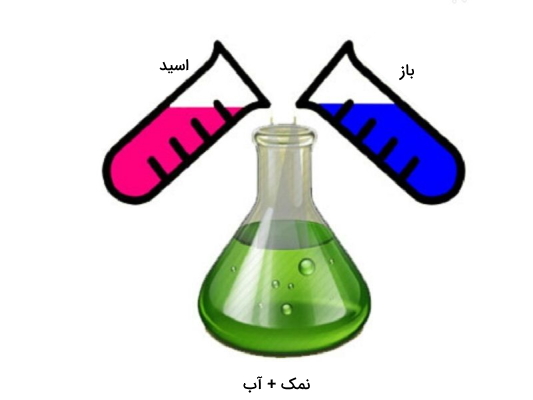
بنابراین طبق تصویر فوق میتوان نتیجه گرفت فرمول کلی مربوط به واکنش اسید و باز به صورت زیر است.
$$HA+BOHrightarrow BA+H_{2}O$$
یکی از رایجترین واکنشهای جابجایی دوگانه از نوع ترکیب اسید و باز، ترکیب سرکه یا همان استیک اسید با جوش شیرین یا همان بیکربنات سدیم است. در اثر این واکنش گاز کربن دیاکسید آزاد میشود که سبب کف کردن آن در حین واکنش است. واکنش جانشینی دوگانه جوش شیرین با سرکه در زیر آورده شده است.
$$NaHCO_{3}(aq)+ CH_{3}COOH(aq)\rightarrow CO_{2}(g) +H_{2}O(l) + NaC_{2}H_{3}O_{2}(aq)$$
در این واکنش جای کاتیونها با هم یا جای آنیونها با هم عوض میشود و نمک حاصل از این واکنش در آب محلول است. به عبارتی در واکنش فوق جای ($$Na^{+}$$) با ($$H^{+}$$) با هم عوض شده است و نمک سدیم استات محلول در آب با فرمول ($$NaC_{2}H_{3}O_{2}$$) بهوجود آمده است.
تصویر زیر مربوط به ترکیب جوش شیرین با سرکه است که در اثر واکنش جانشینی دوگانه بین واکنشدهندهها کف سفید رنگی تولید میشود.

بر اساس مقدار انحلال نمک، نمک میتواند به شکل یونی یا رسوب در محلول باقی بماند. واکنش برگشت واکنش خنثی شدن، هیدرولیز نام دارد. در طی این واکنش نمک با آب واکنش می دهد و اسید و باز را بوجود میآورد. فرم کلی این واکنش به صورت زیر است:
$$BA+H_{2}Orightarrow HA+BOH$$
به طور کلی اسید و بازها به چهار حالت میتوانند با هم واکنش دهند که عبارتند از:
- حالت اول: واکنش اسید قوی و باز قوی
- حالت دوم: اسید قوی + باز ضعیف
- حالت سوم: اسید ضعیف + باز قوی
- حالت چهارم: اسید ضعیف + باز ضعیف
1. واکنش اسید قوی و باز قوی
زمانی که یک اسید قوی مانند HCl با باز قوی مانند NaOH طبق واکنش زیر با هم ترکیب میشوند، نمک سدیم کلرید و آب بوجود میآید. در این واکنش اسید و باز همدیگر را خنثی میکنند بنابراین pH نهایی محلول برابر ۷ خواهد بود و یونهایی که بوجود آمدهاند دیگر با آب واکنش نمیدهند.
$$HCl+NaOH \rightarrow NaCl + H_{2}O $$

۲. واکنش اسید قوی و باز ضعیف
در اثر واکنش میان اسید قوی (HCl) و باز ضعیف ($$NH_{3}$$) مانند واکنش قبلی نمک تولید میشود. اما معمولا آب تشکیل نمیشود زیرا باز ضعیف به هیدروکسید شدن تمایلی ندارد. در این حالت (واکنش برگشت)، آب به عنوان حلال با کاتیون نمک واکنش میدهد تا باز ضعیف دوباره تشکیل شود.
واکنش زیر مربوط به تشکیل نمک در اثر ترکیب یک اسید قوی با باز ضعیف است (واکنش رفت).
$$HCl(aq) + NH_{3}(aq) \rightleftharpoons NH_{4}Cl(aq)$$
واکنش زیر مربوط به مسیر برگشت واکنش فوق است.
$$NH_{4}^+(aq) +H_{2}O(l) \rightleftharpoons NH_{3}(aq) + H_{3}O^+(aq)$$
۳. واکنش اسید ضعیف و باز قوی
زمانیکه اسید ضعیف (HClO) با باز قوی (NaOH) همانند واکنش زیر با هم ترکیب شوند یک محلول بازی بوجود میآورند.
$$HClO+NaOHrightarrow NaClO + H_{2}O $$
همچنین نمک هیدرولیز میشود تا اسید را بوجود آورد. بنابراین در اثر هیدرولیز نمک و با تشکیل یون هدروکسید ($$OH^{-}$$) دوباره اسید ضعیف بوجود میآید (یعنی واکنش فوق در جهت برگشت رخ میدهد).
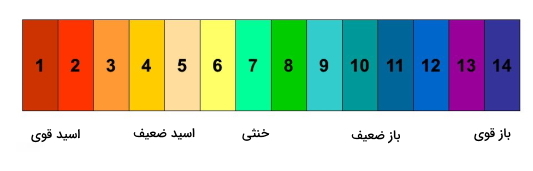
۴. واکنش اسید ضعیف و باز ضعیف
pH محلولی که در اثر واکنش یک باز و اسید ضعیف به وجود میآید بستگی به قدرت اسیدی و بازی واکنشدهندهها دارد. به عنوان مثال واکنش زیر را در نظر بگیرید:
$$HClO + NH_{3}\rightleftharpoons NH_{4}ClO$$
در واکنش فوق اگر ثابت تفکیک اسید ($$K_{a}$$) HClO برابر با $$ 3.4times 10^{-8}$$ و ثابت یونش $$(K_{b})$$ باز $$NH_{3}$$ برابر با $$1.6times 10^{-5}$$ باشد، محلول آبی این دو اسید و باز، بازی خواهد بود زیرا ثابت یونش یا همان قدرت تفکیک اسید (HClO) کمتر از باز ($$NH_{3}$$) است.
واکنش تشکیل گاز
آخرین نوع از واکنش جانشینی دوگانه واکنشی است که طی جابجایی یونها گاز تشکیل میشود. سپس این گازها به صورت حباب در میآیند و وارد هوا میشوند. به طور مثال در اثر واکنش سدیم سولفید و هیدروکلریک اسید، فراوردههای واکنش مطابق واکنش زیر برابر سدیم کلرید و گاز هیدروژن سولفید خواهند بود.
$$Na_{2}S(aq) + 2HCl(aq)\rightarrow 2NaCl(aq) +H_{2}S(g)$$
مثال برای واکنش جانشینی دوگانه
در این قسمت مثالهایی از مهمترین واکنشهای جانشینی دوگانه برای آشنایی بیشتر با این نوع واکنش به همراه تصاویر مربوطه آورده شده است.
رسوب آهن (III) هیدروکسید و آهن (II) هیدروکسید
اگر به محلول شفاف آهن (III) کلرید قطرهقطره محلول سدیم هیدروکسید را اضافه کنید خواهید دید که یک رسوب قرمز متمایل به قهوهای مشاهده میکنید که واکنش موازنه آن در زیر آورده شده است.
$$NaOH(aq) + FeCl_3rightarrow Fe(OH)_3(s) +NaCl(aq)$$
حال اگر مراحل بالا را با آهن (II) کلرید انجام دهید همانطور که در تصویر زیر مشخص است رنگ رسوب به رنگ سبز تغییر خواهد کرد. واکنش مربوطه در زیر آورده شده است.
$$NaOH(aq) + FeCl_2rightarrow Fe(OH)_2(s) +NaCl(aq)$$

واکنش پتاسیم یدید با سرب نیترات
در این واکنش پتاسیم یدید با سرب نیترات که هر دو پودر جامد سفیدرنگی هستند، با آب محلول بیرنگ شفافی را تشکیل میدهند. زمانی که محلول سرب (II) نیترات با محلول پتاسیم یدید ترکیب میشود طبق واکنش موازنه شده زیر رسوب جامد زردرنگ سرب (II) یدید تشکیل میشود.
$$Pb(NO_3)_2(aq) + 2KI(aq) \rightarrow 2KNO_3(aq) + PbI_2(s)$$
تصویر زیر مربوط به رسوب زردرنگ سرب (II) یدید نامحلول در آب است.

واکنش فلوئوریک اسید با سدیم هیدروکسید
زمانی که اسید فلوئوریک با سدیم هیدروکسید بازی ترکیب میشود، آن واکنش از نوع خنثی شدن خواهد بود. بنابراین طی این واکنش همانطور که در واکنش زیر نشان داده شده است محلول سدیم فلوئورید و آب به وجود میآید.
$$HF(aq) + NaOH(aq) \rightarrow H_2O + NaF(aq)$$
رسوب حاصل از واکنش مس (II) سولفات با سدیم هیدروکسید چه رنگی است ؟
زمانی که محلول شفاف باز قوی سدیم هیدروکسید با محلول آبی روشن مس (II) سولفات واکنش میدهد رسوب آبی تیرهرنگ که مربوط به مس (II) هیدروکسید است طبق واکنش زیر تشکیل میشود.
$$NaOH(aq) + CuSO_4(aq) \rightarrow Cu(OH)_2(s) + Na_2SO_4(aq)$$

رسوب آهن کربنات چه رنگی است؟
رسوب آهن (II) کربنات یا ($$FeCO_3$$) جامد نامحلولی است که از واکنش محلول آهن (II) سولفات با سدیم کربنات بوجود میآید. طبق واکنش زیر زمانی که دو محلول شفاف محلول آهن (II) سولفات با سدیم کربنات با هم واکنش میدهند یک رسوب جامد به رنگ سبز لجنی حاصل میشود که همان رسوب آهن (II) کربنات است.
$$Na_2CO_3 (aq) + FeSO_4 (aq) \rightarrow FeCO_3 (s) + Na_2SO_4(aq)$$

البته لازم به ذکر است که این رسوب از واکنش محلول شفاف سدیم کربنات با محلول سبز روشن آهن (II) کلرید نیز میتواند به دست آید و رنگ آن همانطور که قبلا توضیح دادیم تغییر نخواهد کرد. واکنش ترکیب محلول سدیم کربنات با آهن (II) کلرید در زیر آورده شده است.
$$Na_2CO_3 (aq) + FeCl_2 (aq) \rightarrow FeCO_3 (s) + NaCl(aq)$$

رسوب کبالت کربنات چه رنگی است ؟
همانطور که در تصویر زیر نشان داده شده است با اضافه شدن محلول شفاف سدیم کربنات به محلول قرمزرنگ کبالت (II) کلرید، رسوب صورتیرنگ کبالت (II) کربنات حاصل میشود. واکنش زیر مربوط به تشکیل رسوب کبالت (II) کربنات است.
$$NaCO_3(aq) + COCl_2(aq) \rightarrow COCO_3 (s) + NaCl(aq)$$

سوالات متداول در رابطه با واکنش جابجایی دوگانه
در این قسمت برای اینکه به طور کامل یاد بگیرید واکنش جانشینی دوگانه چیست سوالاتی مرتبط با واکنش جانشینی یا جابجایی دوگانه آورده شده که به آنها پاسخ کامل داده شده است.
واکنش جانشینی دوگانه چیست ؟
واکنش جانشینی دوگانه یا همان واکنش جابجایی دوگانه یکی از انواع واکنش شیمیایی است که در آن دو ترکیب یونی با هم واکنش میدهند. طی این واکنش مکان یونها با هم عوض میشوند و ترکیبات جدید را بوجود میآورند. برای این واکنش، واکنشدهندهها حتما باید ترکیبات یونی محلول در آب یا اسید و باز باشند.
انواع واکنش جانشینی دوگانه چیست ؟
واکنشهای جابجایی دوگانه بر اساس حالت فیزیکی فراورده به سه نوع واکنش رسوبی، خنثی شدن و تشکیل گاز تقسیم میشوند.
در واکنش جابجایی دوگانه چه عواملی در تشکیل رسوب نقش دارند؟
یکی از واکنشهای جابجایی دوگانه، واکنشهای رسوبی هستند که تشکیل یا عدم تشکیل این رسوب به یک سری عوامل بستگی دارد. این عوامل شامل دما، pH و غلظت یونهای واکنشدهندهها است. همچنین رسوبی که در این حالت تشکیل میشود نباید در آب حل شود.
رسوب نقره کلرید چه رنگی است؟
نقره کلرید میتواند از چندین ترکیب یونی حاصل شود که در هر حالت رسوب جامد آن سفیدرنگ است و با تغییر ترکیبات یونی رنگ آن تغییر نخواهد کرد.
رنگ رسوب آهن (III) هیدروکسید با آهن (II) هیدروکسید چه تفاوتی دارد؟
اگر آهن (III) کلرید با سدیم هیدروکسید ترکیب شود رسوب (III) هیدروکسید با رنگ قرمز - قهوهای تشکیل خواهد شد. در حالیکه اگر آهن (III) کلرید با سدیم هیدروکسید واکنش دهد، رسوب آهن (II) هیدروکسید سبزرنگ خواهد بود.










