واکنش تجزیه چیست؟ — به زبان ساده
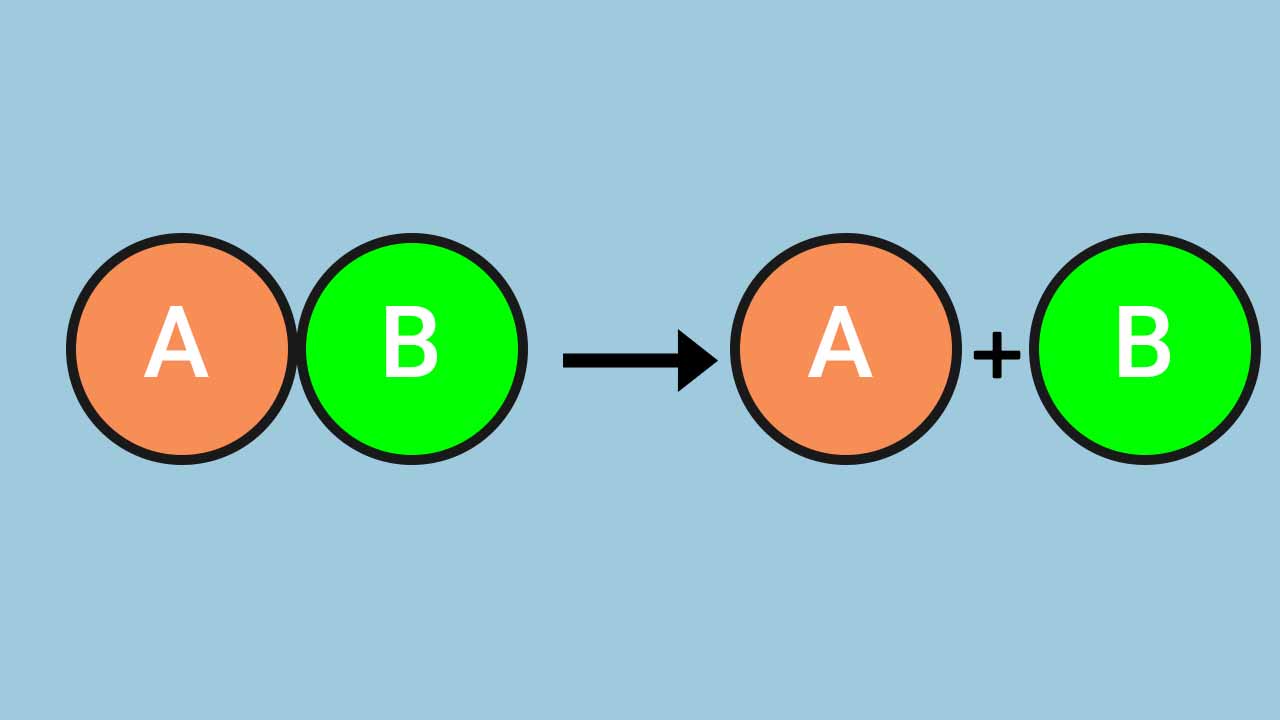
منظور از «واکنش تجزیه» (Chemical Decomposition) شکسته شدن پیوندهای شیمیایی یک واکنشدهنده و تبدیل آن به دو یا تعداد فراوردههای بیشتری است. این واکنش در مقابل «واکنش سنتز» یا همان ترکیب شیمیایی (Chemical Synthesis) قرار دارد. بنابراین، باید گفت زمانی که طی یک واکنش، پیوندهای شیمیایی واکنشدهندهای شکسته و به اجزای سازنده خود تبدیل شوند، فرایند تجزیه رخ داده است. در ادامه به کمک مثالهایی از چند واکنش تجزیه ازجمله تجزیه کلسیم کربنات، یاد میگیرید که واکنش تجزیه چیست و با این نوع از واکنشها بیشتر آشنا میشوید.
واکنش تجزیه چیست ؟
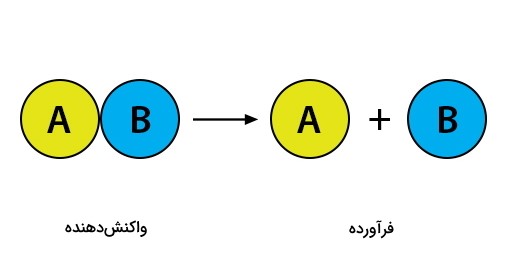
واکنش تجزیه به واکنشی گفته میشود که در آن واکنشدهنده در اثر شکسته شدن پیوندهای شیمیایی به اجزای سازنده خود (فراوردهها)، تبدیل میشود. برای شکستن این پیوندهای شیمیایی انرژی معینی موردنیاز است و مقدار آن به نوع پیوند بستگی دارد. در بین پیوندهای بیناتمی، پیوندهای کوالانسی، یونی و فلزی ازجمله پیوندهای مستحکم به شمار میروند. بنابراین اگر پیوندهای بیناتمی یکی از این سه حالت باشد برای شکسته شدن آنها انرژی بیشتری باید صرف شود.
واکنش تجزیه چه واکنشی است ؟
به طور خلاصه واکنش تجزیه واکنشی است که طی آن پیوندهای شیمیایی ازجمله پیوندهای بیناتمی یا بینمولکولی - ازجمله پیوند هیدروژنی و واندروالسی - شکسته میشود. به همین دلیل به این واکنش شیمیایی در انگلیسی «Chemical Breakdown» نیز میگویند. لازم به ذکر است که فراوردههای حاصل از این واکنش، اجزای سازنده واکنشدهنده(ها) خواهد بود.
در واکنش زیر، واکنش کلی مربوط به فرایند تجزیه آورده شده است.
$$ABrightarrow A+B$$
ترمودینامیک واکنش تجزیه
همانطور که در بخش بالا توضیح داده شد واکنشدهنده(ها) برای شکسستن پیوندها نیاز به انرژی دارند بنابراین میتوان نتیجه گرفت که اغلب واکنشهای تجزیه، «گرماگیر» (Endothermic) هستند. البته برخی از واکنشهای تجزیه جزء واکنشهای گرماده یا «گرمازا» (Exothermic) به شمار میروند به عنوان مثال:
- تجزیه مونوکسید نیتروژن به گازهای نیتروژن و اکسیژن
- تجزیه اوزون به اکسیژن و رادیکال آزاد آن.
بنابراین تمامی واکنشهای تجزیه لزوماً گرماگیر نیستند و اغلب آنها گرماگیر هستند و این گرما را به یکی از سه روش زیر میتوانند جذب کنند:
- گرما (حرارت)
- تشعشع
- رطوبت
- حلال اسیدی
زمانی که ترکیبات شیمیایی در معرض یکی از شرایط محیطی فوق و یا ترکیبی از آنها قرار بگیرد دیگر از لحاظ ترمودینامیکی پایدار نخواهند بود و به اجزای سازنده اصلی خود تجزیه میشوند.
آنتالپی و آنتروپی واکنش تجزیه
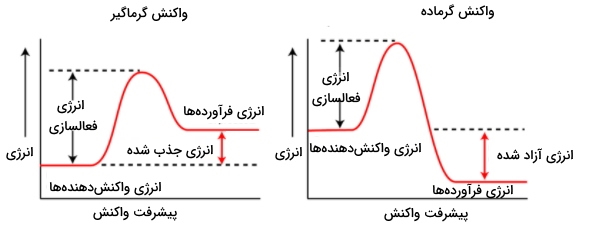
آنتالپی معیاری برای گرمای کلی واکنش در فشار ثابت و آنتروپی معیاری برای بینظمی در یک سیستم ترمودینامیکی است. همانطور که در قسمت قبلی اشاره کردیم اغلب واکنشهای تجزیه گرماگیر هستند یعنی گرمای کلی واکنش مثبت است. به این معنا که سطح گرما یا همان انرژی واکنشدهنده(ها) پایینتر از سطح انرژی فراوردههاست ($$H_2 >\; H_1$$). بنابراین گرمای کلی واکنش که برابر اختلاف انرژی سطح فراوردهها و واکنشدهنده(ها) است مقداری مثبت ($$H_2 - H_1 >\; 0$$) خواهد بود.
حال اگر برخی از واکنشهای تجزیه مانند تجزیه اوزون را در نظر بگیرید گرماده هستند. یعنی سطح انرژی واکنشدهنده(ها) بالاتر از سطح فراوردههاست ($$ H_1 >\;H_2$$). بنابراین اختلاف انرژی سطح فراوردهها و واکنشدهنده(ها) مقداری منفی ($$ H_2 - H_1 <\;0$$) خواهد بود.
در تصویر زیر سطوح انرژی برای واکنشهای گرماگیر و گرماده آورده شده است.
نحوه محاسبه آنتروپی که معیاری برای بینظمی است ممکن است کار سادهای نباشد. اما به طور میانگین اگر مولکولهای گاز در سمت راست واکنش بیشتر از مولکولهای جامد یا گاز در سمت چپ واکنش باشند باشد در اینصورت آنتروپی سیستم ترمودینامیکی افزایش پیدا کرده است. همانطور که از شکل زیر مشخص است دلیل این امر آن است که در حالت جامد اتمها به هم نزدیکترند و فضایی برای حرکت آزادانه ندارند.
در حالیکه در حالت گازی، اتمها از هم فاصله بسیار زیادی دارند و می توانند آزادانه حرکت کنند بنابراین سیستم بینظم میشود. به عنوان مثال در واکنش زیر در قسمت واکنشدهنده ۲ مول جامد و در قسمت فراورده ۳ مول گاز وجود دارد بنابراین سیستم ترمودینامیکی بینظم شده یا به عبارتی آنتروپی آن افزایش پیدا کرده است.
$$2KClO_{3} (s)\rightarrow 2KCl(s) + 3O_2(g)$$
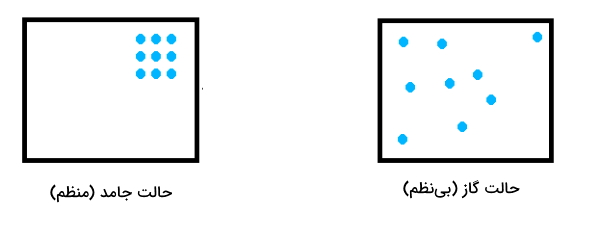
پس نتیجه میگیریم که در واکنشهای تجزیه اغلب آنتروپی افزایش پیدا میکند زیرا مقدار فراوردههای گازی بیش از واکنشدهنده(ها) است.
انواع واکنش تجزیه
واکنشهای تجزیه میتوانند به سه دسته کلی تقسیم شوند که عبارتند از:
- حرارتی (Thermal)
- الکتریکی ( Electrolytic)
- نورکافتی (Photolytic)
واکنش تجزیه حرارتی
واکنش تجزیه حرارتی، واکنشی است که فرایند تجزیه با جذب انرژی حرارتی آغاز میشود. به عبارتی دیگر در این نوع واکنش، واکنشدهندهها با جذب گرما یا همان حرارت تجزیه میشوند. واکنشهای تجزیه حرارتی، گرماگیر هستند.
نتایج تجزیه حرارتی
- کربناتها با فرمول $$CO_3^{2-}$$ به کربن دیاکسید و ترکیبات اکسیدی تجزیه میشوند.
- کلراتها با فرمول $$ClO_{3}^{-}$$ به گاز اکسیژن و کلرید تجزیه میشوند.
- هیدروکسیدها با فرمول $$OH^-$$ به آب و ترکیبات اکسیدی تجزیه میشوند.
- اسیدهای حاوی اکسیژن به عنوان مثال «کلریک اسید» $$(HClO_3)$$ به آب و مولکولهای اکسیدی تجزیه میشوند.
- ترکیبات اکسیدی به اکسیژن و سایر عناصر تجزیه میشوند.
رنگ حاصل از واکنش تجزیه کلسیم کربنات چیست ؟
کلسیم کربنات را میتوان از منابعی همچون سنگ آهک، سنگ گچ و مرمریت (سنگ مرمر) استخراج کرد. کلسیم کربنات استخراج شده به منظور تولید پودر آهک، حرارت داده میشود و در طی این فرایند رنگ آن از سفید به زرد تغییر میکند. به همین منظور در واکنش زیر از علامت دلتا $$(\Delta)$$ استفاده شده است زیرا این واکنش در دسته واکنش تجزیه حرارتی قرار می گیرد.
با حذف منبع حرارتی مانند خاموش کردن شعله، ماده اولیه خنک میشود و بعد از حدود ۱۰ دقیقه رنگ آن مجدد سفید خواهد شد اما نسبت به حالت اولیه از براق بودن آن کاسته میشود. این پودر سفیدرنگ همان اکسید کلسیم است. طبق واکنش زیر کلسیم کربنات بعد از تجزیه شدن، به اجزای سازنده خود یعنی اکسید کلسیم یا همان «آهک» (lime) و کربن دیاکسید تبدیل میشود.
$$\mathrm{CaCO}_3 \stackrel{\Delta}{\rightarrow} \mathrm{CaO}+mathrm{O}_2$$
واکنش تجزیه الکتریکی
این واکنش هنگامی رخ میدهد که جریان الکتریکی از محلول عبور کند. یکی از ملموسترین مثالها برای این نوع واکنش، تجزیه آب است و به آن الکترولیز آب میگویند. در فرآیند الکترولیز آب، دو الکترود با صفحه های فلزی (یکی در نقش کاتد و دیگری در نقش آند) در سلول الکترولیتی و آب قرار میگیرد. الکترولیت میتواند اسید، باز و نمکهای فلزی باشد و دلیل اضافه کردن آن به آب این است که آب به خوبی نمیتواند جریان الکتریکی را انتقال بدهد. حال زمانی که یک منبع جریان الکتریکی مستقیم (DC) مانند باتری به دو الکترود وصل می شود و جریان الکتریکی از آب عبور میکند. بنابراین انرژی لازم برای تجزیه آب از طریق اعمال ولتاژ و تشکیل واکنش اکسایش - کاهش فراهم میشود. بهاین صورت مانند تصویر زیر آب به مولکولهای دواتمی هیدروژن و اکسیژن تبدیل میشود.
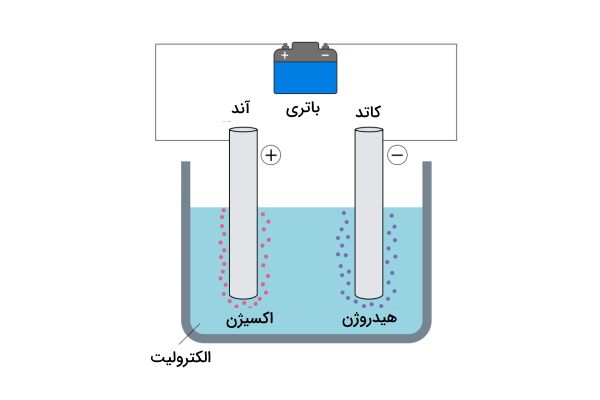
در واکنش زیر واکنش تجزیه آب نشان داده شده است.
$$\mathrm{2H_2}O \stackrel{Elec.}{\rightarrow} \mathrm{2H_2}+mathrm{O}_2$$
واکنش تجزیه نورکافتی
واکنش تجزیه نورکافتی یا نوری برای شکسته شدن پیوندهای واکنشدهنده به نور (انرژی فوتون) نیاز دارد. به همین خاطر است که بعضی از داروهای پزشکی یا مواد اولیه آزمایشگاهی را در ظرفهای تیره و دور از نور نگهداری میکنند. زیرا عبور نور از شیشه مواد آزمایشگاهی یا دارویی سبب تجزیه آنها میشود. به عنوان مثال واکنش تجزیه اوزون در حضور نور انجام میگیرد.
$$\mathrm{O}_3 \stackrel{hnu}{\rightarrow} \mathrm{O}_2+mathrm{O}^.$$
تجزیه نقره برمید نیز مثال دیگری از این نوع واکنش است. پودر زردرنگ نقره برمید در صورتی که در معرض نور خورشید یا هر منبع نوری دیگر قرار بگیرد به نقره و برم تجزیه میشود. بههمین خاطر رنگ نقره برمید بعد از فرآیند تجزیه به دلیل تشکیل نقره به رنگ خاکستری تبدیل میشود.

واکنش زیر مربوط به تجزیه نقره برمید در حضور نور است.
$$\mathrm{2Ag Br} \stackrel{hnu}{\rightarrow} \mathrm{2Ag}+mathrm{Br}_2$$
واکنش تجزیه دوگانه چیست؟
واکنش تجزیه دوگانه که در شیمی آن را با نام واکنش جانشینی دوگانه یا جابهجایی دوگانه میشناسیم یکی از انواع واکنشهای تجزیه است. در این نوع واکنش یونهای مثبت و منفی در دو ترکیب یونی جایگزین هم میشوند. به طور کلی در این واکنش مراحل زیر رخ میدهد:
- ابتدا پیوندهای دو ترکیب یونی شکسته میشود.
- سپس جابهجایی یونها صورت میگیرد.
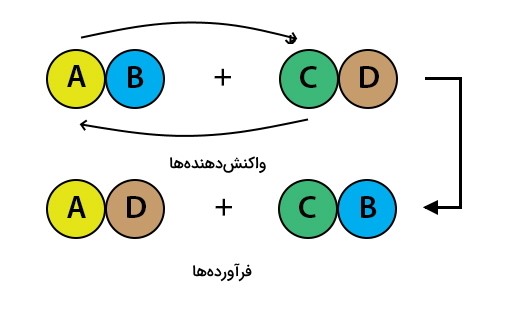
دقت کنید در تصویر فوق کاتیون و آنیون به ترتیب یونهای A-C و B-D هستند. همانطور که در شکل مشاهده میشود ابتدا پیوند میان ترکیبهای AB و CD شکسته میشود. با شکسته شدن این دو ترکیب، یونهای A و C باهم جابهجا میشوند و دو ترکیب جدید AD و BC تشکیل می شود.
کاربرد واکنش تجزیه چیست ؟
بیشتر واکنشهای تجزیه در طبیعت به صورت ناخواسته رخ میدهند اما با این حال در زندگی روزمره و زمینههای مختلف صنعتی و آزمایشگاهی کاربرد گستردهای دارند.
صنعت
در صنعت از واکنش تجزیه به طور گستردهای استفاده میشود که مهمترین آنها در زیر آورده شده است:
- تولید اکسید کلسیم یا «آهک زنده» (Quicklime)
- تولید اکسید لیتیم
- تولید اکسیژن و کربن دیاکسید
- در صنایع مربوط به مواد یا همان «متالورژی» (Metallurgy) برای استخراج فلزات از اکسیدها و کلریدهای فلزی، کانی و سنگهای معدنی مربوطه
- تولید برخی محصولات مانند سدیم
- «جوشکاری ترمیت» (Thermite Welding)

همچنین یکی از کاربردهای مهم این واکنش در صنعت خودروسازی و مربوط به کیسههای هوا یا همان «ایربگ» (Airbag) است. در کیسههای هوا مادهای سمی به نام سدیم آزید با فرمول $$NaN _{3}$$ وجود دارد. همانطور که در شکل زیر نشان داده شده است در صورت تصادف، حسگر ضربه سیگنال الکتریکی را به ناحیهای که سدیم آزید در آنجا وجود دارد ارسال میکند. این سیگنال سبب جرقه زدن و اشتعال میشود که در اثر آن گرما آزاد خواهد شد. این گرمای بهوجود آمده موجب تجزیه سدیم آزید و تولید گاز نیتروژن میشود.
در نتیجه با تولید گاز نیتروژن فشار درون کیسه کاهش پیدا میکند و بر اساس «قانون بویل» (Boyle's Law) این کاهش فشار، سبب افزایش حجم گاز (N2) میشود. در نتیجه این گاز توسط سیستم بادکننده در کل کیسه هوا پخش خواهد شد.
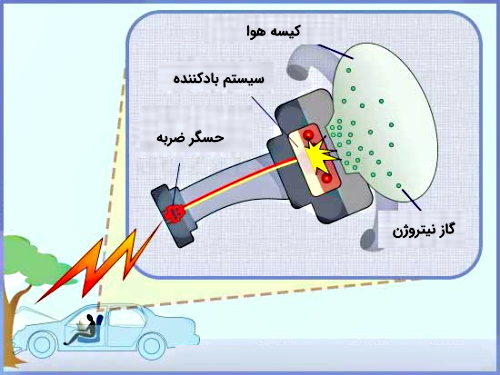
واکنش زیر مربوط به تجزیه سدیم آزید در کیسههای هوا است.
$$2NaN_{3}\rightarrow 2Na + 3N_{2}$$
زندگی روزمره
طی زندگی روزمره پدیدههای طبیعی زیادی رخ میدهد که دلیل آنها واکنشهای تجزیه است اما ممکن است تابهحال متوجه آنها نشده باشیم. برخی از این پدیدهها عبارتند از:
- با باز شدن در قوطی نوشابه گازدار، پیوندهای کربنیک اسید میشکنند و آب و کربن دیاکسید را تولید میکنند. همین موضوع سبب پخش شدن و کف کردن گاز نوشابه به هنگام باز شدن در قوطی آن است.
- در زمان هضم غذا کربوهیدراتها، چربیها و پروتئینها به مواد ساده و قابل استفادهای برای بدن تجزیه میشوند.
- در گذشته، برای تهیه فیلمهای عکاسی از نقره برمید استفاده میشد چراکه این ترکیب نسبت به نور بسیار حساس است.
- زمانی که مقداری آب اکسیژنه یا هیدروژن پراکسید بر روی زخم یا جراحتی ریخته شود شروع به تجزیه شدن میکند و حبابهای اکسیژن را بوجود میآورد. این حبابها میتوانند زخم را ضدعفونی کنند یا مانع از خونریزی مجدد شوند.
- بیکینگ پودر یا همان (بیکربنات سدیم) که در در شیرینیپزی مورد استفاده قرار میگیرد در اثر حرارت تجزیه میشود و کربن دیاکسید و سدیم هیدروکسید را تولید میکند.
- واکنش تجزیه در مواد غذایی که تخمیر میشوند از جمله تخمیر شیر جهت تولید ماست اتفاق میافتد. همچنین غذاها و میوههای فاسد در اثر تجزیه، مواد بسیار مغذی را برای خاک تولید میکنند و نقش کود گیاهی را دارند.

آزمایشگاه
واکنشهای تجزیه در آزمایشگاه و کارهای پژوهشی نیز کاربرد دارند که عبارتند از:
- طیفسنجی جرمی (Mass Spectrometry): این آنالیز براساس جداسازی ذرات یونی ترکیبات، مانند اتمها و مولکولها با استفاده از اختلاف جرم به بار انجام میگیرد. آنالیز طیف سنجی جرمی میتواند برای محسابه وزن مولکولی ذرات مورد استفاده قرار بگیرد.
- آنالیز وزنسنجی (Gravimetric Analysis): از این آنالیز برای اندازهگیری جرم یا غلظت مواد با استفاده از تغییرات جرمی استفاده میشود. به عنوان مثال جهت اندازهگیری جرم یک ماده در ترکیبی مشخص، آن ترکیب را حرارت میدهند تا پیوندها شکسته و مواد فرار خارج شوند. بنابراین جرم نسبت به حالت اولیه تغییر میکند و جرم ثانویهای بدست میآید. با اندازهگیری اختلاف جرم ثانویه و اولیه، جرم ماده موردنظر بدست خواهد آمد.
- آنالیز توزین حرارتی (Thermogravimetric analysis | TGA): در این آنالیز، نمونه در اتمسفر گاز نجیب تحت حرارت قرار میگیرد و به طور پیوسته وزن میشود. در بسیاری از ترکیبات جامد واکنشهایی از نوع تجزیه رخ میدهد که محصولات گازی تولید میکنند. این فراوردههای گازی طی حرارتدهیِ پیوسته تبخیر و باعث تغییر در مقدار جرم میشوند. این تغیر جرم اندازهگیری و از جرم اولیه کاسته میشود تا جرم ترکیب موردنظر بدست آید.
چند واکنش تجزیه
تا اینجا بهخوبی میدانیم که واکنش تجزیه چیست و چه کاربردهایی در صنعت و زندگی روزمره ما دارد. در ادامه با معرفی چند واکنش تجزیه درک بیشتری از این واکنش پیدا میکنیم.
واکنش تجزیه آب اکسیژنه
محلول غلیظ آب اکسیژنه یا همان «هیدروژن پراکسید» (Hydrogen Peroxide) مطابق واکنش موازنه شده زیر تجزیه میشود و اکسیژن، آب و همچنین گرما تولید میکند.
$$2H_{2}O_{2}\rightarrow 2H_{2}O +O_{2}$$
واکنش تجزیه سدیم هیدروژن کربنات
زمانی که پودر سفیدرنگ سدیم هیدروژن کربنات یا همان بیکربنات سدیم (ماده اولیه در بیکینگ پودر) حرارت میبیند در صورتی که دما به ۸۰ درجه سانتیگراد برسد شروع به تجزیه شدن میکند. فراوردههای ناشی از تجزیه این ماده، سدیم کربنات، آب و کربن دیاکسید است. لازم به ذکر است که بعد تجزیه شدن سدیم هیدروژن کربنات تغییر رنگی مشاهده نمیشود و دلیل آن این است که رنگ سدیم کربناتی که تولید میشود نیز سفید است.
$$2NaHCO_{3}\rightarrow Na_{2}CO_{3} + H_{2}O + CO_{2}$$
واکنش تجزیه نیتروگلیسیرین
نیتروگلیسیرین اغلب به عنوان گشادکننده عروق مورد استفاده قرار میگیرد و در اثر ضربه یا حرارت کم تجزیه میشود. تمام محصولات در این واکنش انفجاری، حالت گاز دارند بنابراین به هنگام کارکردن با آن باید احتیاط کرد. واکنش موازنه شده تجزیه نیتروگلیسیرین مطابق زیر است.
$$4C_{3}H_{5}(NO_{3})_3rightarrow 12CO_{2} + 10H_{2}O+6N_{2} +O_{2}$$
رنگ پودر حاصل از تجزیه آمونیوم دی کرومات چیست ؟
آمونیوم دی کرومات جامد بلوری نارنجیرنگ متمایل به قرمز است. این جامد بلوری بسیار اشتعالپذیر است و و از نظر ترمودینامیکی ناپایدار است. بههمین دلیل در اثر حرارت میسوزد و به اکسید کروم، بخار آب، نیتروژن تجزیه میشود و حرارت تولید می کند. این واکنش به «واکنش کوه آتشفشان» نیز معروف است. رنگ اکسید کروم حاصل از این واکنش سبز تیره است.

واکنش تجزیه زیر مربوط به آمونیوم دی کرومات است.
$$(NH_{4})_{2} Cr_{2}O _{7}(s)\rightarrow N_2(g) + 4H_2O(g) + Cr_2O_7(s)$$
واکنش تجزیه پتاسیم کلرات
پتاسیم کلرات به شکل بلورهای سفیدرنگی است که طی واکنش زیر - اغلب در حضور «اکسید منگنز» (MnO2) به عنوان کاتالیزور - تجزیه میشود. اکسیژن و پودر پتاسیم کلرید سفیدرنگ از فراوردههای این واکنش هستند.
$$2KClO_{3} (s)\rightarrow 2KCl(s) + 3O_2(g)$$
واکنش تجزیه جوش شیرین
جوش شیرین همان بیکربنات سدیم است که واکنش تجزیه آن به صورت موازنه در زیر آورده شده است.
$$2NaHCO_{3}\rightarrow Na_{2}CO_{3} + H_{2}O + CO_{2}$$
واکنش تجزیه آمونیاک
آمونیاک گاز بیرنگ است که در اثر حرارت تجزیه میشود و گازهای نیتروژن و هیدروژن تولید میکند. از آنجا که سرعت واکنش تجزیه آمونیاک پایین است اغلب تجزیه آن در حضور یک کاتالیزور صورت میگیرد. به همین دلیل معمولا این روش در صنعت برای تولید نیتروژن مورد استفاده قرار نمی گیرد.
$$2NH_3(g) \rightarrow N_2(g) + 3H_2(g)$$
واکنش تجزیه گلوکز
گلوکز با فرمول شیمیایی $$C_6H_12O_6$$ در حضور یا عدم حضور اکسیژن میتواند تجزیه شود که در هر حالت فراوردهها متفاوت هستند. در حالت اول آب و کربن دیاکسید و در حالت دوم الکل به همراه کربن دیاکسید تولید میشود. لازم به ذکر است که در هر دو واکنش انرژی آزاد میشود. تجزیه گلوکز بدون اکسیژن به «واکنش بیهوازی تخمیر گلوکز» نیز معروف است که به الکل (اتانول) بهدست آمده از این واکنش سوخت سبز نیز میگویند.
در دو واکنش زیر، واکنش اول مربوط به تجزیه گلوکز در حضور اکسیژن و دوم در نبود اکسیژن است.
$$C_{6}H_{12}O_{6} +6O_2rightarrow 6CO_2 + 6H_2O$$
$$C_{6}H_{12}O_{6} \rightarrow 2CO_2 + 2C_{2}H_{5}OH$$
سوالات متداول در رابطه با واکنش تجزیه
در این قسمت سوالات متداول در رابطه با واکنش تجزیه گردآوری و به آنها پاسخ داده شده است.
واکنش تجزیه چه واکنشی است؟
این واکنش شیمیایی به واکنشی گفته میشود که در طی آن پیوندهای شیمیایی یک ماده میشکنند و به اجزای سازنده خود تبدیل میشوند.
واکنش تجزیه گرماگیر است یا گرماده؟
اغلب واکنشهای تجزیه گرماگیر هستند زیرا برای شکستن پیوند نیاز به صرف انرژی دارند. در برخی موارد واکنشهای تجزیه بسیاری ازجمله تجزیه اوزون، گلوکز و غیره گرماده هستند یعنی تجزیه آنها با آزاد شدن انرزی همراه است.
واکنش تجزیه چند نوع دارد؟
این واکنش براساس نوع انرژی جذب شده برای شکستن پیوند به سه نوع حرارتی، الکتریکی و نوری تقسیم میشوند.
رنگ پودر حاصل از تجزیه آمونیوم دی کرومات چیست ؟
جامد بلوری آمونیوم دی کرومات در اثر تجزیه، اکسید کروم، بخار آب، نیتروژن و گرما تولید میکند. رنگ پودر اکسید کرروم تولید شده سبز تیره خواهد بود.










