هیدروژن چیست؟ — از صفر تا صد

در سال 1671، رابرت بویل واکنش بین خردههای آهن و اسید رقیق را به طور کامل تشریح کرد که موجب تولید گاز هیدروژن بود. در بین سالهای 1766 تا 1781، «هنری کاوندیش» (Henry Cavendish)، اولین کسی بود که متوجه شد گاز هیدروژن یک ماده مجزا است و به هنگام سوختن، آب تولید میکند. او آن را «هوای قابل اشتعال» (Flammable Air) نامید. آنتوان لاوازیه نام هیدروژن را برای این عنصر انتخاب کرد که از ریشه یونانی آن شامل واژههای (Hydro) به معنی آب و (Genes) به معنای خالق گرفته شده است.
برای اولین بار در سال 1898، «جیمز دیوئر» (James Dewar) هیدروژن را به کمک روش «سرمایش بازیابی» (Regenerative Cooling) و اختراع خود به نام «محفظه خلاء» (Vacuum Flask)، به مایع تبدیل کرد. او همچنین در سال بعد، هیدروژن جامد را تولید کرد.

هیدروژن، گازی بیرنگ، بیبو و بدون مزه است که بیشترین فراوانی را در بین عناصر روی زمین دارد. این عنصر از نظر جرم اتمی به عنوان سبکترین عنصر شناخته میشود که اتم آن شامل یک پروتون و یک الکترون و فاقد نوترون است. این عنصر را میتوان در همهجا پیدا کرد. در آب، چربیها، نفت خام، هیدروکربنها، اسیدهای چرب، کربوکسیلیک اسیدها، شکر، آمونیاک، هیدروژن پراکسید و بسیاری از مواد دیگر، ردی از هیدروژن یافت میشود.
جدول زیر اطلاعاتی کلی از این اتم را نشان میدهد:
| عدد اتمی | نماد | وزن اتمی | آرایش الکترونی | عدد اکسایش | شعاع اتمی | نقطه ذوب | نقطه جوش | دستهبندی عنصری | خصوصیات در دمای اتاق |
| 1 | $$H$$ | $$1.0079$$ | $$1 s ^ 1$$ | $$1 , -1$$ | $$78 \ pm$$ | $$-259.34 \ C ^ \circ$$ | $$-252.87 \ C ^ \circ$$ | نافلز | گاز دواتمی بیرنگ و بیبو |
خواص هیدروژن
هیدروژن به دسته نافلزات تعلق دارد و محل آن در جدول تناوبی، با توجه به آرایش الکترونی و شباهت این آرایش به فلزات قلیایی، در بالای این فلزات قرار دارد. البته این عنصر خواصی مشابه فلزات قلیایی ندارد چراکه برخلاف فلزات قلیایی، به راحتی کاتیون $$H ^ +$$ را تشکیل نمیدهد. گواهی بر این مدعا، انرژی یونش بالا نسبت به این دسته از فلزات است. انرژی یونش (یونیزاسیون) هیدروژن برابر با $$1312 \ KJ/mol$$ است در حالیکه انرژی یونش لیتیوم مقداری برابر با $$520 \ KJ/mol$$ دارد.
از آنجایی که هیدروژن یک نافلز است و تشکیل $$H ^ -$$ میدهد، در مواردی آنرا در بالای هالوژنها قرار میدهند. این عنصر همچنین مانند هالوژنها، مولکولهای دو اتمی را تشکیل میدهد. نیروهای جاذبه در بین مولکولهای $$H _ 2$$ بسیار ضعیف است که نتیجه آن را میتوان در نقطه ذوب و جوش پایین مشاهده کرد. با این حال، $$H _ 2$$ نیروهای بین مولکولی بسیار قوی دارد و به همین علت، واکنشهای $$H _ 2$$ در دمای اتاق عموما با سرعت پایینی انجام میشوند. مولکول $$H _ 2$$ به سادگی توسط گرما، پرتودهی و کاتالیزور فعال میشود و گازهای هیدروژن فعال به سرعت و به صورت گرماده با بسیاری از مواد وارد واکنش میشوند.

همچنین، این اتم توانایی تشکیل پیوندهای کووالانسی با بسیاری از مواد را دارد چراکه پیوندهای قدرتمند $$O -H$$ را میسازد. همچنین $$H _ 2$$ به عنوان یک کاهنده مناسب برای اکسیدهای فلزی عمل میکند. به طور مثال در واکنش زیر، $$H _ 2 (g)$$ با عبور از $$Cu O (s)$$، $$Cu ^ {2+}$$ را به $$Cu$$ کاهش میدهد و خود اکسید میشود.
$$Cu O (s) + H _ 2 (g) \rightarrow Cu (s) + H _ 2 O (g)$$
واکنشهای هیدروژن
هیدروژن، هم رفتاری مانند فلزات قلیایی و هم رفتاری مانند هالوژنها دارد که واکنشهای آن در زیر آورده شدهاند:
$$H_{(g)} \rightarrow H^+_{(g)} + e^-$$
$$H_{(g)} + e^- \rightarrow H^-_{(g)}$$
واکنش هیدروژن با فلزات فعال
هیدروژن، الکترون را از فلز فعال میگیرد و هیدریدهای یونی همچون $$LiH$$ تشکیل میدهد. واکنش هیدروژن با فلزات گروه یک جدول تناوبی در زیر آورده شده است. در این واکنش، $$M$$ بیانگر فلزات قلیایی است:
$$M_{(s)}+H_{2(g)} \rightarrow MH_{2(s)}$$
مثال:
$$\begin{array} { l } { C a _ { ( s ) } + H _ { 2 ( g ) } \rightarrow C a H _ { 2 ( s ) } } \\ { C a _ { ( s ) } + C l _ { 2 ( g ) } \rightarrow C a C l _ { 2 ( s ) } } \end{array}$$
واکنش هیدروژن با فلزات قلیایی خاکی در زیر آورده شده است که اینبار، $$M$$ بیانگر فلزات قلیایی خاکی است:
$$M_{(s)}+H_{2(g)} \rightarrow MH_{2(s)}$$
مثال:
$$\begin{array} { l } { C a _ { ( s ) } + H _ { 2 ( g ) } \rightarrow C a H _ { 2 ( s ) } } \\ { C a _ { ( s ) } + C l _ { 2 ( g ) } \rightarrow C a C l _ { 2 ( s ) } } \end{array}$$
واکنش هیدروژن با نافلزات
بر خلاف فلزات که پیوندهای یونی با نافلزات تشکیل میدهند، پیوندهای بین هیدروژن با نافلزات از نوع کووالانسی است.
هیدروژن هالید $$\rightarrow$$ هالوژن + هیدروژن
$$H_{2(g)}+ Cl_{2(g)} \rightarrow HCl_{(g)}$$
واکنش هیدروژن با اکسیژن گرمای زیادی تولید میکند:
$$H_{2(g)}+O_{2(g)} \rightarrow H_2O_{(g)} \ \Delta H = 572 \;kJ $$
واکنش هیدروژن با فلزات واسطه
واکنش هیدروژن با عناصر (فلزات) واسطه سبب تولید هیدریدهای فلزی میشود. هیچ نسبت ثابتی از اتمهای هیدروژن نسبت به این فلزات وجود ندارد چرا که در حقیقت، اتمهای هیدروژن حفرات بین ساختار بلوری این فلزات را پر میکنند.
موارد استفاده از هیدروژن
قسمت اعظمی از هیدروژنی که امروزه به طور صنعتی به تولید میرسد، حاصل فرآوری گاز متان با بخار یا تولید «گاز آب» (Water Gas) از واکنش زغالسنگ با بخار است. بیشتر هیدروژن تولیدی در فرآیند هابر برای تولید آمونیاک به مصرف میرسد.
هیدروژناسیون
همچنین از این عنصر برای «هیدروژناسیون» (Hydrogenation) روغنهای گیاهی استفاده میشود تا آنها را از حالت مایع به جامد تبدیل کنند مانند کره مارگارین. علاوه بر این، از هیدروژن مایع در سوخت موشکها نیز بهره میگیرند زیرا همانطور که اشاره شد، ترکیب هیدروژن و اکسیژن انرژی بسیار زیادی تولید میکند. علاوه بر این، از آنجایی که هیدروژن کاهنده مناسبی است، از آن برای تولید فلزاتی همچون آهن، مس، نیکل و کبالت نیز استفاده میکنند.
کشتی هوایی
یک متر مکعب از هیدروژن میتواند تا بیش از 300 گرم از یک ماده را از روی زمین بلند کند که این امر استفاده از کشتیهای هوایی را در اوایل قرن 19 رونق داد. البته استفاده از این گاز در طول جنگ جهانی دوم منسوخ شد چراکه در مواردی سبب انفجارهای شدید شده بود. بعد از وقایع جنگ جهانی و انفجارهای حاصل از این گاز، تصمیم بر آن شد تا از گازهای نجیب همانند هلیوم استفاده شود.

جایگزین سوخت فسیلی
با توجه به لزوم پیدا کردن جایگزین مناسب برای سوختهای فسیلی، در دهههای اخیر تحقیقاتی به همین منظور در خصوص این عنصر صورت گرفته است تا بتوان آن را به عنوان منبعی برای انرژی در نظر گرفت. به علت انرژی زیادی که در هیدروژن مایع و گاز فشرده هیدروژن وجود دارد، استفاده از آنها به عنوان سوخت آینده دور از ذهن نیست. از نکات مثبت این سوخت میتوان به پاک بودن آن اشاره کرد زیرا با سوختن آن، تنها آب تولید میشود. البته این کار با فناوریهای امروزی بسیار پرهزینه خواهد بود.

احتراق سوختها انرژی زیادی تولید میکند که میتوان آن را با چرخش یک توربین به انرژی الکتریکی تبدیل کرد. البته این کار بازده پایینی دارد زیرا انرژی زیادی به صورت گرما از دست میرود. تولید الکتریسیته از طریق سلولهای ولتایی، بازده بیشتری دارد. سلولهای ولتایی که انرژی شیمیایی را به انرژی الکتریکی تبدیل میکنند موسوم به «پیل سوختی» (Fuel Cell) هستند. از آنجایی که این پیلها به طور خودکار عمل نمیکنند، نمیتوان آنها را به عنوان یک باتری در نظر گرفت.

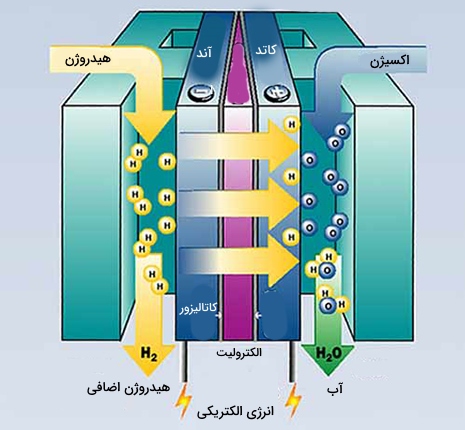
سلولهای هیدروژنی
سلول هیدروژنی نوعی از پیل سوختی است که در آن، واکنش بین $$H _ 2 (g)$$ و $$O _ 2 $$ موجب تشکیل آب میشود و بازدهی آن بیش از دو برابر بازده بهترین موتور درونسوز است. در سلول و تحت شرایط بازی، اکسیژن در کاتد کاهش پیدا میکند و در همین زمان هیدروژن در آند اکسید میشود. البته استفاده از این فناوری بسیار پرهزینه است و نمیتوان از آن در زندگی روزمره استفاده کرد.
واکنش کاهش: $$\mathrm { O } _ { 2 } ( \mathrm { g } ) + 2 \mathrm { H } _ { 2 } \mathrm { O } ( \mathrm { l } ) + 4 \mathrm { e } ^ { - } \rightarrow 4 \mathrm { OH } ^ { - } ( \mathrm { aq } )$$
وکنش اکسایش: $$\mathrm { H } _ { 2 } ( \mathrm { g } ) + 2 \mathrm { OH } ^ { - } ( \mathrm { aq } ) \rightarrow 2 \mathrm { H } _ { 2 } \mathrm { O } ( \mathrm { l } ) + 2 \mathrm { e } ^ { - }$$
واکنش کلی: $$2 \mathrm { H } _ { 2 } ( \mathrm { g } ) + \mathrm { O } _ { 2 } ( \mathrm { g } ) \rightarrow 2 \mathrm { H } _ { 2 } \mathrm { O } ( \mathrm { I } )$$
هیدروژن در طبیعت
هیدروژن را به عنوان سوخت مورد نیاز واکنشهای درون خورشید و دیگر ستارگان میشناسند. این عنصر، سبکترین و فراوانترین عنصر در کیهان است. بین 70 تا 75 درصد از عالم هستی را هیدروژن تشکیل میدهد. در حقیقت تمامی ستارگان، اجرامی بزرگ از این گاز هستند که از طریق فرآیند «همجوشی» (Fusion) هیدروژن، حجم عظیمی از انرژی را تولید میکنند. در ستارههای کوچکتر، اتمهای هیدروژن در اثر برخورد و همجوشی، به هلیوم و سایر عناصر سبکتر همچون نیتروژن و کربن تبدیل میشوند. در ستارههای بزرگتر، این اتم سبب تولید عناصر سنگینتری مانند کلسیم، سیلیکون و اکسیژن خواهد بود.
در جو زمین، این عنصر معمولا به همراه اکسیژن و به شکل $$H _ 2 O $$ یافت میشود. هیدروژن خالص 15 درصد از حجم و 0/9 درصد از جرم فراوانی زمین را به خود اختصاص داده است و این درحالیستکه، آب 70 درصد از کره زمین را تشکیل میدهد. از آنجایی که هیدروژن وزن بسیار کمی دارد، غلظت آن در اتمسفر تنها $$0.5 \ ppm$$ است که با توجه به اشتعالپذیر بودن آن، غلظت مناسبی خواهد بود.
دیگر منابع هیدروژن
گاز هیدروژن را میتوان به کمک واکنش یک اسید رقیق قوی مانند هیدروکلریک اسید با یک فلز فعال تولید کرد. در این واکنش، فلز به اکسید تبدیل میشود و $$H ^ +$$ از اسید، در یک واکنش اکسید و احیا به گاز هیدروژن کاهش پیدا میکند. این روش را میتوان برای تولید آزمایشگاهی هیدروژن در مقدار کم بکار برد اما روشی پرهزینه برای مصارف صنعتی است. نمونهای از این واکنش در زیر آورده شده است:
$$Zn_{(s)} + 2H^+_{(aq)} \rightarrow Zn^{2+}_{(aq)} + H_{2(g)}$$
خالصترین نوع $$H _ 2 (g)$$ را میتوان از الکترولیز (برقکافت) $$H _ 2 O (l)$$ بدست آورد. البته این واکنش نیز صرفه اقتصادی ندارد چراکه نیازمند یک منبع غنی از انرژی است:
$$2H_2O_{(l)} \rightarrow 2H_{2(g)} + O_{2(g)}$$
$$H_2O$$ بیشترین فراوانی را در زمین دارد. در نتیجه دور از ذهن نیست که بخواهیم هیدروژن را از الکترولیز آب بدست آوریم. برای این کار باید هیدروژن با عدد اکسایش $$+1$$ را به هیدروژن با عدد اکسایش $$0$$ تبدیل کنیم. سه مورد از مهمترین کاهندههایی که به این منظور استفاده میشوند عبارتند از: کربن (کُک یا زغالسنگ)، مونو اکسید کربن و متان. این مواد با بخار آب واکنش و تشکیل $$H_2(g)$$ میدهند. لازم به ذکر است که این سه روش، به علت مقرون به صرفه بودن، جهت تولید صنعتی گاز هیدروژن نیز بکار گرفته میشوند:
$$\begin{array} { c } { C _ { ( s ) } + 2 H _ { 2 } O _ { ( g ) } \rightarrow C O ( g ) + H _ { 2 ( g ) } } \\ { C O _ { ( g ) } + 2 H _ { 2 } O _ { ( g ) } \rightarrow C O 2 + H _ { 2 ( g ) } } \\ { C H _ { 4 ( g ) } + H _ { 2 } O _ { ( g ) } \rightarrow C O _{ ( g )} + 3 H _ { 2 ( g ) } } \end{array}$$

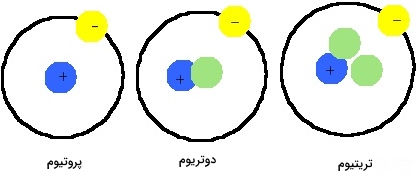
ایزوتوپها
هیدروژن به طور طبیعی دارای سه ایزوتوپ با نامهای «پروتیوم» (Protium)، «دوتریوم» (Deuterium) و «تریتیوم» است.
پروتیوم
فراوانترین ایزوتوپ این عنصر است که 99/98 درصد از هیدروژن موجود در طبیعت را شامل میشود. هسته این اتم تنها یک پروتون دارد و فاقد نوترون است که آن را به صورت $$^ {1} H$$ نشان میدهند.
دوتریوم
دوتریوم ایزوتوپ دیگری است که در هسته خود یک پروتون و یک نوترون دارد. این نوع ایزوتوپ فقط 0/0156 درصد از هیدروژن موجود در طبیعت را تشکیل میدهد. نماد آن معمولا به صورت $$D$$ یا $$^ {2} H$$ و موسوم به هیدروژن سنگین است. این ایزوتوپ را میتوان به کمک تقطیر جزء به جزء هیدروژن مایع یا به کمک الکترولیز طولانی مدت آب بدست آورد. برای تولید یک گالن (3/78 لیتر) «آب سنگین» $$(D _2 O)$$، به حدود 100 هزار گالن $$H _2 O$$ نیازمندیم. این نوع از آب، چگالی، نقطه ذوب و جوش بالاتری نسبت به آب معمولی دارد و در راکتورهای هستهای از آن تحت عنوان سوخت دوتریم استفاده میشود. جایگزینی پروتیوم با دوتریوم، کاربردهای مهمی در پژوهشهای مکانیسم واکنشهای «اثر ایزوتوپی سینتیکی» (Kinetic Isotope Effect) دارد.
تریتیوم
تریتیوم که آن را به شکل $$^ {3} H $$ نشان میدهند، در هسته خود دو نوترون دارد. ایزوتوپ خاصیت رادیواکتیوی دارد و نیمه عمر آن در حدود 12/3 سال است. این ایزوتوپ به طور پیوسته و در اثر پرتوهای کیهانی، در خارج از جو زمین تولید میشود. همچنین در یک راکتور هستهای و به کمک ایزوتوپ لیتیوم-۶ نیز میتوان تریتیوم را تولید کرد. علاوه بر این، در بمبهای هیدروژنی نیز از همین ایزوتوپ استفاده میکنند. بیشتر تریتیوم بوسیله بمباران لیتیوم با نوترون ساخته میشود. از این ایزوتوپ در راکتورهای همجوشی هستهای نیز بهره میگیرند.
اگر این مطلب برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای نرم افزارهای مهندسی شیمی
- آموزش آشنایی با تصفیه آب به روش اسمز معکوس (RO) با نرم افزار ROSA
- آبکاری — به زبان ساده
- تغییر شیمیایی — به زبان ساده
^^











سلام خسته نباشیدببخشیدبرای تولیدهیدروژنازاببهروشالکترولیزازچهفلزیبایداستفادهکردکهخوردهنشود؟
با سلام؛
پیشنهاد میکنیم برای اطلاعات بیشتر، مطلب «الکترولیز — به زبان ساده» را مطالعه کنید.
با تشکر از همراهی شما با مجله فرادرس
من همیشه برای سوالاتم فرا درس با گاما رو انتخاب میکنم به نظرم من کارتون عالیه توی آموزش ادامه بدید با تشکر از سایت و گروه خوبتون
سلام مهندس بحر کاظمی به غیر از آب موارد دیگر که تجزیه می کنیم برای تهیه هیدروژن چه ویژگی هایی دارد؟
سلا مهندس به غیر از آب موارد دیگر که تجزیه می کنیم برای تامین هیدروژن چه ویژگی دارد؟
چرا تجزیه آب برای تامین هیدروژن مورد نیاز پیل سوختی توجیه ندلرد؟
موارد دیگر غیر از آب که تجزیه می کنیم برای تامین هیدروژن چه ویژگی هایی دارد؟
سلام مهندس چرا تجزیه آب برای تامین هیدروژن مورد نیاز پیل سوختی توجیه ندارد؟
با سلام؛
علاوه بر هزینه بالا، خطر انفجار گاز هیدروژن بسیار زیاد و قدرت تخریبی آن بسیار بالا است. به همین دلیل در بسیاری از موارد، ایمنی دلیل اصلی استفاده نکردن از گاز هیدروژن تولیدی است.
با تشکر از همراهی شما با مجله فرادرس
سلام مهندس جان با انرژی حاصل از یک متر مکعب از احتراق هیدروژن چه مقدار میشه برق تولید کرد؟
عالی امیدوارم همیشه اینجوری باشه و به ککار خود ادامه بدید.
سلام. چرا گاز هیدروژن دیامغناطیس است؟
با سلام
به طور معمول، دیامغناطیس در موادی رخ میدهد که اتمهای آنها الکترونهایی جفتشده داشته باشند. به دلیل همین اصل فیزیکی، مولکول هیدروژن دارای ممان مغناطیسی خواهد بود و این ممان القایی که در مقابل میدان اعمال شده قرار دارد، موسوم به دیامغناطیس است.
با تشکر از همراهی شما با مجله فرادرس
سلام وروز بخیر چرا یون هیدروژن یک بار منفی بسیار ناپایدار است ودر طبیعت بافت نمیشود؟
با سلام؛
از آنجایی که این یون (هیدرید) در شکل آزاد خود، حالت برانگیختهای ندارد، به سادگی یافت نمیشود که این امر در سال ۱۹۷۷ به اثبات رسید که اثبات آن به کمک شتابدهندههای ذرات امکانپذیر بود.
از همراهی شما با مجله فرادرس سپاسگزاریم