مهندسی واکنش فتوکاتالیستی | به زبان ساده
واکنش فتوکاتالیستی ناهمگن، روشی جایگزین و مناسب برای حذف آلایندههای آلی از آب به شمار میآید. در علم شیمی، یک فتوکاتالیست (کاتالیزور نوری) به شتابدهی واکنش نوری میگویند که در حضور یک کاتالیزور انجام بگیرد. نور در واکنش فتوکالیستی توسط یک بستر (سوبسترا)، جذب میشود. تجزیه آلایندههای آلی در آب به کمک تابش تیتانیوم دیاکسید، از جمله تحقیقات جدید به شمار میآید. در این مطلب قصد داریم تا اصول اساسی در مدلسازی سرعت واکنش فتوکاتالیستی را بیان کنیم.
مرحله آغازین در واکنش فتوکاتالیستی
برای اینکه یک واکنش فتوکاتالیستی ناهمگن صورت بگیرد، وجود سه جزء در واکنش، الزامی است:
- یک فوتون گسیل شده (با طول موج مناسب)
- یک سطح کاتالیستی همچون مادهای نیمههادی
- عامل اکسنده قوی (در بیشتر موارد، اکسیژن)
دانشمندان نشان دادهاند که فوتونهای جذب شده باید به عنوان واکنشدهندهای غیرمادی در نظر گرفته شوند و همچون سایر ذرات واکنش، وجود آنها برای انجام واکنش، ضروری است.
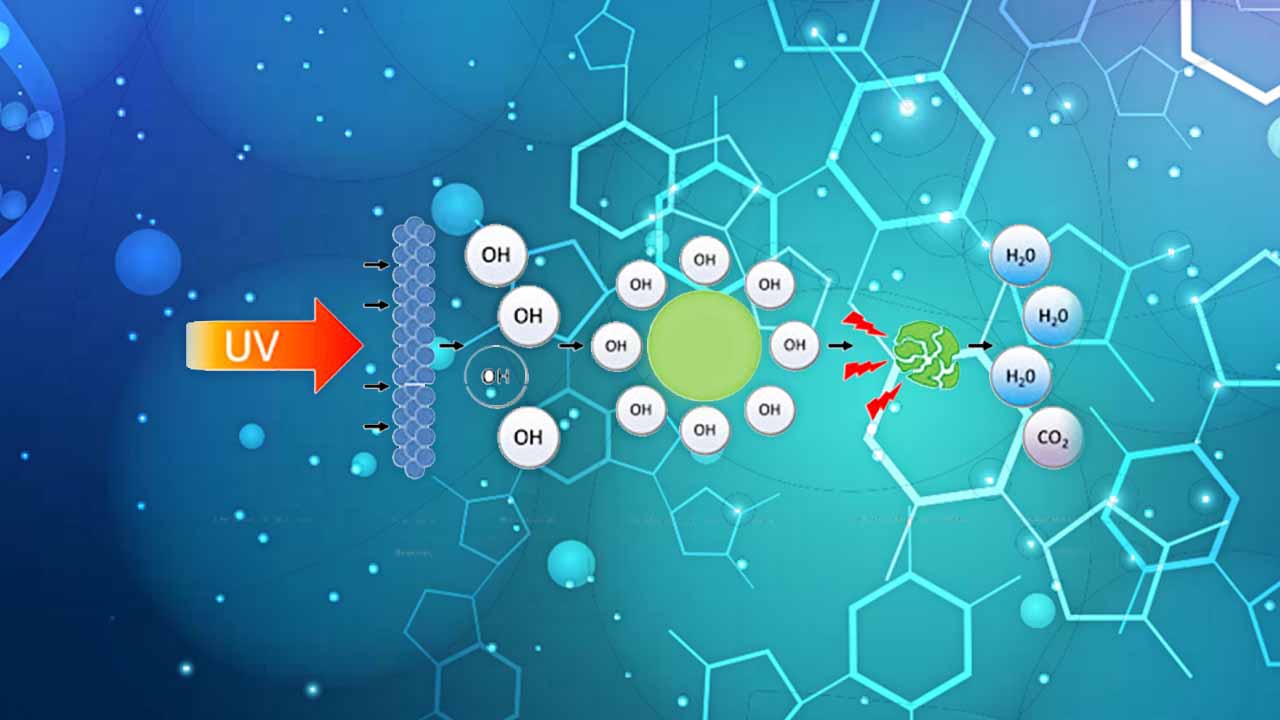
فرآیند فتوکاتالیستی ناهمگن زمانی آغاز میشود که یک فوتون با انرژی معادل یا بیشتر از «انرژی نوار ممنوعه» (Band Gap Energy) مربوط فتوکاتالیست، به سطح این کاتالیزور برسد و سبب برانگیختگی مولکولی شود.انرژی نوار ممنوعه $$(E_{bg})$$ به صورت اختلاف بین نوار ظرفیت پرشده و نوار رسانش خالی یک فتوکاتالیست تعریف میشود و مقادیری در حدود چند الکترونولت دارد.
برانگیختگی مولکولی سبب تولید الکترونهای متحرک در باند رسانش بالاتر $$(E_{cb})$$ و حفرههای مثبت در انرژیهای پایینتر باند ظرفیت $$(E_{vb})$$ در کاتالیست میشود. این توضیحات در رابطه زیر به همراه تصویر آن، آورده شده است.
$$\begin {equation} \text { photocatalyst } \stackrel {E _ {p h} \geq E_{b g} } {\longrightarrow} e^ {-}+h ^{+} \end {equation}$$
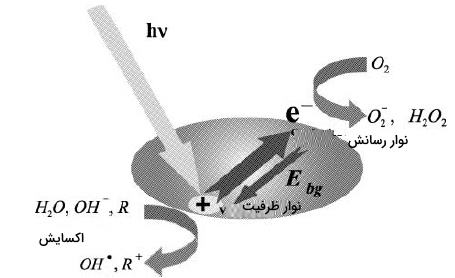
به دنبال مرحله آغازین تشکیل جفت حفره الکترونی، واکنش فتوکاتالیستی از طریق دستهای از وقایع شیمیایی به انجام میرسد. این اتفاقات، سبب بکارگیری حفره الکترونی $$(h^+)$$ برای فرآیندهای اکسایشی و به دام انداختن الکترون $$e^-$$ برای فرآیندهای کاهشی خواهد بود. همچنین، تشکیل آنیونهای سوپراکسید و هیدروژن پراکسید را از اکسیژن خواهیم داشت.
بین الکترون و مرحله ترکیب حفره الکترونی، رقابت وجود دارد. به عبارت دیگر، این رقابت بین رابطه بالا و عکس این رابطه برقرار است. در اثر این اتفاق، کارآیی فرآیند کاهش پیدا میکند و انرژی تامین شده توسط الکترون از دست میرود. این فرآیند را میتوان به عنوان یکی از عوامل مهم محدود کننده راندمان واکنش فتوکاتالیستی دانست.
مکانیسم واکنش فتوکاتالیستی
واکنش ناهمگن فتوکاتالیستی را میتوان به کمک مراحل (مکانیسم) مختلف توضیح داد. $$TiO_2$$ «برانگیخته نوری» (Photo-excited)، الکترون و حفره الکترونی تولید میکند.
$$\begin {equation} T i O _ {2} \stackrel {h v} {\longrightarrow} e ^ { - } + h^{+} \end {equation}$$
الکترون از بسترِ جذب شده ($$RX_{ad}$$)، آب جذب شده یا یون (OH_{ad})، به حفره الکترونی منتقل میشود.
$$\begin {equation} \begin {array} {r}
h^{+} +R X_{a d} \rightarrow R X_ {a d}^{+} \\
h ^{+}+\mid H _{2} O _{a d s} \rightarrow O H_ {a d s}^ {\bullet} + H^{+} \\
h^ {+}+O H _{a d}^{-} \rightarrow O H_{a d} ^ {\bullet}
\end {array} \end {equation}$$
مرحله سوم، اهمیت بسیار بالایی دارد چراکه در اثر تفکیک آب، طبق معادله زیر، یونها تشکیل میشوند.
$$\begin {equation} H _ {2} O \rightarrow O H _ {a d} ^ {-} + H^ {+} \end {equation}$$
اکسیژن مولکولی در واکنش انتقال الکترون، به عنوان یک پذیرنده رفتار میکند.
$$\begin {equation} H _ {2} O \rightarrow O H _ {a d} ^ {-} + H^ {+} \end {equation}$$
در واکنش بالا، آنیون سوپراکسید در واکنشهای زیر بکار گرفته میشود:
$$\begin {equation}
O_ {2}^{-}+ H^{+} \rightarrow H O_ {2} ^ {\bullet} \\
H ^{+}+ O_{2}^{-} + H O_{2}^ {\bullet} \rightarrow H_ {2} O_ {2}+ O_{2}
\end {equation}$$
«تبدیل نوری» (Photo Conversion) هیدروژن پراکسید، سبب تولید رادیکال آزاد بیشتری میشود.
$$\begin {equation} H_{2} O_{2} +h_ {v} \rightarrow 2 O H ^{\bullet} \end {equation}$$
در نهایت، رادیکالهای $$O H ^{\bullet}$$، آلایندههای جذب شده ($$R X _ {ad}$$) را بر روی ذرات دیاکسید تیتانیوم، اکسید میکنند و «مواد واسط» (Intermediate) تولید میکنند.
مواد واسط $$\begin {equation} O H_{a d} ^ {\bullet} + R X _ {a d} \rightarrow \end {equation}$$
رادیکالهای $$O H ^ {\bullet}$$ بسیار واکنشپذیر هستند و با حمله به مولکولهای آلاینده، آنها را به اسیدهای معدنی شامل دیاکسید کربن و آب تجزیه میکنند. واکنش فتوکاتالیستی را به ۲ صورت میتوان توضیح داد. برخی از دانشمندان پیشنهاد میدهند که اکسیداسیونی غیر مستقیم از طریق رادیکال هیدروکسیل صورت میگیرد و برخی دیگر اعتقاد دارند اکسیداسیون مستقیم از طریق «حفره باند ظرفیت» (Valence-band Hole) انجام میشود.

مدل سازی سرعت واکنش فتوکاتالیستی
مدل سازی واکنش فتوکاتالیستی بر اساس روابط ریاضی و به کمک دستهای از معادلات دیفرانسیل معمولی انجام میشود. هرکدام از این معادلات دیفرانسیل برای ذرات شیمیایی بکار گرفته میشوند. معادله ذرات شیمیایی در راکتورهای فوتوکاتالیستی را به شکل زیر میتوان نشان داد.
$$\begin {equation} V \frac {d C_ {i}} {d t}= \left [\sum_ {k} v _{i, k} R _{k} \right] W_ {i r r} \end {equation}$$
- $$V$$: حجم کلی راکتور
- $$C_i$$: غلظت ذره (جزء) i
- $$t$$: زمان
- $$v _{i, k}$$: ضریب استوکیومتری بدون بعد برای ذره شیمیایی در مرحله kام
- $$R_k$$: سرعت تبدیل نوری در مرحله kام
- $$W_ {i r r}$$: وزن واحد کاتالیست تحت تابش
رابطه بالا شامل تعدادی از فرضیات مهم است که در بیشتر واحدهای راکتورهای فتوکاتالیستی دیده میشود. این فرضیات در زیر آورده شدهاند.
- واحد راکتور در حالت «ناپیوسته» (Batch) کار میکند. این شرایط به دلیل سرعت نسبی کم در واکنش فتوکاتالیستی روی میدهد.
- $$W_ {i r r}$$، مجهول نیست.
- اختلاط و گردش مجدد سیال به اندازه کافی بالا است تا سرعت شبهثابت واکنش قابل تعریف باشد.
رابطه بالا را در برخی شرایط میتوان سادهتر و سرعت تبدیل نوری را بر اساس مقادیر و متغیرهای قابل اندازهگیری، بیان کرد. در صورتی که «i» (ترکیب مدل) برابر با ۱ باشد خواهیم داشت:
$$\begin {equation} r_ {1}= \frac {V} {W_ {i r r}} \frac {d C_{1}}{d t}= \sum_ {k} v_ {1, k} R_ {k} \end {equation}$$

۲ رابطه معرفی شده در بالا، سبب پیشرفت مدلهای تبدیل فتوکاتالیستی شد. اساس برخی از این مدلها بر اساس وزن کاتالیست بنا شده است. به این ترتیب، چنین پارامترهایی را میتوان به عنوان پارامترهای ذاتی به همراه مفهوم پدیدهشناسی مرتبط با واکنش فتوکاتالیستی دانست. یکی از این مدلها در رابطه زیر آورده شده است:
$$\begin {equation} \frac {d C _ {i}} {d t } = \frac {-k _{i}^ {\prime \prime \prime} C _ { i } } {1 + \sum _ { j = 1} ^ { n } K _ {j} C _ {j}} \end {equation}$$
در این رابطه، $$k_i$$، ثابت سینتیک برای ذره «i» و $$K_j$$، ثابت جذب برای ذره «j» است. در روشی مشابه قبل نیز میتوان به سرعت تبدیل نوری آلاینده مدل را به سطح خارجی کاتالیست $$(A_{irr})$$ مرتبط کرد.
$$\begin {equation} r _ { 1 } =\frac {V} {A _{i r r} } \frac {d C_ {1}} { d t } = \sum_ {k} v_ {1, k} R _{k} ^{\prime} \end {equation}$$
روش دیگر برای مدل کردن سرعت واکنش فتوکاتالیستی، بهرهگیری از سرعت «ظاهری» (Apparent) تبدیل نوری و بکارگیری $$V_{irr}$$ یعنی حجم راکتور تحت تابش است. در نتیجه، رابطه به شکل زیر تغییر میکند:
$$\begin {equation} V \frac {d C_ {i}} {d t } = \left [\sum _ {k} v _ {i, k} R _ { k } ^{ \prime \prime} \right] V _ {i r r} \end {equation}$$
- $$V$$: حجم کل راکتور (L)
- $$C$$: غلظت جزء «i» (گرم بر لیتر)
- $$t$$: زمان (ثانیه)
- $$v _ {i, k}$$: ضریب استوکیومتری بیبعد جزء «i» در مرحله k
- $$R _ { k } ^{ \prime \prime}$$: سرعت تبدیل نوری مرحله k
برای تبدیل نوری آلاینده مدل، رابطه بالا به شکل زیر تغییر پیدا میکند:
$$\begin {equation} r_ {1}^ {\prime \prime}= \frac {V} {V_ {i r r} } \frac {d C _{1}} {d t} \end {equation}$$
در نهایت، تعریف سرعت تبدیل نوری به صورت زیر خواهد بود:
$$\begin {equation} r_{1}^ {\prime \prime} = \frac {V} {V _ {i r r}} \frac {d C_ {1}} {d t}= \frac {\left (V_ {i r}+V_ {d}\right)} {V _{i r r}} \frac {d C _{1}} {d t } \end {equation}$$
در این رابطه، «V»، یعنی حجم راکتور مدل، ترکیبی خواهد بود از حجمهای تحت تابش و حجم غیرتابشی $$(V_ d)$$. در طول فرآیند محاسبه سرعت تبدیل نوری، به طور معمول، محققان تفاوتی بین حجم کلی راکتور و حجم تحت تابش قائل نیستند. توجه داشته باشید که تنها در شرایط بسیار ویژهای میتوان حجم راکتور را با حجم تحت تابش، یکسان در نظر گرفت و از این طریق، سرعت ظاهری تبدیل نوری را به طور مستقیم از طریق تغییر در غلظت آلاینده جزء «i» بدست آورد. که به این منظور، ۲ رابطه زیر را خواهیم داشت:
$$\begin {equation} \begin {array} {c}
\frac {d C _{1}} {d t}= \sum_ {k} v_ {1, k} R_ {k}^ {\prime \prime} \\
r _{1} = \frac {d C_{1}} {d t}
\end {array} \end {equation}$$
به طور خلاصه، برای مدلسازی یک آلاینده میتوان از رابطه زیر کمک گرفت:
$$\begin {equation} r _ {1} ^ {\alpha \prime}= r_{1} ^{\prime \prime} \frac {V_ {i r r}} {V} = r_ {1} ^{\prime} \frac {A_ {i r r}} {V}= r_{1} \frac {W_ {i r r}} {V} \end {equation}$$
بنابراین، زمانیکه تغییرات مشاهده شده غلظت اجزا در راکتورِ مشخص را به سرعت «تخریب نوری» (Photodegradation) مرتبط میکنیم باید مقادیر $$W_{irr}$$ و $$V_{irr}$$ را به عنوان دو پارامتر مهم در نظر داشته باشیم. پارامترهای سینتیکی را باید به کمک ضرایب ارائه شده در سال ۲۰۰۲ و به شکل زیر تصحیح کرد:
$$\begin {equation} k _ {1}^ {\prime \prime} = k_{1}^ {\prime \prime} \frac {V_ {i r r}} {V}= k_{1}^ {\prime} \frac {A_ {i r r}}{ V} = k_{1} \frac {W_{i r r}} {V} \end {equation}$$
تاثیر تابش نور و بارگذاری کاتالیزور بر سرعت فتوکاتالیستی
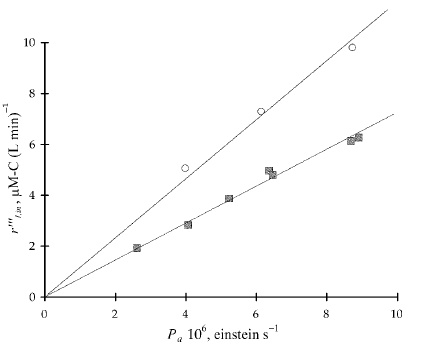
تابش لامپ و غلظت کاتالیزور، هردو نقش بسیار مهمی در فرآیندهای فتوکاتالیستی ایفا میکنند. تاثیر پارامترهای تابشی بر سرعت کل (ظاهری) تبدیل نوری را میتوان با تغییر قدرت بین ۰/۵ تا ۱ نشان داد. اثر وزن فتوکاتالیست را نیز میتوان با استفاده از تابع عمومی کاتالیزور تحت تابش، بیان کرد.
سرعت اولیه واکنش (سرعت ظاهری) به صورت حاصلضرب چندین ویژگی شامل تابعی وابسته به غلظت جزء i در شرایط اولیه $$(f_1(C_{i , in}))$$، تابع وابسته به غلظت یا وزن کاتالیست $$(f_2(C_{C}))$$ و تابع وابسته به سرعت فوتونهای جذب شده $$(f_3(P_{a}))$$ تعریف میشود.
$$\begin {equation} r_{i, i n} ^{ \prime \prime \prime} = f_ {1} \left (C_ {i, i n} \right ) f_{2} \left (C _{ C} \right) f _ {3} \left (P _{a} \right ) \end {equation}$$
بمنظور مشخص کردن وابستگی سرعت تبدیل نوری اولیه با $$(f_3(P_{a}))$$، دانشمندان در سال ۲۰۰۱، آزمایشی را شامل فنول با تغییر تابشهای جذب شده توسعه دادند. وابستگی سرعت تبدیل نوری با تابشی برخوردی را به کمک راکتور «Photo-CREC-Water II» و یک لوله شیشهای همراه با توریهایی با اندازه متفاوت، توسعه دادند.
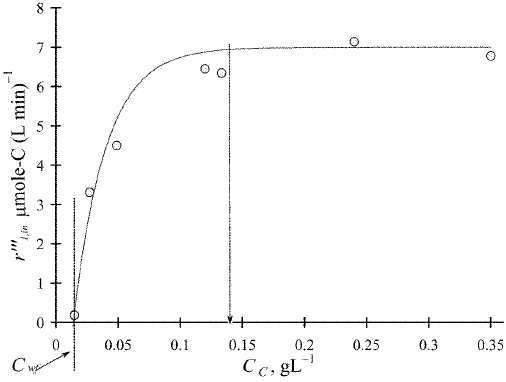
تاثیر بارگذاری کاتالیست $$(f_2(C_{C}))$$ بر سرعت کلی تبدیل نوری اولیه، در تصویر زیر نشان داده شده است. غلظت کاتالیزور از صفر تا 0/35 گرم بر لیتر، تغییر پیدا میکند که به ترتیب متناظر با انتقال تابش 100 و 0/005 درصد است. مشاهده میشود که برای شروع تخریب نوری، مقداری حداقلی از کاتالیزور $$C_{wf}$$ نیاز داریم.
همچنین، درمییابیم که سرعت کلی واکنش با بارگذاری کاتالیست تا زمانی افزایش پیدا میکند که $$r_{1, i n} ^{ \prime \prime \prime}$$ به حداکثر مقدار خود در حدود $$7.0 \mu \ mole-C (L min)^ {-1}$$ در غظت کاتالیزور بیش از 0/14 گرم بر لیتر، برسد.
فیلم آموزش آشنایی با مهندسی واکنش های فوتوکاتالیستی
آنچه که تا اینجا گفته شد، تنها مقدمهای ساده و کلی از مهندسی واکنشهای فتوکاتالیستی بود. با توجه به این که در دو دهه اخیر، واکنش فتوکاتالیستی در تصفیه آبها و توسعه سطوحِ خود تمیزشونده نقش داشتهاند و میتوان این فرآیندها را به عنوان یک تکنولوژی جدید در نظر گرفت، «فرادرس» اقدام به انتشار آموزش ویدیویی با عنوان «آموزش آشنایی با مهندسی واکنشهای فوتوکاتالیستی» کرده که در ادامه، مروری اجمالی بر این آموزش خواهیم داشت.
این آموزش از چهار درس تشکیل میشود که در درس یکم، مقدمهای کلی از واکنش فتوکاتالیستی به همراه مکانیسم و معادلات سرعت واکنش ارئه میشود. درس دوم به معرفی تجهیزات و انواع بازده اختصاص دارد و در درس سوم، راکتورهای فتوکاتالیستی معرفی میشوند.