ماتریکس خارج سلولی چیست؟ — وظایف، انواع و ترکیبات — به زبان ساده
«ماتریکس خارج سلولی» (Extracellular Matrix | ECM) مجموعهای از پروتئینهای رشتهای و غیررشتهای و دیگر مولکولهای فعال زیستی است که بسیاری از فرایندهای سلولی را هدایت میکند. ماتریکس، در بافتهای مختلف ترکیب و ساختار متفاوتی دارد که متناسب با فعالیتهای همان بافت است. ترکیب ماتریکس در بافت پیوندی مثل چسبی محکم سلولها را بههم میچسباند. در این مطلب با ترکیب ماتریکسهای مختلف، تفاوتها و نحوه شکلگیری آنها آشنا میشویم.
ماتریکس خارج سلولی چیست ؟
ماتریکس خارج سلولی را میتوان سوسپانسیونی از درشتمولکولها در نظر گرفت که دامنه وسیعی از فعالیتها، از رشد و تثبیت یک بافت تا حفظ هومئوستازی کل اندام را انجام میدهند. تمام مولکولهای ساختاری و بیشتر مولکولهای محلول در ماتریکس خارج سلولی بهوسیله سلولهای اطراف ساخته و ترشح میشوند. ساختار شبکهای این ماتریکس بهوسیله اتصال عرضی رشتههای پروتئینی شکل میگیرد. ماتریکس خارج سلولی از دو نوع تشکیل شده است.
- «غشای پایه» (Basal Lamina): ترکیبات اصلی غشای پایه لامینین، فیبرونکتین و کلاژن IV هستند. این بخش تراکم بیشتر و منافذ کمتری نسبت به بخش شبکهای دارد. پرلیکان، گلیکوپروتئین مهم در غشای پایه است که فاکتور رشد فیبروبلاستی و رگزایی به آن میچسبند. این بخش، ماتریکس خارج سلولی بافت پوششی است.
- «ماتریکس شبکهای» (Interstitial Matrix): ترکیبات اصلی این بخش کلاژن، الاستین و فیبرونکتین هستند که ژل سهبعدی بیشکلی میسازند.
ماتریکس خارج سلولی چه وظایفی دارد؟
با وجود اینکه سلولهای بافت فاصله بسیار کمی با هم دارند، اما درهمفرورفته نیستند و بهوسیله مولکولهای ماتریکس در ارتباط با هم قرار میگیرند. ECM نهتنها فاصله بین سلولی را پر میکند بلکه در حفظ آب و هومئوستازی بافت نیز نقش کلیدی دارد. ماتریکس خارج سلولی وظایف زیر را در بافت انجام میدهد.
- اتصال سلولها به هم
- جلوگیری از مهاجرت سلول یا ایجاد مسیر برای آن
- ذخیره و کمک به انتقال پیام
- جلوگیری یا انتقال فشار مکانیکی به بافت
ترکیبات ماتریکس خارج سلولی
ساختار شبکهای ماتریکس خارج سلولی را ترکیبات زیر تشکیل میدهند.
- فیبرهای پروتئینی: ویژگیهای مکانیکی ماتریکس به این مولکولها بستگی دارد.
- کلاژن
- الاستین
- پروتئوگلایکانها: این مولکولها از یک بخش پروتئینی و یک بخش پلیساکاریدی به اسم «گلایکوزآمینوگلایکانها» (Glycosaminoglycans | GAGs) تشکیل شدهاند.
- تناسین
- اگریکان
- گلیکوپروتئینها: این مولکولها از بخش پروتئینی بزرگ و چند زنجیره کربوهیدات تشکیل شدهاند.
- فیبرونکتین
- لامینین
- فاکتورهای رشد
- متالوپروتئینازهای ماتریکس

فیبرهای پروتئینی
کلاژنها و الاستین فیبرهای پروتئینی هستند که بیشتر بهصورت پیشساز از سلولهای ترشح میشوند و هضم آنزیمی آنها را به شکل فعال تبدیل میکند.
کلاژن
کلاژن سومین پروتئین فراوان در بدن پستانداران و جزو ساختاری مهم در ماتریکس خارج سلولی است. این پروتئین با آرایش رشتهای، استحکام لازم برای محافظت از بافت در برابر فشار و کشش را در ماتریکس بهوجود میآورد. ۳۰ نوع کلاژن در بدن انسان شناسایی شده است که فقط انواع I، II، III، V و XI در ساختار ماتریکس خارج سلولی شرکت میکنند.
کلاژن نوع V و VI در تشکیل غشای پایه پوست مشارکت دارند. این پروتئین ساختاری، در تاندون و مفصل نیز وجود دارد. با افزایش سن تولید کلاژن در بدن کاهش مییابد. دیگر مولکولهای ECM ازجمله پروتئوگلایکان دکورین و فیبرومودولین، و رسپتورهای غشایی ازجمله اینتگرین آرایش کلاژنها را تنظیم میکنند.
الاستین
الاستین پروتئین ساختاری دیگر ماتریکس است که به کلاژن متصل میشود. خواص مکانیکی این پروتئین، کمک میکند بافتی مثل پوست، پس از تحمل کشش مداوم به حالت اولیه برگردد.
تفاوت الاستین و کلاژن
الاستین و کلاژن هر دو پروتئینهای رشتهای هستند که در ساختارهای مختلف بدن ازجمله بافت پیوندی شرکت میکنند. هر دو این پروتئینها بهوسیله فیبروبلاستها و بهصورت پیشساز ساخته میشوند. فراوانی کلاژن در بدن از الاستین بیشتر است. دیگر تفاوتهای این دو مولکول را در جدول زیر شرح میدهیم.
| الاستین | کلاژن |
| فراوانی کمتر از کلاژن | فراوانی بیشتر از الاستین |
| زرد رنگ | سفید رنگ |
| فراوانی بیشتر در رگ خونی و پوست | فراوانی بیشتر در بافت پیوندی، ماهیچهها، استخوان و قرنیه |
| افزایش خاصیت کشسانی ساختار | افزیش استحکام ساختار |
| تولید از ابتدای تولد تا شروع پیری | تولید بخش اعظم آن در دوره جنینی و عدم تولید پس از بلوغ |
پروتئوگلایکان
این مولکولها از دو بخش پروتئینی و قندی تشکیل میشوند. بخش قندی، پلیساکارید بدون انشعاب که از واحدهای تکراری دیساکاریدی تشکیل میشود. یکی از مونوساکاریدهای موجود در به این واحدها قندهای آمنیه $$-N$$استیل گلوکز آمین یا $$-N$$استیل گالاکتوزآمین است که در بیشتر مواقع گروههای سولفیدی به آنها متصل میشوند. به همین دلیل به این واحدهای تکراری GAGs (حروف اول ترکیبات آن) میگویند. براساس نوع قند و پیوند بین آنها، و تعداد و محل اتصال گروههای سولفیدی، GAGs به چهار گروه اصلی تقسیم میشوند.
- «هیالورونان» (Hyaluronan)
- «کندوروتین سولفات» (Chondroitin Sulfate) و «درماتان سولفات» (Dermatan Sulfate)
- «هپاران سولفات» (Heparan Sulfate)
- «کراتان سولفات» (Keratan Sulfate)
زنجیرههای پلیساکاریدی برخلاف فیبرهای پروتئینی، انعطافپذیر نیستند و بهدلیل بار منفی زیادی که در ساختار دارند، کاتیونها (بیشتر $$Na^+$$) را بهخود جذب میکنند. این برهمکنش سبب ایجاد اختلاف فشار اسمزی و جذب فراوان آب میشود. جذب آب با ایجاد فشار تورمی یا آماسی، ماتریکس را در برابر نیروهای خارجی مقاوم میکند.
هیالورونان
«هیالورونان» (Hyaluronan) یا هیالورونیک اسید یکی از سادهترین GAGs است. این پلیساکارید تنها GAG سولفاته نشده است و در تمام بافتهای جانوری بهخصوص جنین وجود دارد. هیالورونان هسته پروتئینی ندارد و برخلاف دیگر ترکیبات ماتریکس، بهجای اگزوسیتوز بهوسیله مجموعه آنزیمی موجود در غشای سلولی، خارج میشود. وظایف هیالورونان در زیر آمده است.
- ایجاد مقاومت در برابر فشارهای مکانیکی
- کاهش اصطحکاک در مفصلها
- ایجاد مسیر برای مهاجرت سلولی
- پرکننده فضای خالی بین سلولی در دوران جنینی و ایجاد تغییر شکل در بافتها
گلیکوپروتئینها
گلیکوپروتئینها مولکولهایی هستند که از یک بخش پروتئینی و یک بخش کربوهیدراتی تشکیل میشوند. فیبرونکتین، لامینین و تناسین ازجمله گلیکوپروتئینهای ماتریکس خارج سلولی بهحساب میآیند.
فیبرونکتین
فیبرونکتین گلیکوپروتئینی در غشای پایه ماتریکس خارج سلولی است و در اتصال سلولها به هم و ترمیم زخم نقش کلیدی دارد. این پروتئین به دو شکل در بدن وجود دارد.
- فیبرونکتین پلاسما: در سلولهای کبدی ساخته میشود و بهوسیله گردش خون به بافت میرسد.
- فیبرونکتین سلولی: بهوسیله تعدا زیادی از سلولها ازجمله کندروسیتها، سلولهای اندوتلیال و فیبروبلاستها ساخته میشوند.
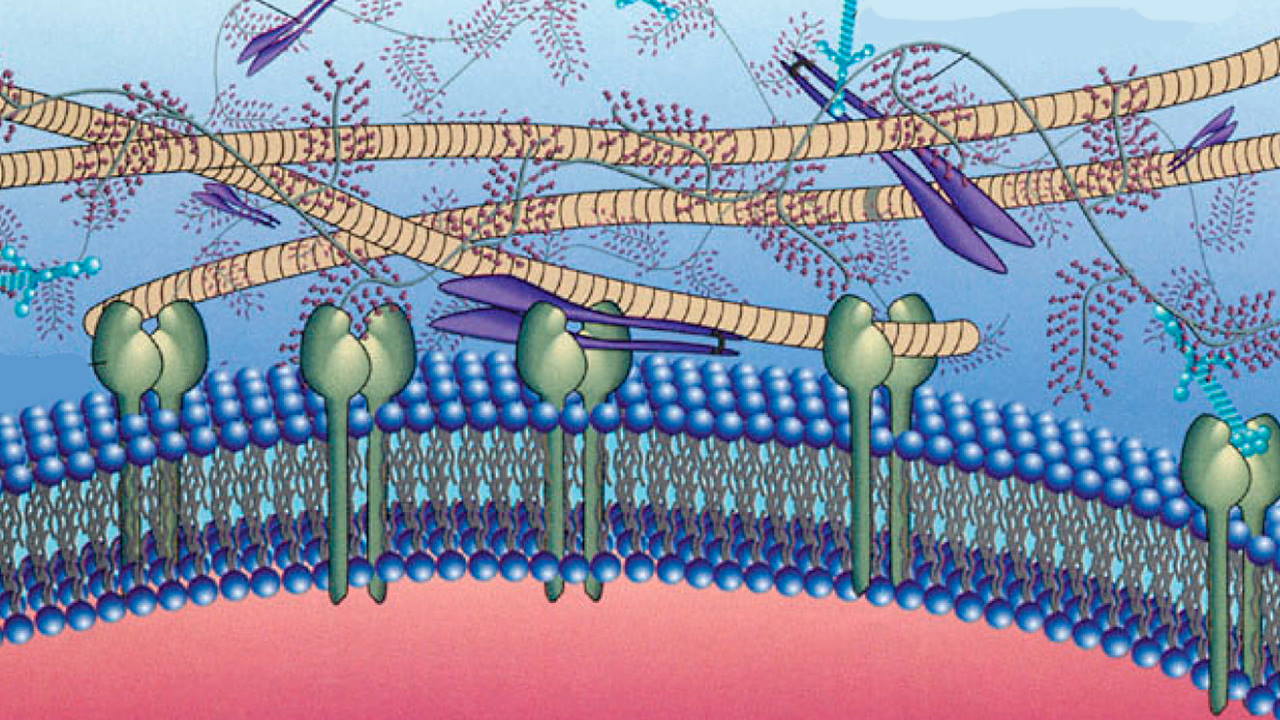
آرایش مولکولهای فیبرونکتین مثل کلاژن به شکل شبکهای توری (Mesh) است که به رسپتورهای سلولی متصل میشود. رشتههای فیبرونکتین که در سطح یا نزدیکی فیبروبلاستها قرار دارند، با رشتههای اکتین اسکلت داخل سلولی موازی هستند. این دو رشته داخلی و خارجی سلول، به کمک مولکولهای عرض غشایی اینتگرین برهمکنش میکنند. در نتیجه کشیده شدن رشتههای فیبرونکتین بهوسیله اکتین، جایگاه اتصال فیبرونکتین در دسترس قرار میگیرد و اتصال مستقیم این رشتهها به هم را تسهیل میکند. افزون بر این، این کشش تعداد بیشتری از جایگاههای اتصال به اینتگرین را در دسترس قرار میدهد. اکتین، پلیمریزاسیون و ساختاربندی فیبرونکتینها از این راه کنترل میکند.
لامینین
لامینین پروتئینی بزرگ و انعطافپذیر است. این گلیکوپروتئین تریمر از سه زنجیره $$\alpha$$، $$\beta$$ و $$\gamma$$ تشکیل میشود که با پیوندهای دیسولفیدی بههم متصل و ساختاری متقارن تشکیل میدهند. بسیاری از سلولها ازجمله سلولهای ماهیچهای و سلولهای اپیتلیال، لامینین ترشح میکنند. این پروتئینها در تمایز و مهاجرت سلولی نقش دارند.
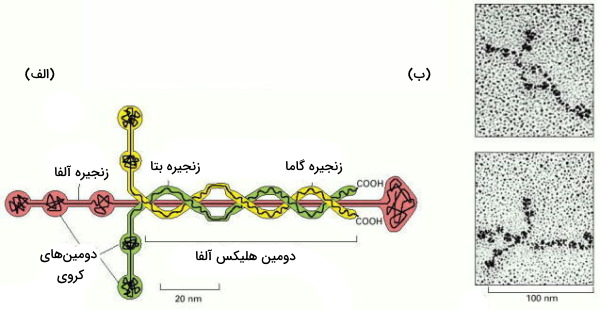
جایگاههای اتصال لامینین، به گلیکوپروتئینهای پرلیکان و نیدوژن، و رسپتورهای سطح غشایی متصل میشوند.
تناسین
پروتئینهای «تناسین» (Tenascins) ۵ نوع هستند. این پروتئینها در ماتریکس خارج سلولی بافت پیوندی که فشار و نیروهای مکانیکی زیادی تحمل میکند بیشتر است اما در پوست و مغز نیز وجود دارد.
تفاوت پروتئوگلاین و گلیکوپروتئین
با اینکه پروتئوگلایکان و گلیکوپروتئینها هردو از ترکیب پروتئين و کربوهیدرات تشکیل میشوند، مولکولهای متفاوتی هستند که تفاوت آنها را در جدول زیر شرح میدهیم.
| گلیکوپروتئین | پروتئوگلایکان |
| همه پروتئینهای متصل به کربوهیدرات هستند. | پروتئینهای متصل به گلیکوآمینوگلایکان هستند. |
| ۱۰ تا ۱۵٪ ترکیبات قندی است. | ۵۰ تا ۶۰٪ ترکیبات قندی است. |
| بخش قندی منشعب و غیرمنشعب دارد. | بخش قندی منشعب دارد. |
| بخش قندی بار مثبت یا بار منفی دارد. | بخش قندی بار منفی دارد. |
| بیشتر در غشای سیتوپلاسمی وجود دارد. | بیشتر در ماتریکس خارج سلولی وجود دارد. |
| پروتئینهای عرض غشایی است. | پروتئین خارج سلولی است. |
| در اتصال سلول یه سلول و انتقال پیام نقش دارد. | در استحکام بخشیدن به بافت نقش دارد. |
فاکتورهای رشد
ماتریکس خارج سلولی، منبع ذخیرهای برای فاکتورهای رشد است. فاکتورهای رشد اندوتلیال رگ خونی، فاکتور رشد فیبروبلاستی و «فاکتور رشد تغییر شکل» (Transforming Growth Factor) ازجمله فاکتورهای رشدی هستند که بهوسیله گلیکوپروتئینهای هپارین یا هپارین سولفات به فیبرهای ECM متصل میشوند.
متالوپروتئینازهای ماتریکس
متالوپروتئینازها ازجمله پروتئازهای کلیدی در تجزیه ماتریکس هستند. تجزیه ماتریکس خارج سلولی در برخی فرایندهای بافت ازجمله رگزایی و بازسازی استخوان بسیار مهم است. بههمین دلیل تنظیم آنها بهدقت و از سه روش زیر کنترل میشوند.
غشای پایه
غشای پایه، ماتریکس خارج سلولی باریک (۴۰-۱۲۰ نانومتر) و انعطافپذیری است که سطح زیری تمام بافت پوششی و لولههای بدن را میپوشاند. افزون براین، غشای پایه غلافی اطراف سلولهای ماهیچهای، چربی و «شوآن» (Schwann Cell) تشکیل میدهد و سلول را از بافتهای دیگر جدا میکند. در گلومرولهای کلیوی، غشای پایه بین دو صفحه سلولی قرار می گیرد و فیلتر انتخابی مواد است. به وظایف دیگر غشای پایه در زیر اشاره میکنیم.
- تعیین قطبیت سلول
- تغییر متابولیسم سلول
- سازماندهی پروتئینها در غشای پلاسمایی سلولهای مجاور
- بهبود بقا، تکثیر و تمایز سلولها
- ایجاد مسیر اختصاصی مهاجرت
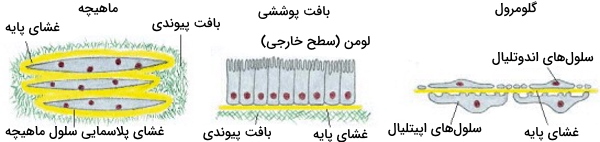
غشای پایه بهوسیله سلولهای اطراف تولید و ترشح میشود و در بعضی از بافتهای چندلایه، مثل بافت اپتلیومِ مخطط مکعبی، که اپیدرم پوست را تشکیل میدهد، بهوسیله فیبرهای کلاژن VII به بافت پیوندی متصل میشود. اصطلاح «Basement Membrane» معمولا برای توضیح ترکیب غشای پایه و لایه کلاژن اتصالی استفاده میشود. در بعضی بیماریهای پوستی این اتصال از بین میرود و برآمدگی اپیدرم، تاول پوستی ایجاد میکند.
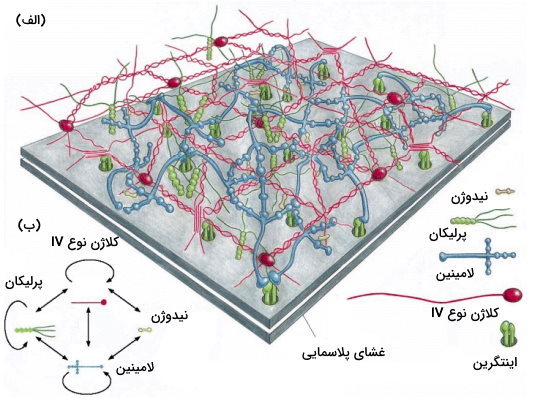
ترکیب غشای پایه از سلولی به سلول دیگر متفاوت است اما بیشتر غشاهای پایه بالغ از ترکیبات زیر تشکیل میشوند.
- مولکول کلاژن IV: این پروتئین چند ایزوفرم دارد که انعطافپذیری بیشتری نسبت به از فرم رشتهای دارند. کلاژن IV از سه هلیکس بههمپیچیده تشکیل میشود که پس از ترشح هضم آنزیمی ندارند.
- گلیکوپوتئین پرلیکان (یک نوع هپارین سولفات)
- گلیکوپروتئین لامینین
- «اینتاکتین» (Entactin) یا «نیدوژن» (Nidogen)
وظایف غشای پایه
غشای پایه وظایف متنوعی دارد.
- فیلتر مولکولی: در گلومرولها، غشای پایه یک فیلتر مولکولی است که به تشکیل ادرار کمک میکند. مولکول هپارین سولفات در انجام این عملکرد نقش مهمی دارد، چون فعالیت فیلتری غشا با تجزیه آنزیمی زنجیرههای GAG از بین میرود.
- سد نیمهتراوا: غشای پایه در بعضی بافتها مثل یک سد نیمهتروا عمل میکند. برای مثال در اپیتلیوم اجازه ارتباط فیبروبلاستها با سلولهای اپیتلیوم را نمیدهد اما ماکروفاژها و لنفوسیتها از آن عبور میکنند.
- بازسازی و ترمیم بافت: وقتی سلولهای ماهیچهای، عصبی و پوششی آسیب میبینند، غشای پایه مثل داربستی عمل و به مهاجرت سلولهای ترمیمی و بازسازی بافت کمک میکند.در بعضی بافتها مثل پوست و قرنیه، میزان فیبرونکتین غشای پایه پس از جراحت افزایش مییابد و مهاجرت سلول را تسهیل میکند.
ترشح ماتریکس خارج سلولی
ترکیبات ماتریکس خارج سلولی، را سلولهایی میسازند که ماتریکس آنها را احاطه کرده است و سازمانیافتگی اسکلت سلولی، در سیتوپلاسم، سازمانیافتگی ماتریکس خارج سلولی را کنترل میکند. در بیشتر بافتهای پیوندی، فیبروبلاستها ترکیبات ماتریکس خارج سلولی را تولید و ترشح میکنند. در بافت غضروفی و استخوانی این ترکیبات بهوسیله نوع خاصی از فیبروبلاستها به نام کندروسیت و استئوبلاست تولید میشوند.
ماتریکس خارج سلولی در مهاجرت سلول
طول عمر مولکولهای ماتریکس خارج سلولی در فرایندهای زیستی نقش مهمی دارد. برای مثال به دلیل جمع شدن رحم پس از تولد نوزاد، سرعت فرسایش ماتریکس افزایش مییابد. گلبولهای سفید نیاز است برای پاسخ به عفونت از غشای پایه رگهای خونی مهاجرت و به بافت عفونی برسند. در این شرایط ماتریکس با همکاری پروتئازهای ترشحی از سلولهای اطراف، تجزیه میشود. این پروتئازها دو دسته هستند.
- متالوپروتئازهای ماتریکس که برای فعالیت به $$Ca^{+2}$$ و $$Zn^{+2}$$ نیاز دارند.
- سرین پروتئینازها که در جایگاه فعال آنها سرین فعال دارند.
تجزیه ماتریکس خارج سلولی از چند روش مهاجرت سلول را تسهیل میکند.
- مسیر حرکت سلول را باز میکند.
- با در دسترس قرار دادن جایگاههای اتصال مخفی، اتصال سلول-سلول، سلول-ماتریکس یا هر دو را افزایش میدهد.
- باز شدن اتصال سلول و در نتیجه مهاجرت آن را افزایش میدهد.
- پروتئینهای انتقال پیام خارج سلولی آزاد میکند که مهاجرت را تحریک میکنند.
فعالیت پروتئازهای دخیل در مهاجرت سلولی با سه مکانیسم پایه کنترل میشوند.
- فعال شدن منطقهای: بسیاری از پروتئازها بهشکل پیشسازهای غیرفعال ترشح میشوند که در مواقع لازم فعال شوند.
- محدود شدن بهوسیله گیرندههای سطحی: بسیاری از سلولهای رسپتورهای سطحی پروتئیاز دارند که فعالیت این آنزیم را در منطقهای خاص محدود میکند.
- ترشح مهارکنندهها: بعضی سلولهای مولکولهای مهارکنندهای ترشح میکنند که مخصوص پروتئازها است و با اتصال محکم به جایگاه فعال آنزیم، فعالیت آن را مسدود میکند.
ماتریکس خارج سلولی بافت پیوندی
بافت پیوندی یکی از چهار بافت پایه انسان است و از ترکیبات رشتهای ECM تشکیل میشود. بافت پیوندی، از بافتهای نرمی مثل چربی تا بافتهای بسیار سخت مثل استخوان را شامل میشود. تفاوت ماتریکس خارج سلولی در این بافتها یکی از اصلیترین دلایل ویژگیهای مکانیکی و سختی این بافتها است.
ماتریکس خارج سلولی غضروف
ماترکیس خارج سلولی غضروف از دو ترکیب اصلی تشکیل شده است که ویژگیهای مکانیکی و ساختاری آن را تعیین میکند.
- شبکه کلاژنی: مقاومت کشسانی ماتریکس غضروف را تعیین میکند.
- پروتئوگلایکانها: بیشترین پروتئوگلایکان موجود در ماتریکس خارج سلولی غضروف، «اگریکان» (Aggrecan) است. خاصیت کشسانی و تورم اسمزی ماتریکس را این ماده تعیین میکند.
ماتریکس خارج سلولی استخوان چه ترکیبی دارد ؟
ترکیب ماتریکس خارج سلولی استخوان، از ۴۰٪ مواد آلی و ۶۰٪ مواد معدنی تشکیل میشود و ترکیب آن بر اساس جنسیت، سن و وضعیت سلامتی فرد تغییر میکند. ترکیبات اصلی ماتریکس خارج سلولی استخوان به شرح زیر است.
- بخش آلی: بخش آلی ماتریکس خارج سلولی در استخوان از رشتههای پروتئینی و گلیکوپروتئینها تشکیل شده است.
- کلاژن: کلاژنهای I، III و IV فراوانترین مولکولهای بخش آلی ماترکیس در استخوان هستند. که از بین آنها نوع I بیشترین سهم را به خود اختصاص میدهد. وظیفه اصلی این مولکولها ایجاد داربست برای سلولهای استخوانی است.
- پروتئوگلایکان: این مولکولها در تکثیر سلولی، استخوانزایی، رسوب مواد معدنی و بازسازی بافت استخوان نقش دارند.
- پروتئینهای حاوی کربوکسی گلوتامیک اسید: این پروتئینها به مولکول $$\gamma$$ کربوکسی گلوتامیک اسید متصل میشوند و در سرم، ماتریکس استخوان و دندان وجود دارند.
- گلیکوپروتئینها: «استئونکتین» (Osteonectin) یکی از گلیکوپروتئینهای فراوان در ماتریکس استخوان است. این مولکول نقش مهمی در تنظیم آزادشدن کلسیم دارد.
- بخش معدنی: ماده معدنی اصلی در بافتهای سخت ازجمله استخوان و دندان، هیدروکسی آپاتیت (AH | $$Ca_{5}(PO_4)_3OH)$$)) است. AH در فرایند «معدنی شدن زیستی» (Biomineralization) رسوب میکند. برهمکنش بین بخش معدنی و پروتئینهای غیرکلاژنی تشکیل AH را کنترل میکند. کلاژن طی فرایند معدنی شدن تولید میشود و الگویی برای رسوب هیدروکسی آپاتیت است.
ماتریکس خارج سلولی در سرطان
ماتریکس خارج سلولی در گسترش و پیشرفت سرطان نقش مهمی دارد. افزایش پروتئینهای ECM، ویژگیهای لازم برای تکثیر، مهاجرت و تهاجم سلولهای سرطانی را تسهیل می کند. مولکولهای ماتریکس خارج سلولی ازجمله هیالورونان و فیبرونکتین از اجزای اصلی ماتریکس سلولهای متاستازی هستند. این دو مولکول با فعال کردن مسیرهای مختلف در سلولها، تکثیر سلول از راه میتوز را افزایش میدهند.
جمعبندی
ماتریکس خارج سلولی ترکیبی ار مولکولهای ترشح شده از سلولها است که حمایت ساختاری و بیوشیمیایی از سلولها، بافت و اندام ایجاد میکند. ترکیب ماتریکس خارج سلولی در بافت انسان، آب، پروتئینها و پلیساکاریدهایی است که درصد ترکیب آنها عملکرد ماتریکس را نشان میدهد.