لیگاند چیست؟ — به زبان ساده
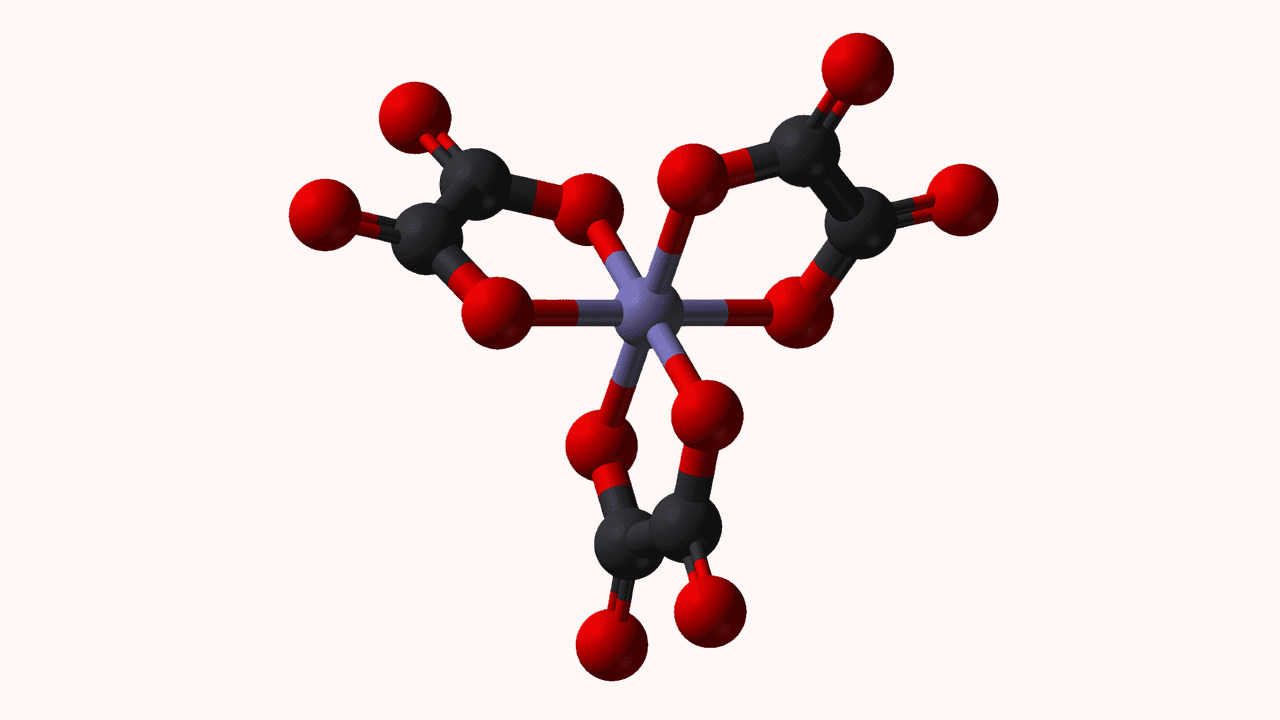
لیگاند «Ligand» یون یا مولکولی است که با دادن یک جفتالکترون به اتم یا یون فلز مرکزی، کمپلکس کوئوردیناسی تشکیل میدهد. گزینش نوع لیگاند در زمینههایی چون شیمی معدنی زیستی و شیمی دارویی، کاتالیز همگن و شیمی محیط زیست یکی از پارامترهای پراهمیت بهشمار میرود. در این مطلب یاد میگیریم که لیگاند چیست و با انواع آن آشنا میشویم.
لیگاند چیست ؟
لیگاندها مولکولهای خنثی یا یونهایی هستند که با اتصال به اتم فلز مرکزی، کمپلکسهای کوئوردیناسی تشکیل میدهند. لیگاندها به عنوان «بازهای لوئیس» (Lewis Bases) در نقش دهنده جفتالکترون و فلز مرکزی در «کمپلکس کوئوردیناسی» (Coordination Complex) به عنوان اسید لوئیس و پذیرنده جفتالکترون در نظر گرفته میشوند. در مواردی استثنا نیز لیگاندها نقش اسید لوئیس را دارند.
لیگاند از واژه لاتین «Ligare» گرفته شده و به معنی «گره زدن، اتصال یا بستن» است که نخستین بار توسط «آلفرد استاک» (Alfred Stock) شیمیدان آلمانی استفاده شد. لیگاندها دست کم یک اتم با یک جفتالکترون دارند که برای تشکیل پیوند کووالانسی با اتم مرکزی استفاده میشود. تقریبا در هر شرایطی فلزها و شبهفلزات میتوانند به لیگاندها متصل شوند. در کمپلکسهای کوئوردیناسی، لیگاندها واکنش پذیری اتم مرکزی را تعیین میکنند و روی ویژگیهای زیر تأثیر میگذارند.
- نرخ جایگزینی لیگاند: به مبادله یک لیگاند با لیگاند نرخ جایگزینی لیگاند میگویند و در سنتز، استریوشیمی و شیمی کاتالیزوری مهم هستند.
- واکنش لیگاندها با یکدیگر
- واکنشهای اکسایش-کاهش (ردوکس)
لیگاندها میتوانند آنیون، کاتیون یا مولکولهای خنثی باشند. نمونههایی از انواع لیگاند در زیر فهرست شده است.
- لیگاندهای کاتیونی: $$NO^+, N_2H_5^+$$
- لیگاندهای آنیونی: $$F^–, Cl^–, Br^–, I^–, S_2^–, CN^–, NCS^–, OH^–, NH_2^–$$
- لیگاندهای خنثی: $$NH_3, H_2O, NO, CO$$
انواع لیگاند
لیگاندها به روشهای مختلفی چون پیوند با اتم فلز مرکزی، بار، اندازه و تعداد الکترونهای اهدایی بر اساس «پیوندپوشی» (Hapticity) و «دندانگی» (Denticity) دستهبندی میشوند. لیگاندها بسته به تعداد الکترونهایی که برای پیوند بین لیگاند و اتم مرکزی فراهم میکنند، به لیگاندهای $$L$$ یا $$X$$ یا ترکیبی از آنها طبقهبندی میشوند.
- لیگاندهای $$L$$: دو الکترون را از جفتالکترون غیرپیوندی به اشتراک میگذارند که در نتیجه پیوند داتیو ایجاد میشود.
- لیگاندهای $$X$$: تنها یک الکترون را به اشتراک میگذارند و اتم مرکزی الکترون دیگر را فراهم میکند و پیوند کووالانسی تشکیل میدهد.
در آلکنها، پیوندهای پای میتوانند با اتمهای فلز کوردینه شوند. برای مثال اتیلن در کمپلکس $$[PtCl_3(C_2H_4)]^-$$ یا نمک زایس چنین شرایطی دارد.
لیگاند تک دندانه
«لیگاندهای تکدندانه» (Mono Dentate Ligands) که یک دندان نیز نامیده میشوند با اتم فلز مرکزی تنها یک پیوند ایجاد میکند. در زیر برخی از رایجترین لیگاندهای تکدندانه فهرست شده است.
| لیگاند | نام |
| $$Br^-$$ | یون برومید |
| $$F^-$$ | یون فلورید |
| $$Cl^-$$ | یون کلرید |
| $$I^-$$ | یون یدید |
| $$H_2O$$ | اکوآ |
| $$NH_3$$ | آمونیاک |
| $$OH^-$$ | هیدروکسید |
| $$CO$$ | کربن مونوکسید |
| $$CN^-$$ | یون سیانید |
| $$SCN^-$$ | یون تیوسیانات |
لیگاند دو دندانه
بازهای لوییس که دو جفتالکترون به اتم فلز مرکزی میدهند به عنوان «لیگاندهای دودندانه» (Bidentate Ligands) یا «شلات کننده» (Chelating Ligands) شناخته میشوند. «اتیلن دیآمین» (Ethylenediamine | en) و «یون اگزالات» (Oxalate Ion | ox) نمونههای رایج لیگاندهای دوتایی هستند. در زیر شکل اتیلن دیآمین نشان داده شده است. اتیلن دیآمین لیگاندی دودندانه است که یک حلقه پنج عضوی را در کمپلکس کوئوردیناسی با یون فلزی $$M$$ تشکیل میدهد.
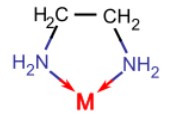
در اتیلن دیآمین اتمهای نیتروژن (آبی) دو الکترون آزاد دارند که از آنها برای پیوند به یک اتم یا یون فلز مرکزی استفاده میکنند.
| نام لیگاند | مخفف | فرمول ساختاری |
| اتیلن دیآمین | $$en$$ |
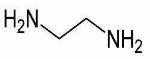 |
| یون استیل استونات فنانترولین | $$acac$$ |
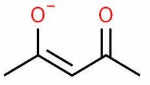 |
| فنانترولین | $$phen$$ |
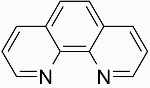 |
| یون اگزالات | $$ox$$ |
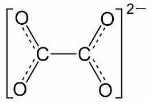 |
لیگاند سه دندانه
«لیگاندهای سه دندانه» (Tridentate Ligands) سه جفتالکترون به اتم یا یون فلز مرکزی اهدا میکنند.
| نام | اتم مرکزی | فرمول ساختاری |
| $$9-Crown-3$$ | $$Li$$ |
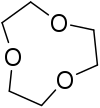 |
| $$Tp^−$$ | $$K, Ru, U$$ |
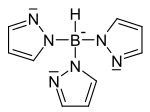 |
| $$PMDTA$$ | $$ Li, AlH_2$$ |
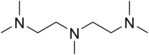 |
| $$Triphos$$ | فلزات واسطه |
 |
| $$9-ane-S3$$ | $$Fe, Cu$$ |
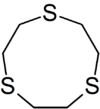 |
| $$Me_3TACN$$ | $$Re,Mn,Ru,Cu,Fe$$ |
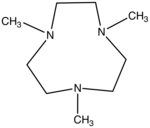 |
| $$TACN$$ | $$Mo$$ |
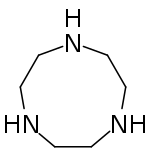 |
| $$tach$$ | $$Ni,Mn$$ |
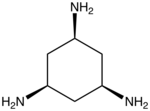 |
لیگاند چند دندانه
مولکولهایی که دو یا بیشتر جفتالکترون به اتم فلزی مرکزی اهدا میکنند بهطور کلی به عنوان لیگاندهای چنددندانه شناخته میشوند.
- چهار جفت: چهاردندانه (Tetradentate)
- پنج جفت: پنجدندانه (Pentadentate)
- شش جفت: ششدندانه (Hexadentate)
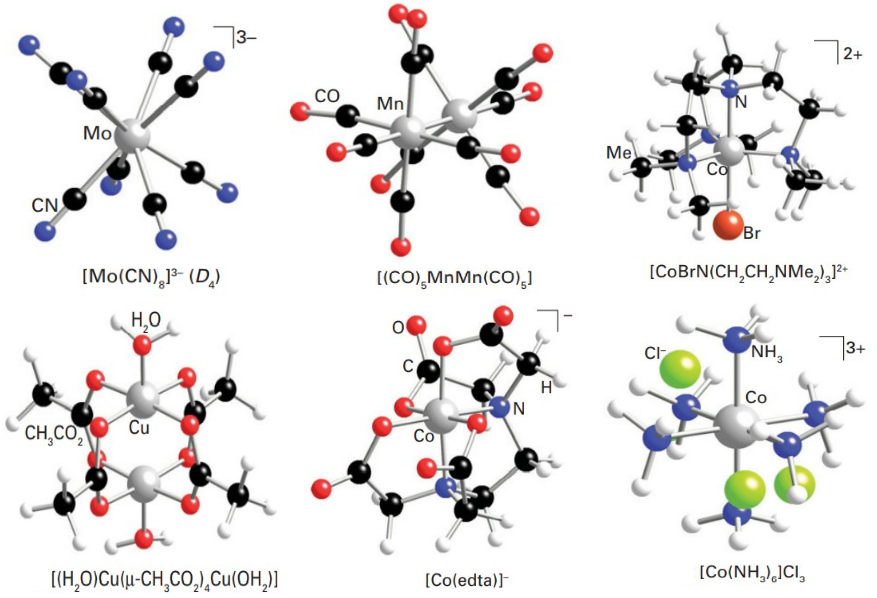
عامل کیلیت کننده
لیگاندهای دودندانه و چند دندانه، اتم فلز مرکزی را مانند «چنگال» (Claw) که از واژه یونانی «chele» گرفته شده است در خود نگه میدارند به همین دلیل به آنها «عامل کلیت کننده، کلات کننده، کلاته کننده یا کلیت ساز» نیز میگویند و به صورت (Chelating Agents) نوشته میشود.
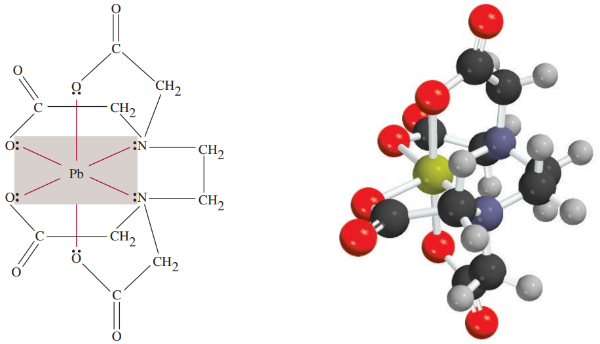
یون اتیلندیآمینتتراستات نمونهای از عامل کلیتکننده است که برای درمان مسمومیت با فلز استفاده میشود. شش اتم دهنده لیگاندها به EDTA این توانایی را میدهند تا بتواند یون کمپلکس پایداری با اتم سرب تشکیل دهد و به این صورت این عنصر را از خون و بافتهای بدن دفع کند. از EDTA همچنین برای پاکسازی نشت فلزات رادیواکتیو استفاده میکنند.
اثر کیلیت چیست؟
به میل ترکیبی لیگاندهای کیلیتساز برای اتصال به یون یا اتم فلزی مرکزی در مقایسه با میل ترکیبی «لیگاندهای تکدندانه غیر کیلیتساز» (Nonchelating Monodentate Ligands) اثر کیلیت گفته میشود.
لیگاند آمبیدنتات چیست؟
«لیگاند آمبیدنتات» (Ambidentate Ligand) دستهای از لیگاندها هستند که در ساختارشان بیش از یک اتم نقش دهنده الکترون را دارد. برای نمونه در یون تیوسیانات $$(NCS^-)$$، اتمهای نیتروژن و گوگرد میتوانند با اتم یا یون فلزی مرکزی پیوند دهند.
لیگاند پل ساز چیست؟
به لیگاندهایی که میتوانند به بیش از یک اتم فلزی مرکزی پیوند دهند «لیگاند پلساز» (Bridging Ligands) میگویند. در جدول زیر برخی از لیگاندهای پلساز فهرست شده اند. لیگاند پل ساز به صورت زیر نمایش داده میشود.

| لیگاند پل ساز | نام | نمونه |
| $$OH^–$$ | هیدروکسید | $$[Fe_2(OH)_2(H_2O)_8]^{4+}$$ |
| $$N_3^–$$ | نیترید | $$[Ir_3N(SO_4)_6(H_2O)_3]^{4+}$$ |
| $$CO$$ | کربونیل | $$Fe_2(CO)_9$$ |
| $$Cl^-$$ | کلرید | $$Nb_2Cl_{10}$$ |
| $$NH_3$$ | آمینو | $$HgNH_2Cl$$ |
| $$H^–$$ | هیدرید | $$B_2H_6$$ |
| $$O_2$$ | اکسید | $$[Cr_2O_7]^{2-}$$ |
نظریه میدان لیگاند
«نظریه میدان لیگاند» (Ligand Field Theory | LFT) ویژگیهای کمپلکسهای کوئوردیناسی را توصیف میکند و به هندسه کمپلکس وابسته است. این نظریه از ترکیب مفاهیمی که در نظریه میدان بلور و نظریه اوربیتال مولکولی مطرح شده بود بهوجود آمد. در نظریه میدان لیگاند، اوربیتالهای گوناگون $$d$$، زمانی که توسط میدانی از لیگاندهای مجاور پوشش داده میشوند، بهطور متفاوتی تحت تأثیر قرار میگیرند و بر اساس قدرت برهمکنش این اوربیتالها با لیگاندها، انرژی آنها افزایش یا کاهش مییابد.
کمپلکس کوئوردیناسی چیست؟
کمپلکسهای کوئوردیناسی با ترکیباتی مانند آبی پروس $$(Fe_4[Fe(CN)_6]_3)$$ و مس(II) سولفات $$(CuSO_4)$$ شناخته شدند. کمپلکس کوئوردیناسی از یک اتم یا یون مرکزی که معمولاً فلز است و مجموعهای از مولکولها یا یونها، به نام لیگاند تشکیل میشود. بسیاری از ترکیبات فلزهای واسطه به شکل کمپلکسهای کوئوردیناسی هستند.

برخی از اصطلاحات در زمینه کمپلکسهای کوئوردیناسی:
- «اتم دهنده» (Donor Atom): به اتمی از لیگاند که جفتالکترون خود را به اتم فلز مرکزی میدهد، اتم دهنده میگویند.
- «کره کمپلکس» (Coordination Sphere): به یون مرکزی به همراه تمام لیگاندهای متصل به آن کره کمپلکس میگویند.
- «کوئوردیناسیون» (Coordination): کوئوردیناسیون به پیوندهای بین لیگاند و اتم مرکزی اشاره دارد.
- «عدد کوئوردیناسیون یا همآرایی» (Coordination Number) یا (Ligancy): به تعداد اتم یا یونهایی که فلزی مرکزی میتواند با آنها پیوند برقرار کند میگویند. رایجترین اعداد کوئوردیناسیون 2، 4 و 6 هستند.
فهرست لیگاند های رایج
در جدول زیر، برخی از لیگاندهای رایج به همراه فرمول ساختاری آنها فهرست شده است.
| نام (مخفف) | فرمول | اتم دهنده | تعداد اتم دهنده |
| استیلاستون $$(acac^-)$$ |
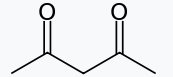 | $$O$$ | 2 |
| آمین | $$ NH_3$$ | $$N$$ | 1 |
| اکوآ | $$H_2O$$ | $$O$$ | ۱ |
| 2،2-بی پیریدین $$(bpy)$$ |
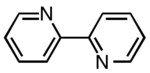 | $$N$$ | ۲ |
| برمیدو | $$ Br^-$$ | $$Br$$ | ۱ |
| کربناتو | $$CO_3^{2-}$$ | $$O$$ | ۱ یا ۲ |
| کربونیل | $$Co$$ | $$C$$ | 1 |
| کلریدو | $$Cl^-$$ | $$Cl$$ | 1 |
| سیانیدو | $$CN^-$$ | $$C$$ | 1 |
| دی اتیلن تریامین $$(dien)$$ | $$NH(CH_2CH_2NH_2)_2$$ | $$N$$ | 3 |
| بیس (دی فنیل فسفینو) اتان $$(dppe)$$ |
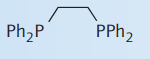 | $$P$$ | 2 |
| بیس (دی فنیل فسفینو) متان $$(dppm)$$ |
| $$P$$ | 2 |
| سیکلوپنتادینیل $$(\zeta p^-)$$ | $$C_5H_5^-$$ | $$C$$ | 5 |
| اتیلن دیآمین $$(en)$$ | $$NH_2CH_2CH_2NH_2$$ | $$N$$ | 2 |
| اتیلن دیآمین تتراستاتو $$(edta^{4-})$$ |
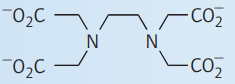 | $$N, O$$ | $$۲N, ۴O$$ |
| فلورید | $$F^-$$ | $$F$$ | 1 |
| گلیسیناتو $$(gly)$$ | $$NH_2CH_2CO_2^-$$ | $$N, O$$ | $$۱N, ۱O$$ |
| هیدریدو | $$H^-$$ | $$H$$ | 1 |
| هیدروکسیدو | $$OH^-$$ | $$O$$ | 1 |
| یدیدو | $$I^-$$ | $$I$$ | 1 |
| نیتراتو | $$NO_۳^-$$ | $$O$$ | 1 یا ۲ |
| نیتریت-$$\kappa O$$ | $$NO_2^-$$ | $$O$$ | 1 |
| نیتریت-$$\kappa N$$ | $$NO_2^-$$ | $$N$$ | 1 |
| اکسیدو | $$O^{2-}$$ | $$O$$ | 1 |
| اگزالاتو $$(ox)$$ |
 | $$O$$ | 2 |
| پیریدین $$(py)$$ |
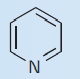 | $$N$$ | 1 |
| سولفیدو | $$S^{2-}$$ | $$S$$ | 1 |
سوالات متدوال
در زیر به برخی از پرسشهای رایج در این زمینه پاسخ داده شده است.
EDTA چه نوع لیگاندی است؟
«اتیلندیآمینتترااستیک اسید» (Ethylenediaminetetraacetic acid | EDTA) از نوع لیگاندهای هگزادنتات یا ششدندانه است. در ساختار $$EDTA$$ اتم اکسیژن چهار پیوند و اتم نیتروژن دو پیوند ایجاد میکند. $$EDTA$$ به صورت نمک و به عنوان یک عامل کیلیت ساز عالی استفاده میشود.
آیا آمونیاک لیگاندی تکدندانه است؟
آمونیاک $$(NH_۳)$$ تنها یک جفتالکترون دارد، پس تنها میتواند با اتم یا یون فلز مرکزی یک جفتالکترون بدهد و نمونهای از یک لیگاند تکدندانه است.
آیا اکسیژن لیگاند است؟
از جمله کمپلکسهای کوئوردیناسی که در ساختارشان $$O_۲$$ به عنوان لیگاند وجود دارد «کمپلکسهای دیاکسیژن» (Dioxygen Complexes) هستند. اکسیژن با بسیاری از فلزات واسطه تشکیل کمپلکس کوئوردیناسی میدهد.
نتیجهگیری
لیگاند، یون یا مولکولی است که یک جفتالکترون به اتم فلز مرکزی میدهد. بر اساس تعداد جفتالکترونهای موجود برای اتم فلز مرکزی، اندازه و بار به دستههای مختلف و همچنین با توجه به تعداد محلهای اتصالی که ایجاد میکنند به لیگاندهای تکدندانه و چنددندانه طبقهبندی میشوند. لیگاندها واکنشپذیری اتم مرکزی را تعیین میکنند و به شکل آنیون، کاتیون یا مولکولهای خنثی هستند.











