لنفوسیت چیست؟ | هر آنچه باید بدانید

بدن برای مبارزه با عوامل بیماریزا مانند ذرات آلوده به آلرژنها، میکروارگانیسمهای عفونی، قارچها و هر نوع ماده خارجی آسیبرسان نیاز به سیستم ایمنی دارد که در چند نوع و چند سطح از بدن محافظت میکنند. یکی از سدهای دفاعی بدن در مقابل عفونت، سلولهای خونی به نام لنفوسیت هستند که در مغز استخوان تولید میشوند و بعد به اندامهای دیگری برای بلوغ مهاجرت میکنند و سپس آماده مبارزه علیه میکروبهای خاصی خواهند بود. برای به دست آوردن اطلاعات کاملتری از چگونگی تشکیل، روش مبارزه و انواع لنفوسیتها ادامه مطلب را دنبال کنید.
سیستم دفاعی بدن چیست؟
سیستم دفاعی بدن شامل مجموعهای از انواع سلولهای خونی، مواد شیمیایی و پروتئینهای خونی مانند آنتیبادی، پروتئینهای کمپلمان، انواع لنفوسیت و اینترفرون است. برخی از این اجزا به صورت مستقیم و برخی با همکاری با یکدیگر، به سیستم ایمنی سلولی بدن کمک میکنند. پیش از این در مطلب سیستم ایمنی بدن — از صفر تا صد به صورت مفصل راجع به اجزای مختلف سیستم ایمنی و نحوه عملکرد آنها توضیح دادهایم که میتوانید آن را مطالعه کنید و در کنار این پست اطلاعات جامعتری در مورد نحوه فعالیت سلولهای سیستم دفاعی بدن به دست بیاورید.
انواع گلبول های سفید خون چه هستند؟
گلبولهای سفید خون بر اساس ساختار، محل تولید و عملکرد و نوع فعالیت انواع مختلفی دارند:
- لنفوسیت: سلولهای بالغ و مبارزه کننده با عفونت هستند که از لنفوبلاستها، نوعی سلول بنیادی خون در مغز استخوان ایجاد میشوند. لنفوسیتها سلولهای اصلی تشکیلدهنده بافت لنفاوی، بخش عمدهای از سیستم ایمنی بدن هستند. بافت لنفاوی در غدد لنفاوی، غده تیموس، طحال، لوزها و آدنوئیدها یافت میشود. همچنین در سیستمهای گوارشی و تنفسی و مغز استخوان پراکنده است. 2 نوع اصلی لنفوسیت ها عبارتند از:
- لنفوسیتهای B (سلولهای B): با توسعه (بلوغ) به سلولهای پلاسمای خون که پروتئینهایی به نام آنتیبادی تشکیل میدهند، از بدن در برابر حمله میکروبها محافظت میکنند. آنتیبادیها به میکروبها (باکتریها، ویروسها و قارچها) متصل میشوند و به سلولهای سفید خون (گلبولهای سفید) دیگر موسوم به گرانولوسیت کمک میکند تا آنها را شناسایی کنند و از بین ببرند. لنفوسیتهای B سلولهایی هستند که غالباً به سلولهای لوسمی لنفوسیتیک مزمن (CLL) تبدیل میشوند.
- لنفوسیت T (سلولهای T): میتوانند سلولهای آلوده به ویروسها را شناسایی کنند و مستقیماً این سلولها را از بین ببرند. آنها همچنین به تنظیم سیستم ایمنی بدن کمک میکنند.
- گرانولوسیتها: سلولهای بالغ و مبارزه کننده با عفونت هستند که از میلوبلاستها، نوعی سلول تشکیلدهنده خون در مغز استخوان ایجاد میشوند. گرانولوسیتها دارای گرانولهایی هستند که مانند لکههایی در زیر میکروسکوپ به نظر میرسند. این گرانولها حاوی آنزیمها و مواد دیگری هستند که میتوانند میکروبهایی مانند باکتریها را از بین ببرند. 3 نوع گرانولوسیت شامل نوتروفیل، بازوفیل و ائوزینوفیل با توجه به اندازه و رنگدانههای آنها در زیر میکروسکوپ قابل تمایز هستند.
- مونوسیتها: از مونوبلاستهای خونساز در مغز استخوان ایجاد میشوند و مربوط به گرانولوسیتها هستند. بعد از حدود یک روز گردش خون در سلولهای خونی، مونوسیتها برای تبدیل شدن به ماکروفاژ وارد بافتهای بدن خواهند شد که با احاطه و هضم آنها میتوانند برخی از میکروبها را از بین ببرند. ماکروفاژها همچنین به لنفوسیتها کمک میکنند تا میکروبها را بشناسند و شروع به ساخت آنتیبادی برای مبارزه با آنها کنند.
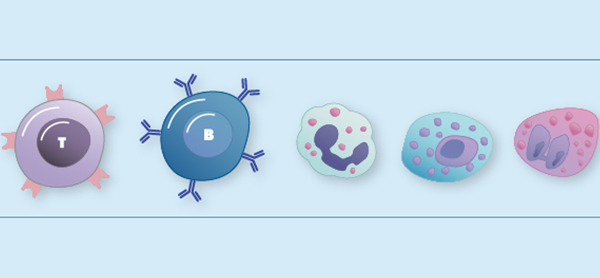
لنفوسیت چیست؟
لنفوسیت نوعی گلبول سفید در سیستم ایمنی مهرهداران است که به مبارزه با عوامل بیماریزا میپردازد. آنها نوع اصلی سلول موجود در لنف هستند که باعث نام لنفوسیت میشوند. لنفوسیتها بین 18 تا 42 درصد لکوسیتهای در گردش را تشکیل میدهند.
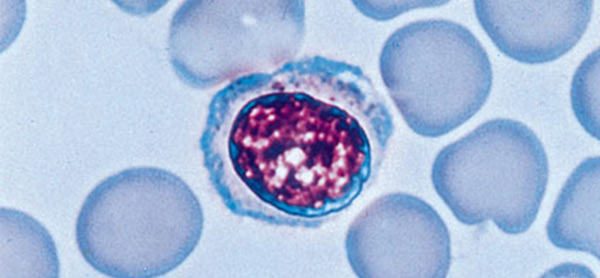
مشاهده لنفوسیت زیر میکروسکوپ
برای شناسایی این سلولها در خون، میتوان از رنگآمیزی رایت استفاده کرد که اغلب برای رنگآمیزی افتراقی در نمونه خون یا مغز استخوان توصیه میشود. مواد و ابزارهای مورد نیاز شاملم وارد زیر هستند:
- نمونه خون که بلافاصله در لوله EDTA ذخیره میشود.
- اسلایدهای شیشهای
- لغزش پوشش
- میکروسکوپ مرکب
- لکه رایت
- شیشه / لیوان
یک قطره خون روی لام شیشهای تمیز قرار دهید و با استفاده از یک اسلاید تمیز در یک زاویه قطره خون را پخش کنید تا یک فیلم نازک از خون ایجاد شود و سپس اجازه دهید تا در هوا خشک شود. هنگامی که اسلاید کاملا خشک شد، با استفاده از پیپت 1/0 میلیلیتر از محلول لکه رایت را روی لایه نازک خون اضافه کنید و اجازه دهید تا حدود 3 دقیقه بماند.
چند قطره آب مقطر یا بافر فسفات (pH 6/8) اضافه کنید و اجازه دهید حدود 5 دقیقه بماند. اجازه دهید لام خشک شود و لکههای اضافی پشت اسلاید را پاک نموده و آن زیر میکروسکوپ مشاهده کنید. لنفوسیتها به شکل بنفش تیره با هستهای مایل به آبی و سیتوپلاسم آبی به نظر میرسند.
انواع لنفوسیت چه هستند؟
لنفوسیتها شامل سلولهای کشنده طبیعی (که در ایمنی ذاتی سیتوتوکسیک با واسطه سلول) عمل میکنند، سلولهای T (برای ایمنی سازشی سلولی با واسطه سلول) و سلولهای B (برای ایمنی تطبیقی هومورال، آنتیبادی) و سه نوع عمده لنفوسیت سلولهای T، سلولهای B و سلولهای کشنده طبیعی (NK) هستند. لنفوسیتها را میتوان از هسته بزرگ آنها تشخیص داد.
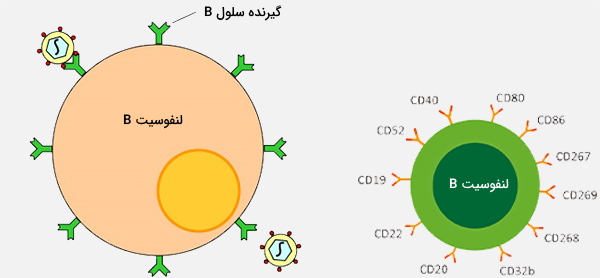
لنفوسیت b چیست؟
سلولهای b یا لنفوسیتهای b نوعی گلبول سفید از زیرگروه لنفوسیت هستند. آنها با ترشح آنتیبادی در مؤلفه ایمنی هومورال سیستم ایمنی انطباقی عمل میکنند. علاوه بر این، سلولهای B آنتیژنهایی را ارائه میدهند (همچنین به عنوان سلولهای حرفهای ارائهدهنده آنتیژن (APC) طبقهبندی میشوند) و سیتوکین ترشح میکنند. در پستانداران، سلولهای B در مغز استخوان که در هسته اکثر استخوانها است بالغ میشوند.
در پرندگان، سلولهای B در Fabricius (اندامی لنفاوی که اولین بار توسط چانگ و گلیک کشف شد) بالغ میشوند در حالی که تصور میشد که این سلولها در مغز استخوان بالغ میشوند. سلولهای B برخلاف دو گروه دیگر از انواع لنفوسیت یعنی سلولهای T و سلولهای کشنده طبیعی، گیرندههای سلولی B یا (BCR) را بر روی غشای سلول خود بیان میکنند. BCR به لنفوسیت B اجازه میدهد تا به یک آنتیژن خاص متصل شودکه در مقابل آن پاسخ را با ترشح آنتیبادی آغاز میکند.
انواع لنفوسیت b
لنفوسیت b انواع مختلفی دارد که عبارتند از:
- پلاسمابلاست: یک سلول ترشح کننده آنتیبادی در حال تکثیر و تکثیر کوتاه مدت و ناشی از تمایز سلول B. پلاسمابلاستها در اوایل آلودگی تولید میشوند و آنتیبادیهای آنها تمایل کمتری نسبت به سلولهای پلاسما نسبت به آنتیژن هدف دارند. پلاسمابلاستها میتوانند ناشی از فعال شدن سلولهای B مستقل از سلول T یا پاسخ خارج فولیکولی ناشی از فعال شدن سلولهای B وابسته به سلول T باشند.
- سلول پلاسما: یک سلول ترشح کننده آنتیبادی بدون تکثیر با عمر طولانی و ناشی از تمایز سلول b شواهدی وجود دارد که سلولهای B ابتدا به یک سلول شبه پلاسمابلاست متمایز میشوند، سپس به سلول پلاسما تمایز مییابند. سلولهای پلاسما بعداً در اثر عفونت تولید میشوند و در مقایسه با پلاسمابلاستها به دلیل بلوغ میل در مرکز جوانه (GC)، آنتیبادیهایی با میل بیشتر نسبت به آنتیژن هدف خود دارند و آنتیبادی بیشتری تولید میکنند. سلولهای پلاسما به طور معمول از واکنش مرکز جوانهزنی در اثر فعال شدن سلولهای B وابسته به سلول T حاصل میشوند، با این وجود میتوانند در اثر فعال شدن سلولهای B مستقل از سلول T نیز ایجاد شوند.
- سلول لنفوپلاسماتیکوئید: سلول با مخلوطی از ویژگیهای مورفولوژیکی لنفوسیت B و سلولهای پلاسما که تصور می شود از نزدیک با سلولهای پلاسما یا یک زیرگروه مرتبط باشد. این نوع سلول در دیسکرازیهای پلاسما سل پیش - بدخیم و بدخیم وجود دارد که با ترشح پروتئینهای مونوکلونال IgM مرتبط هستند. این دیسکرازیها شامل گاموپاتی مونوکلونال IgM با اهمیت نامشخص و «ماکروگلوبولینمی والدنشتروم» (Waldenstrom Macroglobulinemia) است.
- سلول B حافظه: سلول B خاموش، از تمایز سلول B ناشی میشود. عملکرد آنها این است که اگر آنتیژنی را که سلول B اصلی آنها را فعال کرده است (BCR سلولهای حافظه B و سلولهای B اصلی آنها یکسان است، بنابراین آنتی ژن یکسانی را تشخیص میدهند). سلولهای B حافظه میتوانند از طریق فعال شدن وابسته به سلول T از طریق پاسخ خارج فولیکولی و واکنش مرکز ژرمینال و همچنین از طریق فعالسازی سلولهای B1 مستقل از سلول T تولید شوند.
- سلول B-2 - سلول FO B و سلول MZ B.
- سلول B فولیکولار (FO): همچنین به عنوان سلول B-2 شناخته میشود و رایجترین نوع سلول B است و هنگامی که از طریق خون در گردش نیست، عمدتا در فولیکولهای لنفاوی اندامهای لنفاوی ثانویه (SLO) یافت میشود. لنفوسیت B فولیکولار مسئول تولید اکثر آنتیبادیهای با میل بالا در طول عفونت هستند.
- سلول B منطقه حاشیه (MZ): عمدتا در ناحیه حاشیهای طحال یافت میشود و به عنوان اولین خط دفاعی در برابر عوامل بیماریزای منتقل شده از خون عمل میکند، زیرا منطقه حاشیهای مقدار زیادی خون از گردش عمومی دریافت میکند. آنها میتوانند هم از نظر سلولهای T و هم از سلولهای T فعال شوند، اما ترجیحاً از سلولهای T غیر فعال شوند.
- سلول B-1: از یک مسیر رشد متفاوت از سلولهای FO B و سلولهای MZ B ناشی میشود. در موشها آنها عمدتا حفره صفاقی و حفره جمع میشوند، آنتیبادیهای طبیعی تولید میکنند (آنتیبادیهایی که بدون عفونت تولید میشوند)، از پاتوژنهای مخاطی دفاع میکنند و در درجه اول فعالسازی مستقل از سلول T را نشان میدهند. یک همولوگ واقعی از سلولهای B-1 موش در انسان کشف نشده است، اگرچه جمعیت سلولهای مختلف مشابه سلولهای B-1 توصیف شدهاند.
- سلول B تنظیمی: یک نوع سلول سرکوبکننده سیستم ایمنی که از طریق ترشح IL-10 ، IL-35 و TGF-β، گسترش لنفوسیتهای بیماریزا و پیش التهابی را متوقف میکند. همچنین با تعامل مستقیم با سلولهای T، تولید سلولهای نظارتی T یا (Treg) را افزایش میدهد تا تمایز آنها را نسبت به Tregs منحرف کند. هیچ هویت مشترک سلول Breg توصیف نشده است و بسیاری از زیر مجموعههای سلول Breg که دارای عملکردهای نظارتی هستند، در موشها و انسانها یافت شده است.
در حال حاضر مشخص نیست که آیا زیرمجموعههای سلول Breg از نظر رشد به یکدیگر مرتبط هستند و چگونه دقیقاً تمایز به سلول Breg رخ میدهد. شواهدی وجود دارد که نشان میدهد تقریباً همه انواع سلولهای B میتوانند از طریق مکانیسمهایی شامل سیگنالهای التهابی و تشخیص BCR به سلول Breg متمایز شوند.
لنفوسیت b چگونه فعال میشود؟
فعال شدن لنفوسیت b در اندامهای لنفوییدی ثانویه مانند طحال و غدد لنفاوی صورت میگیرد. بعد از بلوغ سلولهای b در مغز استخوان، از طریق خون به این ارگانها مهاجرت میکنند تا از طریق جریان لنفاوی به صورت مداوم آنتیژن دریافت کنند. در اندامهای ثانویه، فعال شدن سلول b زمانی آغاز میشود که به یک آنتیژن از طریق BCR متصل شود.
اگرچه بلافاصله بعد از فعال شدن اتفاقاتی صورت میگیرند اما هنوز برای کامل شدن به زمان نیاز دارند. به نظر میرسد که سلولهای b طبق مدل تفکیک جنبشی فعال میشوند و در ابتدا در لنفوسیتهای T تعیین خواهند شد. این مدل نشان میدهد که قبل از تحریک آنتیژن، گیرندهها از طریق غشایی که در تماس با Lck و CD45 در فرکانس مساوی پخش میشوند و یک تعادل خالص فسفوریلاسیون و غیر فسفوریلاسیون را ارائه میدهند.
فقط هنگام تماس سلول با سلول ارائه دهنده آنتیژن است که CD45 بزرگتر به دلیل فاصله نزدیک بین دو غشا جابجا میشود و به فسفوریلاسیون خالص BCR و شروع مسیر انتقال سیگنال را امکانپذیر میکند. از سه زیر مجموعه سلول B، سلولهای FO B ترجیحاً تحت تأثیر فعال شدن وابسته به لنفوسیت T قرار میگیرند در حالی که سلولهای MZ B و سلولهای B1 B ترجیحاً تحت فعال شدن مستقل از سلول T قرار میگیرند.
فعالسازی سلول B از طریق فعالیت CD21، یک گیرنده سطحی پیچیده با پروتئینهای سطحی CD19 و CD81 افزایش مییابد (هر سه در مجموع به عنوان کمپلکس هسته گیرنده سلول B شناخته می شوند). هنگامی که BCR آنتیژنی را که با قطعهای از پروتئین مکمل C3 برچسب زده شده است متصل میکند، CD21 قطعه C3 را متصل میکند، به هم پیوند میخورد و BCR متصل میشود و سیگنالها از طریق CD19 و CD81 منتقل میشوند تا آستانه فعال شدن سلول کاهش یابد.
فعال سازی وابسته به سلول t
آنتیژنهایی که سلول های B را با کمک سلول T فعال می کنند به عنوان آنتیژنهای وابسته به سلول T یا (TD) شناخته میشوند و شامل پروتئینهای خارجی هستند. نام آنها به این ترتیب است زیرا قادر به ایجاد واکنش هومورال در ارگانیسمهایی نیستند که سلولهای T ندارند. پاسخ سلولهای B به این آنتیژنها چند روز طول میکشد، اگرچه آنتیبادیهای تولید شده میل ترکیبی بالاتری دارند و از نظر عملکرد همه توانتر از آنهایی هستند که از فعالسازی مستقل سلول T تولید شدهاند.
هنگامی که BCR به یک آنتیژن TD متصل میشود، آنتیژن از طریق اندوسیتوز با واسطه گیرنده، به سلول B منتقل و تخریب خواهد شد و در نهایت به عنوان قطعات پپتیدی در ترکیب با مولکولهای MHC-II در غشای سلول به سلولهای T ارائه میشود. سلولهای T کمکی (TH) و سلولهای T کمکی فولیکولی (TFH) این مجتمعهای پپتیدی MHC-II را از طریق گیرنده سلول T خود (TCR) شناسایی و متصل میکنند. به دنبال اتصال TCR-MHC-II به پپتید، سلولهای T پروتئین سطح CD40L و همچنین سیتوکینهایی مانند IL-4 و IL-21 را بیان میکنند.
CD40L به عنوان یک فاکتور محرک ضروری برای فعالسازی سلول B با اتصال گیرنده سطح سلول B CD40، که باعث تکثیر سلول B، تغییر کلاس ایمونوگلوبولین و تغییر بیش از حد بدن و همچنین رشد و تمایز سلول T میشود، عمل میکند. سیتوکینهای مشتق شده از سلول T که به گیرندههای سیتوکین سلول B متصل میشوند، باعث تکثیر سلول B، تغییر کلاس ایمونوگلوبولین و تغییر جهش بدنه و همچنین تمایز میشوند.
سلولهای B پس از دریافت این سیگنالها، فعال شده تلقی میشوند. لنفوسیت B پس از فعال شدن، در یک فرایند تمایز دو مرحلهای شرکت میکند که هم از پلاسما بلاستهای کوتاه مدت برای محافظت فوری و هم از سلولهای پلاسمای طولانی مدت و از سلولهای B حافظه برای محافظت مداوم بهره خواهد برد. اولین مرحله که به عنوان پاسخ خارج فولیکولی شناخته میشود، در خارج از فولیکولهای لنفاوی رخ میدهد اما هنوز در SLO است.
در طول این مرحله سلولهای B فعال تکثیر مییابند، ممکن است تحت کلاس تغییر ایمونوگلوبولین قرار بگیرند و به پلاسما بلاستهایی که آنتیبادیهای ضعیف و زودرس و بیشتر از کلاس IgM تولید میکنند، متمایز شوند. مرحله دوم شامل سلولهای B فعال شده که به یک فولیکول لنفاوی وارد میشوند و یک مرکز جوانه زنی (GC) را تشکیل میدهند، این مرکز یک ریز - محیط است که سلولهای B در آن تحت تکثیر گسترده، تغییر کلاس ایمونوگلوبولین و بلوغ قرار میگیرند.
این فرایندها توسط سلولهای TFH درون GC تسهیل میشود و هم لنفوسیت های B حافظه با میل بالا و هم سلولهای پلاسمای طولانی مدت تولید میکند. سلولهای پلاسمای نتیجه مقادیر زیادی آنتیبادی ترشح میکنند و یا در SLO میمانند یا ترجیحاً به مغز استخوان مهاجرت میکنند.
فعال سازی مستقل از سلول t
آنتیژنهایی که سلولهای B را بدون کمک به سلول T فعال میکنند، به عنوان آنتیژنهای مستقل از سلول T یا (TI) شناخته میشوند و شامل پلیساکاریدهای خارجی و DNA CpG غیر متیل شده هستند. علت نامگذاری آنها این است که قادر به ایجاد واکنش هومورال در ارگانیسمهایی هستند که از سلولهای T به بهرهاند.
پاسخ سلول B به این آنتیژنها سریع است، اگرچه آنتیبادیهای تولید شده تمایل کمتری دارند و از نظر عملکرد کمی متنوعتر از آنهایی هستند که از فعالسازی وابسته به سلول T تولید میشوند. همانند آنتیژنهای TD، لنفوسیت های B فعال شده توسط آنتیژنهای TI، برای فعالسازی کامل به سیگنالهای اضافی نیاز دارند.
اما به جای دریافت آنها از سلولهای T یا با شناسایی و اتصال یک ماده تشکیلدهنده میکروبی مشترک به گیرندههای عوارض مانند (TLR) یا توسط لینکدهی گسترده BCR به اپیتوپهای مکرر روی سلول باکتریایی متصل میشوند.
سلولهای B فعال شده توسط آنتیژنهای TI در خارج از فولیکولهای لنفاوی تکثیر مییابند اما هنوز در SLOها وجود دارند (GCها تشکیل نمیشوند)، احتمالاً تحت تعویض کلاس ایمونوگلوبولین قرار میگیرند و به پلاسمابلاستهای کوتاه مدت متمایز میشوند که آنتیبادیهای ضعیف و زودرس را اغلب از کلاس IgM و همچنین برخی از جمعیت سلولهای پلاسما با عمر طولانی تولید میکنند.
فعال سازی سلول b حافظه
فعال شدن سلول b خاطره با تشخیص و اتصال به آنتیژن هدف که توسط سلول b والد به اشتراک گذاشته شدهاند انجام میشود. برخی از سلولهای B حافظه را میتوان بدون کمک سلول T فعال کرد، مانند برخی سلولهای حافظه B خاص ویروس اما برخی دیگر نیاز به کمک سلول T دارند.
پس از اتصال آنتیژن، سلول B حافظه آنتیژن را از طریق اندوسیتوز گیرنده دریافت میکند، تخریب خواهد کرد و آن را به عنوان قطعات پپتیدی در ترکیب با مولکولهای MHC-II در غشای سلول به سلولهای T ارائه میدهد.
سلولهای کمکی T حافظه (TH)، به طور معمول سلولهای T کمکی فولیکولی حافظه (TFH) که از سلولهای T فعال شده با همان آنتیژن مشتق شدهاند، این مجتمعهای پپتیدی MHC-II را از طریق TCR شناسایی و متصل میکنند. به دنبال اتصال TCR-MHC-II به پپتید و پخش سیگنالهای دیگر از سلول TFH حافظه، سلول B حافظه فعال شده و از طریق یک پاسخ خارج فولیکولی به سلولهای پلاسما و پلاسما متمایز میشود و یا در آنجا سلولهای پلاسما را تولید میکند، وارد یک واکنش مرکز جوانه میشود و سلولهای B حافظه بیشتری ایجاد میکند.
لنفوسیت T چیست؟
لنفوسیت T یکی از مهمترین گلبولهای سفید خون در سیستم ایمنی بدن است و نقش اصلی را در پاسخ ایمنی سازگار در بدن بر عهده دارد. سلولهای T را میتوان با حضور گیرنده سلول T یا (TCR) در سطح سلول آنها به راحتی از سایر لنفوسیتها تشخیص داد. سلولهای T از سلولهای بنیادی خونساز موجود در مغز استخوان تولید میشوند. سپس، سلولهای T در حال رشد به غده تیموس مهاجرت میکنند.
سلولهای T نام خود را از آنجا که از این اندام که در آن رشد میکنند یا بالغ میشوند گرفتهاند. پس از مهاجرت به تیموس، سلولهای پیشساز به چندین نوع متمایز از سلولهای T بالغ میشوند. تمایز سلول T نیز پس از ترک تیموس ادامه مییابد. گروههایی از زیرگروههای اختصاصی و متمایز سلول T دارای عملکردهای مهم و متنوعی در کنترل و شکلدهی پاسخ ایمنی هستند.
یکی از این عملکردها مرگ سلولی یا آپوپتوز (مرگ برنامهریزی شده سلول) با واسطه ایمنی است و توسط دو زیرگروه اصلی انجام میشود:
- CD8 + قاتل
- CD4 + سلولهای T کمکی (این سلولها به دلیل وجود پروتئینهای سطح سلول CD8 یا CD4 نامگذاری شدهاند.)
سلولهای CD8 + T، همچنین به عنوان سلولهای T قاتل نیز شناخته میشوند، سمیت سلولی هستند. یعنی قادر به از بین بردن مستقیم سلولهای آلوده به ویروس و همچنین سلولهای سرطانی هستند.
سلولهای CD8 + T همچنین میتوانند هنگام استفاده از یک پاسخ ایمنی، از پروتئینهای سیگنالینگ کوچک، معروف به سیتوکینها، برای جذب انواع دیگر سلولها استفاده کنند. جمعیت متفاوتی از سلولهای T، سلولهای T CD4 +، به عنوان سلولهای کمکی عمل میکنند.
برخلاف سلولهای T کشنده CD8 +، این سلولهای T کمکی CD4 + با از بین بردن غیرمستقیم سلولهایی که به عنوان عامل خارجی شناخته میشوند عمل و تعیین میکنند که آیا سایر قسمتهای سیستم ایمنی بدن به یک تهدید خاص و قابل درک پاسخ میدهند یا خیر. سلولهای T یاور همچنین از سیگنالینگ سیتوکین برای تأثیر مستقیم بر سلولهای نظارتی B و سایر سلولهای سلول به طور غیرمستقیم استفاده میکنند.
سلولهای T تنظیم کننده هنوز جمعیت متمایز دیگری از سلولهای T هستند که مکانیسم حساس تحمل را فراهم میکنند، به همین دلیل سلولهای ایمنی قادر به تشخیص سلولهای مهاجم از سلولهای خودی هستند که از واکنش نامناسب در برابر سلولهای خودی جلوگیری میکنند، در غیر این صورت واکنش خود ایمنی ایجاد میشود.
به همین دلیل، به این سلولهای T نظارتی سلولهای T سرکوبگر نیز گفته میشود. همین لنفوسیت های T نظارتی همچنین میتوانند توسط سلولهای سرطانی برای جلوگیری از شناسایی و پاسخ ایمنی سلولهای توموری، انتخاب شوند.
مهاجرت لنفوسیت ها به تیموس
همه سلولهای T از سلولهای بنیادی خونساز یا هماتوپویتیک (HSC) که در مغز استخوان قرار دارند سرچشمه میگیرند. در برخی موارد منشا ممکن است کبد جنین در طی رشد جنینی باشد. سپس HSC به مولدهای چند توان (MPP) که پتانسیل تبدیل شدن به سلولهای میلوئیدی و لنفاوی را حفظ میکنند، تمایز مییابد. فرآیند تمایز به مولد لنفاوی مشترک (CLP) ادامه مییابد که فقط میتواند به سلولهای T ،B یا NK متمایز شود.
سپس سلولهای CLP از طریق خون به تیموس مهاجرت میکنند و در آنجا ساکن میشوند. سلولهای اولیه که به تیموس رسیدهاند دو منفی نامیده میشوند زیرا آنها نه گیرندههای CD4 و نه CD8 را بیان نمیکنند. سلولهای تازه وارد CLP سلولهای CD4 − CD8 − CD44 + CD25 − ckit + هستند و سلولهای پیشساز تیموس اولیه (ETP) نامیده میشوند. سپس این سلولها یک دور تقسیم میشوند و c-kit را کم تنظیم میکنند که سلولهای DN1 نام دارند.
توسعه TCR
یک مرحله مهم در بلوغ سلول T ساخت یک گیرنده سلول T عملکردی (TCR) است. هر لنفوسیت T بالغ در نهایت شامل یک TCR منحصر به فرد است که به یک الگوی تصادفی واکنش نشان میدهد و به سیستم ایمنی اجازه میدهد انواع مختلفی از عوامل بیماریزا را تشخیص دهد. TCR از دو جزء اصلی به نام زنجیره های آلفا و بتا تشکیل شده است.
این زنجیرهها، شامل عناصر تصادفی طراحی شده برای تولید طیف گستردهای از TCRهای مختلف هستند اما پیش از آن برای بررسی کارکرد صحیح در بدن آزموده میشوند. در ابتدا، سلولهای T سعی میکنند یک زنجیره بتا عملکردی ایجاد کنند و آن را در برابر یک زنجیره آلفای ساختگی آزمایش میکنند. سپس آنها سعی میکنند یک زنجیره آلفای کاربردی ایجاد کنند. هنگامی که یک TCR فعال تولید شد، سلولهای T باید مشخص شود که TCR میتواند کمپلکس MHC بدن را تشخیص دهد (انتخاب مثبت) و اینکه به پروتئینهای خود واکنش نشان نمیدهد (انتخاب منفی).
انتخاب TCR - Beta
در مرحله (CD44 + CD25)، سلولها ژنهای ترکیبی RAG1 و RAG2 را دگرگون میکنند و مکان TCRβ را با ترکیب V-D-J و ژن های منطقه ثابت در تلاش برای ایجاد یک زنجیره عملکردی TCRβ، دوباره مرتب می کنند. همانطور که تیموسیت در حال رشد از طریق مرحله (CD44 − CD25) پیشرفت میکند، سلول T یک زنجیره آلفای ثابت به نام pre-Tα در کنار ژن TCRβ بیان میکند.
اگر زنجیره بتا با موفقیت با زنجیره آلفای ثابت تغییر کند، سیگنالهایی تولید میشوند که بازآرایی زنجیره بتا را متوقف میکنند (و آلل جایگزین را ساکت میکنند). اگرچه این سیگنالها به این pre-TCR در سطح سلول نیاز دارند اما از اتصال لیگاند به pre-TCR مستقل هستند. اگر pre-TCR تشکیل شود، سلول CD25 را کاهش میدهد و سلول DN4 نامیده میشود (CD25 − CD44−). سپس این سلولها یک دور تکثیر یافته و شروع به تنظیم مجدد مکان TCRα میکنند.
انتخاب مثبت
تیموسیتهایی که دوبار انتخاب مثبت شده باشند (+CD4/CD8+) به عمق قشر تیموس مهاجرت میکنند که در آنها با خود آنتیژنها ارائه میشوند. این خود آنتیژنها توسط سلولهای اپیتلیال قشر مغزی تیمی روی مولکولهای MHC در سطح سلولهای اپیتلیال قشر مغز بیان میشوند. فقط آن دسته از تیموسیتها که با MHC-I یا MHC-II ارتباط برقرار میکنند، یک سیگنال زنده ماندن حیاتی دریافت میکنند. تمام آنچه که نمیتواند (اگر تعامل کافی نداشته باشند) با مرگ بدون سیگنال از بین خواهد رفت.
این فرآیند تضمین میکند که سلولهای T انتخاب شده میل ترکیبی MHC دارند که میتواند عملکردهای مفیدی در بدن داشته باشد (یعنی سلولها باید بتوانند با مجتمعهای MHC و پپتید تعامل داشته باشند تا پاسخهای ایمنی را ایجاد کنند). اکثریت قریب به اتفاق تیموسیتهای در حال توسعه در طی این فرآیند از بین میروند. روند انتخاب مثبت چند روز طول میکشد.
سرنوشت تیموسیت در هنگام انتخاب مثبت تعیین میشود. سلولهای دو مثبت (CD4 + / CD8 +) که با مولکولهای کلاس II MHC تعامل خوبی دارند در نهایت به سلولهای CD4 + تبدیل میشوند، در حالی که تیموسیتهایی که با مولکولهای کلاس I MHC تعامل خوبی دارند به سلولهای CD8 بالغ میشوند. یک سلول T با بیان تنظیمکننده پایین گیرندههای سطح سلول CD8 خود، به یک سلول CD4 + تبدیل میشود.
اگر سلول سیگنال خود را از دست ندهد، به کم تنظیم CD8 ادامه میدهد و به یک سلول مثبت CD4 + تبدیل میشود. این فرآیند تیموسیتهایی را که ممکن است باعث خود ایمنی شوند از بین نمیبرد. سلولهای خود ایمنی بالقوه با فرایند انتخاب منفی که در مدولای تیمیک از بین میروند.
پاسخ منفی
انتخاب منفی، تیموسیتهایی که قادر به اتصال قوی به پپتیدهای MHC هستند را از بین میبرد. تیموسیتهایی که از انتخاب مثبت زنده ماندهاند به سمت مرز قشر و مدولا در تیموس مهاجرت میکنند. در حالی که در مدولا هستند آنها دوباره با یک آنتیژن خودی ارائه شده در مجموعه MHC سلولهای اپیتلیال تیموس مدولار (mTECs). mTECها باید AIRE + باشند تا بتوانند به درستی آنتیژنهای خود را از تمام بافتهای بدن بر روی پپتیدهای MHC کلاس I خود بیان کنند.
برخی از mTECها توسط سلولهای دندریتیک تیموس فاگوسیتوز میشوند. این امر امکان ارائه آنتیژنهای خود بر روی مولکولهای کلاس II MHC را فراهم میکند (سلول های CD4 + مثبت انتخاب شده باید با مولکولهای کلاس II MHC تعامل داشته باشند، بنابراین APCها که دارای کلاس MHC II هستند باید برای انتخاب منفی سلولهای CD4 + T وجود داشته باشند).
تیموسیتها که خیلی با خود آنتیژن ارتباط برقرار میکنند یک سیگنال آپوپتوتیک دریافت میکنند که منجر به مرگ سلول میشود. اما برخی از این سلولها برای تبدیل شدن به سلولهای Treg انتخاب شدهاند. سلولهای باقیمانده از تیموس به عنوان سلولهای T ساده لوح (که به عنوان مهاجران اخیر تیموس نیز شناخته میشوند) خارج میشوند.
این فرآیند یک مؤلفه مهم تحمل مرکزی است و به منظور جلوگیری از تشکیل سلولهای T خود واکنشی که قادر به ایجاد بیماریهای خود ایمنی در میزبان هستند عمل میکند. انتخاب زنجیره بتا اولین نقطه بازرسی است که در آن سلولهای T که قادر به ایجاد یک پیش - TCR عملکردی با یک زنجیره آلفای ثابت و یک زنجیره بتا عملکردی هستند، اجازه ادامه رشد در تیموس را دارند.
در مرحله بعدی، انتخاب مثبت بررسی میکند که سلولهای T با موفقیت مکان TCRα خود را مرتب کرده و قادر به شناسایی مجتمعهای پپتید-MHC با میل مناسب هستند. سپس انتخاب منفی در مدولا سلولهای T را که به شدت به خود آنتیژنهای بیان شده در مولکولهای MHC متصل میشوند، از بین میبرد. این فرایندهای انتخاب اجازه تحمل خود توسط سیستم ایمنی بدن را میدهد. سلولهای T معمولی که از تیموس خارج میشوند (از طریق اتصال کورتیکومدولاری) خود محدود شده، تحمل خود و تک مثبت هستند.
خروج لنفوسیت از تیموس
حدود 98 درصد از تیموسیتها در طی مراحل رشد در تیموس با عدم انتخاب مثبت یا انتخاب منفی میمیرند در حالی که 2 درصد دیگر زنده میمانند و تیموس را ترک میکنند تا به سلولهای T بالقوه ایمنی بالغ تبدیل شوند. تیموس با افزایش سن به بلوغ سلولهای کمتری کمک میکند.
همانطور که تیموس در طول میانسالی سالانه حدود 3 درصد کاهش مییابد یک سقوط مربوط به تولید تیموس سلولهای T ساده لوح رخ میدهد و باعث گسترش و بازسازی سلولهای T محیطی میشود تا در محافظت از افراد مسن نقش بیشتری داشته باشد.
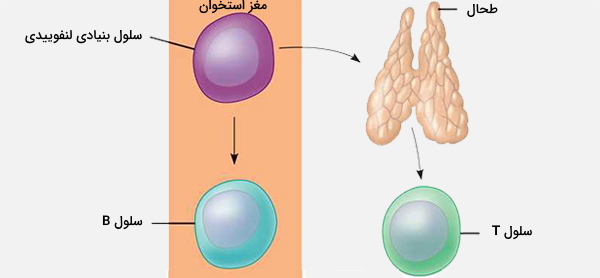
انواع لنفوسیت T
سلولهای T بر اساس عملکردشان در یک سری زیر مجموعهها قرار میگیرند. سلولهای CD4 و CD8 T در تیموس انتخاب می شوند اما در حاشیه به سلولهای تخصصی که عملکردهای مختلف دارند بیشتر تمایز مییابند. زیرمجموعههای سلول T در ابتدا با عملکرد تعریف میشوند اما همچنین دارای الگوی بیان ژن یا پروتئین هستند.
سلول های T کمکی
سلول های T کمکی (Th) که به آنها سلولهای CD4 + یا سلولهای CD4 مثبت نیز گفته میشود، نوعی سلول T است که نقش مهمی در سیستم ایمنی بدن، به ویژه در سیستم ایمنی سازگار دارد. همانطور که از نام آنها پیداست، آنها با آزاد کردن سیتوکینها، واسطههای پروتئینی کوچک که باعث تغییر رفتار سلولهای هدف که گیرنده سیتوکینها را تغییر میدهند، به فعالیت سایر سلولهای ایمنی بدن کمک میکنند.
این سلولها بسته به ماهیت توهین سیستم ایمنی (ویروس در مقابل باکتری خارج سلول در مقابل باکتری داخل سلولی هلمنت در مقابل ویروس و در مقابل آغازیان) به قطبی شدن پاسخ ایمنی در نوع مناسب کمک میکنند. آنها معمولا به عنوان کلاس تغییر یافته آنتیبادیهای b سل (Immunoglobulin Class Switching) باعث تحمل متقابل در سلولهای دندریتیک، در فعالسازی و رشد سلولهای T سیتوتوکسیک و به حداکثر رساندن فعالیت باکتریکش فاگوسیتها مانند ماکروفاژها و نوتروفیلها میشود.
سلولهای Th بالغ پروتئین سطح CD4 را بیان میکنند و به آنها سلولهای T CD4 + گفته میشود. چنین سلولهای CD4 + T به طور کلی با نقش از پیش تعیین شده به عنوان سلولهای T کمکی در سیستم ایمنی درمان میشوند. به عنوان مثال، هنگامی که یک سلول ارائهدهنده آنتیژن یک آنتیژن پپتید را بر روی پروتئینهای کلاس II MHC نشان میدهد، یک سلول CD4 + از طریق ترکیبی از فعل و انفعالات سلول به سلول (به عنوان مثال CD40 (پروتئین) و CD40L) و از طریق سایتوکاین به آن سلولها کمک میکند.
CD154 که CD40L لیگاند یا CD40L نیز نامیده میشود، یک پروتئین سطح سلول است که واسطه عملکرد سلول T در یک فرآیند وابسته به تماس است و عضوی از خانواده مولکولهای TNF محسوب میشود. این ماده بر روی سلولهای ارائهدهنده آنتیژن (APC) به CD40 متصل میشود که بسته به نوع سلول هدف منجر به بسیاری از تأثیرات خواهد شد.
CD154 به عنوان یک مولکول تحریککننده عمل میکند و به ویژه در زیر مجموعهای از سلولهای T به نام سلولهای کمککننده فولیکولی T (سلول های TFH) مهم است. در سلولهای TF ،H D154 با درگیر کردن CD40 در سطح سلول B و در نتیجه تسهیل ارتباط سلول به سلول، بلوغ و عملکرد سلول B را افزایش میدهد. نقص در این ژن منجر به عدم توانایی در تغییر کلاس ایمونوگلوبولین میشود و با سندرم بیش از حد IgM در ارتباط است.
عدم وجود CD154 همچنین تشکیل مراکز جوانهزنی را متوقف میکند و بنابراین بلوغ آنتیبادی را ممنوع میکند، فرایند مهمی در سیستم ایمنی سازگار که امکان تولید آنتیبادیهای با میل بالا را فراهم میکند که برای چالشهای آینده در مقابل عوامل بیماریزا محافظت خواهند کرد.
اهمیت سلولهای T کمکی در مجموع از طریق HIV، ویروسی که در درجه اول سلولهای CD4 + T را آلوده میکند (اما قادر به آلوده کردن سایر سلولهای مهم سیستم ایمنی بدن است مانند ماکروفاژهایی که CD4 را بیان میکنند) دیده میشود. در مراحل پیشرفته عفونت HIV، از دست دادن سلولهای CD4 + T عملکردی منجر به مرحله علامتی عفونت معروف به سندرم نقص ایمنی اکتسابی (AIDS) میشود.
هنگامی که HIV در اوایل خون یا مایعات دیگر بدن شناسایی شود، پیروی مناسب از درمان ضد رترو ویروسی از پیشرفت HIV در ایدز جلوگیری میکند و به بدن اجازه میدهد تا به طور طبیعی تعداد سلولهای CD4 خود را بازیابی کند. بخش کوچکی از افراد قادر به کنترل طولانی مدت بار ویروسی بدون کاهش قابل توجه سطح سلولهای T در طول زمان بدون کمک به درمان ضد رترو ویروسی که به آنها کنترلکنندههای نخبه یا غیرمحرکات طولانی مدت میگویند.
HIV مثالی از اختلال نقص ایمنی ثانویه است. نقص ایمنی اولیه شرایط ژنتیکی است که منجر به نقص ایمنی میشود که از پاکسازی کافی عفونتها جلوگیری میکند و علت آن کمبود سلولهای T به ویژه نوع ویرانگر است. یک مثال SCID (نقص ایمنی ترکیبی شدید) است که دلایل زیادی دارد و بسته به علت در فنوتیپ دقیق آن متفاوت است.
در حالی که بیشتر اشکال SCID در فقدان دو رده لنفوسیت T و B وجود دارند، SCID آتیپیک (تا حدی) با سطح طبیعی سلول B اما کمبود عمیق سلول T مشخص میشود. با این وجود به دلیل کمبود سلولهای T کمکی، سلولهای B عملکرد کاملاً مختل شدهای دارند. به طور کلی، سلولهای T بالغ (آنهایی که از طریق نقاط بازرسی رشد در تیموس عبور کردهاند اما هنوز با آنتیژن همبسته خود مواجه نشدهاند) توسط سلولهای ارائهدهنده آنتیژن اختصاصی تحریک میشوند و یک ماژول تأثیرگذار به دست میآورند.
اینها با وجود یک عامل رونویسی تعیینکننده اصل (یا تعیین کننده اصل و نسب) تعریف می شوند (همچنین تنظیم کننده اصلی نامیده میشود، اگرچه این اصطلاح به دلیل کاهنده بودن بیش از حد انتقاد شده است). از دست دادن عملکرد در یک نسب مشخص فاکتور رونویسی منجر به عدم وجود کلاس مربوطه سلول T کمکی میشود که میتواند برای سلامتی میزبان مخرب باشد.
به عنوان مثال، سلولهای T نظارتی معمولی (سلولهای Treg) با بیان ژن FoxP3 (جعبه Forkhead P3) تعریف میشوند و از دست دادن عملکرد این عامل رونویسی منجر به وضعیتی به نام سندرم IPEX (سلولی مرتبط با X و پلی آنتروکینوپاتی در تنظیم سیستم ایمنی مرتبط با X) میشود که با واکنشهای ایمنی خارج از کنترل که باعث آسیب شدید بافتی و همچنین بیماری خود ایمنی کامل میشود.
توجه داشته باشید که این بیماری خود ایمنی است و فقط وجود واکنش خودکار نیست زیرا این جمعیت سلولهای T کمکی برای تضعیف آنها وجود ندارد. در برخی موارد، جهش از دست دادن عملکرد میتواند در بالا دست فاکتور رونویسی مشخصکننده نسب رخ دهد. به عنوان مثال در سندرم Hyper IgE، جهش در ژن STAT3 وجود دارد که مسئول القای فاکتور رونویسی RORγT در پاسخ به ترکیب TGF-β و یا IL-6 یا IL-21 است که سلولهای TH17 را مشخص میکنند.
در نتیجه عدم وجود این سلولها، بیماران عفونتهای قارچی شدیدی دارند و در پاسخ به عوامل بیماریزای باکتریایی پیوژنیک مشکل دارند (اگرچه نقایص ایمنی دیگری نیز دارند زیرا STAT3 در سایر مسیرهای سیگنالینگ نیز نقش دارد). کمبود STAT3 همچنین توانایی تولید سلولهای TFH را به خطر میاندازد.
لنفوسیت T تنظیم کننده
سلولهای T تنظیم کننده یا سلولهای Treg، که قبلاً به عنوان سلولهای T سرکوبکننده شناخته میشدند، یک زیر جمعیت در سلولهای T هستند که سیستم ایمنی بدن را تعدیل میکنند، تحمل آنتیژنهای خود را حفظ نموده و از بیماری خود ایمنی جلوگیری میکنند. Tregs سرکوب کننده سیستم ایمنی است و به طور کلی القا و تکثیر سلولهای T مؤثر را سرکوب یا تنظیم میکند.
Tregs نشانگرهای زیستی CD4 ، FOXP3 و CD25 را بیان میکند و تصور میشود از همان نژاد سلولهای ساده CD4 گرفته شده باشد. از آنجا که سلولهای T مؤثر CD4 و CD25 را نیز بیان میکنند، تشخیص موثر Tregs از CD4 + بسیار دشوار است و مطالعه آنها را دشوار میکند. تحقیقات اخیر نشان داده است که سیتوکین TGFβ برای تمیز Tregs از سلولهای ساده CD4 + ضروری است و در حفظ هموستاز Treg مهم است.
مطالعه بر روی مدلهای موشی پیشنهاد کردهاند که تعدیل Tregs میتواند بیماری خود ایمنی و سرطان را درمان و پیوند اعضا و ترمیم زخم را تسهیل کند. پیامدهای آنها در مورد سرطان پیچیده است. Tregs تمایل دارد که در افراد مبتلا به سرطان تنظیم مجدد شود و به نظر میرسد که آنها در محل بسیاری از تومورها جذب میشوند.
مطالعات انجام شده روی هر دو مدل انسانی و حیوانی نشان داده است که تعداد زیاد Tregs در محیط تومور نشان دهنده پیش آگهی ضعیف است و تصور میشود Tregs باعث مهار ایمنی تومور میشود، بنابراین مانع توانایی ذاتی بدن در کنترل رشد سلولهای سرطانی میشود. تحقیقات اخیر ایمونوتراپی در حال بررسی چگونگی استفاده از تنظیم سلولهای T در درمان سرطان است.
سیستم ایمنی بدن باید بتواند بین خودی و غیر خودی تفاوت قائل شود. وقتی تبعیض از خود و غیر خود ناتوان شود، سیستم ایمنی بدن سلولها و بافتهای بدن را از بین میبرد و در نتیجه باعث بیماریهای خود ایمنی میشود. سلولهای T نظارتی فعالانه سیستم ایمنی بدن را سرکوب میکنند و از خود واکنشپذیری پاتولوژیک یعنی بیماری خود ایمنی جلوگیری میکنند.
نقش مهمی که سلولهای T نظارتی در سیستم ایمنی ایفا میکنند با سندرم خود ایمنی شدید که ناشی از نقایص ژنتیکی در سلولهای T نظارتی است نشان داده میشود. فعالیت تنظیمی / مهاری به طور قطعی مشخص نشده است و موضوع تحقیقات فشرده است. به طور قطعی مشخص نشده است و موضوع تحقیقات فشرده است. آزمایشات آزمایشگاهی نتایج متفاوتی را در مورد نیاز تماس سلول به سلول با سلول سرکوب شده ارائه داده است.
موارد زیر برخی از مکانیسمهای سرکوب سیستم ایمنی را نشان میدهند:
- سلولهای T تنظیم کننده تعدادی سیتوکین مهاری تولید میکنند. این موارد شامل تبدیل فاکتور رشد بتا، اینترلوکین 35 و اینترلوکین 10 است. همچنین به نظر میرسد که سلولهای T نظارتی میتوانند سلولهای دیگر را برای بیان اینترلوکین -10 ترغیب کنند.
سلولهای T تنظیم کننده میتوانند گرانزیم B تولید کنند که به نوبه خود میتواند باعث القا آپوپتوز در سلولهای مؤثر شود. گزارش شده است که سلولهای T تنظیمی در موشهای دارای کمبود گرانزیم B سرکوبگر، مهارکنندگان ضعیفتری برای فعال شدن سلولهای T مؤثر هستند. - سیگنالینگ معکوس از طریق تعامل مستقیم با سلولهای دندریتیک و القا سرکوبکننده سیستم ایمنی ایندولامین 2،3-دی اکسیژناز
- سیگنالینگ از طریق اکتو آنزیم CD39 و CD73 با تولید آدنوزین سرکوبکننده سیستم ایمنی
- از طریق فعل و انفعالات مستقیم با سلولهای دندریتیک توسط LAG3 و توسط TIGIT
مکانیسم کنترل دیگر از طریق حلقه بازخورد IL-2 است. سلولهای T فعال شده با آنتیژن، IL-2 تولید میکنند که سپس بر روی گیرندههای IL-2 در سلولهای T نظارتی عمل میکند و آنها را از این واقعیت که فعالیت سلولهای T بالا در منطقه رخ میدهد یک واکنش سرکوبکننده بر علیه آنها ایجاد میکنند. این یک حلقه بازخورد منفی است تا اطمینان حاصل شود که واکنش بیش از حد رخ نمیدهد.
اگر عفونت واقعی وجود داشته باشد، سایر عوامل التهابی سرکوب را کم میکنند. اختلال در حلقه منجر به بیش فعالی میشود، تنظیم میتواند قدرت پاسخ ایمنی را تغییر دهد. یک پیشنهاد مرتبط در رابطه با اینترلوکین 2 این است که سلولهای T نظارتی فعال آنچنان مشتاقانه اینترلوکین 2 را میگیرند که مانع از سلولهای T موثر برای جلوگیری از آپوپتوز میشوند.
لنفوسیت T تنظیم کننده القایی
لنفوسیتهای T تنظیم کننده یا (iTreg) القا شده (توسط CD4 + CD25 + Foxp3 +) و سلولهای سرکوبگری هستند که در تحمل نقش دارند. نشان داده شده است که سلولهای iTreg سرکوب سلولهای T و بیماریهای خود ایمنی تجربی را سرکوب میکنند. این سلولها شامل سلولهای Treg17 هستند. سلولهای iTreg از سلولهای T متعارف CD4 + خارج از تیموس رشد میکنند و باعث تمایز مشخصی بین سلولهای تنظیم کننده طبیعی T یا (nTreg) و سلولهای iTreg میشوند.
اگرچه سلولهای iTreg و nTreg عملکرد مشابهی دارند سلولهای iTreg اخیراً نشان داده شده است. زیر مجموعه نظارتی غیر اضافی ضروری که سلولهای nTreg را مکمل میکند تا حدی با گسترش تنوع TCR در پاسخهای نظارتی ارتباط دارد. کاهش شدید سلول iTreg در مدلهای موش منجر به التهاب و کاهش وزن شده است. سهم سلولهای nTreg در مقابل سلولهای iTreg در حفظ تحمل ناشناخته است اما هر دو مهم هستند.
اختلافات اپیژنتیکی بین سلولهای nTreg و iTreg مشاهده شده است با این اولی دارای بیان Foxp3 با ثباتتر و متیلزدایی گستردهتر هستند. محیط روده کوچک دارای ویتامین A زیاد و محلی برای تولید اسید رتینوئیک است. اسید رتینوئیک و TGF-beta تولید شده توسط سلولهای دندریتیک در این منطقه سیگنال تولید سلولهای T تنظیم کننده است.
ویتامین A و TGF-beta تمایز سلول T را به سلولهای T نظارتی مخالف سلولهای Th17 حتی در حضور IL-6 ارتقا می دهد. محیط روده می تواند منجر به سلولهای T نظارتی ناشی از (iTregs) با TGF-beta و اسید رتینوئیک شود، برخی از آنها بیانکننده گیرنده لکتین مانند CD161 هستند و برای حفظ یکپارچگی سد با تسریع بهبود زخم تخصص دارند. Tregs درون روده پس از معرفی آنتیژن از سلولهای T ساده متفاوت است.
لنفوسیت T کشنده
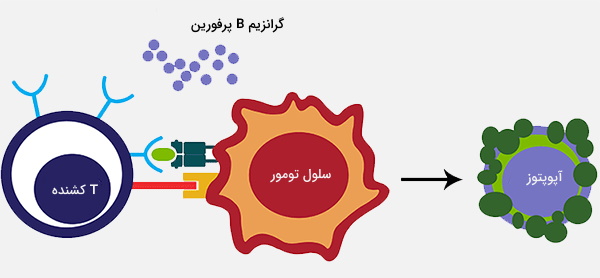
«سلولهای t کشنده» (Cytotoxic T Cell) سلول T سیتوتوکسیک (همچنین به عنوان TC، لنفوسیت T سیتوتوکسیک، CTL، سلول T کشنده، سلول T سیتولیتیک، سلول T8 CD8 یا سلول T کشنده) لنفوسیت T (نوعی گلبول سفید) است که سلولهای سرطانی، سلولهای آلوده (به ویژه با ویروسها) یا سلولهایی که از راههای دیگر آسیب دیدهاند را از بین میبرد.
بیشتر سلولهای T سیتوتوکسیک گیرندههای سلول T یا (TCR) را بیان میکنند که میتوانند یک آنتیژن خاص را تشخیص دهند. آنتیژن مولکولی است که توانایی تحریک پاسخ ایمنی را دارد و اغلب توسط سلولهای سرطانی یا ویروسها تولید میشود. آنتیژنهای داخل سلول به مولکولهای کلاس I MHC متصل میشوند و توسط مولکول کلاس I MHC به سطح سلول آورده میشوند، جایی که توسط سلول T قابل شناسایی هستند.
اگر TCR مختص آن آنتیژن باشد، به مجموعه مولکول کلاس I MHC و آنتیژن متصل میشود و سلول T سلول را از بین میبرد. برای اینکه TCR به مولکول MHC کلاس I متصل شود، نمونه اول باید با گلیکوپروتئین به نام CD8 همراه باشد که به قسمت ثابت مولکول MHC کلاس I متصل میشود. بنابراین، این سلولهای T سلولهای CD8 + T نامیده میشوند.
میل بین CD8 و مولکول MHC سلول TC و سلول هدف را در حین فعالسازی اختصاصی آنتیژن به هم نزدیک نگه میدارد. سلولهای CD8 + T پس از فعال شدن به عنوان سلولهای TC شناخته میشوند و به طور کلی طبقهبندی میشوند که دارای نقش سیتوتوکسیک از قبل تعریف شده در سیستم ایمنی بدن هستند. با این وجود سلولهای CD8 + T همچنین توانایی ساخت برخی سیتوکینها را دارند.
لنفوسیت T کشنده طبیعی
«سلولهای T کشنده طبیعی» (Natural killer T cell) سلولهای کشنده طبیعی T یا (NKT) گروهی ناهمگن از سلولهای T هستند که از نظر خصوصیات مشترکی با سلولهای T و سلولهای کشنده طبیعی را دارند. بسیاری از این سلولها مولکول غیر چند شکل CD1d را تشخیص میدهند، یک مولکول ارائه دهنده آنتیژن که چربیها و گلیکولیپیدهای خود و خارجی را متصل میکند.
آنها فقط تقریباً 1 درصد از کل سلولهای T خون محیطی را تشکیل میدهند. سلولهای T کشنده طبیعی نه باید با سلولهای کشنده طبیعی و نه سلولهای T کشنده (سلولهای T سیتوتوکسیک) اشتباه گرفته شوند. پس از فعال شدن، سلولهای NKT قادر به تولید مقادیر زیادی از اینترفرون گاما، IL-4 و عامل تحریک کلنی گرانولوسیت-ماکروفاژ و همچنین چندین سیتوکین و کموکین دیگر هستند (مانند IL-2 ،IL-13 ،IL-17 ،IL-21 و TNF-alpha).
سلولهای NKT عوامل محافظت شده چربی میکروبی را که توسط سلولهای ارائهدهنده آنتیژن CD1d بیان میشود، تشخیص میدهند. این به عنوان راهی برای سلولهای NKT در مبارزه با عفونتها و تقویت ایمنی هومورال عمل میکند. سلولهای NKT از سلولهای B که به عنوان یک دفاع میکروبی عمل و در هدف قرار دادن واکسنهای سلول B کمک میکنند، پشتیبانی نمایند.
لنفوسیت T خاطره
سلولهای T حافظه زیرمجموعه لنفوسیتهای T هستند که ممکن است عملکردهای مشابه سلولهای B حافظه را داشته باشند. اصل و نسب آنها مشخص نیست. سلولهای T خاطره اختصاصی آنتیژن مخصوص ویروسها یا سایر مولکولهای میکروبی را میتوان در هر دو زیر مجموعه TCM و TEM قرار داد. اگرچه بیشتر اطلاعات در حال حاضر براساس مشاهدات در زیر مجموعه سلولهای T سیتوتوکسیک (CD8 مثبت) است اما به نظر میرسد جمعیتهای مشابهی هم برای سلولهای T کمکی (CD4 مثبت) و هم سلولهای T سیتوتوکسیک وجود داشته باشد.
عملکرد اصلی سلولهای حافظه، افزایش ایمنی بدن پس از فعالسازی مجدد سلولها با ورود مجدد پاتوژن مربوطه به بدن است. توجه به این نکته مهم است که این رشته به شدت مورد مطالعه قرار گرفته و ممکن است برخی از اطلاعات هنوز در دسترس نباشد.
- TCM: لنفوسیتهای TCM دارای چندین ویژگی مشترک با سلولهای بنیادی هستند و مهمترین آنها توانایی تجدید خود است، عمدتا به دلیل سطح بالای فسفوریلاسیون در فاکتور اصلی رونویسی، STAT5. در موشها، TCM ثابت کرد که ایمنی قویتری در برابر ویروسها، باکتریها و سلولهای سرطانی ایجاد میکند، در مقایسه با لنفوسیتهای TEM در چندین مدل تجربی.
- TEM: لنفوسیتهای TEM و TEMRA در درجه اول به عنوان انواع CD8 فعال هستند، بنابراین به طور عمده مسئول عملکرد سمیت سلولی علیه عوامل بیماریزا خواهند بود.
- TRM: از آنجا که لنفوسیتهای TRM به مدت طولانی در بافتها یا مهمتر از همه، بافتهای سد کننده وجود دارند (به عنوان مثال اپیتلیوم)، آنها برای پاسخ سریع به نقض سد و پاسخ به هر بیماریزای مربوطه بسیار مهم هستند. یک مکانیسم مورد استفاده توسط TRM برای محدود کردن عوامل بیماریزا ترشحگر آنزیم B است.
- TSCM: این لنفوسیتها همانند لنفوسیتهای TCM قابلیت تجدید خود را دارند و همچنین قادر به تولید زیرمجموعههای TCM و TEM هستند. در حال حاضر حضور این جمعیت در انسان در دست بررسی است.
- TVM: از هم اکنون تنها عملکردی که در سلولهای TVM آشکار است تولید سیتوکینهای مختلف است اما گمانهزنیهایی در مورد تأثیر آنها در مهار وضعیتهای ایمنی ناخواسته و استفاده از آنها در درمان اختلالات خود ایمنی وجود دارد.
ﻟﻨﻔﻮﺳﯿﺖ ﻫﺎى T ﮔﺎﻣﺎ-دﻟﺘﺎ
سلولهای T گاما دلتا زیرمجموعه کوچکی از سلولهای T هستند که دارای یک TCR γδ به جای TCR αβ در سطح سلول هستند. اکثر سلولهای T زنجیرههای αβ TCR را بیان میکنند. این گروه از سلولهای T در انسان و موش بسیار کمتر دیده میشوند (حدود 2 درصد از کل سلولهای T) و بیشتر در مخاط روده، در جمعیت لنفوسیتهای داخل اپیتلیال وجود دارند. در خرگوش، گوسفند و مرغ، تعداد سلولهای T γδ میتواند تا 60 درصد سلول T کل باشد.
مولکولهای آنتیژنیک که سلولهای γδ T را فعال میکنند هنوز بیشتر ناشناخته هستند. با این حال، سلولهای γδ T محدودیتی در MHC ندارند و به نظر میرسد قادر به شناسایی پروتئینهای کامل هستند تا اینکه نیاز به پپتیدهای ارائه شده توسط مولکولهای MHC در APCها باشد.
برخی از سلولهای Tγδ موش، مولکولهای کلاس MHC IB را تشخیص میدهند. سلولهای گاماδT انسان که از قطعات ژن Vγ9 و Vδ2 استفاده میکنند، جمعیت اصلی سلولهای Tγδ را در خون محیطی تشکیل میدهند و از این نظر منحصر به فرد هستند که به طور خاص و سریع به مجموعهای از پیشسازهای ایزوپروئید فسفریله شده غیرپپتیدی که در مجموع فسفو آنتیژن نامیده میشوند، پاسخ میدهند.
تقریباً همه سلولهای زنده شایعترین فسفوآنتیژنهای سلولهای حیوانی و انسانی (از جمله سلولهای سرطانی) ایزوپنتنیل پیرو فسفات (IPP) و ایزومر دی متیل آلیل پیرو فسفات (DMPP) هستند. بسیاری از میکروبها علاوه بر IPP و DMAPP، ترکیب بسیار فعال هیدروکسی-DMAPP (HMB-PP) و ترکیبات مونونوکلئوتیدی مربوطه را نیز تولید میکنند. سلولهای گیاهی هر دو نوع فسفوآنتی ژن را تولید میکنند.
داروهای فعالکننده سلولهای T Vγ9 / Vδ2 انسانی شامل فسفوآنتیژنهای مصنوعی و آمینوبیس فسفوناتها هستند که IPP / DMAPP درونزا را تنظیم میکنند.
بیماری های مرتبط با لنفوسیت
شمارش لنفوسیتها به طور معمول بخشی از شمارش سلولهای خونی محیطی کامل است و به صورت درصد لنفوسیتها به تعداد کل گلبولهای سفید خون شمرده میشود. افزایش کلی تعداد لنفوسیتها به عنوان لنفوسیتوز شناخته میشود، در حالی که کاهش به عنوان لنفوسیتوپنی شناخته میشود.
بالا بودن لنفوسیت خون
افزایش غلظت لنفوسیتها به طور معمول نشانه عفونت ویروسی است (در برخی موارد نادر، لوسمیها از طریق افزایش غیر طبیعی تعداد لنفوسیتها در یک فرد غیر طبیعی مشاهده میشوند). تعداد زیاد لنفوسیتها با تعداد نوتروفیلهای کم ممکن است در اثر لنفوم ایجاد شود.
سم سیاه سرفه یا PTx) Bordetella pertussis) که قبلاً به عنوان عامل تقویتکننده لنفوسیتوز شناخته میشد، باعث کاهش ورود لنفوسیتها به غدد لنفاوی میشود که میتواند منجر به یک بیماری شناخته شده به عنوان لنفوسیتوز شود که با تعداد لنفوسیتهای کامل بیش از 4000 در میکرولیتر در بزرگسالان یا بیش از 8000 در هر میکرولیتر در کودکان مشخص میشود. این از آن جهت منحصر به فرد است که بسیاری از عفونتهای باکتریایی، در عوض غلبه نوتروفیل را نشان میدهند.
پایین بودن لنفوسیت خون
غلظت کم و مطلق لنفوسیت مطلق با افزایش میزان عفونت پس از جراحی یا ضربه همراه است. هنگامی که ویروس نقص ایمنی انسانی (HIV) سلولهای T را آلوده و از بین میبرد (به طور خاص، زیر گروه CD4 + لنفوسیتهای T که سلولهای T کمکی هستند)، یک پایه برای لنفوسیتهای سلول T کم رخ میدهد.
بدون دفاع کلیدی که این سلولهای T ارائه میدهند، بدن مستعد ابتلا به عفونتهای فرصتطلب میشود که در غیر این صورت افراد سالم را تحت تأثیر قرار نمیدهد. میزان پیشرفت HIV به طور معمول با اندازهگیری درصد سلولهای CD4 + T در خون بیمار تعیین میشود - HIV در نهایت به سندرم نقص ایمنی اکتسابی (AIDS) تبدیل میشود. اثرات ویروسها یا سایر اختلالات لنفوسیتی را نیز میتوان اغلب با شمارش تعداد لنفوسیتهای موجود در خون تخمین زد.
لنفوسیت نفوذپذیر تومور
در بعضی از سرطانها مانند ملانوم و سرطان روده بزرگ، لنفوسیتها میتوانند به تومور مهاجرت کرده و به آن حمله کنند که گاهی اوقات منجر به بازگشت تومور اولیه میشود.
آزمایش لنفوسیت خون
این آزمایش برای تشخیص عفونت، کم خونی یا سرطان خون یا برای کنترل تأثیر درمان درا فراد مبتلا انجام شود. نتایج عادی انواع آزمایشات گلبولهای سفید به صورت درصدی ارائه میشود و مقادیر نرمال آنها به طور کلی عبارتند از:
- نوتروفیل: 40 تا 60 درصد
- لنفوسیت: 20 تا 40 درصد
- مونوسیت: 2 تا 8 درصد
- ائوزینوفیل: 1 تا 4 درصد
- بازوفیل: 0/5 تا 1 درصد
- باند (نوتروفیل جوان): 0 تا 3٪ درصد
نتایج غیر عادی یعنی چه هرگونه عفونت یا استرس حاد باعث افزایش تعداد گلبولهای سفید خون میشود. تعداد بالای گلبولهای سفید خون ممکن است به دلیل التهاب، پاسخ ایمنی یا بیماریهای خونی مانند سرطان خون باشد. درک این نکته مهم است که افزایش غیر طبیعی یک نوع گلبول سفید میتواند باعث کاهش درصد انواع دیگر گلبولهای سفید خون شود. افزایش درصد نوتروفیلها ممکن است به دلیل موارد زیر باشد:
- عفونت حاد
- استرس حاد
- اکلامپسی (تشنج یا کما در یک زن باردار)
- نقرس (نوعی آرتروز به دلیل تجمع اسید اوریک در خون)
- اشکال حاد یا مزمن سرطان خون
- بیماریهای میلوپرولیفراتیو
- روماتیسم مفصلی
- تب روماتیسمی (بیماری ناشی از عفونت با باکتریهای استرپتوکوک گروه A)
- تیروئیدیت (بیماری تیروئید)
- ضربه
- سیگار کشیدن
کاهش نوتروفیلها ممکن است به دلیل موارد زیر باشد:
- کم خونی آپلاستیک
- شیمی درمانی
- آنفلوانزا (آنفولانزا)
- پرتودرمانی
- قرار گرفتن در معرض عفونت ویروسی
- عفونت شدید باکتریایی گسترده
افزایش درصد لنفوسیتها ممکن است به دلیل موارد زیر باشد:
- عفونت باکتریایی مزمن
- هپاتیت عفونی (تورم کبد و التهاب ناشی از باکتری یا ویروس)
- مونونوکلئوز عفونی یا مونو (عفونت ویروسی که باعث تب، گلودرد و تورم غدد لنفاوی میشود)
- لوسمی لنفاوی (نوعی سرطان خون)
- مولتیپل میلوما (نوعی سرطان خون)
- عفونت ویروسی (مانند اوریون یا سرخک)
کاهش درصد لنفوسیتها ممکن است به دلیل موارد زیر باشد:
- شیمی درمانی
- عفونت اچ آی وی / ایدز
- سرطان خون
- پرتودرمانی
- قرار گرفتن در معرض سپسیس (پاسخ شدید التهابی به باکتری یا سایر میکروبها)
- استفاده از استروئید
افزایش درصد مونوسیتها ممکن است به دلیل موارد زیر باشد:
- بیماری التهابی مزمن
- سرطان خون
- عفونت انگلی
- سل (عفونت باکتریایی که ریهها را درگیر میکند)
- عفونت ویروسی (به عنوان مثال مونونوکلئوز عفونی، اوریون، سرخک)
افزایش درصد ائوزینوفیلها ممکن است به دلیل موارد زیر باشد:
- بیماری آدیسون (غدد فوق کلیوی به اندازه کافی هورمون تولید نمیکنند)
- واکنش آلرژیک
- سرطان خون میلوژن مزمن
- بیماری عروقی کلاژن
- سندرم هایپرئوزینوفیل
- عفونت انگلی
افزایش درصد بازوفیلها ممکن است به دلیل موارد زیر باشد:
- بعد از عمل جراحی طحال
- واکنش آلرژیک
- لوسمی میلوژن مزمن (نوعی سرطان مغز استخوان)
- بیماری عروقی کلاژن
- بیماریهای میلوپرولیفراتیو (گروه بیماریهای مغز استخوان)
- آبله مرغان
درصد کاهش بازوفیل ممکن است به دلیل موارد زیر باشد:
- عفونت حاد
- سرطان
- آسیبدیدگی شدید