قانون گازها — به زبان ساده

در فیزیک کلاسیک، مواد به سه حالت جامد، مایع و گاز دستهبندی شده و برای هر یک از این حالتها قوانین فیزیک به خوبی رفتار ماده را تحلیل و بررسی میکنند (از مواد در مقیاس اتمی، زیراتمی و بسیار بزرگ در بیان جمله بالا صرفنظر شده است). در این آموزش از مجله فرادرس قانون گازها و معادلات حرکت مربوط به گازها را مورد مطالعه قرار میدهیم.
قوانین کلی حاکم بر رفتار گازها
در مجموع باید بیان کرد که چهار قانون کلی برای گازها وجود دارد که عنوان این قوانین با نام کاشف آنها مطابقت داده شده است. این قوانین عبارتند از:
- «قانون شارل» (Charles' Law)
- «قانون بویل» (Boyle's Law)
- «قانون آووگادرو» (Avagadro's Law)
- «قانون گیلوساک» (Gay Lussac's Law)
در ادامه، هر یک از قوانین گازها را با جزئیات بیشتری مورد بررسی قرار میدهیم.
قانون شارل
این قانون رابطه میان حجم و دما را در صورتی که فشار و مقدار گاز ثابت باشد، بیان میکند. طبق این قانون در فشار و مقدار ثابت گاز، اگر حجم زیاد شود، دما افزایش پیدا میکند و همچنین با کاهش حجم، دما نیز کم خواهد شد. در حقیقت، این قانون بیان میکند که بین حجم و دمای یک گاز، رابطه مستقیم وجود دارد.
بیان ریاضی قانون شارل با شروع از حالت اولیه $$V_{1}$$ و $$T_{1}$$ به صورت زیر است:
$$\large\frac{V_{1}}{T_{1}}=\frac{V_{2}}{T_{2}}$$

قانون بویل
این قانون رابطه میان حجم و فشار را بیان میکند. بر اساس این قانون حجم یک گاز در دمای ثابت به صورت عکس با فشار رابطه دارد.
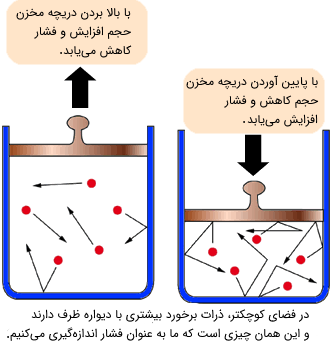
کاهش حجم یک گاز در دمای ثابت به این معنا است که مولکولهای گاز بیشتر با دیوارههای ظرف برخورد کرده و در نتیجه فشار افزایش مییابد. بالعکس با افزایش حجم یک گاز در دمای ثابت، مولکولهای گاز کمتر با دیوارهای ظرف برخورد کرده و فشار کاهش مییابد. مانند قانون شارل با دانستن فشار و حجم گاز در یک حالت اولیه در دمای ثابت، میتوان فشار و حجم را در زمانهای بعد طبق رابطه زیر بررسی کرد:
$$\large P_{1}V_{1}=P_{2}V_{2}$$
قانون آووگادرو
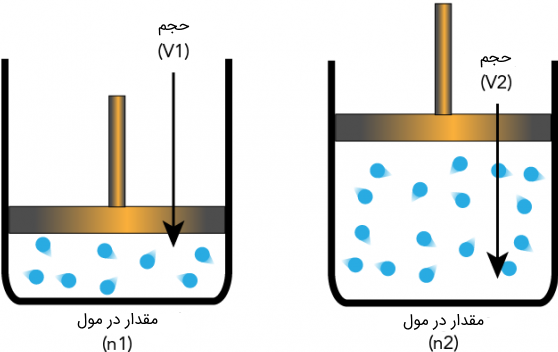
رابطه میان حجم و تعداد مولهای گاز در فشار و دمای ثابت، توسط قانون آووگادرو بررسی میشود. بر اساس این قانون اگر تعداد مولهای یک گاز در یک ظرف در فشار و دمای ثابت کاهش یابد، حجم کاهش پیدا میکند و بالعکس. بیان ریاضی این قانون از حالت اولیه $$V_{1}$$ و $$n_{1}$$ به صورت زیر است:
$$\large\frac{V_{1}}{n_{1}}=\frac{V_{2}}{n_{2}}$$
قانون گیلوساک
این قانون تحت عنوان «آمونتونس» (Amonton's Law) نیز شناخته میشود. براساس این قانون، فشار یک گاز که در حجم ثابت نگه داشته شده است، به صورت مستقیم با دمای گاز بر حسب کلوین رابطه دارد. توجیه این مسئله نیز ساده است؛ با گرم کردن یک گاز در حجم ثابت مولکولهای گاز انرژی بیشتری کسب کرده و سریعتر حرکت میکنند و در نتیجه با دیوارههای ظرف بیشتر برخورد میکنند.
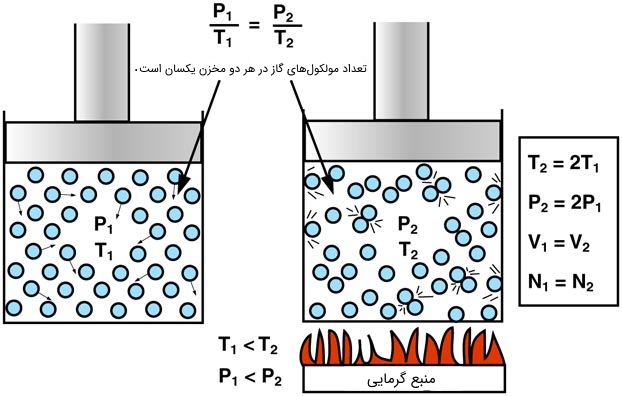
برای محاسبه تغییرات فشار در این حالت از رابطه زیر استفاده میکنیم:
$$\large\frac{P_{1}}{T_{1}}=\frac{P_{2}}{T_{2}}$$
قانون ترکیب گازها
با ترکیب قوانین بویل، شارل و گیلوساک برای یک جرم مولی معین، میتوان به یک بیان کلی در مورد رفتار گازها دست پیدا کرد و بدین ترتیب داریم:
$$\large\frac{P×V}{T}=constant$$
از این قانون برای بررسی شرایط گاز در حالتهای مختلف دیگر نیز میتوان استفاده کرد.
گاز ایدهآل
از سه رابطه بویل، شارل و آووگادرو به ترتیب داریم:
$$\large V\propto\frac{1}{P}$$
$$\large V\propto T$$
$$\large V\propto n$$
در نتیجه، میتوان گفت:
$$\large V\propto\frac{nT}{P}\rightarrow V=R\frac{nT}{P}$$
در رابطه بالا، $$R$$ ثابت گاز ایدهآل است. در رابطه گاز ایدهآل دما همواره بر حسب کلوین است. برای فهم بیشتر مباحث مطرح شده در این بخش به بررسی چند مثال در رابطه با قانون گازها میپردازیم.
مثال هایی از کاربرد قانون گازها
مثال ۱: یک گاز با حجم $$4 (L)$$ در فشار $$205 (kPa)$$ امکان افزایش حجم تا $$12(L)$$ در دمای ثابت را دارد. در این حالت فشار گاز چه قدر است؟
حل: فشار ثانویه با استفاده از قانون بویل به سادگی قابل محاسبه است و داریم:
$$\large P_{2}=\frac{4\ L\times205\ kPa}{12\ L}=68.3\ (kPa)$$
همان طور که میبینید کار با این معادلات بسیار آسان است. تنها نکته مهم، واحد کمیتها در رابطه است که باید به آن دقت کرد.
مثال ۲: یک گاز حجم $$900 (mL)$$ را در دمای $$27^{\circ} C$$ اشغال میکند. این گاز در دمای $$132^{\circ} C$$ چه حجمی را اشغال میکند؟
حل: با استفاده از قانون شارل، حجم ثانویه به راحتی قابل محاسبه است. تنها نکتهای که باید مورد توجه قرار گیرد، واحد دما در این رابطه است که باید برحسب کلوین باشد. با تبدیل واحد از سانتیگراد به کلوین طبق رابطه زیر داریم:
$$\large K=27^{\circ}C+273$$
با استفاده از این رابطه، دمای ابتدایی برابر با $$300 K$$ و دمای نهایی برابر با $$405K$$ میشود. حال با استفاده از رابطه شارل داریم:
$$\large \frac{900\ mL}{300\ K}=\frac{V_{2}}{405\ K}\rightarrow V_{2}=1215\ (mL)$$
مثال ۳: گاز درون یک قوطی اسپری مو در دمای $$27^{\circ} C$$ فشار $$30\frac{lbs}{in^{2}}$$ به دیوارههای قوطی وارد میکند. اگر فشار گاز به دیوارهها به $$620528\ Pa$$ برسد، قوطی منفجر میشود. مشخص کنید در هنگام انفجار قوطی اسپری مو، دما چه قدر است؟
حل: نکته مهم در حل مثال این است که واحد فشار در حالت اولیه و ثانویه یکسان نیست و نمیتوان از دو واحد متفاوت برای حل این مسئله استفاده کرد. بدین ترتیب لازم است یا $$\frac{lbs}{in^{2}}$$ به پاسکال و یا پاسکال به $$\frac{lbs}{in^{2}}$$ تبدیل شود. در اینجا تبدیل پاسکال با $$\frac{lbs}{in^{2}}$$ را انجام میدهیم. در نتیجه با توجه به اینکه $$1\ Pa=1.45038\times 10^{-4}\frac{lbs}{in^{2}}$$ است، فشار ثانویه برابر با $$90\frac{lbs}{in^{2}}$$ میشود. حال با استفاده از رابطه گایلوساک در قانون گازها داریم (دقت کنید در اینجا نیز تبدیل سانتیگراد به کلوین ضروری است):
$$\large \frac{30\ \frac{lbs}{in^{2}}}{300\ K}= \frac{90\ \frac{lbs}{in^{2}}}{T_{2}}\rightarrow T_{2}=900\ K$$
مثال ۴: چگالی دیاکسید کربن در شرایط استاندارد چه قدر است (۱ مول از هر گاز = ۲۲٫۴ لیتر از گاز در شرایط استاندارد)؟
حل: برای حل این سوال به کمی اطلاعات شیمی و فیزیک نیاز داریم. رابطه چگالی برابر است با:
$$\large \rho = \frac{m}{V}$$
از طرفی جرم مولی دیاکسید کربن از رابطه زیر محاسبه میشود:
$$\large CO_{2}=12.01\ \frac{g}{mol}+2\times 16\ \frac{g}{mol}=44.01\ \frac{g}{mol}$$
در نتیجه چگالی برابر است با:
$$\large \rho = \frac{44.01\ \frac{g}{mol}}{22.4\ \frac{L}{mol}}=1.96\ (\frac{g}{L})$$
مثال ۵: وقتی حجم یک محفظه گاز از $$85\ mL$$ به $$350\ mL$$ افزایش یابد، فشار آن از $$1200\ mm\ Hg$$ به $$850\ mm\ Hg$$ کاهش پیدا میکند. اگر دمای اولیه محفظه گاز $$90^{\circ} C$$ باشد، دمای نهایی چهقدر است؟
حل: با استفاده از قانون گازها که به عنوان قانون ترکیبی گازها معرفی کردیم، میتوان دمای نهایی را محاسبه کرد:
$$\large \frac{(1200\ mm\ Hg)(85\ mL)}{(90+273)\ K}=\frac{(850\ mm\ Hg)(350\ mL)}{T_{2}}$$
$$\large \rightarrow T_{2}=1058.75\ K$$











سلام ، من یک روز آمدم با تلمبه دوچرخه لاستیکم را باد کرد ، اما زمانی دستم به انتهای تلمبه جایی که گاز هوا فشورده میشد به شدت داغ شده بود مگر با افزایش فشار و کم شدن حجم دما افزایش پیدا میکند ؟ چون در قانون ها یا حجم ثابت یا فشار را ثابت یا دما را ثابت در نظر میگرفتن تا رابطه ی دوتا از متغیرهای حالت با هم بفهمن ولی کسی رابطه ستارو نگفته ؟
آیا قوانین گازها برای فرایند های غیر تعادلی نیز صدق میکند؟
سلام و روز شما بهخیر؛
بله، میتوان از این قوانین برای فرآیندهای غیرتعادلی نیز بهره برد.
خوشحالیم که با مجله فرادرس همراه هستید.
رابطه بین حجم وفشار چگونه است?اگر بایک تلمبه داخل یک ظرف دربسته به اندازه حجم داخل ان ظرف هوا بدمیم.فشار داخل این ظرف چقدر تغییر میکند؟
سلام و عرض ارادت .
از اینکه در این شرایط که همه بدنبال مادیات هستند انرژی و وقت خود را صرف مطالب مفید و کاربردی علمی میکند جای سپاس و قدردانی دارد،
سلام ایران بانوی گرامی جهت تبدیل شدن یکصد سی سی گاز طبیعی به گاز مایع چه مقدار فشار و در چه دمایی این فرایند به صورت متوالی تبدیل گاز به مایع و مایع به گاز نیاز است ،، پیشا پیش از هرگونه پیگری و پاسخ شما سپاسگزارم،
با سلام؛
از ارائه بازخورد محبتآمیز شما سپاسگزاریم.
با تشکر از همراهی شما با مجله فرادرس
سلام و وقت شما بخیر
اگر نشتی گاز سمی داشته باشیم و در نقطه انتشار 200 ppm باشد در فاصله 50 سانت و 100 سانت غلظت گاز چقدر میشود؟ (در صورت نبودن وزش باد)
لطفا با فرمول باشد
تشکر و خیلی ممنون
با سلام
امكان محاسبه حجم هوا بر اساس فشار و ابعاد محل عبور هوا مي باشد؟
(معلومات=فشار و ابعاد محل عبور.
مجهولات= حجم و سرعت)
سلام وقت بخیر
در یک ساختار اگر دما بالا باشد بر اساس رابطه شار…بر فرض اینکه حجم ثابت باشد ،فشار چه تغییری می کند؟
سلام و روز شما به خیر؛
طبق قانون گی لوساک در این حالت فشار و دما با هم رابطه مستقیم دارند و با بالا رفتن دما فشار افزایش مییابد.
از همراهی شما با فرادرس خرسندیم.
سلام سوال بنده شبیه به سوال دوست عزیزمان است با کمی تفاوت <<<< ما ۱۰ عدد کپسول هوای ۲۰۰ بار با حجم 22 لیتر داریم و میخواهیم با اون یک کپسول ثانویه را به اندازه ۱۸۰ بار هوا که حجمش 43 لیتر است پر کنیم . حالا سوال اینه که با چند تا از کپسول های ۲۰۰ بار 22 لیتری میتوانیم این کپسول را به اندازه ۱۸۰ بار پر کنیم؟ فرمول نحوه محاسبه ریاضی آن را میخاستم و سوال دیگه اینکه هوای باقی مانده در هر کدان از 10 کپسولی که استفاده شده چقدر است؟؟فرمول نحوه محاسبه ریاضی
مجموع حجم شما ۲۶۳ لیتر میشه که بعد اتصال کپسولها به هم و ارسال گاز فشار همه مخزنها ۱۶۷ بار میشه
سلام سوال من هم مثل سوال نیما عزیز هستش که پاسخ داده نشد . تنها تفاوت سوال من این هستش که حجم دو کپسول هم با هم متفاوت هستش؟ و سوال دیگه اینکه اگه با کپسول اول پر کپسول ثانویه با حجم متفاوت پر کنیم حالا چقدر هوا در کپسول اولیه باقی می ماند؟( روابط کلی برایم مهم است)
سلام و روز شما به خیر؛
پاسخ به سوال شما و همراه دیگر مجله فرادرس با توجه به شرایط انجام آزمایش با استفاده از قوانین و روابط حاکم بر گازها به راحتی قابل محاسبه است. ولی تا زمانی که شرایط انجام آزمایش را از منظر دمایی نداشته باشیم نمیتوان به سوالات پاسخ داد.
از همراهی شما با فرادرس خرسندیم.
چرا در قانون گیلوساک فشار با دما نسبت مستقیم دارد؟ در حالی که طبق قانون بویل باید نسبت عکس داشته باشند.
سلام و روز شما به خیر؛
در هر دو قانون فشار و دما نسبت مستقیم دارند. در حقیقت در قانون بویل داریم $$PV=nRT$$ که به وضوح مشخص است که فشار با دما نسبت مستقیم دارد.
از همراهی شما با فرادرس خرسندیم.
مطالب بسیار عالی بود
سلام ممنونم از مطالب خوبتون
برای محاسبه گاز مصرفی یک مشعل که حجم جسمی ک مشعل داخل ان است و گرم میکند و نوع متریال و درجه سانتیگراد رو هم داریمرچجوری محاسبه کنیم ممنونم
سلام و روز شما به خیر؛
از اینکه مطلب برای شما مفید بوده است بسیار خرسندیم.
سلام تشکر بابت آموزش خوب شما. سوالی داشتم:
ما 10 عدد کپسول هوای 200 بار داریم و میخواهیم با اون یک کپسول ثانویه را به اندازه 180 بار هوا پر کنیم . حالا سوال اینه که با چند تا از کپسول های 200 بار میتوانیم این کپسول را به اندازه 180 بار پر کنیم؟ فرمول نحوه محاسبه ریاضی آن را میخاستم و اینکه این نکته که با حداقل تعداد کپسول این کار اتفاق بیفتد.( فقط میدونم که با هر بار باز کردن یک کپسول200 بار هوای بین دو کپسول هم هوا یا برابر هم میشود یعنی در ابتدا که کپسول خالی است هوا هر دو کپسول به 100 بار می رسد و به همین شکل تا شارژ به 180 برسد اما رابطه ریاضی اون با توجه با حجم متفاوت کپسول ها؟؟؟)
سلام ببخشید اگه در فشار ثابت دما دو برابر بشه حجم چه تغیری میکنه؟
سلام و روز شما به خیر؛
با دو برابر شدن دما در فشار ثابت و استفاده از قانون شارل، حجم ثانویه یا نهایی گاز دو برابر میشود.
از اینکه با فرادرس همراه هستید خرسندیم.
ببخشید اگر تغییر دما داشتیم و همنیطور در سوال فشار دوم بخاد از چی استفاده کنیم
اصن بزارید سوال رو بگم
گازی در فشار ۲اتمسفر در دمای۲۵ درجه سانتی..دمای گاز را به ۱۰۰ درجه.. میرسانیم وحجم گاز را دوبرابر میکنیم فشار گاز در این حالت بدست اورید
سلام و روز شما به خیر؛
سوالی که مطرح کردهاید دقیقاً شبیه مثال 5 است که در نوشتار حل شده و با استفاده از رابطه قانون ترکیب گازها فشار برای این حالت برابر با 1.25 اتمسفر به دست میآید.
از اینکه با فرادرس همراه هستید خرسندیم.
سلام.چرا دما باید به صورت کلوین باشه و نمیتونه بر اساس سانتی گراد باشه؟
واقعا مطالب عالی بودن و استفاده کردم خیلی ممنونم ازتون?
سلام و روز شما به خیر؛
واحدهای مورد استفاده در روابط در فیزیک باید بر حسب یکاهای استاندارد بین المللی باشد و این یکای استاندارد برای دما برحسب کلوین است. برای مطالعه بیشتر در مورد یکا ها مطلب یکا چیست؟ — هرآنچه باید بدانید را مطالعه کنید.
از اینکه با مجله فرادرس همراه هستید خرسندیم.
اولین مثال اشکال تایپی داره
205 پاسکال
سلام ممنون از مطالب
یه سوال برام پیش آمده اگر در یک مخزن ثلب که سیکل آن بسته است با حجم ثابت اگر دما افزایش یابد فشار آن هم افزایش می یابد آیا جرم آن هم افزایش می یابد ؟
سلام و روز به خیر؛
205 کیلوپاسکال صحیح بود که در متن سوال اصلاح شد.
از اینکه با مجله فرادرس همراه هستید خرسندیم.