فلوسایتومتری چیست؟ — تکنیک، اصول کلی و کاربردها — به زبان ساده
فلوسایتومتری یک روش آزمایشگاهی است که برای بیان مولکولها، شناسایی و شمارش سلولهای خاص استفاده میشود و اولین بار توسط ایمونولوژیستهایی ابداع شد که نیازمند جداسازی سلولهای ایمنی از یکدیگر بودند. این روش همچنین میتواند اجزای خاص درون سلولها را شناسایی کند. این اطلاعات بر اساس مشخصات فیزیکی یا نشانگرهایی به نام آنتیژن در سطح یا درون سلولها است که منحصر به نوع سلول هستند. این روش ممکن است برای ارزیابی سلولهای خون، مغز استخوان، مایعات بدن مانند مایع مغزی نخاعی (CSF) یا تومورها مورد استفاده قرار گیرد.
فلوسایتومتری چیست؟
فلوسایتومتری به طور معمول در تحقیقات پایه، آزمایشهای شیمی و آزمایشهای بالینی مورد استفاده قرار میگیرد. فلوسایتومتری (FC) تکنیکی است که برای شناسایی و اندازهگیری خصوصیات فیزیکی و شیمیایی جمعیت سلولها یا ذرات، مورد استفاده قرار میگیرد. در این فرآیند، یک نمونه حاوی سلولها یا ذرات در یک مایع معلق شده و به دستگاه سنجش جریان تزریق میشود.
این نمونه طوری تنظیم شده است که به صورت ایدهآل هر بار سلول را از طریق یک پرتوی لیزر جریان دهد، جایی که نور پراکنده مشخصه سلولها و اجزای آن است. سلولها اغلب با مارکرهای فلورسنت برچسبگذاری میشوند بنابراین نور جذب شده و سپس در یک باند از طول موج ساطع میشود.
دهها هزار سلول میتوانند به سرعت مورد بررسی قرار گیرند و دادههای جمعآوری شده توسط رایانه پردازش شوند. موارد استفاده فلوسایتومتری عبارتند از: شمارش سلولها، مرتبسازی سلولها، تعیین خصوصیات و عملکرد سلولها، تشخیص میکروارگانیسمها، تشخیص بیومارکرها، مهندسی پروتئین و تشخیص اختلالاتی مانند سرطان خون. آنالایزر فلوسایتومتری ابزاری است که دادههای کمی را از یک نمونه تهیه میکند. ابزارهای دیگر با استفاده از فلوسایتومتری شامل دستهبندی سلولی هستند که از نظر فیزیکی سلولهای مورد نظر را بر اساس ویژگیهای نوری آنها جدا میکنند.
تاریخچه ابداع فلوسایتومتری
اولین دستگاه فلوسایتومتری مبتنی بر امپدانس، توسط Wallace H. Coulter اختراع و در سال 1953 در ثبت اختراعات ایالات متحده، ثبت شد. مک فولویلر مخترع پیشینی سیلومترهای جریان امروزی، به ویژه طبقهبندی سلولی بود. فولویلر این مسئله را در سال 1965 با انتشار در ژورنال Science منتشر کرد. اولین دستگاه جریان سنجش جریان فلورسانس (ICP 11) در سال 1968 توسط ولفگانگ گوهده از دانشگاه مونستر ساخته شد، در 18 دسامبر 1968 ثبت اختراع شد و اولین بار در سال 1968/69 توسط توسعه دهنده و تولیدکننده آلمانی به نام «Partec» تجاری شد.
در آن زمان، روشهای جذب هنوز به طور گستردهای مورد پسند سایر دانشمندان نسبت به روشهای فلورسانس بودند. اندکی بعد، ابزارهای فلوسایتومتری از جمله موارد زیر ابداع شدند:
- Cytofluorograph از «Bio/ Physics Systems Inc» در سال ۱۹۷۱
- PAS 8000 از «Partec» در سال ۱۹۷۳
- اولین ابزار FACS (مرتبسازی سلول فعال شده با فلورسانس) از بکتون دیکینسون در سال 1974
- ICP 22 از «Partec» در سال ۱۹۵۵
- Phywe از «Coulter» در سال 1977
اولین سیتومتر جریان امپدانس با فرکانس بالا بدون برچسب بر اساس آزمایشگاه روی تراشه میکروسیال ثبت شده، Ampha Z30، توسط Amphasys (2012) معرفی شد. نام اصلی فناوری فلوسایتومتری مبتنی بر فلورسانس، بر اساس اولین کاربرد ثبت اختراع در فلوسایتومتری مبتنی بر فلورسانس «سایتوفوتومتری پالس» بود. در پنجمین کنفرانس بنیاد مهندسی آمریکا در سیتولوژی اتوماتیک در پنساکولا (فلوریدا) در سال 1976 هشت سال پس از معرفی اولین فلوسایتومتر مبتنی بر فلورسانس (1968) - توافق شد که معمولاً از نام فلوسایتومتری استفاده شود، اصطلاحی که به سرعت محبوب شد.
اجزای دستگاه فلوسایتومتری چه هستند؟
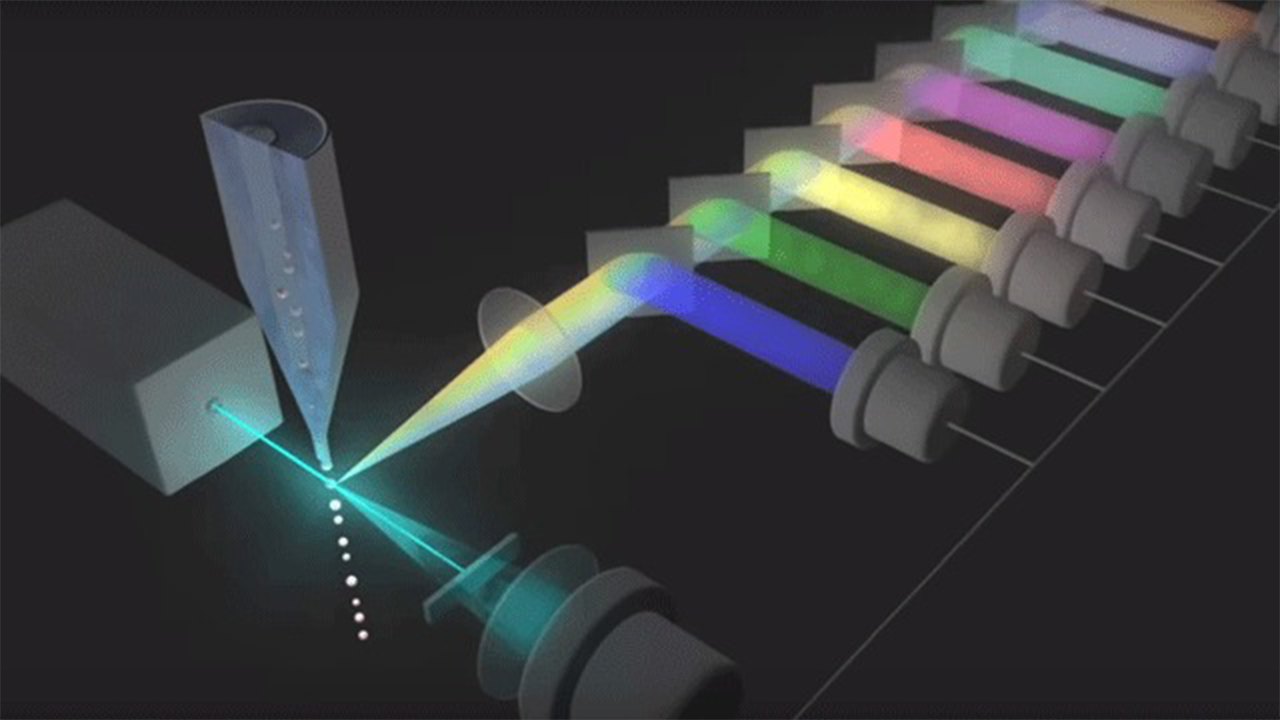
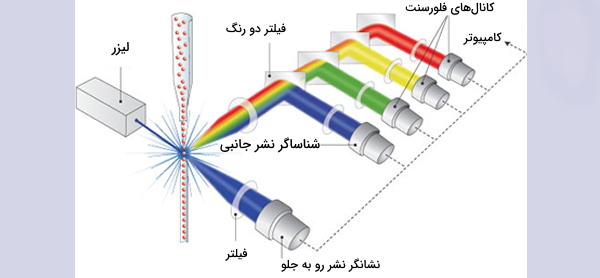
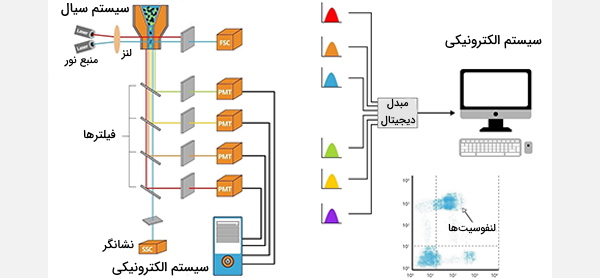
دستگاه فلوسایتومتری از سه سیستم اصلی سیال، اوپتیک و الکترونیک تشکیل شده است. سیستم سیالات شامل یک سلول جریان است که در آن مایعات نمونه تزریق میشوند. سلول جریان برای حمل و تراز سلولها یا ذرات به مایع غلاف نیاز دارد تا آنها ار یک کانال باریک عبور کنند و در یک فایل واحد به داخل مسیر لیزر برسند. این تمرکز هیدرودینامیکی امکان تجزیه و تحلیل همزمان یک سلول را با به کار گرفتن لیزر فراهم میکند. سیستم نوری از فیلترهای مختلف، آشکارسازهای نور و منبع نور تشکیل شده است که معمولا یک خط لیزر هستند و یک طول موج نوری را یا فرکانسی خاص تولید میکنند که محل عبور ذرات از حداقل یک پرتوی لیزر است.
لیزرها در طول موجهای مختلف ماوراءبنفش تا فروسرخ در دسترس هستند و همچنین دامنه متغیر سطح قدرت (خروجی فوتون/ زمان) دارند. پرتوی لیزر هر پروب فلورسنت سازگاری را که با آنتیبادیها متسل شده است تحریک میکند و باعث میشود که پروبها در طول موجهای مشخص شده، نور منتشر کنند.

سیگنال های نوری فلوسایتومتری
این سیگنالها در دو حالت پراکنده به جلو و پراکنده جانبی هستند. پارامترهای اصلی که توسط دستگاه فلوسایتومتری اندازهگیری میشوند عبارتند از:
- پراکندگی نور جلو (FSC)
- پراکندگی نور جانبی (SSC)
- سیگنالهای انتشار فلورسانس
سیگنال نور پراکنده رو به جلو، نوری است که توسط سلول در جهت جلو شکسته میشود و در همان جهتی که نور در حال حرکت بود ادامه مییابد (به طور معمول تا ۲۰ درجه از محور پرتو لیزر جابجا میشود). این سیگنال توسط PMT به نام کانال پراکندگی رو به جلو جمعآوری و معمولا برای تعیین اندازه ذرات استفاده میشود. معمولا ذرات بزرگتر نسبت به ذرات کوچکتر نور پراکنده به جلو تولید میکنند و سلولهای بزرگتر دارای سیگنال پراکنده رو به جلو هستند.
نور پراکنده جانبی، نوری است که توسط سلولها شکسته شده و در جهتی متفاوت از مسیر اصلی خود حرکت میکند (با زاویه ۹۰ درجه نسبت به خط تحریک اندازهگیری میشود). معمولا اطلاعاتی در مورد دانه دانه بودن و پیچیدگی سلولها فراهم میکند. سلولهایی که دارای دانهبندی و پیچیدگی کم هستند، نور پراکنده جانبی کمتری تولید میکنند، در حالی که سلولهای بسیار دانهای با درجه پیچیدگی داخلی (مانند نوتروفیلها)، منجر به سیگنال پراکندگی جانبی بالاتر میشوند. اگرچه از نظر شکل و اندازه سلولها تحت تأثیر قرار میگیرند اما به غشاها، سیتوپلاسم، هسته و سایر اندامکها حساستر است.
بنابراین با استفاده از تشخیص نور پراکنده رو به جلو و جانبی، جمعیت سلولها را اغلب میتوان بر اساس تفاوت مشخصه در اندازه سلول و دانهبندی تشخیص داد. هر دو اندازهگیری تحت تأثیر عوامل متعددی قرار دارند و SSC و FSC به کیفیت تهیه نمونه نیز بستگی دارند بنابراین برای جمعآوری اطلاعات دقیقتر میتوان از تکنیکهای برچسب زدن فلورسنت یا فلوسایتومتر استفاده کرد.
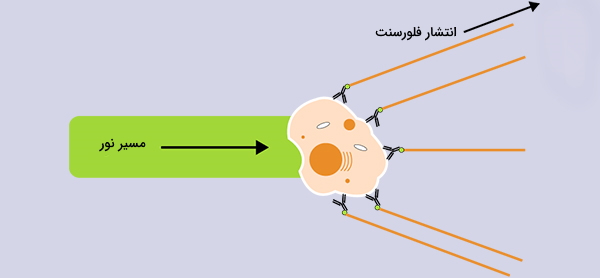
سیگنال های انتشار نور فلورسنت
نکتهای که باید به آن توجه شود این است که سیگنالهای فلورسنت نیز ممکن است از مواد طبیعی فلوسورساز در سلول مکانند نوکلئوتیدهای پیریدن کاهش یافته (NAD(P)H) و فلاوینهای اکسید شده (FAD) به وجود بیایند که اصطلاحا «اتوفلورسنس» (Autofluorescence) گفته میشود. به طور کلی، سلولهای دانهای بزرگتر به دلیل داشتن مقدار زیادی از ترکیبات فلورسنت، سطح فلورسانس بالاتری دارند. سطح اتوفلورسنس را میتوان با استفاده از کنترل رنگآمیزی نشده تعیین کرد. اغلب داشتن کنترلهای رنگآمیزی نشده یا FMO (فلورسانس منهای یک) کاربرد دارد. FMO کمک میکند تا سلولها را در حین تجزیه و تحلیل دادهها، شناسایی و از آنها استفاده کرد.
انواع نمونه فلوسایتومتری
سادهترین نمونهها براین فلوسایتومتری سلولهای کشت شده، میکروارگانیسمهای آب، باکتری و مخمر هستند. استفاده از خون نیز نسبتا آسان است چون گلبولهای قرمز خون طی فرایند لیز کردن از بین میروند و بعد میتوان انواع گلبولهای سفید را در نمونه شناسایی کرد. برای فلوسایتومتری، سلولهای منفرد باید از بافتهای جامد تولید شوند. این کار با تفکیک بافت انجام میشود. تفکیک مکانیکی برای بافتهایی که به صورت آزاد پیوند میخورند مانند سلولهای چسبنده از کشت بافت، مغز استخوان و بافت لنفاوی به خوبی کاربرد دارند.
در تجزیه مکانیکی، بافت خرد شده از طریق سوزنی طریف به طور مکرر به سوسپانسیون منتقل میشود. همچنین میتوان بافت مورد نظر را از طریق آنزیمی تجزیه کرد که طی آن میانکنشهای پروتئینی و ماتریکس خارج سلولی که سلولها را کنار هم نگاه داشتهاند تخریب میشوند. آنزیمها بر اساس فاکتورهایی مانند pH، دما و سایر فاکتورهایی اینتخاب میشوند که روی عملکرد آنزیم تأثیرگذار هستند.
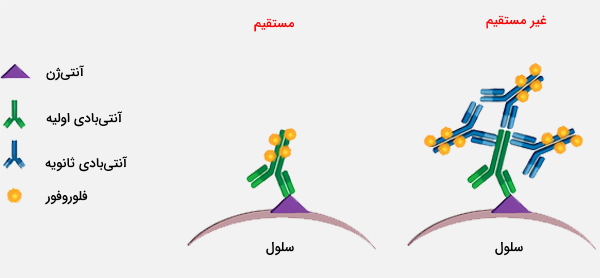
فلوسایتومتری مستقیم و غیر مستقیم
فلوسایتومتری به صورت مستقیم و غیر مستقیم قابل انجام است. در فلوسایتومتری غیر مستقیم، سلول با یک آنتیبادی اولیه علیه آنتیژن مورد نظر رنگآمیزی میشود و با استفاده از آنتیبادی ثانویه برچسبگذاری شده، آنتیبادی اولیه تشخیص داده خواهد شد. از فلوسایتومتری میتوان اطلاعات زیادی را از جمعیت سلول مانند اندازه، مورفولوژی، پیچیدگی، فنوتیپ و عملکرد جمعآوری کرد. به همین ترتیب، انواع متنوعی از معرفها برای کاربرد فلوسایتومتری خاص در دسترس هستند.
به عنوان مثال، رنگهای غیرقابل نفوذ به غشا و فرآیندهای غشایی DNA مانند 7-AAD و یدید پروپیدیوم (PI) از سلولهای زنده حذف میشوند، و آنها را به عنوان ابزار رایج در ارزیابی سلامت سلول و زنده ماندن سلولها در اختیار میگذارد. DAPI، یک رنگ رایج دیگر، هسته سلولهای زنده و ثابت را رنگآمیزی میکند. در تجزیه و تحلیل مارکرهای سلولی خاص، از مولکولهای فلورسنت معمولاً استفاده میشود. فلورسئین / FITC ،APC، سیانین، PE و TRITC از شناختهشدهترینها هستند، اگرچه مارکرهای جدید به طور مداوم در دسترس هستند.
این فلوروفورها را میتوان با آنتیبادیهای ثانویه یا مولکولهای دیگر مانند پروتئین A، پروتئین G یا استرپتاویدین متصل کرد. پروتئین A و G به ایمونوگلوبولینها متصل میشوند در حالی که استرپتاویدین به آنتیبادیهای متصل به بیوتین متصل میشود. استفاده از چندین رنگ امکان مالتی پلکس و اندازهگیری همزمان چندین آنالیت را فراهم میکند. سایر معرفهای فلوسایتومتری شامل استانداردهایی برای فلوروفورها، انواع سلولها و کالیبراسیون ابزارها است.
زمانی که رنگآمیزی مستقیم غیر عملی باشد، رنگآمیزی غیر مستقیم با استفاده از معرفهای ردیابی ثانویه انعطافپذیری لازم برای استفاده از انواع فلوفورها جهت جایگیری در بیشتر پانلهای جریان سایتومتری را فراهم میکند. از آنجا که مولکولهای آنتیبادی ثانویه متعددی به هر آنتیبادی متصل میشوند، سیگنالها تقویت خواهند شد که یک مزیت مهم برای مشاهده آنتیژنهایی با چگالی کم است. با بهینهسازی دقیق همچنان میتوان با آنتیبادیهای ثانویه رنگآمیزی بسیار خوبی به دست آورد.
با تکثیر سیگنال، تمام اتصالات غیر اختصاصی و اتصالات ناصحیح نیز تقویت میشوند. البته برخی از دستورالعملهای ساده را میتوان برای اطمینان از وجود رنگآمیزی خاص و بهینه برای به حداکثر رساندن نتایج دنبال کرد. در ادامه راهنمای استفاده از رنگآمیزی غیر مستقیم در فلوسایتومتری با معرفهای تشخیصی ثانویه توضیح داده شدهاند.
رنگآمیزی ساده آنتی بادی اولیه
هنگام رنگآمیزی نمونهها با آنتیبادی اولیه اتصالی مستقیم، پس از انکوباسیون اولیه و چند مرتبه شستشوی ساده نمونه آماده است. رنگآمیزی غیر مستقیم با استفاده از آنتیبادی اولیه غیر کانژوگه شناسایی شده با آنتیبادی ثانویه، شامل مراحل اضافی زیر است:
- انکوباسیون با آنتیبادی اولیه
- شستشو
- انکوباسیون با آنتیبادی ثانویه دارای برچسب فلورسنت که آنتیبادی اولیه را تشخیص میدهد.
- پس از شستشوی بیشتر نمونه قابل دستیابی خواهد بود.
علیرغم این موارد، اگر ترکیبی از آنتیبادیهای اصلی کونژوگه و غیر کونژوگه وجود داشته باشند که به آنتیبادیهای ثانویه در پانل نیاز دارند، رنگآمیزی پیچیدهتر میشود. برای جلوگیری از اتصال غیر اختصاصی علاوه بر کنترلهای معمول جریان سیتومتری (سلولسنجی)، پروتکلهای رنگآمیزی، مراحل انسداد و شستشو و گزینههای آنتیبادی هم در نظر گرفته میشوند.

ترکیب آنتی بادی های کونژوگه و غیر کونژوگه
یکی از مشکلات رایج هنگام ترکیب آنتیبادیهای کونژوگه و غیر کونژوگه، تشخیص نادرست آنتیبادی اولیه و آنتیبادیهای کونژوگه است که منجر به مثبت کاذب میشود. برای جلوگیری از این مشکل باید بتوان آنتیبادیهای اصلی غیر کونژوگه و کونژوگه را با استفاده از گونهها، کلاس یا ایزوتایپ تشخیص داد. آنتیبادیهای اولیه را میتوان با هم انکوبه کرد، شستشو داد و سپس با آنتیبادیهای ثانویه برچسبگذاری نمود که فقط گونهها، کلاسها و ایزوتایپهای آنتیبادیهای اصلی غیر کونژوگه را تشخیص میدهند.
برای بهینهسازی رنگآمیزی در حالت ایدهآل، هر دو آنتیبادی اولیه و ثانویه باید تیتر شوند تا حداقل زمینه با حداثر سیگنال خاص تضمین شود. همچنین توصیه میشود که کنترل ثانویه فقط برای آنتیبادی و یک کنترل حاوی تمامی آنتیبادیها به جز آنتیبادی اولیه بدون برچسب برای بررسی رنگآمیزی غیر اختصاصی وجود داشته باشند.
مسدود کردن و شستشو
انکوباسیون با یک سرم مناسب، قبل از افزودن آنتیبادیهای اولیه، میتواند با مسدود کردن گیرندههای FC، پس زمینه را کاهش دهد. این گونه باید مشابه با گونه همان سلولی باشد که در حال آنالیز است و هرگز نباید مشابه با گونه مشابه با آنتیبدی اولیه میزبان باشد زیرا آنتیبادی ثانویه سرم مسدودکننده و آنتیبادی اولیه را تشخیص میدهد. اگر از آلبومین سرم گاوی استفاده شود، ممکن است با IgG بووین آلوده شده باشد که با گونههای نزدیک مانند بز و گوسفند واکنش متقابل ایجاد میکند.
برای شستشوی آنتیبادیهای اولیه و ثانویه اضافی، باید مراحل شستشوی کافی در نظر گرفته شوند. برای از بین بردن تمام آنتیبادیهای اضافی به پروتکلهای رنگآمیزی درون سلولی مراحل شستشوی بیشتر و طولانیتری نیاز هستند. علاوه بر این، ممکن است انتخاب نفوذپذیری و بافر شستشو بر روی رنگآمیزی تأثیر بگذارد و باید برای آزمایش بهینه شود.
انتخاب آنتی بادی برای فلوسایتومتری غیر مستقیم
انتخاب آنتیبادی اولیه و ثانویه بر روی طراحی آزمایش تأثیرگذار است. واکنش متقابل گونههای ناخواسته را میتوان با استفاده از آنتیبادیهای ثانویه جذب متقابل یا ایزوتایپ خاص حذف نمود. این کار اطمینان ایجاد میکند که سیگنال از آنتیبادی ثانویه خاص هدف اصلی است. اگر در حال رنگآمیزی بافت ایمنی هستید که حاوی گیرندههای Fc زیادی است، ممکن است بخواهید علاوه بر انسداد با سرم، برای کاهش اتصال غیر اختصاصی یک قطعه F (ab) را به عنوان یک آنتیبادی ثانویه در نظر بگیرید.
در صورت عدم وجود آنتیبادیهای اولیه در گونههای مختلف، ممکن است کلاسهای مختلف ایمونوگلوبولین در دسترس باشند. مثلا IgG و IgM اجازه میدهند که از آنتیبادیهای ثانویه مخصوص کلاس از همان گونه استفاده شود. بسیاری از آنتیبادیهای مونوکلونال اولیه IgG1 و IgG2a موش یا رت یا IgG2b هستند. آنتیبادیهای ثانویه خاص ایزوتایپ امکان مالتی پلکس شدن آنتیبادیهای خالص شده از همان گونه را فراهم میکنند. ممکن است با ترکیب و تطبیق این روشها، گزینههای رنگآمیزی افزایش پیدا کنند اما باید همیشه اطمینان حاصل کرد که آنتیبادیهای ثانویه چندین هدف را تشخیص نمیدهند و کنترلها به درستی انجام شدهاند.
جبران فلورسانس
هنگام استفاده از آنتیبادیهای ثانویه برچسبگذاری شده در یک صفحه چند رنگ، همچنان باید کنترل جبران صحیح فلوروفور ثانویه انجام شود. سادهترین راه انجام کنترل جبران رنگآمیزی منفرد با استفاده از آنتیبادی اولیه غیر کونژوگه و آنتیبادی ثانویه همراه است. اگر این مسئله به عنوان مثال به دلیل بیان کم، مشکلساز باشد، میتوان از دانههای جبرانی استفاده کرد. بر اساس میزان قابلیت اتصال آنتیبادیها، ممکن است امکان استفاده مستقیم از آنها با آنتیبادی ثانویه وجود داشته باشد.
گزینه سوم انجام جبران با استفاده از آنتیبادی اولیه متصل مستقیم به همان فلوفور است که در آنتیبادی ثانویه استفاده خواهد شد. اما استفاده از فلوفورهای متوالی با این روش به دلیل تفاوتها ذاتی بین دستههای متوالی فلوفلور باید با احتیاط فراوان انجام گیرد.
استرپتاویدین به عنوان معرف ثانویه
در صورتی که فقط یک آنتیبادی اولیه بیوتینیله موجود باشد، استفاده از استرپتاویدین با مارکر فلورسنت با چنین آنتیبادی، آن را برای فلوسایتومتری بدون نیاز به آنتیبادیهای ثانویه مناسب خواهد کرد. این گزینه به بررسی واکنش متقابل آنتیبادیهای ثانویه با سایر آنتیبادیهای اولیه را برطرف میکند و میتواند گزینههای رنگآمیزی را هم افزایش دهد. با وجود این همچنان باید کنترلهای منفی و جبران صحیح انجام شوند.
کنترل جریان عمومی
کنترلهای خاصی مانند کنترلهای FMP، ایزوتایپ، زندهمانی، جبران و عدم رنگآمیزی برای فلوسایتومتری نیاز هستند. ساخت پانلهای چند رنگ ممکن است باعث مشکل شده و رعایت دستورالعملهای مربوط به انتخاب ابزار و فلوفور در هنگام انجام رنگآمیزی غیر مستقیم به یک اندازه مهم هستند. علاوه بر این کنترلها و دستورالعملهای استاندارد فلوسایتومتری استفاده از آنتیبادیهای ثانویه ممکن است نیاز به کنترلهای اضافی و بهینهسازی هر دو آنتیبادی و پروتکل رنگآمیزی داشته باشد.
اتصال غیر اختصاصی آنتیبادی ثانویه را میتوان با رنگآمیزی با آنتیبادی ثانویه بدون آنتیبادی اولیه اختصاصی، به تنهایی یا در ترکیب با آنتیبادیهای اولیه که هدف فلوسایتومتری نیستند، ارزیابی نمود. در ادامه میتوان از آنتیبادی اولیه که آنتیبادی ثانویه به آن متصل میشود استفاده کرد، که در نمونه به عنوان منفی شناخته میشود. این کار از جهت اتصال به نمونه و سایر آنتیبادیهای موجود در صفحه، ایده ایجاد میکند و امکان ارزیابی رنگآمیزی غیر اختصاصی پسزمینه را ایجاد میکند.
ابزارهای مورد استفاده در فلوسایتومتری
آنتیبادیهای اولیه به آنتیژنهای مورد نظر متصل میشوند اما برای تشخیص مستقیم برچسبگذاری نمیشوند. معرفهای ثانویه آنتیبادیهای اولیه را هدف قرار میدهند و به صورت ترکیبات مختلفی در دسترس هستند. از معرفهای ثانویه میتوان برای تقویت تشخیص آنتیژنها یا مارکرهایی با بیان کم استفاده کرد زیرا آنتیبادیهای ثانویه پلیکلونال میتوانند در بیش از یک ناحیه به آنتیبادی اولیه متصل شوند و سیگنال ناشی از آن را تقویت کنند.
فلوسایتومترها
انواع فلوسایتومتری مدرن قادر به تجزیه و تحلیل هزاران ذره در ثانیه، در زمان واقعی هستند و در صورت پیکربندی سلولی، میتوانند ذرات دارای مشخصات نوری مشخص را با سرعت مشابه جدا کنند. فلوسایتومتر مشابه میکروسکوپ است، با این تفاوت که به جای تولید تصویری از سلول، فلوسایتومتری کمیت خودکار و پُرقدرت پارامترهای نوری مشخص را بر اساس سلول به سلول ارائه میدهد. برای تجزیه و تحلیل بافتهای جامد، ابتدا باید سوسپانسیون تک سلولی تهیه شود. جریان سنج دارای پنج جز اصلی است:
- سلول جریان: دارای یک جریان مایع (مخزن پوشش دهنده) است، که سلولها را حمل و تراز میکند به طوری که آنها برای سنجش از یک پرتوی نور یک پرونده عبور میدهند.
- سیستم اندازهگیری: سیستم اندازهگیری معمولاً از اندازهگیری امپدانس (یا رسانایی) و سیستمهای نوری، لامپها (جیوه، زنون) استفاده میکند. لیزرهای خنک شده با آب با قدرت بالا (آرگون، کریپتون، لیزر رنگ). لیزرهای با درجه پایین خنک کنندگی هوا (آرگون (488 نانومتر)، HeNe قرمز (633 نانومتر)، HeNe سبز، HeCd (UV))، لیزرهای دیود (آبی، سبز، قرمز، بنفش) و در نتیجه سیگنالهای نوری ایجاد میشوند.
- سیستم ردیاب: سیستم ردیاب و تبدیل آنالوگ به دیجیتال (ADC) اندازهگیریهای آنالوگ نور پراکنده رو به جلو (FSC) و نور پراکنده کناری (SSC) و همچنین سیگنالهای فلورسانس مخصوص رنگ را به سیگنالهای دیجیتالی تبدیل میکند که توسط کامپیوتر قابل پردازش است.
- سیستم تقویت: سیستم تقویت میتواند خطی یا لگاریتمی باشد.
- کامپیوتر برای تجزیه و تحلیل سیگنالها: فرآیند جمعآوری دادهها از نمونهها با استفاده از فلوسایتومتر کسب نامیده میشود. اکتساب توسط رایانهای متصل است که از نظر فیزیکی به فلوسایتومتر متصل است و نرمافزاری که رابط دیجیتال را با سیتومتر کنترل میکند. این نرمافزار قادر به تنظیم پارامترها (به عنوان مثال ولتاژ و جبران) نمونه مورد آزمایش است و همچنین در حین دستیابی به دادههای نمونه، به نمایش اطلاعات اولیه نمونه کمک میکند تا اطمینان حاصل شود که پارامترها به درستی تنظیم شدهاند.
به طور کلی دستگاههای اولیه فلوسایتومتری، آزمایشی بودند اما پیشرفتهای تکنولوژیک اخیر، کاربردهای گستردهای در اهداف بالینی و تحقیقاتی با کمک فلوسایتومتری را امکانپذیر کردهاند. با توجه به این پیشرفتها، بازار قابل توجهی برای ابزار دقیق، نرمافزار تجزیه و تحلیل و همچنین معرفهای مورد استفاده در کسب مانند آنتیبادیهای دارای برچسب فلورسنت توسعه یافتهاند. ابزارهای مدرن معمولاً دارای چندین لیزر و آشکارسازهای فلورسانس هستند. رکورد فعلی یک ابزار تجاری ده لیزر و 30 ردیاب فلورسانس است.
افزایش تعداد لیزرها و آشکارسازها امکان برچسبگذاری آنتیبادیهای متعدد را فراهم میکند و میتواند با استفاده از مارکرهای فنوتیپی آنها، به طور دقیقتری یک جمعیت را شناسایی کند. برخی از ابزارها حتی میتوانند از سلولهای منفرد تصاویر دیجیتالی بگیرند و امکان تجزیه و تحلیل مکان سیگنالهای فلورسنت را در داخل یا روی سلولها فراهم کنند.
سیستم سیال فلوسایتومتر
سلولها باید به طور یکنواخت از مرکز پرتوهای لیزر متمرکز عبور کنند تا خصوصیات نوری سلولها را در هر دمای سنجش اندازهگیری کنند. هدف سیستم سیال حرکت دادن سلولها یک به یک از طریق پرتوی لیزر و در سرتاسر دستگاه است. سیالات موجود در یک فلوسایتومتر با قابلیت مرتبسازی سلول از جریان برای انتقال سلولهای مرتب شده به داخل لولههای جمعآوری یا چاهها نیز استفاده میکنند.
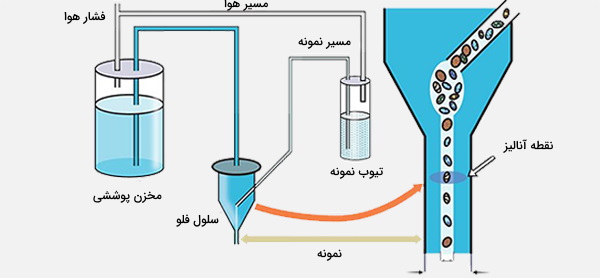
تمرکز هیدرودینامیکی فلوسایتومتر
برای موقعیت دقیق سلولها در یک جهت مایع، از تمرکز هیدرودینامیکی در اکثر سایتومترها استفاده میشود. سلولهای معلق وارد دستگاه محصور شده توسط یک مایع غلاف خارجی میشوند. هسته نمونه در مرکز مایع غلاف نگهداری میشود. میزان ورودی نمونه یا سرعت جریان سلولها در سنجش با لیزر را میتوان با فشار مایع غلاف روی هسته نمونه کنترل کرد. در شرایط مطلوب، جریان مایع مرکزی و مایع غلاف مخلوط نمیشوند.
از فناوری تمرکز صوتی برای پشتیبانی از تمرکز هیدرودینامیکی در برخی از فلوسایتومترها استفاده میشود. امواج صوتی (بیشتر از 2 مگاهرتز) قبل از معرفی مایع غلاف، نمونه را متمرکز میکنند. نمونه متمرکز شده سپس به هسته هیدرودینامیکی تزریق میشود و از طریق دستگاه جریان مییابد. این ممکن است به افزایش دقت دادهها در نرخ ورودی بالای نمونه کمک کند.
فیلترهای نوری فلوسایتومتر
نوری که از فلوروفورها ساطع میشود در طیف خاصی از طول موج است، بنابراین ترکیب چندین فلوروفور ممکن است باعث همپوشانی شود. برای افزودن ویژگیهای اختصاصی، از فیلترهای نوری و آینههای دیکروئیک برای فیلتر کردن و انتقال نور به آشکارسازهایی مانند لولههای چند برابر کننده نور (PMTها) یا فوتودیودهای بهمنی (APD) استفاده میشود. فیلترهای نوری به عنوان فیلترهای باند گذر (BP)، طولانی گذر (LP) یا کوتاه گذر (SP) طراحی شدهاند. بیشتر سیلومترهای جریان از آینه های دو رنگ و فیلترهای عبور باند برای انتخاب باندهای خاص طیف نوری استفاده میکنند.
منشورها، توری ها و سایتومتری جریان طیفی
فلوسایتومتری طیفی از منشورها یا توری های پراش برای پراکنده کردن نور ساطع شده از یک نشانگر در یک آرایه آشکارساز استفاده میکند. این اجازه میدهد تا طیف کامل از هر ذره اندازهگیری شود. طیفهای اندازهگیری شده از سلولهای منفرد متعاقباً با استفاده از طیفهای مرجع از تمام رنگهای استفاده شده و طیف خود فلورسانس مخلوط نمیشوند. این ممکن است برای طراحی پانل گستردهتر و استفاده از نشانگرهای بیولوژیکی جدید امکانپذیر باشد.
سیتومتری جریان تصویربرداری کمی
سیتومتری جریان تصویربرداری کمی (IFC) تصاویر چند کاناله از سلولها را ضبط میکند. آشکارسازهای مورد استفاده در سیستم عامل های تصویربرداری میتوانند مجهز به دستگاه متصل به شارژ (CCD) یا نیمه هادی فلز اکسید مکمل (CMOS) باشند تا تصاویر سلولهای جداگانه را ضبط کنند.
روش انجام فلوسایتومتری
اگرچه آزمایشگاههای مختلف پروتکل فلوسایتومتری را با روشهای مختلفی بهینهسازی کردهاند اما به طور کلی شامل مراحل زیر است:
- نمونهای از سلولها در مایعی معلق هستند. سلولها با بیاثر ساختن پروتئینهای مورد نظر و رویدادهای سیگنالینگ گذرای آنها، با فرمالدهید تثبیت میشوند.
- به لوله آزمایش متانول یا مواد شوینده اضافه میشود تا سلولها در برابر آنتیبادیها نفوذپذیر شده و سپس وارد فضای بین سلول شوند.
- آنتیبادیهایی با برچسب فلورسنت اضافه میشوند که باید با دقت انتخاب شده باشند تا هدفگیری بهینه از اپیتوپها و تشخیص آنتیژن مناسب هنگام رنگآمیزی پروتئینهای سطحی و داخل سلولی به طور همزمان انجام شود.
- لوله آزمایش در سیتومتر جریان قرار میگیرد و مایع اجازه مییابد تا به یک سلول، هر بار به محفظه جریان برسد و سپس از آن خارج شود. با عبور هر سلول از پرتوی لیزر، نوری که از آن باز میگردد به آشکارسازهای نور / رنگ منتقل میشود.
- قبل از آزمایش و بسته به سلولهای مورد تجزیه و تحلیل، نمونه را میتوان با رنگهای مخصوص تیمار کرد تا بیشتر انواع فرعی سلول را تعریف کند. رنگها (فلوروکرومها) که استفاده میشوند به آنتیبادیهای مونوکلونال متصل میشوند که به سلولهای خاص یا اجزای اصلی سلولها متصل میشوند.
- نمونه حاوی سلولها از ابزاری به نام فلوسایتومتر عبور میکند.
- در ابزار، مایعی که سلولها در آن معلق هستند از کانالهای بسیار باریکی عبور میکند به طوری که سلولها هنگام عبور از آشکارساز (ها) در یک فایل واحد سازمان مییابند. این کار با سرعت بالایی انجام میشود (صدها تا هزار سلول در ثانیه).
- فلوسایتومتر شامل یک یا چند لیزر و یک سری آشکارسازهای عکس است که قادر به شناسایی ویژگیهای خاص منحصر به انواع سلولهای مختلف است. سیستم تعلیق تکسلولی رویدادهای پراکندگی نور منحصر به فردی را ایجاد میکند که با عبور هر سلول از نور لیزر اتفاق میافتد. این وقایع اولیه مشخصه اندازه و شکل سلول و همچنین شدت سیگنالی است که توسط رنگهای خاص تولید میشود، بنابراین الگوهایی ایجاد میشود که نوع سلول را منعکس میکند.
- سیگنالهای ردیابها تقویت میشوند و به رایانه ارسال میشوند. آنها به بازخوانی دیجیتالی نمایش داده شده در صفحه کامپیوتر یا در یک چاپ تبدیل میشوند.
- دادهها معمولاً به صورت نمودار نمایش داده میشوند.
تجزیه و تحلیل امکان ارزیابی انواع و تعداد سلولهای موجود در نمونه را فراهم میکند. جریانسنج حساسیت کافی برای تجزیه و تحلیل سلولها یا ذرات به قطر یک میکرون (به اندازه یک هفتاد و پنجم از موی انسان) را دارد و میتواند در اندازههای نمونه نسبتاً کوچک انجام شود. هزاران سلول را میتوان در عرض چند دقیقه شمارش و تجزیه و تحلیل کرد که تصویری کاملاً دقیق از هرگونه ترکیب سلولی بافت یا مایع بدن ارائه میدهد. یکی از عملکردهای اضافی یک سیلومترسنج، توانایی جدا کردن فیزیکی سلولهای منحصر به فرد براساس ویژگیهای ذکر شده است.
هنگامی که نمونهای از ردیابهای نور لیزر و عکس عبور کرد، میتوان یک بار الکتریکی را برای سلولهای مورد نظر اعمال کرد. این اتفاق زمانی رخ میدهد که یک نمونه مایع به قطرههایی تقسیم میشود که دارای بار مثبت یا منفی هستند و سپس توسط صفحات انحراف با بار مخالف، منحرف میشوند. سپس میتوان سلولهای مورد نظر را به صورت فیزیکی و جداگانه برای آزمایش بیشتر جمعآوری کرد.
رنگ آمیزی آنتی بادی در فلوسایتومتری
رنگآمیزی موفقیتآمیز به بهینهسازی شرایط آزمایش مانند تیتراسیون آنتیبادیها، روشهای تثبیت، نفوذپذیری و تنظیم کنترلها بستگی دارد. رنگآمیزی آنتیبادی روشهای متفاوتی دارد که به صورت خلاصه عبارتند از موارد زیر:
- در رنگآمیزی مستقیم، سلولها با آنتیبادی که مستقیماً به یک فلوروکروم متصل میشود، انکوبه میشوند که یک مرحلهای بوده و به ویژه برای رنگآمیزی داخل سلولی بسیار مفید است.
- در رنگآمیزی غیر مستقیم، آنتیبادی اولیه برچسبگذاری نشده است بلکه در عوض توسط آنتیبادی ثانویه دارای برچسب فلوروکروم شناسایی میشود. این روش به این معنی است که میتوان آنتیبادیهای اولیه مصرف نشده را در برابر اهداف مختلفی ایجاد کرد که باعث افزایش انتخاب پروتئینهای هدف برای محقق میشود.
- رنگآمیزی داخل سلول به لکهای از آنتیژنهای داخل سلولی اشاره دارد.
- پروتئینهای ترشح شده توسط یک سلول را میتوان با یک بلوک گلژی برچسبگذاری و ردیابی نمود و به دنبال آن رنگآمیزی داخل سلولی ایجاد کرد.
رنگ آمیزی مستقیم آنتی بادی
هر سلول انسانی صدها هزار آنتیژن را برای سطح سلول بیان میکند که نوع سلول، عملکرد بیولوژیکی، مرحله رشد و سایر ویژگیهای منحصر به فرد آن را تعیین میکند. سلولهای ارگانهای مختلف نیز دارای آنتیژنهای سطحی مشخصی هستند و میتوان با استفاده از آنتیبادیهای متصل به فلوئوروکروم مخصوص این مارکرهای سطحی، آنها را با کمک فلوسایتومتری تجزیه و تحلیل کرد. در رنگآمیزی ایمونوفلورسانس مستقیم، سلولهای انکوبه شده با یک آنتیبادی مستقیما به یک فلوئوروفور مانند PerCP متصل میشوند که فقط به یک مرحله انکوباسیون آنتیبادی نیاز دارد و بنابراین امکان اتصال غیر اختصاصی از آنتیبادی ثانویه را از بین میبرد.
رنگآمیزی مستقیم در طول رنگآمیزی درون سلولی سودمند است زیرا مجتمعهای بزرگ آنتیبادی - فلوئوفرو از جمله آنتیبادیهای ثانویه ممکن است به دام بیفتند و منجر به اتصال غیر اختصاصی شوند یا ممکن است وارد سلول نشوند که منجر به عدم شناسایی آنها خواهد شد. اگر آنتیبادی خالص غیر کونژوگه رنگآمیزی شده باشد، باید یک مرحله اضافی از رنگآمیزی با یک آنتیبادی ثانویه کونژوگه فلورسنت وجود داشته باشد (رنگآمیزی غیر مستقیم).
رنگ آمیزی غیر مستقیم آنتی بادی
در رنگآمیزی غیر مستقیم آنتیبادی ثانویه مزدوج با فلوفور، آنتیبادی اولیه غیر کونژوگه تشخیص داده میشود. روش دیگر سیستم آویدین - بیوتین است که با آن یک آنتیبادی متصل به بیوتین با آویدین دارای برچسب فلوئوفور شناسایی میشود. امروزه طیفی وسیعی از آنتیبادیهای کونژوگه موجود هستند و با رنگآمیزی غیر مستقیم، انتخاب پروتئینهای هدف افزایش مییابد. از آنتیبادیهای اصلی غیر کونژوگه تولید شده برای آنتیژنهای هدف متفاوتی استفاده کرد و همراه با آنتیبادی ثانویه کونژوگه برای آنالیز فلوسایتومتری استفاده نمود.
رنگ آمیزی درون سلولی آنتی بادی
علاوه بر آنتیژنهای سطح سلول، روش رنگآمیزی داخل سلولی امکان اندازهگیری مستقیم آنتیژنها (سیتوکینها یا عوامل رونویسی) موجود در داخل سیتوپلاسم یا هسته سلول را فراهم میکند. در این روش تثبیت و نفوذپذیری سلولها مورد نیاز هستند. سلولهای تثبیتکننده پروتئین مورد نظر را در محل سلولی اصلی خود حفظ کرده و معمولا از پایداری بهتر آنتیژنهای محلول با نیمه عمر کوتاه اطمینان حاصل میکنند.
تشخیص آنتیژنهای داخل سلول قبل از رنگآمیزی به نفوذپذیری سلول احتیاج دارد و برای اطمینان از نفوذپذیری سلولها باید آنتیبادیها ررا در بافر نفوذپذیری تهیه کرد. این روش رنگآمیزی اصلاح شده امکان اندازهگیری مستقیم فعالیت عملکردی هر سلول مد نظر موجود در خون یا سایر بافتها را بدون جداسازی بیشتر فراهم میکند. روشهای مختلف تثبیت و نفوذپذیری در دسترس هستند تا امکان دسترسی آنتیبادیها به پروتئینهای داخل سلول فراهم شود. برای دستیابی به نتایج بهتر ممکن است به تحریک اضافی در شرایط آزمایشگاهی با مقداری میتوژن رایج برای تحریک تولید بیشتر سیتوکینها در داخل سلولها نیاز باشد.
برخی از میتوژنهای متداول شامل PMA، یون کلسیم یا اپیتوپ پپتیدی و مهارکننده پروتئین ناقل و بریفلدین A (Brefeldin A) هستند. اگر پروتئینها قبل از تشخیص، از سلول آزاد شوند، تشخیص پروتئینهای ترشحی دشوار خواهد بود. در این شرایط توصیه میشود که بریفلدین A یا سایر ترکیباتی که مانع ترشح پروتئین از دستگاه گلژی میشوند، مورد استفاده قرار بگیرند. یک بلوک گلژی مانند بریفلدین A، از ترشح پروتئینهای بیان شده از گلژی جلوگیری کرده و آنها را در سلول به دام میاندازد تا شناسایی شوند و روش رنگآمیزی داخل سلولی برای تشخیص پروتئین هدف قابل استفاده خواهد بود.
آنالیز دادههای فلوسایتومتری
در آزمایش فلوسایتومتری، هر سلولی که از نقطه شناسایی عبور کند، به عنوان یک واقعه متمایز محاسبه میشود. هر نوع نوری که تشخیص داده شود نیز کانال منحصر به فرد خود را دارد. دادههای مربوط به هر رویداد به طور مستقل رسم میشوند تا شدت سیگنال نور شناسایی شده در هر کانال را برای هر رویداد نشان دهند. این دادهها میتوانند به روشهای مختلفی از نظر بصری نمایش داده شوند بنابراین ممکن است لازم باشد با انواع مختلف نمودار داده و نحوه تنظیم دروازهها بازی کنید. متداولترین انواع نمودار داده در فلوسایتومتری، هیستوگرام، نمودار نقطهای، نمودار چگالی و نمودار نقشهای هستند. با پیچیدهتر شدن تحلیلهای چند پارامتری، تکنیکهای تجزیه و تحلیل میتوانند شامل نقشههایی با ابعاد بیشتر مانند نمودارهای سه بعدی و درختهای SPAD باشند.
هر فلوروکروم دارای طیف وسیعی از فلورسانس است. هنگامی که بیش از یک فلوئورکروم استفاده میشود، همپوشانی بین فلوروکرومها میتواند رخ دهد. به این وضعیت همپوشانی طیف گفته میشود. باید بر این وضعیت غلبه کرد. به عنوان مثال، طیف انتشار برای FITC و PE به این صورت است که نوری که توسط فلورسئین منتشر میشود همان طول موج را که از فیلتر استفاده شده برای PE عبور میدهد همپوشانی دارد. این همپوشانی طیفی با حذف بخشی از سیگنال FITC از سیگنالهای PE یا بالعکس اصلاح میشود. این فرآیند جبران رنگ نامیده میشود، که یک فلوئوروکروم را به عنوان درصد برای اندازهگیری خود محاسبه میکند.
جبران فرآیند ریاضی است که توسط آن همپوشانی طیفی دادههای سایتومتریک جریان چند پارامتر اصلاح میشود. از آنجا که فلوروکرومها میتوانند طیف گستردهای داشته باشند، میتوانند با هم همپوشانی داشته باشند و باعث ایجاد نتیجه نامطلوب سردرگمی در هنگام تجزیه و تحلیل دادهها شوند. این همپوشانی، که به عنوان سرریز شناخته میشود و در ضریب سرریز کمی تعیین میشود، معمولاً توسط آشکارسازهای فلوروکروم خاص اندازهگیری یک قله قابل توجه در طول موج از فلوروکروم متفاوت ایجاد میشود. برای انجام این تصحیح اغلب از جبر خطی استفاده میشود.
به طور کلی، هنگامی که نمودارهای یک یا چند پارامتر نمایش داده میشود، برای نشان دادن این است که پارامترهای دیگر در توزیع نشان داده شده سهیم نیستند. به خصوص هنگام استفاده از پارامترهایی که بیش از دو برابر هستند، این مشکل شدیدتر است. در حال حاضر، هیچ ابزاری برای نمایش کارآمد پارامترهای چند بعدی کشف نشده است. جبران برای دیدن تمایز بین سلولها بسیار مهم است.
دادههای تولید شده توسط دستگاه های فلوسایتومتری را میتوان در یک بعد واحد، برای تولید هیستوگرام، یا در نمودارهای دو بعدی یا حتی در سه بعد ترسیم کرد. مناطق موجود در این قطعات را میتوان بر اساس شدت فلورسانس، با ایجاد یک سری استخراج زیرمجموعه، به اصطلاح دروازه از هم جدا کرد. پروتکلهای مخصوص دروازه برای اهداف تشخیصی و بالینی، به ویژه در رابطه با خونشناسی وجود دارد. سلولهای منفرد اغلب با دوبل سلول یا عرض پالس، از طریق پرتوی لیزر با تمرکز دقیق متمایز و نقشهها اغلب در مقیاسهای لگاریتمی ساخته میشوند.
از آنجا که طیفهای انتشار رنگهای مختلف فلورسنت با هم تداخل دارند، سیگنالهای موجود در آشکارسازها باید به صورت الکترونیکی و همچنین محاسباتی جبران شوند. دادههای جمع شده با استفاده از فلوسایتومتر را میتوان با استفاده از نرمافزار تجزیه و تحلیل کرد. پس از جمعآوری دادهها، دیگر نیازی به اتصال به فلوسایتومتر نیست و آنالیزها اغلب در یک رایانه جداگانه انجام میشوند. این امر خصوصاً در تأسیسات اصلی که استفاده از دستگاهها زیاد است، برای حفاظت از اطلاعات ضرورت دارد.
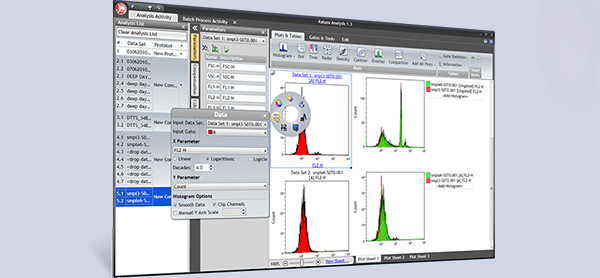
نمودار هیستوگرام فلوسایتومتری
نمودار هیستوگرام تک متغیری، فقط یک پارامتر را اندازه میگیرد. به طور معمول محور Y تعداد وقایع (تعداد سلول) است که فلورسانس دریافتی را نشان میدهد و محور X شدت نسبی فلورسانی است که در یک کانال واحد تشخیص داده میشود. تعداد زیادی از وقایع شناسایی شده با یک شدت خاص، به عنوان پیک روی هیستوگرام نمایش داده میشوند. در حالت ایدهآل فقط یه پیک مشخص تولید میشود و میتواند به عنوان مجموعه داده مثبت تفسیر شود (نمایانگر سلولهایی با مشخصات مورد نظر). با این حال اغلب، تحلیل فلوسایتومتری در جمعیت مخلوطی از سلولها انجام و منجر به تولید چندین پیک در هیستوگرام میشود. در این شرایط، آزمایش فلوسایتومتری باید با کنترل ایزوتایپ منفی مناسب تکرار شود تا به شناسایی مجموعه دادههای مثبت کمک کند. برای نتیجه مثبت، باید به دنبال تغییر شدت بین کنترل منفی و نمونههای مثبت بود.
برای آنالیز دو متغیری، دادهها اغلب به صورت نمودارهای نقطهای یا نمودارهای چگالی و نمودارهای برجسته نشان داده میشوند. با آنالیز پارامترهای مختلف میتوان رابطه بین دو نشانگر مختلف را نشان داد تا فنوتیپهای پیچیدهتر شناسایی شده و جمعیتهای مهم مورد نظر از طریق دروازه جدا شوند. گیتینگ یک روش مهم در آنالیز دادههای فلوسایتومتری است که برای تجسم انتخابی سلولهای مورد نظر و از بین بردن نتایج حاصل از ذرات ناخواسته مانند سلولهای مرده و بقایا استفاده میشود.
نمودار تراکم فلوسایتومتری
نمودارهای نقطهای و نمودارهای تراکم به طور همزمان 2 یا 3 پارامتر را در یک نمودار پراکندگی مقایسه میکنند که هر رویداد به عنوان یک نقطه نشان داده میشود. نمودار نقطهای شکل است که رابطه بین چند متغیر را همزمان نشان میدهد و پارامترها میتوانند هر ترکیبی از سیگنالهای پراکندگی و فلورسانس باشند. سه ترکیب متداول مورد استفاده عبارتند از:
- پراکندگی رو به جلو (FSC) در مقابل پراکندگی جانبی (SSC)
- تک رنگ در مقابل پراکندگی جانبی
- طرح فلورسانس دو رنگ
نمودار تراکم به عنوان راهی برای نشان دادن نه تنها سطوح بیان، بلکه تعداد نسبی وقایع (تراکم) در یک منطقه مشخص ایجاد شد. در نمودار تراکم، هر نقطه نشاندهنده یک سلول منفرد است که از نقطه سیلومتر جریان عبور کرده است. اندازهگیری شدت کانالهای مختلف در محورهای مختلف نشان داده شده است به طوری که حوادث با شدت مشابه در همان منطقه بر روی نمودار پراکندگی جمع میشوند. نمودارهای تراکم برای مشاهده فرکانس زیرجمعیتها عالی هستند. در این مثال از یک نمودار نقطهای، میتوان جمعیت سلولها را در یک نمونه خون محیطی بر اساس سیگنالهای نوری پراکنده به جلو و به سمت جانبی شناسایی کرد.
نمودار نقشهای فلوسایتومتری
نمودار نقشهای روش دیگری برای نشان دادن تراکم دادهها است.این نوع نمودار فارغ از تعداد رویدادهای جمع شده، فراوانی نسبی جمعیتها را نشان میدهد. نمودار نقشهای احتمال کانتورینگ با خصوص مستقل شده را و تعداد مشابه سلولها را نشان میدهد. حلقههای متحدالمرکز در اطراف معیتها تشکیل میشوند، به طوری که هرچه چگالی بیشتر باشد حلقهها به نمودار نقشهای نزدیکتر هستند. بنابراین، این نمودار به صورت یک نقشه ارتفاع جغرافیایی با جزایر تند با تراکم بالا ظاهر میشود. در یک طرح نمودار برجستگی ۵ درصد،پنج درصد از سلولها در خط هر نمودار قرار میگیرند.
بنابراین بیرونیترین خط شامل ۹۵ درصد و خط دوم شامل ۹۰ درصد از سلولها هستند. یکی ازم عایب این نمودارها این است که اطلاعات مربوط به جمعیت کمیاب قابل مشاهده نیست زیرا این نمودارها در نمایش نقاط خوب عمل نمیکنند. در این شرایط برخی از برنامههای آنالیز کننده گزینهای دارند مه نقاط پر تعداد را به بیشتر انواع نمودار اضافه کند. استراتژی دیگر این است که نمودار نقشهای با نمودار نقطهای ترکیب شود تا هم تخمین تراکم و هم اطلاعات رویدادهای نادر نمایش داده شوند.
آنالیز محاسباتی فلوسایتومتری
پیشرفتهای اخیر در شناسایی خودکار جمعیت با استفاده از روشهای محاسباتی جایگزینی برای استراتژیهای سنتی ارائه داده است. سیستمهای شناسایی خودکار میتوانند به طور بالقوه به یافتن جمعیت نادر و پنهان کمک کنند.
روشهای خودکار نمایندگی شامل FLOCK در پایگاه داده ایمونولوژی و پورتال تجزیه و تحلیل (ImmPort)، SamSPECTRAL و FlowClust در Bioconductor و FLAME در GenePattern است. جاسازی همسایه تصادفی توزیع شده (tSNE) الگوریتمی برای انجام کاهش ابعاد طراحی است تا امکان تجسم دادههای پیچیده چند بعدی را در یک نقشه دو بعدی فراهم کند.
تلاشهای مشترک منجر به ایجاد یک پروژه باز به نام «FlowCAP» برای ارائه یک روش عینی برای مقایسه و ارزیابی روشهای خوشهبندی دادههای فلوسایتومتری و همچنین راهنمایی در مورد استفاده مناسب استفاده از این روشها شدهاند.
کنترل FMO
کنترلهای فلورسانس منهای یک (FMO) برای تفسیر دادهها هنگام ساخت پانلهای چند رنگ مهم هستند که در آنها سلول به طور همزمان با چندین فلوروکروم آغشته شده است. کنترلهای FMO مقیاس سرریز فلورسانس را در یک کانال داده شده فراهم میکنند و اجازه جبران میدهند. برای تولید کنترل FMO، یک نمونه با تمام فلوروکرومها رنگآمیزی میشود، به جز نمونهای که در حال آزمایش است، به این معنی که اگر از 4 فلوروکروم مختلف استفاده میشود، کنترل FMO باید فقط شامل 3 مورد باشد (به عنوان مثال فلوروکرومهای A ،B ،C ،D FMOها - ABC_، AB_D، A_CD، _BCD).
مرتبسازی سلولها بر اساس فلوسایتومتری
مرتبسازی سلولی روشی برای تصفیه جمعیت سلولها بر اساس وجود یا عدم وجود مشخصات فیزیکی خاص است. در سیلومترهای جریان با قابلیت مرتبسازی، این ابزار سلولها را با استفاده از پارامترهایی از جمله اندازه سلول، مورفولوژی و بیان پروتئین و سپس فناوری قطره برای مرتبسازی سلولها و بازیابی زیرمجموعهها برای استفاده پس از آزمایش، تشخیص میدهد. اولین مرتبکننده نمونه اولیه در «آزمایشگاه ملیِ لوسآلاموس» (LANL) در سال 1965 توسط فیزیکدان «مک جی فولویلر» با پیوستن به سنسور حجم کولتر با چاپگر جوهر افشان تازه اختراع شده، ساخته شد.
مرتبسازی سلول زنده سلول یا طبقهبندی سلول فعال شده با فلورسانس (FACS) توسط «لن هرزنبرگ» تولید شد، که متعاقباً برای کار اصلی خود جایزه کیوتو را در سال 2006 برنده شد. مرتبکنندههای سلول فلوسایتومتری برخلاف آنالیز کنندههای فلوسایتومتری دارای سیستم جمعآوری هستند. فرآیند جمعآوری هنگامی شروع میشود که نمونه به جریان مایع غلاف تزریق میشود که از سلول جریان عبور و لیزر را قطع میکند. این جریان سپس سلول را از طریق یک نازل ارتعاشی حمل میکند که قطرات تولید میکند که بیشتر آنها حاوی یک سلول هستند یا هیچ سلول ندارند.
یک حلقه شارژ الکتریکی دقیقاً در نقطه ای قرار میگیرد که جریان به قطرات شکسته شود و بلافاصله قبل از اندازهگیری شدت فلورسانس، یک بار روی حلقه قرار میگیرد. بار مخالف در هنگام قطره شدن از جریان قطره قطره شده و قطرات شارژ میشوند. قطرات باردار سپس از طریق سیستم انحراف الکترواستاتیک می افتند که قطرات را بر اساس بار آنها به داخل ظرف هدایت میکند. در بعضی از سیستم ها، بار مستقیماً به جریان وارد میشود و قطره قطره شارژ همان علامت جریان را حفظ میکند. پس از قطع قطره، جریان به حالت خنثی برگردانده میشود. پس از جمعآوری، میتوان این سلولها را بیشتر کشت، دستکاری و مطالعه کرد.
نشانه گذاری در فلوسایتومتری
فلوسایتومتری از خصوصیات نوری پراکنده از سلولها یا ذرات برای شناسایی یا اندازهگیری کمی خصوصیات فیزیکی استفاده میکند. از برچسبها، رنگها و لکهها میتوان برای تجزیه و تحلیل چند پارامتری استفاده کرد. ایمونوفنوتایپ، تجزیه و تحلیل جمعیتهای ناهمگن سلولها با استفاده از آنتیبادیهای برچسب خورده و سایر معرفهای حاوی فلوروفور مانند رنگها و لکهها است.
برچسب های فلورسنت
طیف گستردهای از فلوروفورها را میتوان به عنوان برچسب در فلوسایتومتری استفاده کرد. فلوئوروفورها یا به سادگی فلورها، به طور معمول به آنتیبادی متصل میشوند که یک ویژگی هدف را در سلول یا در سلول تشخیص میدهد. آنها همچنین ممکن است به یک ماده شیمیایی متصل به غشای سلول یا ساختار سلولی دیگری متصل شوند. هر فلوروفور دارای یک اوج مشخصه تحریک و طول موج انتشار است و طیف های انتشار اغلب با هم همپوشانی دارند. در نتیجه، ترکیبی از برچسبهای قابل استفاده به طول موج لامپ (ها) یا لیزر (های) مورد استفاده برای تحریک فلوئورکرومها و ردیابهای موجود بستگی دارد.
تصور میشود که حداکثر تعداد برچسبهای فلورسنت قابل تشخیص 17 یا 18 باشد و این سطح از پیچیدگی برای به حداقل رساندن مصنوعات و همچنین الگوریتمهای پیچیده تجزیه تکنیک برای جداسازی طیفهای همپوشان، بهینهسازی پر زحمت را ضروری میکند. فلوسایتومتری از فلورسانس به عنوان ابزاری کمی استفاده میکند. حداکثر حساسیت فلوسایتومتری با سایر سیستم عاملهای تشخیص فلورسنت مانند میکروسکوپ کانفوکال قابل مقایسه نیست.

حساسیت مطلق فلورسانس به طور کلی در میکروسکوپ کانفوکال کمتر است زیرا سیگنالهای خارج از فوکوس توسط سیستم نوری کانفوکال رد میشوند و به این دلیل که تصویر از اندازهگیریهای جداگانه در هر مکان از سلول به صورت سریال ساخته میشود، باعث کاهش مدت زمان جمعآوری سیگنال میشود. برخی از انواع برچسبهای فلورسنت برای فلوسایتومتری در ادامه ذکر شدهاند:
- لیزر آرگون آبی (۴۸۸ نانومتر): این لیزر با هوای خنک همراه است و بنابراین راهاندازی و کاربرد آسانتری دارد و در دستگاههای تک لیزر استفاده میشود. برخی از برچسبهای این لیزر عبارتند از:
- برای کانال سبز روی FL1: الکسا فلوئور، GFP ،FITC ،CFSE و CFDA - SE
- برای کانال نارنجی روی FL2: استفاده از PE یا PI
- برای کانال قرمز روی FL3: معمولا PE- الکسافلوئور ۷۰۰، PerCP - Cy5/5 ،PerCP Cy5/5 یا PE-Cy5
- برای کانال مادون قرمز معمولا روی FL4 (در همه دستگاهها موجود نیست): PE - الکسافلوئور۷۵۰ یا PE - Cy7
- لیزر دیود قرمز (۶۳۵ نانومتر):
- APC-Cy7 ،Cy5 ،APC ،Draq-5، نانوکریستالهای eفلوئور ۶۰۵، ۶۲۵ یا ۶۵۰
نقاط کوانتومی
از نقاط کوانتومی به علت وجود قلههای انتشار باریک، گاهی اوقات به جای فلوروفورهای سنتی استفاده میشود.
برچسب گذاری ایزوتوپ
سایتومتری جرم با استفاده از ایزوتوپهای لانتانید متصل به آنتیبادیها، برچسبگذاری فلورسنت را پشت سر میگذارد. این روش از نظر تئوری میتواند از 40 تا 60 برچسب قابل تشخیص استفاده کند و برای 30 برچسب نشان داده شده است. سایتومتری جرم اساساً با فلوسایتومتری متفاوت است: سلولها به یک پلاسما وارد و یوندار میشوند و ایزوتوپهای مرتبط از طریق طیفسنجی جرمی کمیسازی میشوند. اگرچه این روش استفاده از تعداد زیادی برچسب را مجاز میداند، اما در حال حاضر ظرفیت عملیاتی کمتری نسبت به فلوسایتومتری دارد. همچنین سلولهای مورد تجزیه و تحلیل را از بین میبرد و مانع بهبودی آنها با مرتبسازی میشود.
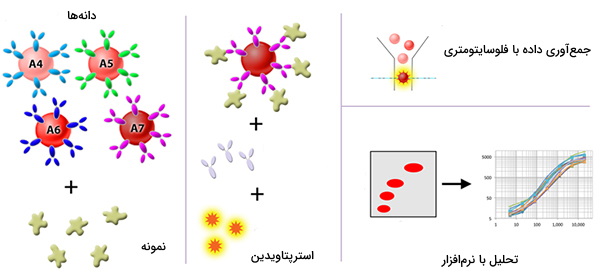
آرایه دانه سایتومتری
علاوه بر توانایی برچسبگذاری و شناسایی سلولهای فردی از طریق آنتیبادیهای فلورسنت، محصولات سلولی مانند سیتوکینها، پروتئینها و سایر عوامل نیز ممکن است اندازهگیری شوند. مشابه سنجش ساندویچ الایزا (ELISA)، سنجش آرایه دانه سایتومتریک (CBA) از جمعیت مهرههای متعددی استفاده میکند که به طور متناوب با اندازه و سطوح مختلف شدت فلورسانس متفاوت هستند تا تجزیه و تحلیلهای متعدد در یک روش واحد را تشخیص دهند. مقدار آنالیت گرفته شده از طریق آنتیبادی بیوتینیله شده در برابر یک اپیتوپ ثانویه پروتئین و به دنبال آن درمان با استرپتاویدین- R - فیکوئیرترین تشخیص داده میشود.
شدت فلورسنت R - فیتوکراتین روی دانهها بر روی یک فلوسایتومتر مجهز به منبع تحریک 488 نانومتر اندازهگیری میشود. غلظت یک پروتئین مورد علاقه در نمونهها را میتوان با مقایسه سیگنالهای فلورسنت با منحنی استاندارد تولید شده از رقت سریال غلظت شناخته شده آنالیت به دست آورد. معمولاً به عنوان آرایه مهره سیتوکین (CBA) نیز شناخته میشود.
سیتومتری بر اساس امپدانس چیست؟
سیستمهای تجزیه و تحلیل تک سلولی مبتنی بر امپدانس معمولاً به عنوان شمارندههای Coulter شناخته میشوند. آنها روشی کاملاً ثابت برای شمارش و اندازهگیری تقریباً هر نوع سلول و ذره را نشان میدهند. فناوری بدون برچسبگذاری اخیراً با استفاده از رویکرد آزمایشگاه روی تراشه و با استفاده از جریان متناوب فرکانس بالا (AC) در دامنه فرکانس رادیویی (از 100 کیلوهرتز تا 30 مگاهرتز) به جای مستقیم ثابت افزایش یافته است.
با استفاده از فلوسایتومتری بر اساس امپدانس (Impedance Flow Cytometry)، میتوان میزان سمیت نانو مواد را با سرعت و دقت بالا اندازهگیری کرد. نانو مواد ویژگیهای فیزیکوشیمیایی مفیدی دارند که منجر به افزایش استفاده آنها در صنایع مختلف مانند داروسازی، بیوتکنولوژی، الکترونیک، تغذیه و کشاورزی شده است. اما افرادی که با این موارد سر و کار دارند، به دلیل سمیت بالا، در خطر هستند. علیرغم نیاز به مطالعات سمشناسی گسترده در مورد مواد نانو، تکنیکهای استاندارد کمی امکان بررسی اثرات بالقوه آنها بر سلامت و ارزیابی خصوصیات آنها را دارند.
مثلا در صنایع دارویی و شیمیایی بیشتر از آزمایشهای رنگسنجی برای بررسی سمیت نانومواد استفاده میشود در حالی که ثابت شده است که این آزمایشات اغلب نتایج مثبت و منفی کاذب و دقت پایینی دارند. اگرچه فلوسایتومتری روش برای بررسی دقیق سلولها در مدت زمانی کوتاه است اما نیاز به نشانهگذاری سلولها قبل از آنالیز، ممکن است باعث تداخل این برچسبها با نانوذرات شود. از طوی دیگر فلوسایتومتری مبتنی بر امپدانس بدون نیاز به برچسب انجام میشود و میتواند اطلاعات چند پارامتری مشابهی را در مورد سلولها ارائه دهد در نتیجه برای بررسی سمیت نانو ذرات هم کاربرد دارد.
در پایان فلوسایتومتری وابسته به امپدانس، دادهها به صورت امپدانس الکتریکی (Z) از آنالیتهای سلول ارائه میشوند که نشاندهنده مقاومت (R) و واکنش (X) (وابسته به فرکانس) هستند. برای به دست آوردن این مقادیر، سیتومتری جریان امپدانس متکی به تجزیه و تحلیل مبتنی بر میدان الکتریکی است که رفتار آنالیت را هنگامی که در میدان الکتریکی با فرکانسهای مختلف قرار میگیرد کنترل میکند. به عنوان مثال در فرکانسهای پایین، سد غشای سلولی در برابر جریان مقاومت میکند که کاربر را قادر میسازد تا اطلاعات مربوط به اندازه سلول را به دست آورد. با افزایش فرکانسها به سطح متوسط، میتوان اطلاعات بیشتری در مورد خصوصیات ویژه غشای سلول به دست آورد.
فرکانسهای بالا میتوانند به غشای سلول نفوذ کرده و اطلاعاتی در مورد اجزای داخلی سلول فراهم کنند. علاوه بر اینکه فلوسایتومتری امپدانس اطلاعات بیشتری نسبت به روس TB در اختیار میگذارد، میتواند ده هزار سلول را اندازهگیری کند که در مقایسه با ۲۰۰ تا ۳۰۰ سلول در سیتومتری، عدد بسیار بالایی است.
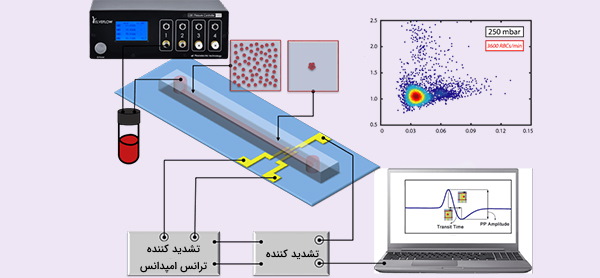
میدان جریان متناوب
جریان (DC) یا فرکانس پایین امکان تجزیه و تحلیل بسیار دقیق سلول را فراهم میکند و اطلاعات اضافی مانند ظرفیت غشایی و زنده ماندن را فراهم میکند. اندازه و استحکام نسبتاً کوچک این امکان را میدهد تا در محل از طریق باتری استفاده شود.
پارامترهای قابل اندازهگیری با فلوسایتومتری
پارامترهایی که میتوان با این روش اندازهگیری کرد عبارتند از موارد زیر:
- آپوپتوز سلولی (کمیسازی، اندازهگیری تخریب DNA، پتانسیل غشای میتوکندری، تغییرات نفوذپذیری، فعالیت کاسپاز)
- نکروز سلولی
- آنالیز چرخه سلولی
- چسبندگی سلول (به عنوان مثال به میزبان پاتوژن)
- رنگدانههای سلولی مانند کلروفیل یا فیکوئیرترین
- آنتیژنهای سطح سلول (نشانگرهای CD)
- زنده ماندن سلولها
- آنالیز اسپرم در مایع منی
- نمونهبرداری از غدد لنفاوی
- جداسازی و تصفیه سلولهای توموری در گردش خون
- توصیف مقاومت چند دارویی (MDR) در سلولهای سرطانی
- تجزیه و تحلیل و مرتبسازی کروموزومها (ساخت کتابخانه، رنگ کروموزوم)
- تغییر تعداد کپی DNA (توسط فناوری Flow - FISH یا BACs - on - Beads)
- فعالیت آنزیمی گلوتاتیون
- آنتیژنهای داخل سلولی (سیتوکاینهای مختلف، واسطههای ثانویه و غیره)
- سیالیت غشای سلولی
- نظارت بر قابلیت انعطافپذیری الکتریکی سلولها
- آنتیژنهای هستهای
- انفجار اکسیداتیو
- شمارش گلبولهای قرمز
- بررسی HLA
- pH
- کلسیم و منیزیم یونیزه داخل سلول
- پتانسیل غشای سلول
- تغییرات درون نورونها و سایر سلولهای سیستم عصبی
- بیان و محلیسازی پروتئین، اصلاحات پروتئین و فسفوپروتئینها
- اندازهگیری حجم (با پراکندگی رو به جلو) و پیچیدگی ریختشناسی (توسط پراکندگی جانبی) سلولها یا سایر ذرات، حتی آنهایی که غیر فلورسنت هستند (ترتیب FSC و SSC)
- محتوای ژنوم
- سینتیک سلول
- تکثیر، پلوئیدی، آنوپلوئیدی، تکثیر Endored و سایر مسائل مرتبط با DNA
- محتوای RNA کل محصولات تراریخت در داخل بدن، به ویژه پروتئین فلورسنت سبز و سایر پروتئینهای فلورسنت مرتبط
- ترکیبات مختلف مانند آنتیژنهای DNA (هستهای) و آنتیژنهای سطحی
کاربردهای فلوسایتومتری چه هستند؟
این فناوری در زمینههای مختلفی از جمله زیستشناسی مولکولی، آسیبشناسی، ایمونولوژی، ویروسشناسی، زیستشناسی گیاهی و زیست دریایی کاربرد دارد همچنین در پزشکی به ویژه در پیوند، هماتولوژی، ایمونولوژی تومور و شیمیدرمانی، تشخیص قبل از تولد، ژنتیک و مرتبسازی اسپرم برای انتخاب جنسیت مورد استفاده قرار میگیرد. فلوسایتومتری برای بسیاری از بررسیهای ژنتیکی مانند بررسی کروموزمها، بیان پروتئین، کمیسازی RNA و DNA و تشخیص ناهنجاری سلولهای اسپرم در ارتباط با قطعه قطعه شدن DNA در روشهای باروری مردان استفاده میشود. همچنین در تحقیقات برای تشخیص آسیب DNA، شکاف کاسپاز و آپوپتوز کاربرد دارد.
فلوسایتومتری فتوآکوستیک در مطالعه باکتریهای مقاوم به چند دارو (معمولاً MRSA) برای شناسایی، تمایز و کمیسازی باکتری در خون مشخص شده با باکتریوفاژهای رنگ شده استفاده میشود. در علوم اعصاب، بیان مشترک سطح سلول و آنتیژنهای داخل سلولی نیز قابل تجزیه و تحلیل است. در میکروبیولوژی، میتوان از آن برای غربالگری و مرتبسازی کتابخانههای جهش یافته ترانسپوزون ساخته شده با ترانسپوزون رمزگذار GFP (TnMHA) یا ارزیابی زنده ماندن استفاده کرد. در مهندسی پروتئین، از فلوسایتومتری بهمراه نمایش مخمر و نمایش باکتری جهت شناسایی انواع پروتئین سطح سلول با خصوصیات مورد نظر استفاده میشود.
مزایای اصلی فلوسایتومتری نسبت به بافتشناسی و IHC امکان اندازهگیری دقیق آنتیژنها و امکان رنگآمیزی هر سلول با چندین آنتیبادی - فلوروفور است، در آزمایشگاههای فعلی حدود 10 آنتیبادی میتواند به هر سلول متصل شود. این بسیار کمتر از سیتومتر جرمی است که در حال حاضر میتوان 40 را با قیمت بالاتر و سرعت پایینتر اندازهگیری کرد. فلوسایتومتری چندین دهه در دسترس بوده و برای استفاده در بسیاری از زمینههای آزمایش بالینی سازگار شده است. در زیر فقط چند نمونه از آزمایشاتی که از فلوسایتومتری استفاده میکنند آورده شده است:
- تعداد رتیکولوسیتها
- تعداد CD4 تایپ HLA
- آنالیز اسپرم
- ایمونوفنوتیپ
- آزمایشات عملکرد پلاکت
- آسپیراسیون و بیوپسی مغز استخوان
- نمونهبرداری از غدد لنفاوی
فلوسایتومتری در شناسایی انواع سلولهای منحصر به فرد در برخی بیماریها اعمال شده است. یکی از شایعترین آنها در تشخیص سرطانهای مرتبط با خون مانند سرطان خون و لنفوم است. از آنتیبادیهای مونوکلونال بسیار خاصی که تحت درمان با فلوروکروم قرار گرفتهاند، برای تشخیص وجود یا عدم وجود اجزای مختلف سلولی شایع در انواع خاصی از سرطانها، استفاده میشود. این اطلاعات در تشخیص، پیشآگهی و درمان این بیماریها استفاده میشود. این امر به ویژه در مراحل اولیه بیماری بدخیم که ممکن است فقط چند سلول سرطانی در نمونه وجود داشته باشد و با معاینه معمولی زیر میکروسکوپ قابل شناسایی نباشند، بسیار مفید است.
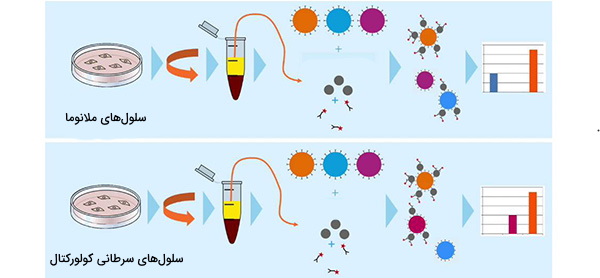
مطالعه سرطان با آزمایش فلوسایتومتری
فلوسایتومتری در تحقیقات جدید سرطان بسیار مهم است. با استفاده از رنگآمیزی برای آنتیژنهای سطحی خاص، فلوسایتومتری به ما امکان میدهد بین سلولهای مختلف سرطانی در غدد لنفاوی، مغز استخوان و نمونه خون بیمار تشخیص داد. به عنوان مثال، لنفوم اغلب با استفاده از فلوسایتومتری قابل تشخیص است. به همین ترتیب، این ابزار میتواند با اندازهگیری مقدار DNA واکنشپذیر به نور در سلولهای سرطانی، خطر عود سرطانهای مثانه، پستان و پروستات را ارزیابی کند. این به وضوح ابزاری حیاتی برای میلیونها بازمانده از سرطان است که هر سال در بهبودی به سر میبرند.
کاربردهای آن در تشخیص بیماریهای نقص ایمنی اولیه (PI) نیز به همان اندازه قوی است. بیماریهای نقص ایمنی اولیه گروهی از اختلالات مزمن نادر هستند که سیستم ایمنی بیمار مبتلا را از مبارزه با عفونتها به خطر میاندازد. این عفونتها عود میکنند و ممکن است پوست، ریه، حلق، مغز یا حتی دستگاههای گوارشی و ادراری بیمار را تحت تأثیر قرار دهند. در حالی که تشخیص اختلالات نقص ایمنی اولیه به چندین آزمایش نیاز دارد، فلوسایتومتری یک قسمت اصلی از آزمایش اولیه و مدیریت پس از تشخیص بیماری است.
بررسی آبزیان با آزمایش فلوسایتومتری
در سیستمهای آبی، از فلوسایتومتری برای تجزیه و تحلیل سلولهای فلورسانس یا سلولهایی که دارای لکههای فلورسنت هستند و دارای لکههای اضافه شده هستند، استفاده میشود. این تحقیق در سال 1981 زمانی آغاز شد که کلاریس ینتس با استفاده از فلوسایتومتری برای اندازهگیری فلورسانس در جزر و مد قرمز تولید دینوفلاژلات. سال بعد محققان اندازهگیری های فلوسایتومتری چندین گونه جلبکی را منتشر کردند که میتوان آنها را بر اساس ویژگی های فلورسانس آنها تشخیص داد.
تا سال 1983، محققان دریایی در حال جمعآوری فلوسایتومترهای خود یا استفاده از فلوسایتومترهای تجاری موجود در نمونههای آب دریا جمع شده در برمودا بودند تا نشان دهند سلولهای فیتوپلانکتون را میتوان از مواد غیر زنده تشخیص داد و سیانوباکتریها را از یک جامعه مخلوط طبقهبندی کرد متعاقباً در آزمایشگاه کشت داده شد. فلوسایتومتری همچنین به محققان دریایی این امکان را میدهد تا بین پروکلروکوک کم نور فلورسانس و میکروارگانیسمهای هتروتروف تفاوت قائل شوند، تمایزی که با ارزیابیهای میکروسکوپی دشوار است.
پیشرفتهای فناوری اکنون به دانشمندان زیستشناسی آبزیان این امکان را میدهد تا در طول سفرهای تحقیقاتی از فلوسایتومتر به طور مداوم استفاده کنند و از فلوسایتومتر برای تهیه تصاویر سلولهای فیتوپلانکتون منفرد استفاده میشود. دانشمندان علوم دریایی از توانایی مرتبسازی سیلومترها برای اندازهگیری گسسته فعالیت و تنوع سلولی استفاده میکنند. برای انجام تحقیقات در مورد روابط متقابل بین میکروارگانیسمهایی که در نزدیکی هم زندگی میکنند و اندازهگیری میزان بیوژئوشیمیایی فرآیندهای موجود در اقیانوسها نیز از فلوسایتومتری استفاده میشود.
روش تکثیر سلولی در فلوسایتومتری
تکثیر سلولی عملکرد اصلی در سیستم ایمنی بدن هنگام مواجهه با عوامل بیماریزا است. غالباً لازم است ماهیت تکثیر سلولها تجزیه و تحلیل شود تا نتیجهگیری شود. یکی از این روشها برای تعیین تکثیر سلولی ردیابی رنگ کربوکسی فلوئورسئین دی استات سوکسینیمیدیل استر (CFSE) است. به نظارت بر سلولهای تکثیر کمک میکند. این روش دادههای کمی و همچنین کیفی را در طول آزمایشهای سری زمانی ارائه میدهد. این رنگ به صورت کووالانسی با مولکولهای طولانی مدت موجود در سلول پیوند می یابد. هنگامی که سلولها تقسیم میشوند، مولکولها نیز تقسیم میشوند و سلولهای دختری، نیمی از رنگ را نسبت به جمعیت والدین دارند.
این کاهش شدت را میتوان با فلوسایتومتری مشاهده کرد. در ادبیات، از این روش قدرتمند فلوسایتومتری و CFSE برای یافتن کارایی سلولهای T در از بین بردن سلولهای هدف در سرطان مانند سرطان خون استفاده شده است. به منظور تجسم مرگ سلول هدف، چه سریع و چه آهسته، دانشمندان از برچسب CFSE با رنگآمیزی آنتیبادی در انواع خاصی از سلولها و ریز دانههای دارای برچسب فلورسنت استفاده کردهاند. این همچنین اطلاعاتی در مورد تکثیر سلولهای هدف در درمان سیتوکین های خاص را به دست میدهد.
استانداردهای فلوسایتومتری
استانداردهای فلوسایتومتری Flow Cytometry Standard( (FCS)) یک استاندارد پرونده داده برای خواندن و نوشتن دادههای حاصل از آزمایشهای فلوسایتومتری است. مشخصات FCS به طور سنتی توسط انجمن بین المللی پیشرفت سایتومتری (ISAC) توسعه و نگهداری میشود.FCS قبلاً تنها فرمت پرونده به طور گستردهای در فلوسایتومتری بود. اخیراً، قالبهای استاندارد فایلهای اضافی توسط ISAC ایجاد شده است.
قالب فایل استانداردهای فلوسایتومتری فایلی را توصیف میکند که ترکیبی از دادههای متنی و به دنبال آن دادههای باینری است. ترتیب طرح فایل به شرح زیر است: بخش HEADER بخش TEXT بخش دادهها بخش آنالیز اختیاری مقدار CRC سایر بخشهای اختیاری بخش HEADER یک رشته متنی ASCII است که با شناسایی نسخه استاندارد FCS استفاده میشود و به دنبال آن سه جفت بایت جبران میشود که موقعیت های TEXT،DATA و ANALYSIS را مشخص میکند.
از آنجا که عرض میدان موقعیت های بایت بخش سرآیند با 8 کاراکتر محدود میشود، حداکثر موقعیتی که میتواند ذخیره کند است. هر چیزی فراتر از آن به عنوان صفر برای موقعیت شروع و پایان رمزگذاری میشود و به جای آن از کلمه کلیدی بخش TEXT مربوطه استفاده میشود. بخش متن یک رشته متنی ASCII است که به مجموعهای از جفت های مقدار-کلید تقسیم میشود که توسط برخی از کاراکترهای انتخاب شده، مثلاً «|» اولین کاراکتری که بلافاصله قسمت هدر را دنبال میکند، جداکننده است.
استاندارد دادههای فلوسایتومتری
دادههای فلوسایتومتری به طور معمول برای تجزیه و تحلیل به صورت آرایه ذخیره میشود، کانال های فلورسانس و پراکندگی در ستونها نشان داده میشوند و رویدادهای جداگانه (بیشتر آنها سلول هستند) و ردیفها را تشکیل میدهند. تعداد وقایع به دست آمده از هر نمونه معمولاً بین هزاران کم و میلیون ها کم است. اولین نسخه از استاندارد فلوسایتومتری (FCS) در سال 1984 توسعه یافت. از آن زمان، FCS به قالب استاندارد پرونده پشتیبانی میشود که توسط تمام فروشندگان نرمافزار و سختافزار جریانسنج پشتیبانی میشود.
FCS یک فرمت فایل باینری با سه بخش اصلی است: یک بخش متنی حاوی دادههای متا در ساختار جفت کلمات کلیدی / مقدار، یک بخش داده که معمولاً حاوی ماتریسی از مقادیر بیان شناسایی شده است (اصطلاحاً قالب حالت لیست) و یک بخش تحلیل که به ندرت استفاده میشود. با گذشت سالها، به روزرسانی ها برای انطباق با پیشرفتهای فن آوری در هر دو روش فلوسایتومتری و فناوریهای رایانه ای انجام شد. در سال 1990، FCS 2 معرفی شد. ویژگیهای معرفی شده در FCS 2 شامل گزینههای مجموعه دادههای متعدد در داخل یک فایل داده، استفاده از سفارشات مختلف بایت متناسب با تغییرات سخت افزاری در سیستم عامل های مختلف محاسباتی و اطلاعات پایه و جبران و مقیاس گذاری است.
FCS 2 در سال 1997 توسط FCS 3/0 دنبال شد، که امکان ذخیرهسازی مجموعه دادههای بزرگتر از 100 مگابایت را ارائه میداد. آخرین نسخه، FCS 3/1، در سال 2010 معرفی شد. ساختار اصلی فایل FCS و بیشتر ویژگیهای نسخههای قبلی استاندارد را حفظ میکند. تغییرات موجود در FCS 3/1 ابهامات احتمالی نسخههای قبلی را برطرف میکند و استاندارد قویتری را ارائه میدهد. اینها شامل پشتیبانی ساده از شخصیتهای بین المللی و پشتیبانی بهتر برای ذخیره است. عمده موارد اضافی پشتیبانی از مقیاس نمایش ترجیحی، یک روش استاندارد برای گرفتن حجم نمونه، اطلاعات مربوط به منشا پرونده دادهها و پشتیبانی از صفحه و شناسایی چاه در بازده بالا و آزمایشات مبتنی بر صفحه است.
بیوانفورماتیک فلوسایتومتری
بیوانفورماتیک فلوسایتومتری کاربرد بیوانفورماتیک در دادههای فلوسایتومتری است که شامل ذخیره سازی، بازیابی، سازماندهی و تجزیه و تحلیل دادههای فلوسایتومتری با استفاده از منابع و ابزارهای گسترده محاسباتی است. بیوانفورماتیک فلوسایتومتری نیاز به استفاده گسترده از آنها دارد و به توسعه تکنیکهای آماری محاسباتی و یادگیری ماشین کمک میکند. فلوسایتومتری و روشهای مربوط به آن، امکان تعیین تعداد نشانگرهای زیستی مستقل بر تعداد زیادی سلول منفرد را فراهم میکند.
رشد سریع دادههای چند بعدی و توان فلوسایتومتری، به ویژه در دهه 2000، منجر به ایجاد انواع روشهای تجزیه و تحلیل محاسباتی، استانداردهای دادهها و پایگاههای داده عمومی و به اشتراکگذاری نتایج شده است. روشهای محاسباتی برای کمک به پیشپردازش دادههای فلوسایتومتری، شناسایی جمعیت سلولهای درون آن، تطبیق آن جمعیت سلولها در نمونهها و انجام تشخیص و کشف با استفاده از نتایج مراحل قبلی وجود دارد. برای پیش پردازش، این شامل جبران همپوشانی طیفی، تبدیل دادهها در مقیاسهای مناسب برای تجسم و تجزیه و تحلیل، ارزیابی دادهها برای کیفیت و عادیسازی دادهها در بین نمونهها و آزمایشات است.
برای شناسایی جمعیت، ابزارهایی برای کمک به شناسایی جمعیتها در قطعات پراکندگی دو بعدی (دروازه)، استفاده از کاهش ابعاد برای کمک به دروازه ها و یافتن جمعیت به طور خودکار در فضای بعدی با روشهای مختلف وجود دارد. همچنین میتوان دادهها را به روشهای جامع تری مانند روش تقسیم فضای دودویی باینری با تراکم هدایت شده و یا به عنوان دروازه ترکیبی مشخص کرد. سرانجام، تشخیص با استفاده از دادههای فلوسایتومتری میتواند با استفاده از روشهای یادگیری نظارت شده، و کشف انواع سلولهای جدید از اهمیت بیولوژیکی با استفاده از روشهای آماری با بازده بالا، به عنوان بخشی از خطوط لوله شامل تمام روشهای فوق الذکر.
استانداردهای باز، دادهها و نرمافزارها نیز از قسمتهای اصلی بیوانفورماتیک جریان سنجش جریان هستند. استانداردهای داده شامل استاندارد فلوسایتومتری (FCS) است که نحوه ذخیرهسازی دادهها از سیتومتر را تعریف میکند، اما همچنین چندین استاندارد جدید تحت توسعه توسط انجمن بینالمللی پیشرفت سایتومتری (ISAC) برای کمک به ذخیره اطلاعات دقیقتر در مورد طراحی آزمایشی و مراحل تحلیلی دادههای باز با افتتاح پایگاه داده CytoBank در سال 2010 و FlowRepository در سال 2012 به آرامی در حال رشد است، هر دو این امکان را برای کاربران فراهم میکند تا آزادانه دادههای خود را توزیع کنند و مورد دوم به عنوان مخزن ترجیحی دادههای سازگار با MIFlowCyt توسط ISAC توصیه شده است. نرم افزار Open به طور گسترده در قالب مجموعهای از بستههای Bioconductor در دسترس است، اما برای اجرای وب در بستر GenePattern نیز موجود است.
میکروفلوسایتومتری چیست؟
میکروفلوریمتری سازگاری از فلوریمتری برای مطالعه خواص بیوشیمیایی و بیوفیزیکی سلولها با استفاده از میکروسکوپ برای تصویربرداری از اجزای سلول برچسب خورده با مولکولهای فلورسنت است. این نوعی میکروفتومتری است که کمی از ماهیت کیفی اندازهگیری فلورسنت را اندازهگیری میکند و بنابراین نتایج قطعی را که قبلاً با چشم غیر مسلح قابل تشخیص نبودند، فراهم میکند. میکرو فلوریمتری برای زمینههای مختلف از جمله بیولوژی سلول، میکروبیولوژی، ایمونولوژی، تجزیه و تحلیل چرخه سلولی و کاریوتیپ جریان سلولها استفاده میشود.
در کاروتیپینگ جریان، کروموزومهای متافاز جدا شده رنگآمیزی و در میکرو فلورومتر جریان اندازهگیری میشوند. رنگآمیزی فلورسنت کروموزومها همچنین میتوانند توزیع مربوط به فراوانی نسبی وقوع و محتوای DNA کروموزومی، کروموزومهای اندازهگیری شده را ارائه دهند. این روش اجازه میدهد تا کاریوتایپ را با سرعت بالاتری نسبت به روشهای قبلی انجام دهیم و با استفاده از کروموزومهای همستر چینی دقیق نشان داده شد. از میکرو فلوریمتری جریان (FMF) نیز میتوان برای تعیین جمعیتهای مختلف سلولها با استفاده از مارکرهای فلورسنت با نمونه سلولهای کوچک استفاده کرد.
نشانگرهای مورد استفاده برای اندازهگیری در میکروفلوریمتری جریان از آنتیژنهای فلورسنت یا عوامل اتصال DNA تشکیل شده است. این امکان را برای اندازهگیری دقیق واکنش آنتیبادی با آنتیژن فراهم میکند. از میکروفلوریمتری جریان همچنین در تحقیقات دارویی برای تعیین نوع سلول، بیان پروتئین و DNA، چرخه سلولی و سایر خصوصیات سلول در طی درمان دارویی استفاده میشود. به عنوان مثال، میکروفلوریمتری در سلولهای عصبی برای مقایسه اثرات نوروتوکسینها بر غلظت یون کلسیم و پتانسیل غشای میتوکندری در سلولهای جداگانه استفاده میشود.
میکروفلوریمتری همچنین میتواند به عنوان روشی برای تشخیص میکروارگانیسمهای مختلف از یکدیگر با تجزیه و تحلیل و مقایسه محتوای DNA هر سلول مورد استفاده قرار گیرد. همین مفهوم را میتوان برای تشخیص انواع سلولها با استفاده از یک رنگ فلورسنت مناسب که بسته به هدف متفاوت است و یک روش حیاتی در زیستشناسی و ژنومیک سلولها است، به کار برد. کاربرد دیگر میکرو فلورومتری فلوسایتومتری است که از انتشار مولکولهای فلوئورکروم و معمولاً لیزر به عنوان منبع نور برای ایجاد داده از ذرات و سلولها استفاده میکند.
میتوان از آن برای جداسازی کروموزومها با سرعت بسیار بالا استفاده کرد و به راحتی با توالییابی نسل بعدی استفاده کرد. این تکنیک میتواند به سادگی و با جدا کردن فقط کروموزومهای مربوطه با سرعت بسیار سریع حاصل شود. به عنوان مثال، باکتریوفاژهای E. coli لامبدا و T4 با استفاده از فلوسایتومتری که امکان تجزیه و تحلیل ژنومی را داشت که قبلاً دشوار بود، قادر به جدا شدن بودند.
میکروفلوریمتری بر اساس روش تعیین شده اندازهگیری فلوریمتری است. با استفاده از رنگی که در حضور یک ترکیب هدف فلورس میکند، فلوریمتری میتواند با تعیین وجود و شدت فلورسانس، حضور ترکیب را تشخیص دهد. برای تعیین غلظت ترکیب میتوان از اختلاف شدت استفاده کرد. به علاوه، اگر رنگ دچار تغییر طیفی شود، میتوان بدون توجه به دانش غلظت رنگ، غلظت مطلق هدف را تعیین کردد. Fura-2 نمونه ای از رنگ فلورسنت است که برای اندازهگیری کلسیم استفاده میشود.
میکروفلوریمتری با افزودن یک جز میکروسکوپی به اندازهگیریها، امکان تجزیه و تحلیل سلولهای منفرد و سایر علایق میکروسکوپی را در فلوریمتری گسترش میدهد. منابع زیادی از خطا در روند کار وجود دارد اما خطاهای بیولوژیکی مانند عدم توانایی در تهیه نمونههای همگن بیشتر از خطاهای فنی محدودیت دارند.
میکروفلورمتر چیست؟
میکروفلورومتر یک اسپکتروفتومتر فلورسانس همراه با میکروسکوپ است که برای اندازهگیری طیفهای فلورسانس نمونههای میکروسکوپی یا نواحی کوچک طراحی شده است یا میتواند برای اندازهگیری طیف انتقال و بازتاب مناطق نمونه میکروسکوپی به کار برده شود. این میتواند یک میکروفلورومتر کامل باشد که به طور انحصاری برای میکروسکوپکتروسکوپی فلورسانس ساخته شده یا واحد طیف سنج فلورسانس است که به درگاه نوری میکروسکوپ متصل میشود. میتوان از میکرو فلورومتر برای برآورد مقدار و توزیع اجزای شیمیایی در سلولهای جداگانه یا کروموزومها استفاده کرد.
به منظور تخمین میزان اجزای شیمیایی، شدت فلورسنت آن با استفاده از نورسنج فوتوالکتریک اندازهگیری میشود در حالی که توزیع با اندازهگیری شدت عکسهای صفحات متافاز کروموزومهای منفی پیدا میشود. میکروسپکتروفتومتر میتواند انتقال، جذب، بازتاب و طیف انتشار را اندازهگیری کند سپس با استفاده از الگوریتمهای ساخته شده طیفی تولید خواهد شد که میتواند با دادههای قبلی از نظر ترکیب، غلظت و سایر موارد مقایسه شود.
روش مرتب سازی سلول های فعال فلورسنت چیست؟
تکنیک مرتبسازی سلولهای فعال فلورسنت (FACS) برای تصفیه جمعیت سلولی خاص بر اساس فنوتیپهای تشخیص داده شده توسط فلوسایتومتری است. این روش محققان را قادر میسازد تا ویژگیهای یک جمعیت سلولی را بدون تأثیر سایر سلولها بررسی کنند. FACS به عنوان یک روش برای طبقهبندی سلولها استفاده میشود و اغلب با جزئیات بیشتری نسبت به فلوسایتومتری یا سایر تکنیکهای تحلیلی نتایج را نشان میدهد. در حالیکه فلوسایتومتری برای آنالیز است و بیشتر در اندازهگیری میزان بیان پروتئینها یا بیان همزمان در یک جمعیت سلولی مخلوط استفاده میشود.
با کمک این روش میتوان مجموعهای از پارامترها را در یک جمعیت سلولی منفرد بررسی کرد. تفاوت کلیدی بین فلوسایتومتری و FACS، توصیف سلول در کاربردی بودن روش مورد استفاده است. به خاطر تفاوتهای این دو روش، برای سلولهای متفاوتی قابل استفاده هستند و گاهی نیز در کنار هم استفاده میشوند. FACS فرایندی است که طی آن نمونهای از سلولها با توجه به ویژگیهای پراکندگی نور و فلورسانس آنها در دو یا چند ظرف طبقهبندی میشوند اما فلوسایتومتری روشی است که طی تجزیه و تحلیل جمعیت ناهمگن از سلولها با توجه به مولکولهای مختلف سطح، اندازه و حجم استفاده میشود که امکان بررسی تک تک سلولها را فراهم میکند.
بررسی آپوپتوز با فلوسایتومتری
گاهی فقط یک زیرمجموعه کوچک از جمعیت سلولی در ارگانیسم، ویژگیهای آپوپتوز را نشان میدهند و فلوسایتومتری را راهی عالی برای شناسایی آنها است. برای تشخیص آپوپتوز می توان از بیش از 30 رنگ مختلف استفاده کرد. همچنین میتوان گفت که آنها ویژگیهای آپوپتوز منفرد را به جای کل فرایند بیوشیمیایی انتخاب میکنند.
همه موجودات چند سلولی باید تکثیر و مرگ سلولی (آپوپتوز) را با تولید سلولهای جدید متعادل کنند. سلولها اغلب به طور تصادفی یا بر اثر تقسیمات متعدد از بین میروند و در شرایط خاصی مانند خشک شدن و ریزش برگ درختان در پاییز، آپوپتوز راهی برای چرخه زندگی ارگانیسم است.
مرگ سلولی از طریق چندین مسیر بیوشیمیایی رخ میدهد و ممکن است با ترکیبی از روشهای اتوفاژی، نکروپتوز و پاراپتوز (به ترتیب نکروز تنظیم شده و شکل متناوب مرگ سلولی) باشد. چهار مرحله از مسیر آپوپتوز با روش فلوسایتومتری قابل تشخیص هستند:
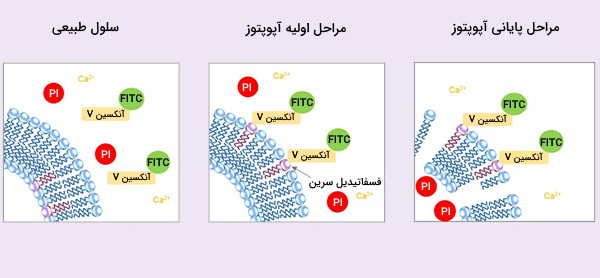
- تغییر در اندامکها به ویژه میتوکندری. پتانسیل غشای میتوکندری با رنگهایی مانند TMRE و JC-1 قابل اندازهگیری است. هنگامی که سلول وارد آپوپتوز میشود، شیب پروتون در غشای میتوکندری از بین میرود. از دست دادن این شیب باعث کاهش فلورسانس این رنگها میشود. همچنین میتوان انتشار سیتوکروم c را از طریق روش آنتیبادی با نشانهگذاری فلورسنت پیگیری کرد.
- فعالسازی کاسپازهای خاص به ویژه کاسپاز ۳ که به عنوان مجری آوپتوز نیز شناخته میشود. چندین آنتیبادی وجود دارند کع مخصوص فرم فعال این آنزیم هستند بنابراین کاسپاز ۳ فعال فقط در سلولهای آپوپتوزی تشخیص داده میشود.
- تغییرات غشای پلاسمایی. یکی از روشهای کلاسیک برای تشخیص آپوپتوز به کمک فلوسایتومتری، استفاده از آنکسین V استکه به بقایای فسفاتیدیل سرین موجود در غشای پلاسمایی متصل میشود. باقیماندههای فسفوتیدیل سرین هنگام آپوپتوز از غشا خارج میشوند بنابراین تنها سلولهایی که مسیر آپوپتوز در آنها فعال شده است با اتصال به آنکسین V شناسایی میشوند.
- تغییر در DNA هستهای. با پیشرفت مرگ سلولی، DNA قطعه قطعه میشود. تکنیکهای نشانهگذاری انتهای DNA یا شستشوی سلولها و تخلیص و مشاهده DNA روشهایی برای بررسی خرد شدن DNA هستند. در این روش «Sub-G1» به طور گستردهای استفاده میشود که در آن محتوای DNA سلولهای در حال آپوپتوز، کمتر از سلولهای طبیعی G1 است.
با توجه به اینکه بر اساس عوامل مختلف روشهای تشخیص آپوپتوز متفاوت هستند، برای استفاده از فلوسایتومتری، باید از نوع لیزرهای موجود در سیتومتر اطلاع داشت، زیرا فلوروکرومهایی که میتوان استفاده کرد بستگی به طول موج لیزرها دارند. همچنین، باید بدانیم که کدام فیلترهای نوری برای تشخیص فلورسانس ساطع شده موجود هستند.
تعیین ایمونوفنوتیپ با فلوسایتومتری
ایمونوفنوتیپ با فلوسایتومتری یک روش آزمایشگاهی است که وجود یا عدم وجود نشانگرهای گلبولهای سفید (آنتیژن) را تشخیص میدهد. این آنتیژنها ساختارهای پروتئینی هستند که بر رو یا در داخل گلبولهای سفید یافت میشوند. گروهبندیهای خاصی از این آنتیژنها به طور معمول در یا در داخل گلبولهای سفید وجود دارند و منحصر به انواع سلولهای خاص و مراحل بلوغ سلولی است. علاوه بر این ، الگوهای خاصی از آنتیژنها بر روی سلولهای غیر طبیعی مشاهده شده در لوسمی و لنفوم وجود دارد.
ایمونوفنوتیپ فلوسایتومتری ممکن است در تشخیص، طبقهبندی، درمان و تعیین پیش آگهی این سرطانهای سلول خونی مفید باشد. لوسمی و لنفوم در اثر گلبول سفید غیرطبیعی ایجاد میشوند که بدون کنترل شروع به تقسیم میکند و کپیهای متعددی ایجاد میکنند (کلون). سلولهای غیرطبیعی رشد میکنند اما با عفونتها مبارزه نمیکنند و عملکردهای دیگری مانند گلبولهای سفید معمولی را انجام نمیدهند. آنها با سرعت طبیعی نمیمیرند بنابراین در مغز استخوان، غدد لنفاوی یا سایر بافتها تجمع مییابند.
با افزایش تعداد سلولهای غیرطبیعی در مغز استخوان، ممکن است آنها جمع شده و مانع از تولید گلبولهای سفید طبیعی، گلبولهای قرمز خون و پلاکتها شوند و در نهایت ممکن است سلولهای غیر طبیعی نیز در خون آزاد شوند. با افزایش تعداد سلولهای غیر طبیعی در غدد لنفاوی، اندازه غدد لنفاوی افزایش مییابد. گاهی لنفومها خون یا مغز استخوان را نیز درگیر میکنند. اگر مبتلا به لوسمی یا لنفوم هستید، آزمایشهای معمول مانند شمارش کامل خون (CBC) و دیفرانسیل WBC ممکن است افزایش تعداد گلبولهای سفید خون با غلبه یک نوع را نشان دهد.
این آزمایشات ممکن است لنفوم یا لوسمی را نشان دهد اما به طور کلی اطلاعات بیشتری برای تأیید تشخیص و شناسایی نوع خاصی از لوسمی یا لنفوم مورد نیاز است. ایمونوفنوتیپ فلوسایتومتری ممکن است روی خون، مغز استخوان یا نمونههای دیگر انجام شود تا این اطلاعات اضافی را ارائه دهد. این میتواند سلولهای طبیعی و همچنین سلولهای غیر طبیعی را که الگوی نشانگرهای آنها معمولاً با انواع خاصی از لوسمی و لنفوم مشاهده میشود، تشخیص دهد.
نتایج ممکن است برای پیشبینی میزان تهاجمی بودن سرطان یا پاسخ آن به درمان خاصی مورد استفاده قرار گیرند. اکثر آنتیژنهایی که با استفاده از روش ایمونوفنوتیپ سیتومتری شناسایی میشوند با شماره CD (خوشههای تمایز یا تعیین خوشه) مشخص میشوند. شمارههای CD بر اساس قرارداد نامگذاری بر اساس اجماع بین المللی هستند. در حالی که صدها آنتیژن شناسایی شده و دارای یک شماره CD منحصر به فرد هستند، فقط تعداد کمی از آنها به طور معمول استفاده میشود.

سرطان خون و لنفوم توسط یک گلبول سفید غیر طبیعی ایجاد میشود که شروع به تقسیم غیرقابل کنترل میکند و نسخه های بی شماری از خود (کلونها) را ایجاد میکند. سلولهای غیرطبیعی رشد میکنند اما با عفونت ها مبارزه نمیکنند یا عملکردهای دیگری مانند گلبولهای سفید طبیعی را انجام نمیدهند. آنها با سرعت طبیعی نمیمیرند، بنابراین در مغز استخوان، غدد لنفاوی یا سایر بافتها جمع میشوند.
با افزایش تعداد سلولهای غیرطبیعی در مغز استخوان، ممکن است سلولها به بیرون جمع شده و از تولید گلبولهای سفید خون طبیعی، گلبولهای قرمز و پلاکتها جلوگیری کنند و در نهایت سلولهای غیرطبیعی نیز در خون آزاد شوند. با افزایش تعداد سلولهای غیرطبیعی در یک غدد لنفاوی، اندازه غده لنفاوی نیز افزایش مییابد. گاهی اوقات لنفومها شامل خون یا مغز استخوان نیز میشوند. برای به دست آوردن این اطلاعات اضافی، ممکن است ایمونوفنوتیپ فلوسایتومتری بر روی خون، مغز استخوان یا سایر نمونهها انجام شود.
ایمونوفلوسایتومتری میتواند سلولهای طبیعی و همچنین سلولهای غیر طبیعی را که الگوی مارکرهای آنها با انواع خاصی از لوسمی و لنفوم مشاهده میشود، تشخیص دهد. همچنین ممکن است از نتایج برای پیشبینی میزان پرخاشگری سرطان و یا اینکه آیا به درمان خاصی پاسخ میدهد، استفاده شود.
از روش فلوسایتومتری ایمونوفنوتایپ برای کمک به تشخیص و طبقهبندی سرطانهای سلولهای خونی (لوسمیها و لنفومها) و راهنمایی در درمان آنها استفاده میشود که ممکن است در پیگیری برای شمارش کامل خون (CBC) و گلبولهای سفید که تعداد لنفوسیتهای افزایش یافته، وجود سلولهای خونی نابالغ یا سایر سلولهای غیر طبیعی را نشان میدهد، استفاده شود. از ایمونوفنوتیپ جریان فلوسایتومتری نیز ممکن است با اهداف زیر استفاده شود:
- پیش بینی میزان پیشرونده بودن سرطان
- پیشبینی اینکه آیا سرطان به درمان خاصی پاسخ میدهد یا خیر.
- تعیین اینکه آیا درمان سرطان خون یا لنفوم موفقیتآمیز بوده است.
- تعیین اینکه آیا بیماری با وجود درمان باقی مانده است.
- آیا پس از درمان موفقیتآمیز، بیماری عود کرده است.
آزمایش ایمونوفلوسایتومتری چیست؟
ایمونوفلوسایتومتری تعیین ایمونوفنوتیپ با استفاده از فلوسایتومتری یک روش آزمایشگاهی است که وجود یا عدم وجود مارکرهای گلبول سفید به نام آنتیژنها را تشخیص میدهد. این آنتیژنها ساختارهای پروتئینی هستند که در گلبولهای سفید یا درون آن قرار دارند. گروههای خاصی از این آنتیژنها به طور معمول در گلبولهای سفید وجود دارند و فقط در انواع سلولهای خاص و مراحل بلوغ سلولها وجود دارند. علاوه بر این، الگوهای خاصی از آنتیژنها در سلولهای غیر طبیعی مشاهده شده در لوسمیها و لنفومها وجود دارد. ایمونوفنوتیپ فلوسایتومتری ممکن است در کمک به تشخیص، طبقهبندی، درمان و تعیین پیش آگهی این سرطانهای سلولهای خونی مفید باشد.
برای کمک به تشخیص و طبقهبندی سرطان خون یا لنفوم، کمک به درمان، پیش آگهی، شناسایی و ارزیابی سلولهای لوسمی یا لنفوم که پس از درمان یا در عود بیماری باقی ماندهاند میتوان از فلوسایتومتری کمک گرفت. هنگامی که فرد علائم و نشانههای دارد که ممکن است به دلیل سرطان خون یا لنفوم باشد از این تست استفاده میشود. همچنین برای کمک به طبقهبندی نوع سرطان خون یا لنفوم، شناسایی گزینههای درمان و پیشبینی روند احتمالی بیماری، برای ارزیابی اینکه آیا درمان مؤثر بوده است یا بیماری که پس از درمان باقی مانده یا دوباره عود کرده است را تشخیص داد.
نمونه خون وریدی برای تست فلوسایتومتری لوکمی استفاده میشود. همچنین نمونه مغز استخوان ممکن است از استخوان ران جمع شود. گاهی نمونهای از بافت مانند غده لنفاوی با استفاده از روش بیوپسی یا آسپیراسیون با سوزن ظریف (FNA) به دست میآید. نمونههای مایع بدن از طریق جمعآوری مایعات در یک ظرف یا با قرار دادن یک سوزن در حفره بدن و مکش بخشی از مایع با سرنگ به دست میآید. این تست نیاز به آمادگی قبلی ندارد.
تفسیر آزمایش ایمونوفلوسایتومتری
آسیب شناس که غالباً در مطالعه بیماریهای خونی یا سرطان سلولهای خونی (متخصص خون) متخصص است، نتایج شمارش کامل خون (CBC)، دیفرانسیل، اسمیر خون، یافتههای مغز استخوان و ایمونوفنوتیپ فلوسایتومتری را در نظر می گیرد. و همچنین آزمایشهای دیگر به منظور ارائه تفسیر تشخیصی. گزارش آزمایشگاهی معمولاً شامل نتایج خاصی از آزمایشات و همچنین تجزیه و تحلیل معنای این نتایج خواهد بود.
نشانگرها (آنتیژنها) که بر روی سلولها وجود دارند و توسط ایمونوفنوتیپ فلوسایتومتری تشخیص داده میشوند، به مشخصه سلولهای موجود کمک میکنند. یک سلول معمولی الگوی آنتیژنهایی را نشان میدهد که با نوع و بلوغ سلول ارتباط دارد. (سلولهای خونی به طور معمول در مغز استخوان بالغ می شوند و هنگامی که بالغ یا تقریباً بالغ هستند به گردش در میآیند.) نتایج حاصل از ایمونوفنوتایپینگ با الگوی آنتیژنهای سلولهای طبیعی و همچنین با الگوهای مرتبط با غیر طبیعی سلولها (به عنوان مثال، سلولهای مبتلا به لوسمی و لنفوم) مقایسه میشود.
پزشک نتایج ایمونوفنوتیپ فلوسایتومتری را همراه با سابقه بالینی، معاینه فیزیکی، علائم و نشانهها و همچنین تمام آزمایشات آزمایشگاهی برای کمک به تشخیص در نظر می گیرد. شرایط هر فرد منحصر به فرد خواهد بود. ممکن است آنتیژنهای خاصی (که معمولاً دیده میشوند) داشته باشد و با این وجود هنوز نوع خاصی از لوسمی یا لنفوم تشخیص داده شود. به عنوان مثال، کودک بزرگتر یا فرد بزرگسال به طور معمول حاوی برخی از سلولهای B بالغ است اما سلولهای B نابالغ در گردش به طور معمول وجود ندارند.
هر دو سلول B بالغ و نابالغ به طور معمول برای نشانگر CD19 مثبت هستند. سلولهای B بالغ به طور معمول برای CD20 مثبت اما CD34 مثبت نیستند. CD20 نشانگر بلوغ و CD34 نشانگر عدم بلوغ است. در واقع این دو نشانگر معمولاً با هم بیان نمیشوند. در حال حاضر، اگر یک فرد بالغ دارای تعداد کمی سلول B بالغ باشد اما تعداد زیادی سلول B نارس نیز داشته باشد که برای CD19 مثبت است (CD19 نشانگر سلول B است) و همچنین برای CD34 و CD20 مثبت است (مشخصکننده سلولهای نابالغ و غیرطبیعی هستند).
سپس فرد مبتلا به لوسمی سلولهای B نابالغ است که به لوسمی لنفوبلاستیک B معروف است. جالب است که برخی از آنتیژنهای موجود ممکن است یک زیرگونه ژنتیکی خاص از سرطان خون لنفوبلاستیک B را نشاندهند که ممکن است پیش آگهی خاصی نیز داشته باشد. از همه مهمتر، کلاسهای جدیدتری از گزینههای درمانی مانند درمان CAR-T، درگیرکنندههای سلول T اختصاصی و آنتیبادیهای مونوکلونال وجود دارد که به طور انتخابی مولکولهایی مانند CD19 یا CD20 را هدف قرار میدهند. این درمانهای جدیدتر ممکن است عوارض جانبی را در مقایسه با شیمیدرمانی معمولی کاهش دهد. درمانهای هدفمندتر جدید معمولاً به شیمیدرمانی سنتی اضافه میشوند. پروفایلهای غیر طبیعی ایمونوفنوتیپ معمولا در موارد زیر دیده میشوند:
- لوسمی میلوئید حاد لنفوبلاستیک (ALL)
- لوسمی لنفوسیتی مزمن (CLL)
- لنفومهای غیر هاچکین سلولهای T و B
- مولتیپل میلوما
نوع نمونه مورد آزمایش به تشخیص متخصص بستگی دارد. اگر سلولهای غیر طبیعی در جریان خون باشند، اغلب از نمونه خوت برای ایمونوفنوتیپ با فلوسایتومتری استفاده میشود چون جمعآوری این نمونه آسانتر و غیر تهاجمی است. اما ممکن است سلولهای لنفوم از طریق خون یا مسیر دیگری به خون راه پیدا کرده باشند و بر این اساس به نوع دیگری از نمونه گیری نیاز باشد. تشخیص لوسمی با لنفوم بر اساس بررسی بصری اسمیر خوت یا بیوپسی مغز استخوان و آسپیراسیون برای وجود انواع خاصی از سلولها کاربرد دارد.
بر اساس نتایج ایمونوفنوتایپ فلوسایتومتری، میتوان دوره درمان و میزان پاسخدهی سرطان به درمان را تخمین زد. آنتیژنهای خاص سلولهای لوسمی یا لنفوم ممکن است در طول زمان ثابت باقی بمانند. با این حال شیمیدرمانی ممکن است سلولهای غیر طبیعی را از بین ببرد و در صورت موفقیتآمیز بودن درمان، گلبولهای سفید طبیعی، جایگزین سلولهای غیر طبیعی خواهند شد.
به همین دلیلی نتایج آزمایش فلوسایتومتری بر حسب میزان جایگزین شدن سلولهای سالم، متفاوت خواهد بود. گاهی سلولهای سرطانی به دلیل عدم بیان آنتیژنی که قبلا توسط آنتیبادی مونوکلونال یا درمانهای دیگری مانند CAR- T CELL (کار-تی سل) مورد هدف قرار میگرفتند، با درمان سازگاری پیدا میکنند.
آزمایش نقص ایمنی اولیه با فلوسایتومتری
فلوسایتومتری میتواند اطلاعاتی مانند بیان سیتوکین و فعالسازی مسیر سیگنالینگ و همچنین وجود یا عدم وجود سلولهای سیستم ایمنی در شرایط مورد نیاز را ارائه کند. فلوسایتومتری مونوسیت، روشی جایگزین برای تشخیص آغاز روند اختلال نقص ایمنی اولیه (PIDs) است. در این آزمایش غلظت سیتوکینها بر روی الایزا یا تیتر ویروسی تعیین میشود.
این روش خصوصا برای بیمارانی که مبتلا به انواعی از بیماری با وضعیت نامشخص (VUS) هستند، مفید است. VUS واریانتهای ژنی هستند که با آزمایشات ژنتیکی قابل تشخیص هستند اما اثرات نامشخصی بر سلامتی دارند. به دلیل عدم وجود سنجشهای عملکردی معتبرتری برای نقص ایمنی وجود نداشته باشند، فلوسایتومتری ابزاری ارزشمند است.
آزمایش فلوسایتومتری سرطان خون
متخصص پاتولوژی (آسیبشناس)، اونکولوژیست یا هماتولوژیست، نتایج حاصل از شمارش کامل خون (CBC)، یافتههای مغز استخوان و ایمونوفنوتیپ فلوسایتومتری و سایر آزمایشات به منظور ارائه تفسیر تشخیصی را در نظر میگیرد. یک گزارش آزمایشگاهی معمولاً شامل نتایج خاصی از آزمایشات و همچنین تجزیه و تحلیل معنای این نتایج است. مارکرها (آنتیژنها) که در سلولها وجود دارد و توسط ایمونوفنوتیپ جریان فلوسایتومتری شناسایی میشود، به مشخصه سلولهای موجود کمک میکند.
سلول طبیعی الگویی از آنتیژنها را نشان میدهد که با نوع و بلوغ سلول ارتباط دارند. سلولهای خونی به طور معمول در مغز استخوان بالغ و پس از آن در جریان خون آزاد میشوند. نتایج حاصل از ایمونوفنوتیپ با الگوی آنتیژنهای سلولهای طبیعی و همچنین با الگوهایی که با غیرطبیعی همراه هستند مقایسه میشود. سلولها (به عنوان مثال، سلولهای دارای لوسمی و لنفوم). پزشک مراقبتهای بهداشتی نتایج ایمونوفنوتیپ فلوسایتومتری را به همراه سابقه بالینی، معاینه فیزیکی، علائم و نشانهها و همچنین تمام آزمایشات آزمایشگاهی برای کمک به تشخیص در نظر میگیرد.
شرایط هر فرد منحصر به فرد خواهد بود. ممکن است آنتیژنهای خاصی داشته باشید که به طور معمول دیده میشود، اما هنوز هم ممکن است نوع خاصی از سرطان خون یا لنفوم تشخیص داده شود. در اینجا یک مثال آورده شده است: خون کودک بزرگتر یا بزرگسال به طور معمول حاوی برخی از سلولهای B بالغ است، اما سلولهای B نابالغ در گردش خون به طور معمول وجود ندارند. هر دو سلول B بالغ و نابالغ به طور معمول برای نشانگر CD19 مثبت هستند. سلولهای B بالغ به طور معمول برای CD20 مثبت هستند اما CD34 نیستند. CD20 نشانگر بلوغ و CD34 نشانگر بلوغ است. در واقع، این دو نشانگر به طور معمول با هم بیان نمیشوند.

اگر یک فرد بالغ دارای تعداد کمی سلول B بالغ باشد اما تعداد زیادی سلول B نابالغ نیز داشته باشد که برای CD19 مثبت هستند (به یاد داشته باشید، CD19 نشانگر سلول B است) و همچنین برای CD34 و CD20 نیز مثبت است (که شناسایی میکند این سلولها هر دو نابالغ و غیرطبیعی هستند)، بنابراین فرد مبتلا به لوسمی سلول B نابالغ است که به عنوان لوسمی لنفوبلاستیک B شناخته میشود. جالب اینجاست که برخی دیگر از آنتیژنهای موجود ممکن است یک نوع خاص ژنتیکی از سرطان خون B- لنفوبلاستیک را پیشنهاد دهند، که ممکن است پیشآگهی خاصی نیز داشته باشد.
از همه مهمتر، کلاسهای جدیدی از گزینه های درمانی مانند CAR-T Cell درمانی، گیرندههای سلول T خاص و آنتیبادیهای مونوکلونال وجود دارد که مولکولهایی مانند CD19 یا CD20 را انتخاب میکنند. این روشهای درمانی جدید ممکن است در مقایسه با شیمی درمانی معمولی عوارض جانبی کاهش دهند (درمانهای هدفمند جدید معمولاً به شیمی درمانی سنتی اضافه میشوند). پروفایل های ایمونوفنوتیپ غیرطبیعی معمولاً در موارد زیر وجود دارد:
- سرطان خون حاد میلوئیدی سرطان خون حاد لنفوبلاستیک (ALL)
- لوسمی لنفوسیتی مزمن (CLL)
- لنفوم های غیر هوچکین سلول B و سلول T
- مولتیپل میلوما
فلوسایتومتری خون محیطی چیست؟
کاربرد آزمایش فلوسایتومتری در تحقیقات خونشناسی (هماتولوژی) رو به گسترش است و با کمک آن میتوان اطلاعات کمی و کیفی فراوانی در مورد پروتئینها و گلیکوپروتئینهای سطحی گلبولهای قرمز، لکوسیتها و پلاکتها به دست آورد. در ادامه انواع کاربردهای این تکنیک در خونشناسی توضیح داده شدهاند.
آزمایش فلوسایتومتری بیماری رزوس
یکی از کاربردهای مهم و رایج آزمایش فلوسایتومتری، بررسی گلبولهای قرمز جنین در دوران بارداری است. از فلوسایتومتری اغلب برای تشخیص رزوس (Rhesus) در زنان باردار استفاده میشود. آنتیژن رزیس (RH) بخشی از یک مجموعه پروتئینی است که بر روی RHهای غشای گلبولهای قرمز بیان میشوند و در حفظ یکپارچگی غشای این سلولها نقش دارند. برای تشخیص بیماری رزوس آنتیبادیهای حاوری مارک و همچنین آنهایی که علیه هموگلوبین F هستند میتوانند با فلوسایتومتری ترکیب شوند.
این روش نسبت به آزمایش Kleihauer - Betke ارجحیت دارد چون در تشخیص گلبولهای قرمز جنینی و بالغ و جداسازی آنها بر اساس مقادیر اندک هموگلوبین F، دقیقتر و حساستر است.
شمارش گلبول های قرمز با فلوسایتومتری
تجزیه و تحلیل سیتومتری فعال فلورسنت (FACS) گلبولهای قرمز (رتیکولوسیتها) توسط تیازول نارنجی (TO) یک روش سریع، نسبتاً ساده و دقیق برای شمارش رتیکولوسیتها است. روش خودکار 10000 سلول یا بیشتر در مقابل 1000 سلول شمارش شده توسط روش دستی را شمارش میکند. شمارش گلبولهای قرمز فعالیت تولید گلبولهای قرمز در مغز استخوان را نشان میدهد. تفسیر این آزمایش در کنار سایر نتایج آزمایش مانند شمارش گلبولهای قرمز یا هماتوکریت، انجام میشود. نتایج این آزمون نباید به تنهایی تفسیر شود. هر دو مقادیر کم و زیاد بسته به شرایط میتوانند خوب یا نشاندهنده مشکل باشند.
ارزیابی شکل گلبول قرمز با فلوسایتومتری
غشای گلبول قرمز نقش مهمی در تغییر شکل سلول دارد، فرایندی که برای تبادل اکسیژن در گلبولهای قرمز بالغ ضروری است. این فرایند تحت تأثیر انواع ویژگیهای سلولی از جمله هندسه سلولی و ویسکوزیته سیتوپلاسم قرار دارد. بیماریهایی مانند دیابت، نارسایی کلیه، سپسیس (عفونت خون) و باعث میشود گلبولهای قرمز حالت کرویتری نسبت به گلبولهای قرمز داسی و بیمار داشته باشند.فلوسایتومتری با تشخیص هر نوع تغییر شکل در گلبولهای قرمز، احتمال ابتلا به بیماری و مکانیسمهای ایجاد انواع بیماریها را ارزیابی میکند.
آزمایش فلوسایتومتری گلبول های سفید
یکی از انواع جدید فلوسایتومتری، فلوسایتومتری مقایسه ای است که با ترکیبی از ۵ معرف، ۶ آنتیبادی و یک الگوریتم اتوماتیک برای تمایز ۱۸ جمعیت از گلبولهای سفید مانند بلاستسلها، ایمونوگلوبولینها و لنفوسیت کاربرد دارد. در این روش با قابلیت شمارش بیست هزا گلبول سفید، توانایی بالایی در مقایسه دقیق و سریعتر نسبت به شمارش دستی دارد. حساسیت بالا، اختصاصی بودن و سرعت این تکنیک منجر به کاربردهای بالینی آن در تشخیص و غربالگری لوکوپنیا، سپسیس یا متاستاز در انواع سرطان شده است.
آزمایش فلوسایتومتری پلاکت خون
بررسی وضعیت پلاکتها با استفاده از فلوسایتومتری را میتوان از هر دو روش مستقیم و غیر مستقیم آزمایشات ایمونوگلوبولین وابسته به پلاکت انجام داد. آزمایش فلوسایتومتری نقش اساسی در تشخیص پورپوریای ترومبوایمونوسیتوپنی ایمنی (ITP) دارد که یک اختلال ژنتیکی ناشی از افزایش تجمع پلاکتها است.
به دلیل کوچک بودن نسبی، بی رنگ بودن و مقدار کمتر پلاکتها در مقایسه با سایر سلولهای خونی، شمارش و تعیین ویژگیهای آنها خصوصا در بیماران ITP اغلب مشکل است. به همین دلیل فلوسایتومتری روشی با حساسیت بالا برای شمارش پلاکتها و تشخیص ایمونوگلوبولین G وابسته به پلاکت (PAIgm) است که یک مارکر تشخیصی برای کودکان مبتلا به بیماری ITP محسوب میشود.
آزمایش فلوسایتومتری ایدز
یکی از علائم اولیه و استانداردهای طلایی در تشخیص بیماری ایدز، تعداد جمعیتهای لنفوسیت CD4+ T (در کنار میزان لود ویروس HIV) هستند و نقش مؤثری در نظارت بر درمانهای ویروسی افراد مبتلا دارند. از آنجایی که یکی از کاربردهای این تکنیک شمارش لنفوسیتها و بررسی آنتیژنهای سطحی است، فلوسایتومتری در مرحلهبندی افراد آلوده به ویروس HIV علامتدار یا بدون علامت کاربرد دارد. از نتایج آزمایش فلوسایتومتری خون این افراد میتوان برای تعیین مناسب بودن درمان با داروهای ضد ویروس، بررسی اثربخش بودن داروها و میزان پیشرفت بیماری استفاده کرد.
فلوسایتومتری کراس مچ چیست؟
پیش از توضیح درباره این روش توضیح مختصری درباره HLA مورد نیاز است. پروتئینهای آنتیژن لکوسیت انسانی (HLA)، یکی از اجزای سیستم ایمنی بدن هستند که در مقابل مواد خارجی مضر و بافت پیوندی پاسخ ایجاد میکنند. برخی از این پروتئینها در سطح تمام سلولهای بدن و برخی فقط به عنوان آنتیژنهای سطحی سلولهای سیستم ایمنی بیان میشوند.
آزمایش فلوسایتومتری کراس مچ (Flow Cytometry Cross-Matching) (FCXM) شامل مخلوط کردن لنفوسیتهای اهدایی، سرم ایمنی دریافتکننده و آنتیبادیهای فلورسنت در یک نمونه است. آنتیبادیهای مورد استفاده برای HLA دهنده و مارکرهای انواعی از سلولهای B و T (مثلا CD3 ،CD۵ و CD۸ برای سلولهای لنفوسیت T و CD۲۰ ،CD۱۹ و CD۲۱ برای سلولهای B) اختصاصی هستند. نمونه از طریق یک سیتومتر اندازهگیری میشود، بنابراین لنفوسیتها میتوانند با آنتیبادیهای سرم اختصاصی HLA گیرنده پیوند ارتباط ایجاد کنند.
اگر آنتیبادی دهنده در سرم وجود داشته باشد، به لنفوسیتهای فرد دهنده متصل خواهند شد که به آنتیبادیهای فلورسنت اجازه اتصال میدهد و به نوبه خود یک تطابق مثبت ایجاد میکند. یکی از مزایای فلوسایتومتری کراس ریچ قبل از انجام پیوند اعضا، مغز استخوان یا سلول بنیادی است. یکی از مشکلات پیوند آلوگرافت (نوعی پیوند مغز استخوان) رد پیوند است که ناشی از تولید آنتیبادی در بدن فرد گیرنده، علیه HLA فرد دهنده، ایجاد میشود و منجر به یک پاسخ ایمنی خواهد شد که در صورت افزایش FCXM، میتواند به رد پیوند بینجامد.
چون FCXM مثبت با افزایش احتمل رد پیوند ارتباط دارد، FCXM مهم است چون با استفاده از این روش میتوان آنتیژنهای دهنده و آنتیبادیهای میزبان را قبل از انجام پیوند بررسی نمود و احتمال هرگونه رد پیوند آلوگرافت را کاهش داد. طی فلوسایتومتری، آنتیبادیهایی مورد استفاده میتوانند به صورت غیر اختصاصی اتصال ایجاد کنند و بنابراین نتایج غیر قابل اطمینان باشند. این مسئله ممکن است ناشی از میانکنشهای بین پروتئینی و بین گلیکولیپیدها، میانکنشهای الکترواستاتیک و اتصال به گیرندههای فلوسایتومتری باشد.
استفاده از یک ماده، پیش از دایجسشن (هضم)، میتواند شانس اتصال غیر اختصاصی را کاهش دهد، که باعث بیشتر شدن حساسیت و اطمینان آنالیز خواهد بود. در نهایت ترکیب سایر تکنیکهای آنالیتیک (مانند جذب سرمی) با FXCM هم میتواند نرخ منفی کاذب را کاهش دهد.
بررسی پاسخ سیستم ایمنی به ویروس کرونا با فلوسایتومتری
بیماری کرونا (COVID-19) ناشی از سندرم تنفسی حاد ویروس کرونا نوع ۲ (SARS-CoV-2) پس از گذشت یک سال و نیم همچنان میلیونها نفر را در سرتاسر جهان مبتلا کرده و بسیاری در اثر ابتلا به آن جان خود را از دست میدهند. طی این مدت چندین مطالعه پژوهشی از تکنیک فلوسایتومتری برای بررسی نحوه واکنش سیستم ایمنی بدن به این ویروس استفاده کردند. این تحقیقات نشان دادهاند که عدم تنظیم سیستم ایمنی با بیماریزایی کویید ۱۹ در ارتباط است.
در یکی از این پژوهشها، سه دسته از بزرگسالان شامل بهبودیافتگان از کرونا، افراد مبتلا به کرونا که در بیمارستان بستری بودند و افراد سالم مورد بررسی قرار گرفتند.فلوسایتومتری خون محیطی این افراد نشان داد که بیماران بستری در مقایسه با افراد بهبود یافته و افراد سالم، کاهش فرکانس سلولهای B و T را نشان دادند. اگرچه این نتیجه ممکن است ناشی از افزایش انواع دیگر سلولهایی باشد که در بیماران کرونایی دیده میشود اما بیشتر به دلیل کاهش این دو نوع سلول است.
تجزیه و تحلیل بیشتر دادههای شمارش سلولها نشان داد که سطح سلولهای TCD8 در مقایسه با سلولهای TCD4 کاهش یافته است که مطابق با یافتههای قبلی مبنی بر کاهش لنفوسیت در افراد مبتلا به کرونا است. همچنین پاسخ ایمنی بیماران بهبود یافته و افراد سالم با بیماران در «تجزیه و تحلیل مؤلفهها» (PCA) متفاوت بود. در این پژوهش با استفاده از فلوسایتومتری بررسی کردند که آیا با بررسی تفاوت در سلولهای تکهستهای خون محیطی، میتوان افرادی را که احتمال ابتلای مزمن به کرونا دارند را شناسایی کرد یا خیر.
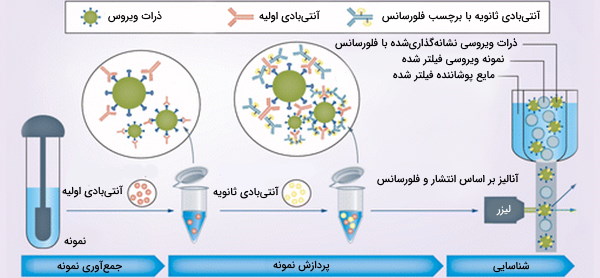
تست فلوسایتومتری چقدر طول میکشد؟
این آزمایش تقریباً سه ساعت طول میکشد و شامل رنگآمیزی سلولها، به دست آوردن سلولها روی یک دستگاه و سپس یک تکنسین ماهر است که نتایج ذخیره شده در یک پرونده رایانه را تجزیه و تحلیل کند. Flow Leads ،Fellows و شرکتکنندگان این نتایج را بررسی و تفسیر میکنند تا بیماران و پزشکان دقیقترین ارزیابی بیماری را ارائه دهند. در بیشتر موارد، ظرف چند ساعت به درستی تشخیص انجام میشود. دریافت نتایج آزمایش احتمالاً چند روز یا بیشتر طول خواهد کشید. پس از آزمایش مغز استخوان، باید از خیس شدن محل باند یا محل آزمایش به مدت 24 ساعت خودداری شود.
خطرات فلوسایتومتری فقط مربوط به جمعآوری نمونه هستند که به نوعه نمونه مورد استفاده بستگی دارد. جمعآوری نمونه خون یا منی نسبتا آسان و غیر تهاجمی است. در مقابل، نمونه مغز استخوان یا بافت دشوارتر هستند و ممکن است ریسکهایی داشته باشند اما خطرناک نیستند. کبودی، خونریزی، عفونت یا واکنش نسبت به بیهوشی از عوارض نادر اسپیراسیون مغز استخوان و بیوپسی هستند. به همین دلایل قبل از این نوع نمونهگیری، متخصص ابتدا نمونه خون را تجویز میکند و در صورتی که بررسی دقیقتری نیاز باید نمونه بافت یا مغز استخوان انجام میشوند.
نمونهگیری از مغز استخوان مجموعا حدود ۳ ساعت زمان لازم دارد و با بیحسی موضعی یا بیهوشی انجام میشود. بعد از نمونهگیری فقط تا رفع اثرات بیهوشی نیاز به ماندن در بیمارستان هست. زمان نمونهبرداری از بافت هم بستگی به نوع بافت دارد. بعد از ترخیص از بیمارستان، در صورت تب، خونریزی مدام، درد یا تغییر میزان درد، تورم محل بیوپسی و قرمزی یا چرک کردن ناحیه انجام بیوپسی باید به پزشک مراجعه کرد.