عنصر سیلیکون و کاربردهای آن — از صفر تا صد
سیلیکون یا سیلیسیم، عنصری شیمیایی با نماد Si در جدول تناوبی و عدد اتمی ۱۴ است که به عنوان نیمههادی نیز کاربرد دارد. این عنصر در دسته شبه فلزات قرار میگیرد و به صورت چهار ظرفیتی دیده میشود و رنگ آبی-خاکستری براقی دارد. در گروه ۱۴ جدول تناوبی، عنصر کربن در بالا و عناصر ژرمانیوم، قلع و سرب نیز در پایین آن قرار دارند. با توجه به تمایل بسیار زیاد این عنصر به اکسیژن، شکل خالص آن تا سال 1823 شناخته نشد. نقطه ذوب و جوش این عنصر به ترتیب 1414 و 3265 درجه سانتیگراد است.
سیلیکون، هشتمین عنصر فراوان در زمین به لحاظ جرمی محسوب میشود که به ندرت به شکل عنصری آن در پوسته زمین قابل مشاهده است. بیشتر سیلیکونی که به صورت تجاری به مصرف میرسد، به میزان بسیار کمی تحت فرآوری قرار میگیرد. اواخر قرن بیستم و اویل قرن ۲۱ را به نام عصر سیلیکون (عصر دیجیتال) میشناسند. چراکه این عنصر، تاثیر زیادی بر اقتصاد مدرن داشته است. نسبت کمی از سیلیکون با خلوص بسیار بالا را در نیمههادیها مورد استفاده قرار میدهند و همچنین در ساخت ترانزیستورها و چیپهای مدارات مجتمع موجود در کامپیوترها و تلفنهای همراه از این ماده بهره میگیرند.
بیشترین کاربرد این عنصر را میتوان در «ماسفت» (MOSFET) دید که بیش از هر دستگاه دیگری در تاریخ، ساخته و تولید شده است. این عنصر در فرآوری فولاد، آلومینیوم و صنایع شیمیایی، کاربردهای بسیاری دارد.

تاریخچه استفاده از سیلیکون
به دلیل فراوانی این عنصر در پوسته زمین، مواد ساخته شده از سیلیکون، از هزاران سال پیش مورد استفاده قرار میگرفتند. بلورهای سیلیکونی در بسیاری از تمدنهای باستان خاصه در مصر، مادهای شناخته شده به شمار میآمد که در ساخت زیورآلات و کوزهها مورد استفاه قرار میگرفت.
در ۱۵۰۰ سال قبل از میلاد، ساخت شیشههای حاوی سیلیکا نزد مصریها و فنیقیها کاربرد داشته است. در ساخت خانهها نیز از ترکیبات طبیعی سیلیکات به عنوان ملات استفاده میشد.
کشف سیلیکون
در سال ۱۷۸۷، «آنتوان لاوازیه» (Antoine Lavoisier) به این نتیجه رسید که ممکن است سیلیکا، اکسیدی از یک عنصر خالص باشد اما به دلیل میل ترکیبی زیاد این عنصر با اکسیژن، ابزاری برای کاهش و جداسازی آن نداشت. بعد از تلاشهایی که برای جداسازی این عنصر انجام شد، «سر همفری دیوی» (Sir Humphry Davy) نام سیلیسیم را در سال 1808 برای آن پیشنهاد داد که از ریشهای لاتین به معنی سنگ چخماق گرفته شده بود.
«گیلوساک» (Gay-Lussac) و «تنارد» (Thenard)، سیلیکون ناخالص آمورف را در سال 181۱ تهیه کردند اما توانایی خالصسازی آن و شناسایی آن به عنوان یک عنصر خالص را نداشتند. نام امروزی سیلیکون توسط شیمیدان اسکاتلندی به نام «توماس تامسون» (Thomas Thomson) انتخاب شد. او نام انتخابی همفری دیوی را به همراه پسوند «-ون» انتخاب کرد چراکه اعتقاد داشت عنصر کشف شده، نوعی نافلز همچون بور و کربن است.
در نهایت، در سال 1823، «یوهان یاکوب برسیلیوس» (Jöns Jacob Berzelius)، سیلیکون آمورف را با همان روش گیلوساک به تولید رساند اما آن را به صورت پودر خالص قهوهای رنگی تبدیل کرد و امروزه، برسیلیوس را به عنوان کاشف این عنصر میشناسند. شکل بلوری سیلیکون را ۳۱ سال بعد، شیمیدانی فرانسوی به نام «دویل» (Deville)، از طریق الکترولیز مخلوط سدیم کلرید و آلومینیوم کلرید تولید کرد.
در اوایل دهه 1920، کارهای «ویلیام لورنس براگ» (William Lawrence Bragg) بر بلورشناسی اشعه ایکس، ترکیبات سیلیکاتها را مشخص کرد. در اواسط قرن بیستم، استفاده از پلیمرهای سیلیکونی، الاستومرها و رزینها گسترش یافت.

سیلیکون به عنوان نیمههادی
همانطور که در بالا نیز به آن اشاره شد، بکارگیری سیلیکون به هنگام تهیه ملات در ساختمانسازی تا تولید ترانزیستورها رواج دارد. در حقیقت، ترانزیستورها را میتوان در تمامی مدارهای الکترونیکی اعم از رادیوها تا موبایلهای هوشمند، مشاهده کرد. نیمههادیهای ابتدایی از سرب (II) سولفید به جای سیلیکون استفاده میکردند. در نهایت، با تلاشهایی که توسط دانشمندان مختلف صورت گرفت، تولید و معرفی اولین سری از ترانزیستورهای سیلیکونی موسوم به ماسفت توسط دانشمند مصری، «محمد محمد عطا الله» (Mohamed M.Atalla) توسعه داده شد.
عصر سیلیکون
عصر سیلیکون به اواخر قرن بیستم و اوایل قرن ۲۱ میلادی اشاره دارد چراکه در این دوره، سیلیکون، ماده اصلی در صنایع تولیدی محسوب میشد. در حقیقت، این دوره زمانی که به عصر دیجیتال هم معروف است، همچون عصر سنگ، آهن و برنز نامگذاری شده است. تولید انبوه ماسفتها و کاهش اندازه این ماسفتها با سرعتی نمایی، سبب بوجود آمدن انقلاب تکنولوژی، اقتصادی و فرهنگی شد. لازم به ذکر است که بیشترین وسیلهای که در تاریخ تولید شده، متعلق به همین قطعه است.
از آنجایی که سیلیکون در دستگاههای نیمههادی با فناوری بسیار مدرن یا «هایتک» (High-Tech)، از عناصر مهم به شمار میآید، مکانهای بسیاری در دنیا از این نام بهره میگیرند. به طور مثال، «خیابان سانتا کلارا» (Santa Clara Valley) در کالیفرنیا، نام مستعار «سیلیکون ولی» (Silicon Valley) را به خود اختصاص داده چراکه بیشتر صنعت هایتک دنیا، در این مکان جمعآوری شده است.
سیلیکون تنها نیمههادی در زمین و حتی بهترین نمونه آن هم نیست اما فراوانترین نمونه به شمار میآید به گونهای که در تمام دنیا در دسترس قرار دارد. کار کردن با این ماده بسیار ساده است و دانشمندان، راههای مختلفی پیدا کردهاند که به کمک آنها، بلورهای منظمی از سیلیکون را تهیه میکنند. در حال حاضر، بلورهای سیلیکون (شمش) را در سیلندرهایی با قطر ۳۰۰ میلیمتر میسازند و با تحقیقات جدید، این قطر به 450 میلیمتر رسیده است که با این کار، هزینه تولید کاهش پیدا میکند و به دنبال آن، برای حدود یک دهه یا بیشتر، سرعت پیشرفت تکنولوژی حفظ خواهد شد.

شاخصههای فیزیکی و اتمی در سیلیکون
اتم سیلیکون دارای ۱۴ الکترون با آرایش الکترونی $$[\mathrm{Ne}] 3 \mathrm{s}^{2} 3 \mathrm{p}^{2}$$ است. از آنجایی که این اتم، چهار الکترون ظرفیت (والانس) دارد، از طریق تشکیل اوربیتال $$sp^3$$ هیبرید و مولکولی با شکل چهاروجهی، با رعایت قانون اکتت، به آرایش گاز نجیب آرگون میرسد. چهار انرژی یونش این اتم به ترتیب با 786/3، 1576/5، 3228/3 و 4354/4 کیلوژول بر مول ذکر میشوند.
در شرایط دما و فشار استاندارد (STP)، این نیمههادی، جلایی فلزی به رنگ آبی-خاکستری دارد و با افزایش دما، مقاومت الکتریکی آن کاهش پیدا میکند. این ماده در ساختارهای عظیم کووالانسی و در شرایط استاندارد متبلور میشود. این تبلور در یک «ساختار الماسشکل» (Diamind Cubic Lattice) بوقوع میپیوندد. از آنجایی که نیروهای بسیار زیادی برای شکستن پیوندهای کووالانسی در این ماده مورد نیاز است، در نتیجه، سیلیکون، نقطه ذوب بسیار بالایی (1414 درجه سانتیگراد) خواهد داشت. از جمله روندهایی که در این عنصر دیده میشود، افزایش عدد کوئوردیناسی با فشار است.
ایزوتوپهای سیلیکون
سیلیکون طبیعی، از سه ایزوتوپ پایدار تشکیل شده ($$^ {2 8} S i$$، $$^ {2 9} S i$$ و $$^ {3 0} S i$$) و لازم به ذکر است که ایزوتوپهای شناخته شده این عنصر، عدد جرمی بین 22-44 دارند.
واکنشهای سیلیکون
در ادامه قصد داریم تا واکنشهای سیلیکون با سایر مواد شیمیایی را مورد بررسی قرار دهیم.
واکنش سیلیکون با هوا
زمانی که تودهای سیلیکونی در معرض هوا قرار بگیرد، لایهای محافظ از جنس دیاکسید سیلیکون $$(SiO_2)$$ روی سطح آن قرار میگیرد. تحت شرایط معمول و بعد از تشکیل این لایه، سیلیکون با هوا وارد واکنش نخواهد شد. اگر این توده بیش از ۹۰۰ درجه سانتیگراد حرارت ببیند، با اکسیژن برای تولید $$SiO_2$$ وارد واکنش میشود.
$$\mathrm{S i}(\mathrm{s})+\mathrm{ O}_{ 2}(\mathrm{ g}) \stackrel{\Delta}{\longrightarrow} \mathrm{S i O}_{2}(\mathrm{s})$$
با ادامه حرارت و افزایش دمای واکنش به 1400 درجه سانتیگراد، سیلیکون با نیتروژن موجود در هوا نیز طبق واکنشهای زیر، $$SiN$$ و $$Si _ 3 N _ 4$$ تولید میکند:
$$\begin{array}{l}
{2 \mathrm{Si}(\mathrm{s})+\mathrm{N}_{2}(\mathrm{g}) \stackrel{\Delta}{\longrightarrow} 2 \mathrm{SiN}(\mathrm{s})} \\
{3 \mathrm{Si}(\mathrm{s})+2 \mathrm{N}_{2}(\mathrm{g}) \longrightarrow \mathrm{Si}_{3} \mathrm{N}_{4}(\mathrm{s})}
\end{array}$$
واکنش سیلیکون با آب
با تشکیل لایه نازک دیاکسید سیلیکون بر روی توده سیلیکونی، این ماده در برابر واکنش با آب و بخار آب مقاوم میشود.
واکنش سیلیکون با هالوژنها
این ماده به شدت با تمامی هالوژنها برای تولید تترا هالیدهای سیلیکون، وارد واکنش میشود. واکنش این ماده با فلوئور، در درمای اتاق صورت میگیرد اما واکنش با سایر هالوژنها نیاز به حرارت بالای ۳۰۰ درجه سانتیگراد دارد. این واکنشها در ادامه آمدهاند:
$$\begin{aligned}
&\mathrm{S i}(\mathrm{s})+2 \mathrm{F}_{2}(\mathrm{I}) \rightarrow \mathrm{Si F}_{4}(\mathrm{g})\\
&\mathrm{Si}(\mathrm{s})+2 \mathrm{Cl}_{2}(\mathrm{I}) \rightarrow \mathrm{Si Cl}_{4}(\mathrm{g})\\
&\mathrm{Si}(\mathrm{s})+2 \mathrm{B r}_{2}(\mathrm{I}) \rightarrow \mathrm{Si B r}_{4}(\mathrm{I})\\
&\mathrm{Si}(\mathrm{s})+2 \mathrm{I}_{2}(\mathrm{I}) \rightarrow \mathrm{Si l}_{4}(\mathrm{s})
\end{aligned}$$
واکنش سیلیکون با اسیدها
سیلیکون در شرایط عادی با بیشتر اسیدها وارد واکنش نمیشود اما در هیدروفلوریک اسید (HF)، حل خواهد شد. این انحلال بیشتر به دلیل تشکیل کمپلکس $$\left[\mathrm{Si F}_{6}\right]^{2-}$$ به عنوان نوعی نیروی محرکه است که واکنش تعادلی آن را در زیر مشاهده میکنید:
$$\mathrm{Si}(\mathrm{s})+6 \mathrm{HF}(\mathrm{aq}) \rightleftharpoons\left[\mathrm{Si F}_{6}\right]^{2-}(\mathrm{a q})+2 \mathrm{H}^{+}(\mathrm{a q})+2 \mathrm{H}_{2}(\mathrm{g})$$
واکنش سیلیکون با بازها
در واکنش با محلولهای قلیایی داغ، یون سیلیکات تشکیل میشود:
$$\mathrm { S i } (\mathrm { s } ) + 2 \mathrm { O H } ^ {- }( \mathrm { a q } ) \longrightarrow \mathrm { S i O} _ { 3} ^ { 2 - } (\mathrm { a q } ) + 2 \mathrm{ H } _ { 2 } (\mathrm{ g } )$$
تولید سیلیکون
سیلیکون با خلوص 96-99 درصد را از طریق فرآیند کاهش کوارتزیت یا ماسه به همراه کُک با خلوص بالا تولید میکنند. این فرآیند کاهشی در یک کوره قوس الکتریکی با مقدار اضافی $$SiO_2$$ انجام خواهد شد تا از تجمع سیلیکون کاربید $$(SiC)$$ جلوگیری شود.
$$\begin{array}{l}
{\mathrm{SiO}_{2}+2 \mathrm{C} \rightarrow \mathrm{Si}+2 \mathrm{CO}} \\
{2 \mathrm{SiC}+\mathrm{SiO}_{2} \rightarrow 3 \mathrm{Si}+2 \mathrm{CO}}
\end{array}$$
واکنش بالا در حضور ضایعات آهن و مقادیر کمی از گوگرد و فسفر انجام میشود که در نهایت به تولید فروسیلیکون منجر خواهد شد. فروسیلیکون، آلیاژی از آهن و سیلیکون است که نسبتهای متفاوتی از آهن و سیلیکون را شامل میشود و در حدود ۸۰ درصد تولید سالانه سیلیکون در دنیا را به خود اختصاص داده است. از فروسیلیکون به طور عمده در صنعت آهن و فولاد بهره میگیرند.
واکنشی دیگری که به طور معمول در تولید این ماده دخالت دارد، فرآیند کاهشی «آلومینوترمال» دیاکسید سیلیکون است:
$$3 \mathrm{SiO}_{2}+4 \mathrm{Al} \rightarrow 3 \mathrm{Si}+2 \mathrm{Al}_{2} \mathrm{O}_{3}$$
شستشوی پودر سیلیکون با خلوص ۹۶-۹۷ درصد به کمک آب، سیلیکون با خلوص 98/5 درصد بدست میدهد که در صنایع شیمیایی مورد استفاده قرار میگیرد. البته برای استفاده از این ماده به عنوان نیمههادی، خلوص بالاتری مورد نیاز است. این مورد نیز به کمک کاهش سیلیکون تتراکلرید یا تریکلروسیلان با فرمول $$HCl_3Si$$ صورت میگیرد. ترکیبات حاصل از این دو واکنش، فرار هستند و در نتیجه به کمک تقطیر جز به جز میتوان آنها را خالصسازی کرد.
تولید پلیمر سیلیکونی
به طور خلاصه، تولید پلیمر سیلیکون، از سیلیکون خالص، شامل سه مرحله کلی است:
- سنتز کلروسیلانها
- هیدرولیز کلروسیلانها
- پلیمریزاسیون تراکمی
سنتز کلروسیلانها
سیلیکون را در ابتدا به کلروسیلانها یعنی ترکیباتی با فرمول $$R S i Cl _ 3$$ ،$$R _ 2 S i Cl _ 2$$ و $$R _ 3 S i Cl $$ تبدیل میکنند. زمانی که کلرومتان از میان سیلیکون در دمایی حدود 276 درجه سانتیگراد عبور میکند، در حضور کاتالیزور مس، مخلوطی فرار از کلروسیلانها بدست میآید که تقطیر میشوند. به طور مثال خواهیم داشت:
$$\mathrm{Si}(\mathrm{s})+2 \mathrm{CH}_{3} \mathrm{Cl}(\mathrm{g}) \longrightarrow\left(\mathrm{CH}_{3}\right)_{2} \mathrm{SiCl}_{2}(\mathrm{g})$$
مخلوط حاصل، شامل این سه ترکیب است:
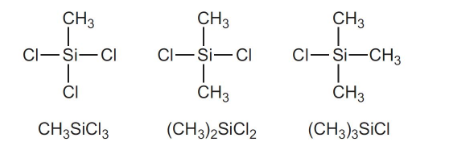
با تقطیر مناسب مخلوط حاصل، کسرهای خالص از کلروسیلانها بدست میآیند. در این میان، فرآورده اصلی، دیمتیل کلروسیلان است. به این ترتیب، سنتز کلروسیلانها انجام میشود.
هیدرولیز کلروسیلانها
دیکلروسیلان را به مولکولی با ۲ گروه هیدروکسیل، هیدرولیز میکنند.

فرآورده نهایی موسوم به «دیسیلانول» (Disilanol) است. گروههای هیدروکسیل سیلانولها به طور خودبهخودی، در اثر واکنش به «سیلوگزان» (Siloxane) تبدیل میشوند:
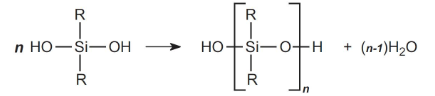
در تصویر بالا، اگر R یک گروه متیل باشد، پلیمر حاصل، پلی دیمتیل سیلوگزان است. این ماده با مقادیر $$n$$ از ۲۰-۵۰ به تولید میرسد که طول مناسبی برای ترکیبات سیلیکونی نیست. این نوع از پلیمرهای کوتاه، موسوم به «اولیگومر» (Oligomer) هستند. در این میان، پلیمرهای حلقوی همچون $$\left(\left(\mathrm{CH}_{3}\right)_{2} \mathrm{SiO}\right)_{4}$$ نیز به تولید میرسند که جداسازی میشوند.
هیدروکلریک اسید تولیدی هم بازیافت میشود تا در اثر واکنش با متانول، کلرومتان تولید کند تا از آن در هیدرولیز کلروسیلانها استفاده شود.
$$\mathrm{CH}_{3} \mathrm{OH}+\mathrm{HCl} \longrightarrow \mathrm{CH}_{3} \mathrm{Cl}+\mathrm{H}_{2} \mathrm{O}$$
پلیمریزاسیون تراکمی
اولیگومرها در حضور کاتالیزور اسیدی، به سرعت متراکم میشوند تا پلیمرهای زنجیره بلند را تولید کنند:
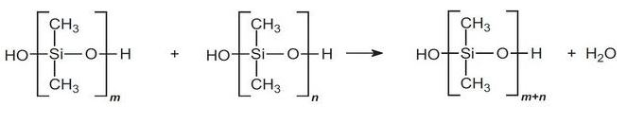
مقدار عبارت $$(m + n)$$ به طور معمول بین 2000 تا 4000 ذکر میشود. تولید زنجیرههای طویل سیلیکونی، در صورت کار در شرایط خلا و حذف آب، مناسبتر است.
کاربردهای سیلیکون
سیلیکون از جمله مواد بسیار پرکاربرد در صنایع مختلف محسوب میشود که در برابر حرارت و تابش فرابنفش مقاوم است. این ماده را به شکلهای مختلف جامد، مایع، روغنی و لاستیکی به تولید میرسانند. در ادامه قصد داریم تا به کاربردهای این ماده بپردازیم:
صنایع آرایشی و بهداشتی
از این ماده در ضد تعریقها به منظور کاهش سفیدک لباسها بهره میگیرند. همچنین، از آنجایی که این ماده، دوام بالایی دارد، بمنظور حفظ رنگ و درخشش لوازم آرایشی، شامپوها و نرمکنندهها بکار گرفته میشود. همچنین، به کمک این ماده میتوان محصولات مراقبت از پوست، همچون کرمهای ضدآفتاب با SPF بالا را تولید کرد.
صنایع انرژی
استفاده از سیلیکون موجب بهبود عملکرد، دوام و بازده پنلهای خورشیدی و دستگاههای فتوولتائیک میشود چراکه این ماده در برابر تابش آفتاب مقاوم است و طول عمر دستگاههای ساخته شده را بالا میبرد.
الکترونیک
همانطور که گفته شد، این ماده در قطعات کامپیوتر و موبایل به وفور یافت میشود. همچنین در دستگاههای کپی و کیبورد نیز میتوان ردی از سیلیکون پیدا کرد. مدارهای کامپیوتری و دستگاههای DVD نیز همگی در ساخت خود از این ماده بهره گرفتهاند. مادهای موسوم به «سیلیکون رابر» (Silicone Rubber) را در عایقهای کامپیوتری مورد استفاده قرار میدهند. همچنین در مصارف پزشکی اعم از لولههای دیالیز نیز کاربرد دارد.

صنعت هوافضا
با توجه به اینکه سیلیکون، دوام بالایی در شرایط دمایی مختلف دارد، از آن به عنوان عایق و محافظ دربها، لبه بال هواپیماها، جعبه سیاه هواپیما، پوسته موتور و بسیاری قطعات دیگر استفاده میکنند.
معماری و ساختمان
این ماده از جمله مواد کلیدی در ساخت و نوسازی ساختمانهای مسکونی و تجاری به شمار میآید. مواد عایق سیلیکیونی در کاهش مصرف انرژی و حفظ دوام و رطوبت و جلوگیری از رشد باکتریها کاربرد دارند.
لوازم آشپزخانه
ظروف سیلیکونی انعطافپذیر در آشپزخانه، شستشوی راحتی دارند و بوی غذاها را نیز به خود جذب نمیکنند. از این ظروف به راحتی میتوان در فر و فریزر و مایکروویو استفاده کرد بدون اینکه طعم غذا در آنها تغییر کند.
رنگها و پوششها
رنگها و پوششهایی که در آنها از سیلیکون استفاده شده است، به دلیل انعطافپذیری، در برابر تغییرات دمایی دچار ترکخوردگی نمیشود. بهرهگیری از پوشش رنگهای سیلیکونی در ریلهای راهآهن، سطح جادهها و دکلهای نفتی، به دلیل مقاومت در برابر نفت، گازوئیل، نمک و بارانهای اسیدی، خوردگی کمتری را به همراه دارد.
لوازم ورزشی
استفاده از این ماده به عنوان عایق در لوازم غواصی و عینکهای شنا کاربرد دارد. سیلیکون، روشهای جدیدی را برای طراحان فراهم کرده است که به کمک آنها میتوانند لباسهایی سبکتر با خاصیت آبگریزی و عملکرد بالاتری تولید کنند و در عین حال، عبور اکسیژن نیز از بین آنها به راحتی انجام شود.
سیلیکون در رژیم غذایی
برخی مطالعات نشان دادهاند که سیلیکون برای سلامت ناخنها، مو، استخوانها و بافتهای پوستی مفید است. به طور مثال، یکی از مطالعات بیان میکند که استفاده از سیلیکون در رژیم غذایی موجب افزایش تراکم استخوانها و حجم آنها در بیماران با پوکی استخوان میشود.
سیلیکون برای سنتز «الاستین» (Elastin) و کلاژن مورد نیاز است. بیشترین مقدار این مواد در آئورت وجود دارند. از آنجایی که این عنصر همواره در دسترس قرار دارد، علائم ناشی از کمبود این ماده را نمیتوان به سادگی تشخیص داد.
موارد ایمنی
افراد ممکن است به هنگام کار، در معرض سیلیکون قرار داشته باشند و هوای شامل این عنصر را تنفس کنند. تماس این ماده با چشم و پوست، التهاب ایجاد میکند. مقدار مجاز تنفس این ماده در محیط کار، $$ 5 mg/m^3$$ در روز کاری ۸ ساعته ذکر شده است. تنفس بلور سیلیکا موجب بروز بیماری ریوی «سیلیکوزیس» (Silicosis) میشود.
اگر این مطلب برای شما مفید بوده است، آموزشها و مطالب زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای مهندسی معدن و مواد
- آموزش شیمی فیزیک
- تیتانیوم و کاربردهای آن — از صفر تا صد
- منیزیم و کاربردهای آن — از صفر تا صد
^^












با سلام و تشکر از مقاله بسیار ارزشمند شما
ساده ترین راه برای تولید سیلیسیوم و نه الزاما ارزانترین آن
کدام است؟
و باز ساده ترین راه خالص سازی آن جهت تولید بلور یکنواخت آن
(ویفر سیلیکون) کدام است ممنون از لطف شما
سلام و عرض ادب
مچکرم بابت مقاله اتون
شما میتونید منبعی به من معرفی کنید که کاربرد سیلیکون رو در سلول های خورشیدی رو به صورت تخصصی بررسی کنه
با سلام؛
برای آشنایی بیشتر، مطالعه مطالب زیر پیشنهاد میشود.
سلول خورشیدی چیست؟ — از صفر تا صد
انواع پنل های خورشیدی — از صفر تا صد
با تشکر از همراهی شما با مجله فرادرس
سلام
بابت مطالب خوب و مفید شما و همکارانتون متشکریم.
سوال 1: در مورد تولید سیلیکون، میشه راجع به این جمله یک توضیح مختصری بفرمایید: “این فرآیند کاهشی در یک کوره قوس الکتریکی با مقدار اضافی SiO2 انجام خواهد شد تا از تجمع سیلیکون کاربید (SiC) جلوگیری شود. ”
سوال 2: وقتی سیلیس رو به منظور بدست آوردن سیلیسیم، داخل کوره حرارت میدیم، از اونجایی که خود الکترودها از جنس کربن هستن، دیگه چه نیازی به کک هست؟ (در واقع میخوام بپرسم چرا اکسیژن سیلیس، به جای کک با کربن الکترودها واکنش نشون نمیده؟! که دیگه نیازی به کک وجود نداشته باشه؟)
سوال 3: من دی اکسید سیلیسیم رو داخل کوره حرارت میدم (دمای حدود 2500 درجه)، اما حاصل کار یک ماده سیاه رنگ با روکش صاف میشه؛ که خود من فکر میکنم کاربید سیلیسیمه. پس چکار باید بکنم که سیلیسیم با کربن واکنش نده و بتونم سیلیسیم رو بدست بیارم؟!
ضمنا نوشتید که واکنش زیر در حضور ضایعات آهن و مقادیر کمی از گوگرد و فسفر انجام میشود که در نهایت به تولید فروسیلیکون منجر خواهد شد. :
SiO2+2C→Si+2CO
2SiC+SiO2→3Si+2CO
سوال 4: ولی آهن تو معادله بالا وجود نداره و در دو واکنش، سیلیسیم با منواکسید کربن و سیلیسیم با دی اکسید کربن بوجود اومده (آخه نوشتید در نهایت، فروسیلیکون تولید میشه)!
کمال تشکر و قدردانی
سلام
درباره سوال 2 باید عرض کنم که کربن الکترودها ،یه نوع کربن پخته شده مخصوص هست که واکنش پذیری کمتری دارد و در کف کوره نیز از همین نوع کربن استفاده میشه
متاسفانه این نوع کربن وارداتی هست و هزینه بالایی دارد و در کوره های قوس الکتریکی باید تلاش شود که کربن الکترود دیرتر تجزیه شود
باسلام . ما درحال پژوهش برای تولید عنصر سیلیسیوم هستیم
. تا به حال ازمایشات ارزشمندی را انجام داده ایم . اگر تمایل دارید خوشحال میشویم باهم همکاری کنیم
با سلام؛
از همراهی شما با مجله فرادرس سپاسگزاریم.
۱. سیلیکون با کاهش دادن کوارتزیت یا ماسه به کمک کک با خلوص بسیار بالا تولید میشود که با استفاده از کوره قوس الکتریکی و سرعت بالا، سیلیکون کاربید یا مادهای که حدس میزنید در سوال سوم بوجود آمده است، تشکیل نمیشود.
۲. وظیفه اصلی کوره، ایجاد حرارت لازم است اما با توجه به مفاهیم «واکنشدهندههای محدود کننده و اضافی» به کک نیاز خواهیم داشت.
۳. همانطور که گفته شد، این فرآیند به صورت کاهشی (واکنش اکسایش و کاهش) صورت میگیرد و صرفا با گرم کردن نمیتوان سیلیکون تولید کرد.
۴. منظور از واکنش، نوع دیگری از فرآیند است که به طور معمول در حضور ضایعات آهن انجام میشود که در این مطلب آورده نشده است.
با تشکر