عنصر روی (Zn) و کاربردهای آن — Zinc از صفر تا صد

روی (زینک)، عنصری شیمیایی است که در جدول تناوبی با عدد اتمی ۳۰ نشان داده شده است که در گروه 12 جدول قرار دارد. این عنصر در دمای اتاق، حالتی شکننده و ظاهری نقرهای رنگ دارد. روی شباهتهای بسیاری به منیزیم دارد. هر دو عنصر، عدد اکسایش $$+2$$ دارند و اندازه یونهای این دو عنصر یکسان است. روی، بیست چهارمین عنصر فراوان در پوسته زمین به شمار میآید که ۵ ایزوتوپ پایدار دارد. از آلیاژهای مهمی که به کمک روی ساخته میشود میتوان به برنج اشاره کرد. بهرهگیری از این عنصر در رژیم غذایی نیز توصیه میشود زیرا کمبود آن موجب مشکلاتی به خصوص در رشد و بلوغ کودکان میشود. علاوه بر این، بسیاری از آنزیمها در بیوشیمی نیز دارای مرکز فعال با اتم روی هستند.
خواص فیزیکی روی
روی، فلزی به رنگ آبی-سفید، درخشان و دیامغناطیس است. این عنصر، چگالی کمتری نسبت به آهن دارد و ساختار بلوری ششوجهی برای آن ذکر میشود. این فلز در بیشتر موارد، حالتی سخت و شکننده دارد اما در دمای بین 100-150 درجه سانتیگراد حالتی چکشخوار پیدا میکند و در دمایی بالاتر از 210 درجه سانتیگراد، دوباره حالتی شکننده پیدا میکند.
همچنین، این فلز، هادی خوبی برای الکتریسیته به شمار میآید. نقطه ذوب و جوش این فلز به ترتیب برابر با 419 و 907 درجه سانتیگراد است که برای یک فلز، مقادیر پایین به شمار میآیند. به غیر از جیوه و کادمیم، نقطه ذوب روی، پایینتر از سایر عناصر بلوک d جدول تناوبی است. عناصر بسیاری همچون آلومینیوم، آنتیوموان، بیسموت، طلا، آهن، سرب، جیوه، نقره، منیزیم و ... با Zn تشکیل آلیاژ میدهند. خوب است بدانید، زمانی که قطعهای از روی را خم کنید، صدای جالبی از آن شنیده میشود.
روی در زمین
غلظت این فلز بر روی پوسته زمین در حدود $$75 ppm$$ ذکر شده است. غلظت این عنصر در خاک، مقداری بین $$5-770 ppm$$ دارد. این عنصر به طور معمول همراه با سایر فلزات پایه همچون سنگ معدنهای مس و سرب یافت میشود. روی، عنصری گوگردپسند (کالکوفیل) است به این معنی که تمایل دارد در مواد معدنی به همراه گوگرد و سایر کالکوژنهای سنگین یافت شود. منابع Zn در زمین، در حدود 1/9-2/8 میلیارد تن تخمین زده شدهاند که منابع عظیمی از آنها در استرالیا، کانادا، آمریکا و ایران وجود دارند.

خواص شیمیایی و ترکیبات روی
در ادامه قصد داریم تا در خصوص خواص شیمیایی همچون واکنشپذیری و همچنین ترکیبات روی صحبت کنیم.
واکنش پذیری روی
آرایش الکترونی روی به صورت زیر است:
$$[Ar] 3 d ^ { 1 0 } 4 s ^ 2 $$
این عنصر، واکنشپذیری نسبتا بالایی دارد و به راحتی با اسیدها و بازها وارد واکنش میشود و همچنین، عامل کاهنده قوی به شمار میآید. سطح این فلز در حالت خالص به سرعت کدر میشود و لایهای محافظ با فرمول $$Z n _ 5 ( O H ) _ 6 ( C O _ 3 ) _ 2$$ در اثر واکنش با دیاکسید کربن موجود در اتمسفر تشکیل میدهد. در اثر سوختن، شعلهای به رنگ سبزـآبی به همراه بخارات سمی از اکسید روی تولید میکند. در واکنش با اسیدهای قوی همچون هیدروکلریک اسید یا سولفوریک اسید، لایه محافظ آن از بین میرود و ادامه واکنش این ماده با آب، گاز هیدروژن آزاد میکند.
خواص شیمیایی این فلز، بیشتر به دلیل عدد اکسایش $$+2$$ است. زمانی که ترکیباتی با این عدد اکسایش تشکیل شوند، زیرلایه s این عنصر در لایه ظرفیت خالی میشود و یون روی با آرایش الکترونی $$[Ar] 3 d ^ {10}$$ بوجود میآید. در محلولهای آبی به طور معمول، کمپلکسی با فرمول $$[Z n ( H _ 2 O ) _ 6 ] ^ {+2}$$ تشکیل میشود. بخار کردن روی در ترکیب با کلرید روی در دمای بالاتر از 285 درجه سانتیگراد، ترکیبی با فرمول $$Zn _ 2 Cl _ 2$$ از خود به جای میگذارد که در این ترکیب، عدد اکسایش روی برابر با $$+1$$ است. تمامی ترکیبات شناخته شده از روی، عدد اکسایشی برابر با $$+1$$ یا $$+2$$ دارند.
خواص شیمیایی روی مشابه عناصر انتهای ردیف اول فلزات واسطه، یعنی نیکل و مس است. شعاع یونی روی و منیزیم تقریبا برابر هستند و به همین دلیل، برخی از نمکهایی که تشکیل میدهند، ساختار بلوری مشابهی دارند. همچنین، در شرایطی که شعاع یونی، عامل تعیین کنندهای باشد، خواص شیمیایی این فلز، بسیار به منیزیم نزدیک است. لازم به ذکر است که این فلز تمایل دارد تا با دهندههای گوگرد و نیتروژن، کمپلکسهای پایداری تشکیل دهد.
ترکیبات روی (I)
ترکیبات Zn با عدد اکسایش $$+1$$ به ندرت یافت میشوند و به لیگاندهایی نیاز دارند تا این عدد اکسایش را به پایداری برسانند. بیشتر این ترکیبات، هستهای به شکل $$[ Z n _ 2 ] ^ { 2 + }$$ دارند. طبیعیت دیامغناطیس آن، وجود ساختار دیمری آنرا تصدیق میکند. اولین ترکیبی که با عدد اکسایش $$+1$$ شناخته شده، با فرمول $$(η ^ 5- C_5 M e _ 5 ) 2 Z n _ 2$$ ذکر شده است. یون $$[ Z n _ 2 ] ^ { 2 + }$$ به سرعت به فلز روی یون روی (II) تبدیل میشود.
ترکیبات روی (II)
به غیر از گازهای نجیب، بسیاری از ترکیبات دوتایی روی در شبه فلزات و نافلزات دیده میشود. پودر $$ZnO$$، اکسید سفیدرنگی است که در محلولهای خنثی انحلالپذیر نیست اما خاصیتی آمفوتری دارد به گونهای که در محلولهای قوی بازی و اسیدی حل میشود. ترکیباتی همچون $$Z n S$$، $$Z n e$$ و $$Z n T e$$ در اپتیک و الکترونیک کاربرد دارند. سایر ترکیبات این عنصر در جدول زیر آورده شدهاند:
| ترکیبات روی (II) | |
| $$Z n _ 3 N _ 2$$ | $$Z n C l _ 2$$ |
| $$$$Z n _ 3 P _ 2$$$$ | $$$$Z n B r _ 2$$$$ |
| $$$$Z n _ 3 A s_ 2$$$$ | $$Z n I _ 2$$ |
| $$$$Z n _ 3 S b_ 2$$$$ | $$Z n F _ 2$$ |
| $$Z n O _ 2$$ | |
در محلولهای بازی ضعیف که حاوی یون $$Z n ^ {2 + }$$ هستند، هیدروکسید $$Z n ( O H ) _ 2$$ رسوبی سفیدرنگ تشکیل میدهد. در محلولهای بازی قویتر، این هیدروکسیددر اثر انحلال، زینکات $$( [Z n ( O H ) _ 4 ] ^ {2 - })$$ تشکیل میدهند. در جدول زیر، برخی از ترکیبات غیرآلی معمول را برای این فلز مشاهده میکنید:
| ترکیبات غیرآلی روی | |
| $$Z n ( N O _ 3 ) _ 2$$ | $$Z n _ 3 (P O _ 4) _ 2$$ |
| $$Z n ( C l O _ 3 ) _ 2$$ | $$Z n M o O _ 4$$ |
| $$Z n S O _ 4$$ | $$Z n ( C N ) _ 2$$ |
| $$Z n ( A s O _ 2)$$ | $$ Z n ( A s O _ 4 ) _2 · 8 H_ 2 O $$ |
از جمله سادهترین ترکیبات آلی روی میتوان به استات روی با فرمول $$Z n (O_ 2 C C H _3 ) _ 2$$ اشاره کرد.

آزمایش تشخیص روی
از کاغذ کبالت سیانید برای تشخیص این فلز بهره میگیرند. 4 گرم از $$K_ 3 C o ( C n ) _ 6$$ و ۱ گرم از $$K C l O _ 3$$ را در 100 میلیلیتر آب حل میکنند. کاغذ مورد نظر را در محلول فرو میبرند و سپس در دمای 100 درجه سانتیگراد آنرا خشک میکنند. یک قطره از نمونه مورد نظر را روی کاغذ خشک میریزند و آنرا حرارت میدهند. رنگ سبز، نشان از حضور فلز روی دارد.
تولید روی
تقریبا تمامی روی تولیدی از سنگمعدنهای سولفیدی این فلز بدست میآیند که حاوی عناصر دیگری همچون سرب، کادمیم، آهن و نقره هستند. معروفترین این سگ معدنها، سولفید روی یا اسفالریت با فرمول $$Z n S$$ است. سنگ معدنهای سولفیدی در سراسر جهان پراکندهاند. معادن اصلی این فلز در قاره آمریکای شمالی، استرالیا، ژاپن، چین، ایران، آفریقای جنوبی، اسپانیا، روسیه و آلمان است. تولید روی به کمک دو فرآیند مهم انجام میگیرد: فرآیند الکترولیتی و حرارتی. بیش از 90 درصد روی تولیدی به کمک فرآیند الکترولیتی تهیه میشود.
فرآیند الکترولیتی در تولید روی
این فرآیند از چهار مرحله تشکیل شده است:
- تغلیظ سنگ معدن
- سوزاندن (برشته کردن) سنگ معدن
- تبدیل اکسید روی به سولفات روی
- الکترولیز محلول سولفات روی
تغلیظ سنگ معدن
بعد از استخراج سنگ معدن از معادن و خرد کردن آنها، تغلیظ آن توسط فرآیند «فلوتاسیون کف» (Froth Flotation) صورت میگیرد. در اثر این فرآیند، اجزای ناخواسته همچون ترکیبات روی و پسماند از سنگ معدن حذف خواهند شد.
برشته کردن سنگ معدن
برشته کردن سنگ معدن در کورهای با دمای 1300 کلوین و دمیدن هوا از پایین انجام میشود. مهمترین تغییر طی این فرآیند، تبدیل سولفید روی به اکسید روی است:
$$\begin{equation} 2 Z n S ( s ) + 3 O _ { 2 } ( g ) \longrightarrow 2 Z n O ( s ) + 2 S O _ { 2 } ( g ) \end{equation}$$
با این وجود، هر سولفید آهنی که در این سنگها موجود باشد به آهن (III) اکسید تبدیل خواهد شد که با اکسید روی واکنش و تشکیل فریت روی میدهد:
$$\begin {equation} \mathrm { F e } _ { 2} \mathrm { O } _ {3 } + \mathrm { Z } \mathrm { n } \mathrm { O } \longrightarrow \mathrm { Z } \mathrm { n O } \cdot \mathrm { F e } _ { 2 } \mathrm { O } _ { 3 } \end {equation}$$
در فرآیند شستشو، نمیتوان به سادگی فلز روی را از سنگ معدن آن بدست آورد به همین دلیل، سنگمعدنهایی با مقادیر کم از آهن، ترجیح داده میشوند. در کنار کوره ذوب نیز به طور معمول، دیاکسید گوگرد را به سولفوریک اسید تبدیل میکنند.
تبدیل اکسید روی به سولفات روی
اکسید روی خام را با الکترولیت غنی از سولفوریک اسید شستشو میدهند تا اکسید حل شود و غلظت سولفات روی در الکترولیت افزایش پیدا کند. واکنش اصلی به همراه نمای کلی از فرآیند شستشو در زیر آورده شده است:
$$\begin {equation} \mathrm { Z } \mathrm { n O }( \mathrm { s } ) + \mathrm { H } _ { 2} \mathrm { S O } _ { 4 } ( \mathrm { a q } ) \longrightarrow \mathrm { Z n S O} _ { 4 } ( \mathrm { a q } ) + \mathrm { H } _ { 2 } \mathrm { O } ( \mathrm { l } ) \end {equation}$$
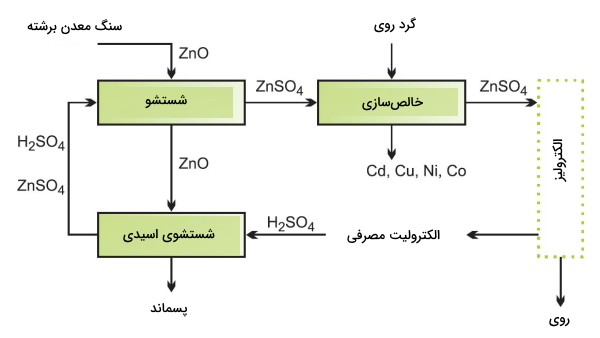
همانطور که در بالا به آن اشاره شد، بخشی از اکسید روی به شکل فریت وجود دارد. کارهای مختلفی برای خالصسازی این فلز در فرآیند شستشو انجام میشود. بیشتر این فعالیتها شامل بکارگیری اسید داغ جهت تولید مخلوطی از روی و آهن (III) سولفات است که به دنبال آن، آهن (III) سولفات حذف میشود. یکی از این روشها در تصویر زیر آورده شده است که در آن، آهن به صورت «جاروسیت» (Jarosite)، ترکیبی بر مبنای آهن (III) سولفات، رسوب میکند.

بعد از شستشو با اسید داغ، رسوب دادن جاروسیت به کمک آمونیوم یا ترکیبات سدیم انجام میشود و مایع حاصل، از فرآیند شستشوی دیگری با شدت کمتر عبور میکند. چنین واکنشهایی موجب تولید سولفوریک اسید خواهند شد. همچنین، برای کنترل خاصیت اسیدی، سنگ معدنهای برشته را به فرآیند تشکیل جاروسیت اضافه میکنند.
$$\begin {equation} 3 \mathrm { F e } _ { 2 } \left ( \mathrm { S O } _ { 4 } \right ) _ { 3 } + \left ( \mathrm { N H } _ { 4 } \right ) _ { 2 } \mathrm { S O } _ { 4 } + 1 2 \mathrm { H } _ { 2 } \mathrm { O } \longrightarrow 2 \mathrm { N H } _ { 4 } \mathrm { F e } _ { 3 } \left ( \mathrm { S O } _ { 4 } \right ) _ { 2 } (\mathrm { O H } ) _ { 6 } + 6 \mathrm { H } _ { 2 } \mathrm { S O } _ { 4 } \end {equation}$$
در ادامه، مخلوط حاوی سولفات روی را فیلتر میکنند تا مواد جامد معلق از آن حذف شود و محلول حاصل را با گرد روی فرآوری میکنند تا فلزی با خاصیت الکتروپوزیتیو کمتر، رسوب کند. به طور مثال، کادمیم از جمله فرآوردههای فرعی این عملیات است:
$$\begin {equation} \mathrm { C d } ^ { 2 + } ( \mathrm { a q } ) + \mathrm { Z n } (\mathrm { s } ) \rightarrow \mathrm { Z n } ^ { 2 + } (\mathrm { a q } ) + \mathrm { C d } ( \mathrm { s } ) \end {equation}$$
روش جایگزین در تولید سولفات روی
سولفات روی را میتوان تحت دو فرآیند شستشوی مستقیم و شستشوی زیستی (بیولیچینگ) به صورت جایگزین تولید کرد که در ادامه به این دو روش خواهیم پرداخت.
شستشوی مستقیم
روشهای مختلفی برای حذف مرحله برشته کردن سنگ معدن توسعه پیدا کردهاند که در آنها، سولفات روی به طور مستقیم از سنگ معدن تلغیظ شده (کنسانتره) بدست میآید. این روشها، شدیدتر از روشهای قبل هستند و در سنگ معدنهایی با ارزش کمتر مورد استفاده قرار میگیرند. یکی از این روشها در کانادا توسعه یافته است که از طریق آن، 99 درصد روی، از سنگ معدن استخراج میشود. این روش از فشار زیاد 10 اتمسفر و دمای 420 کلوین کمک میگیرد. حضور آهن در این سنگها اهمیت زیادی در روش مذکور دارد زیرا در این روش، سولفید روی به سولفات روی تبدیل میشود. به کمک اسید گرم، آهن (II) سولفات به آهن (III) سولفات تبدیل خواهد شد. در ادامه، این ترکیب، تبدیل مورد نظر ما را صورت میدهد و خود به آهن (II) سولفات، کاهش پیدا میکند. همچنین، تحت واکنش زیر، سولفید روی با سولفوریک اسید واکنش میدهد.
$$\begin {equation} \mathrm { Z } \mathrm { n S } + \mathrm { H } _ { 2 } \mathrm { S O } _ { 4 } + 1 / 2 \mathrm { O } _ { 2 } \rightarrow \mathrm { Z } \mathrm { n S O } _ { 4 } + \mathrm { H } _ { 2 } \mathrm { O } + \mathrm { S } \end {equation}$$
همانطور که در واکنش بالا مشاهده میکنید، طی این واکنش، گوگرد نیز به تولید میرسد که از آن برای تهیه سولفوریک اسید استفاده میکنند.
شستشوی زیستی (تصفیه زیستی)
در روش دیگر، به کمک باکتریها میتوان استخراج روی را از سنگمعدنهای فقیر، به خوبی انجام داد. در این روش از باکتریها در دمای 320 کلوین استفاده میکنند تا محلولی از روی بمنظور الکترولیز ایجاد شود.
الکترولیز محلول سولفات روی
مرحله آخر شامل خالصسازی روی به کمک الکترولیز محلول سولفات روی است. این فلز بر روی کاتد تشکیل خواهد شد که در هر 24-72 ساعت، این فلز را از الکترودها جدا میکنند و پس از ذوب کردن، به شکل شمش به تولید میرسند. فلز حاصل، خلوصی در حدود 99/96 درصد دارد. واکنش آند و حضور اکسیژن نیز در زیر آورده شده است. به کمک تنظیم شرایط الکترولیز میتوان این فلز را با خلوصی در حدود 99/995 درصد تولید کرد که از فلز تولیدی در آلیاژهای ریختهگری شامل آلومینیوم، منیزیم و مس بهره میگیرند.
$$\begin {equation} 4 \mathrm { O H } ^ { - } (\mathrm { a q } ) \rightarrow 2 \mathrm { H } _ { 2 } \mathrm { O } ( l ) + \mathrm { O } _ { 2 } ( \mathrm { g } ) + 4 \mathrm { e }^ { - } \end{equation}$$

فرآیند حرارتی تولید روی
این روش از کورههایی موسوم به «ISF» استفاده میکند که به دلیل مصرف انرژی و انتشار گازهای زیاد، بهرهگیری از آن در اروپا متوقف شده و جای خود را به فرآیند الکترولیز داده است. در این روش به طور همزمان، از کلوخهها، روی و سرب به تولید میرسد. کلوخهها به کمک سوزاندن (برشته کردن) مخلوطی از کنسانتره روی و سرب، عوامل روانساز همچون آهک و ماسه و مواد دیگر به تولید میرسند. در فرآیند ISF، کوره بلند را از کُک داغ و کلوخه پر میکنند. هوای داغ با دمای 1200-1350 کلوین از طریق لولههایی به درون کوره دمیده میشود. واکنشهایی که درون کوره رخ میدهند، به طور خلاصه در زیر آورده شدهاند:
$$\begin {equation} \begin {aligned}
& 2 C ( s ) + O _ { 2 } ( g ) \rightarrow 2 C O ( g )\\
& \mathrm { Z n O } (\mathrm { s } ) + \mathrm { C O } ( \mathrm { g } ) \rightarrow \mathrm { Z n } ( \mathrm { g } ) + \mathrm { C O } _ { 2} ( \mathrm { g } ) \\
& \mathrm { C O } _{ 2 } ( \mathrm { g } ) +\mathrm { C }( \mathrm { g } ) \longrightarrow 2 \mathrm { C O } ( \mathrm { g } )
\end {aligned} \end {equation}$$
نقطه ذوب و جوش این دو فلز در جدول زیر آورده شده است:
| سرب | روی | |
| نقطه ذوب (کلوین) | 600 | 693 |
| نقطه جوش (کلوین) | 2024 | 1181 |
تحت شرایط کوره، روی به صورت گاز حضور دارد و سرب به شکل مایع به تولید میرسد. اجزای دیگر کلوخه همچون سیلیکا، آهک، آلومینا و اکسیدهای آهن، سربارهای از سیلیکات را تشکیل میدهند. این مواد نیز به همراه سرب به طور همزمان از کوره خارج و در مخزنی مجزا جمعآوری میشوند. در لایه پایینی این مواد، سرب قرار دارد که در بلوکهای ۲-۴ تنی جداسازی خواهد شد. این فلز مایع را با نام «سرب تصفیه شده» (Refined Lead) میشناسند. سرباره مذاب (در دمای 1300-1550 کلوین) نیز به کمک فشار آب (واترجت)، به شکل دانهای تبدیل و کنار گذاشته خواهد شد. اما بخار روی در یک کندانسور به همراه جریان گازهای دیاکسید و مونواکسید کربن جمعآوری و از طریق اسپری کردن سرب مایع، سرد میشود.
کدانسور مذکور، توسط دستهای از روتورها سرب را اسپری میکند. مخلوط روی-سرب به داخل کندانسور در درمای 830 کلوین پمپ و به کمک آب تا دمای 710 کلوین سرد خواهد شد. این مخلوط با گذر از یک حمام، جداسازی خواهد شد. فلزی که از این روش بدست میآید، در حدود 1-1/3 درصد دارای ناخالصی سرب است که در صورت نیاز، به کمک روشهای تقطیر، این خلوص تا 99/95 درصد افزایش پیدا میکند. در طول این فرآیندها، فلزات ارزشمندی همچون کادمیم نیز بدست میآیند.
تولید ثانویه روی
بیش از 35 درصد روی تولیدی، حاصل از بازیافت این فلز است. در بیشتر موارد، این مقدار فلز از فولاد اندود شده با روی بدست میآید. فرآیند بازیافت به کمک کوره قوس الکتریکی انجام میشود که در آن، روی به همراه گازهای دیگر از کوره خارج و در اثر سرد شدن، به صورت گرد روی، جمعآوری خواهد شد. این گرد به کمک هوا حرارت میبیند تا اکسید روی تشکیل شود و این اکسید به کمک سولفوریک اسید، سولفات روی را بوجود میآورد و از طریق فرآیندهای بالا، به طور مجدد خالصسازی میشود.
کاربردهای روی
این فلز را به شکل اندود شده جهت محافظت از فولاد و آهن در برابر خوردگی استفاده میکنند چراکه در اثر اکسید شدن روی، لایهای محافظ بوجود میآید که از خوردگی بیشتر آن جلوگیری میکند. حتی درصورت ایجاد خراش بر روی سطح اندود شده، خوردگی ادامه پیدا میکند تا لایه محافظ تکمیل شود. در حقیقت فلز روی، نقش «فلز فداشونده» (Sacrificial Metal) را ایفا میکند. روشهای مختلفی برای اندود کردن آهن و فولاد با این فلز وجود دارند. یکی از این روشها، قرار دادن آهن و فولاد در حمامی از رویِ مذاب است که به این فرآیند، «گالوانیزه شیب گرم» (Hot Dip Galvanizing) میگویند. ورقههای فولادی را در بیشتر موارد از این طریق گالوانیزه میکنند، خاصه در مواردی که نیاز به تولید کالاهایی سفیدرنگ همچون بدنه خودروها، یخچال و ماشین لباسشویی باشد.
سایر محصولات فولادی همچون گاردریل بزرگراهها، تیرهای برق و لولههای انتقال آب را نیز میتوان به کمک قوطهوری در حمامی از روی، گالوانیزه کرد. انواع اتصالات را نیز به همین شکل میتوان اندود کرد با این تفاوت که از سانتریفیوژ برای کاهش قطر لایه اندود بهره میگیرند. به طور جایگزین میتوان از آبکاری فلزات هم استفاده کرد که دوام کمتری نسبت به این روش دارد. روش دیگری که از آن برای اشیا کوچک همچون میخ و پیچ استفاده میشود این است که آنها را داخل گردونهای دوار و به کمک گرد روی، تا دمای 650 کلوین حرارت میدهند. این فرآیند، موسوم به «روخورانی» (Sherardizing) است. سازههای عظیم همچون پلها را نیز حتی بعد از نصب، به کمک پاشش روی مایع، از خوردگی محافظت میکنند.
آندهایی به صورت آلیاژ روی، بمنظور جلوگیری از خوردگی در دکلهای نفتی و کشتیها مورد استفاده قرار میگیرند. این آندها را به محلهای مستعد خوردگی متصل میکنند تا به جای فولاد، دچار خوردگی شوند. در نهایت، زمانی که خوردگی به طور کامل انجام شد، تعویض میشوند. از آلیاژهای روی-آلومینیوم بمنظور ریختهگری تحت فشار استفاده میشود که نتیجه حاصل، محصولاتی متنوع همچون قطعات موتور خودرو است. علاوه بر این، از این فلز در باتریهای مختلف نیز بهره میگیرند.
تهیه آلیاژ
از آلیاژ برنج به طور گسترده در موارد مختلفی استفاده میشود. برنج، آلیاژی از مس و روی با درصد 3-45 است که بسته به نوع آلیاژ، این ترکیب درصد متفاوت خواهد بود. برنج به طور کلی نسبت به مس، چکشخواری و استحکام بیشتری دارد و به طور ویژهای در برابر خوردگی مقاوم است. این خواص، علت اصلی بهرهگیری از این آلیاژ در تجهیزات مخابراتی، سختافزارها، آلات موسیقی و شیرهای آب به شمار میآید. از آلیاژهای دیگری که روی در آنها استفاده شده است میتوان به ورشو (نیکل نقره)، سیم لحیم و برنز اشاره کرد. علاوه بر این، در تاسیسات و لولهکشیها از روی به جای آلیاژهای قلع-سرب بهره میگیرند.

سایر مصارف صنعتی
در حدود یک چهارم کل روی تولیدی آمریکا بمنظور تهیه ترکیبات این فلز به مصرف میرسد. به طور مثال استفاده از اکسید روی (زینک اکساید) به عنوان رنگ سفید و همچنین کاتالیزور در تولید لاستیک کاربرد دارد. همچنین، این ماده را برای محافظت لاستیکهای پلیمری از اشعه ماورا بنفش بکار میگیرند. علاوه بر این، از خواص این اکسید در وریستور و دستگاههای کپی استفاده میشود.
همچنین، بمنظور حفاظت از چوبها در مقابل آتشسوزی و سایر عوامل دیگر، از $$Z n C l _ 2$$ بهره میگیرند. استفاده از $$Zn S$$ در تولید رنگهای درخشنده و صفحات نمایشگر اشعه ایکس کاربرد دارد. از بلورهای این ترکیب نیز در لیزرها استفاده میکنند. روی-پریتیون را نیز بمنظور تهیه رنگهای ضد جرم و لجن بکار میبرند.
در مدلهای کوچک از موشک، پودر روی را به عنوان سوخت استفاده میکنند. زمانی که مخلوط فشردهای از 70 درصد پودر این فلز به همراه 30 درصد پودر گوگرد، شعلهور شود، واکنش شیمیایی شدیدی به همراه دارد. این واکنش سبب ایجاد $$Z n S$$ به همراه مقادیر زیادی از گازهای گرم و نور میشود.
مصارف دارویی
در بسیاری از قرصهای مکمل از اشکال مختلف روی همچون $$Z n S$$، زینک استات (استات روی) و زینک گلوکونات استفاده میکنند. این مکملها به ویژه در کشورهای فقیر بمنظور پیشگیری از فقر روی، توصیه میشود. به طور معمول، زینک استات یا زینک گلوکونات در درمان سرماخوردگی موثر است به گونهای که مصرف دوز مشخصی از آن در طول 24 ساعت اولیه بیماری، طول دوره سرماخوردگی را در بزرگسالان به شدت کاهش میدهد. کاهش روی در بدن، بیاشتهایی را به همراه دارد. در برخی موارد، از ترکیبات روی برای افزایش وزن بهره میگیرند. علاوه بر این، پماد زینک اکسید در آفتابسوختگیها یا سوختگیهای ناشی از سوز سرما کاربرد دارد.
نقش بیولوژیکی
روی از جمله عناصری به شمار میآید که به مقدار کمی در بدن موجودات زنده و گیاهان وجود دارد و برای عملکرد بیش از 300 آنزیم و 1000 «عامل رونویسی» (Transcription Factor) ضروری است.
منابع روی در رژیم غذایی
همانطور که در طول متن نیز به آن اشاره شد، مصرف روی در رژیم غذایی بسیار ضروری است که در بهبود سیستم ایمنی و ترمیم بافتها تاثیر دارد. مصرف روزانه 11 و ۸ میلیگرم از روی به ترتیب برای آقایان و بانوان توصیه شده است که البته مصرف آن باید با مشورت پزشک صورت بگیرد. در ادامه، فهرستی از منابع غذایی حاوی روی را مورد بررسی قرار میدهیم:
- گوشت: گوشت قرمز منبعی غنی از روی به شمار میآید که هر 100 گرم آن حاوی 4/8 میلیگرم از این عنصر است.
- صدف: این ماده غذایی، مقادیر بسیاری از روی را در خود جای داده است به طوریکه 6 صدف متوسط، حاوی 32 میلیگرم از این عنصر را شامل میشود.
- حبوبات: 100 گرم حبوبات پخته شده، 12 درصد از این عنصر را در رژیم غذایی روزانه تکمیل میکنند.
- بذرها: میتوان انواع بذرها همچون تخم کتان و کدو را به سالاد اضافه کرذ چراکه 30 گرم از آن، در حدود 30 درصد نیاز روزانه به این عنصر را تامین میکنند.
- مغزها: بادام زمینی، مغز بادام و همچنین بادام هندی از منابع مهم روی به شمار میآیند. به طور مثال، 28 گرم بادام هندی شامل 15 درصد از نیاز روزانه به این عنصر است.
- لبنیات: مصرف روزانه لبنیات همچون شیر و پنیر در تامین این عنصر بسیار مهم هستند به طوریکه با مصرف 100 گرم پنیر چدار، 28 درصد از نیاز روزانه خود به این ماده را تامین میکنید.
- تخم مرغ: هر تخم مرغ بزرگ در حدود ۳ تا ۵ میلیگرم از این عنصر را شامل میشود.
- سبزیجات: به طور کلی، سبزیجات و میوهها، منابع غنی از این عنصر به شمار نمیآیند اما برخی افراد که گوشت مصرف نمیکنند میتوانند برای تامین این ماده، از برخی سبزیجات کمک بگیرند. به طور مثال، هر سیبزمینی بزرگ در حدود 1 میلیگرم از این عنصر را شامل میشود. همچنین، هر 100 گرم نخود سبز و کلم برگ در حدود ۳ درصد از نیاز روزانه به این عنصر را تامین میکنند.
- شکلات تلخ: هر 100 گرم شکلات تلخ (70-85 درصد)، در حدود 3/3 میلیگرم روی را در رژیم غذایی تامین میکند. البته به علت کالری بالای شکلات تلخ، مصرف آن به عنوان منبع اصلی غذایی توصیه نمیشود.

اگر این مطلب برای شما مفید بوده است، آموزشها و مطالب زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای مهندسی مواد و معدن
- آموزش اصول استخراج فلزات – پیرومتالورژی (Pyrometallurgy)
- الکتروشیمی — به زبان ساده
- تیتانیوم و کاربردهای آن — از صفر تا صد
^^










