رفتار گازها — به زبان ساده

رفتار گازها وابسته به خواص و قوانین حاکم بر مولکولهای گاز است. توزیع مولکولها در یک گاز با توزیع مولکولها در مایعات و جامدات بسیار متفاوت است که همین امر سبب ایجاد رفتار متفاوت گازها و قوانین مختلف آن شده است. در این آموزش قصد داریم تا خواص و قوانین حاکم بر رفتار گازها را بررسی کنیم تا درک بهتری از این حالت ماده داشته باشیم.
گاز چیست ؟
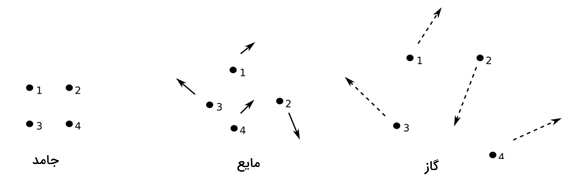
گاز را به عنوان سیالی همگن با چگالی و ویسکوزیته پایین تعریف میکنند که حجم آن با حجم ظرف محتوی آن برابر است. گازها را به دو دسته ایدهآل و واقعی (حقیقی) تقسیمبندی میکنند. در تصویر زیر، به شکل ساده توزیع مولکولها در مایع، جامد و گاز نشان داده شده است.
توصیف رفتار گازها به کمک نظریه جنبشی گازها
رفتار گازها را میتوان به کمک نظریه جنبشی گازها توصیف کرد که مولکولها را در مقیاس ماکروسکوپی میسنجد. در زیر، ۵ فرض اصلی در این نظریه آورده شده است.
- گاز شامل تعداد زیادی از مولکولهایی با حرکت تصادفی است.
- از آنجایی که فاصله بین مولکولهای گاز، بیشتر از اندازه مولکولها است، از حجم مولکولهای گاز میتوان صرف نظر کرد.
- برهمکنشهای بین مولکولی قابل صرف نظر هستند.
- برخورد مولکولها با یکدیگر و همچنین با دیواره ظرف، به عنوان برخوردهایی الاستیک در نظر گرفته میشوند.
- انرژی جنبشی میانگین تمامی مولکولهای گاز، وابسته به دمای آن است.
تراکم پذیری در گازها
غواصان در زیر آب همواره کپسول هوایی برای تنفس همراه خود دارند. فشار معمول در این کپسولها در حدود ۲۰۰-۳۰۰ اتمسفر ذکر شده است. برخلاف سایر حالتهای ماده، گازها برای پر کردن ظرف حامل خود، منبسط میشوند و به همین دلیل، مقادیری زیادی از یک گاز را میتوان در فضایی اندک مانند یک کپسول، محبوس کرد. در صورتیکه هوای فشرده شده در یک کپسول غواصی را به کپسولی با فشار یک اتمسفر منتقل کنیم به حجمی در حدود ۲۵۰۰ لیتر نیاز خواهیم داشت.

«تراکمپذیری» (Compressibility)، معیاری است تا بتوان میزان فشردگی یک ماده در اثر اعمال فشار را اندازهگیری کرد. زمانی که فشاری بر یک جامد یا مایع اعمال میکنیم، تغییر آنچنانی در حجم مشاهده نخواهیم کرد زیرا با توجه به فشردگی بین ذرات، این کار امکانپذیر نخواهد بود.
نظریه جنبشی گازها دلیل تراکمپذیری گازها نسبت به مایعات و جامدات را به خوبی بیان میکند. تراکمپذیری گازها به این دلیل است که بیشتر حجم گازها شامل فضای خالی بین آنها است. در دما و فشار استاندارد، فاصله متوسط بین مولکولهای گاز در حدود ده برابر قطر مولکولها ذکر میشود. به هنگام تراکم یک گاز در کپسولی همچون کپسول غواصی، ذرات گاز به یکدیگر فشرده میشوند.
از کپسولهای فشرده گاز در موارد بسیاری استفاده میشود. به طور مثال، کپسولهای اکسیژن بیمارستانها در اختیار بیمارانی با مشکلات تنفسی قرار میگیرد. همچنین، جوشکاری به شعله بسیار داغی نیاز دارد که از مخلوط گازهای استیلن و اکسیژن تولید میشود. بسیاری از اجاقهای خوراکپزی نیز از کپسولهای گاز پروپان پر میشوند.
عوامل موثر بر فشار گاز
به طور حتم در ورزشهایی مانند بسکتبال به دریبل زدن بازیکنها و بالا و پایین رفتن توپ در ارتفاعی معین دقت کردهاید. در حقیقت، گازی که در درون توپ قرار دارد باید فشار مناسبی داشته باشد تا توپ به این ارتفاع برسد و این فشار، به طور مستقیم به مقدار گاز درون توپ یا هر محفظه دیگری وابسته است.
پیشتر گفتیم که در نظریه جنبشی گازها، ذرات گاز به صورت تصادفی در خطی مستقیم حرکت میکنند و با دیگر ذرات گاز و همچنین دیواره ظرف، برخوردهایی کشسان (الاستیک) دارند. به عبارتی، این برخوردها هستند که فشار گاز را تعریف میکنند. برای اینکه شرایط یک گاز را به درستی تعریف کنیم باید از چهار متغیر استفاده شود که عبارتند از:
در ادامه، تاثیر این متغیرها بر فشار و رفتار گازها را بررسی میکنیم.
مقدار گاز
تصویر زیر اثر اضافه شدن یک گاز به محفظهای صلب را نشان میدهد. محفظه صلب به کپسولی میگویند که نمیتواند دچار کاهش یا افزایش حجم شود. همانطور که در این تصویر مشاهده میکنید، افزایش فشار سبب افزایش تعداد ذرات گاز میشود.
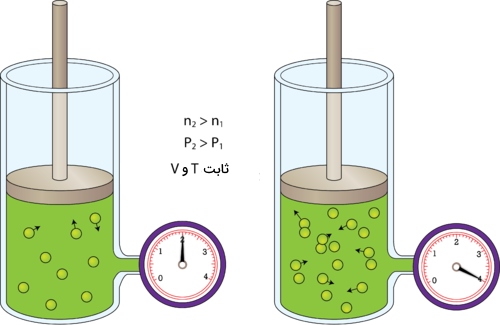
در تصویر بالا، کپسول سمت چپ دارای مقدار معینی گاز است. با استفاده از پمپ هوای متصل به این سیلندر، مقدار گاز کپسول به دو برابر افزایش خواهد یافت. از آنجایی که این کپسول نمیتواند منبسط شود، تعداد مولکولهای بیشتر گاز نسبت به قبل، برخوردهای بیشتری با یکدیگر خواهند داشت. نتیجه این خواهد بود که فشار گاز بیشتر میشود.
حجم
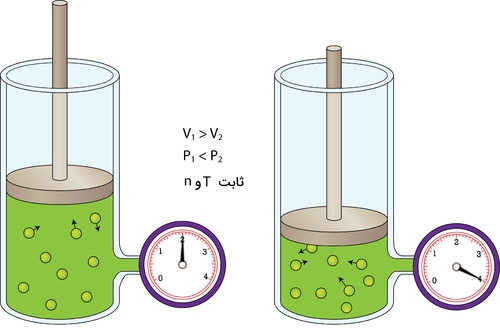
فشار، متاثر از حجم کپسول هم هست. اگر حجم یک کپسول کاهش پیدا کند، مولکولهای گاز فضای کمتری برای حرکت خواهند داشت که در نتیجه آن، به دیوارههای ظرف برخورد میکنند و سبب افزایش فشار میشوند. تصویر زیر، سیلندری از یک گاز را نشان میدهد که حجم آن توسط پیستون کنترل میشود.
در تصویر سمت چپ، پیستون در بالاترین حالت خود قرار دارد که در این حالت، مقدار معینی فشار خواهیم داشت. در تصویر سمت راست، پیستون به اندازهای پایین آمده است که گاز محبوس شده در نیمی از فضای قبل قرار گرفته باشد. در اثر این اتفاق، همانطور که در فشارسنج سمت راست نشان داده شده است، فشار گاز به دو برابر افزایش پیدا میکند. بررسی رفتار گازها نشان میدهد که افزایش حجم محفظه، تاثیری معکوس بر میزان فشار خواهد داشت و در اثر افزایش حجم، فشار کاهش پیدا میکند.
دما
قراردادن قوطی کنسرو بر روی آتش یا چراغ خوراکپزی در نهایت سبب ترکیدن آن خواهد شد. این اتفاق را نظریه جنبشی گازها توضیح میدهد. هوای داخل کنسرو، انرژی جنبشی بیشتری در اثر حرارت ناشی از آتش کسب میکند. انرژی جنبشی سبب میشود تا مولکولهای هوا سریعتر حرکت کنند و برخورد آنها با دیواره ظرف با نیرو و تعداد دفعات بیشتری همراه باشد.
همانطور که دیدیم، افزایش برخوردها سبب افزایش فشار میشود و این افزایش فشار درونی میتواند بیش از استحکام قوطی کنسرو باشد که در نهایت سبب ترکیدن آن میشود. عامل دیگری نیز در اتفاق دخیل است و آن، احتمال جوشیدن غذای داخل کنسرو است که همین امر نیز سبب افزایش فشار هوای درون کنسرو نیز میشود.
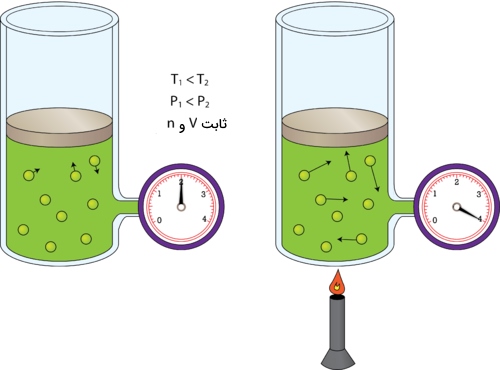
در تصویر زیر میبینید که سیلندر گاز در سمت چپ و در دمای اتاق قرار دارد. در سمت راست، سیلندر حرارت میبیند تا به دمایی دو برابر یعنی ۶۰۰ کلوین برسد. در اثر این اتفاق، انرژی جنبشی مولکولهای گاز افزایش مییابد و در نتیجه، برخورد مولکولها با دیواره ظرف، شامل نیروهای بیشتری نسبت به قبل خواهد بود. حاصل این فرآیند، افزایش دو برابری فشار است. بنابراین، بررسی رفتار گازها نشان داد که کاهش دما، نتیجه مستقیم در برابر فشار خواهد داشت و سبب کاهش فشار میشود.
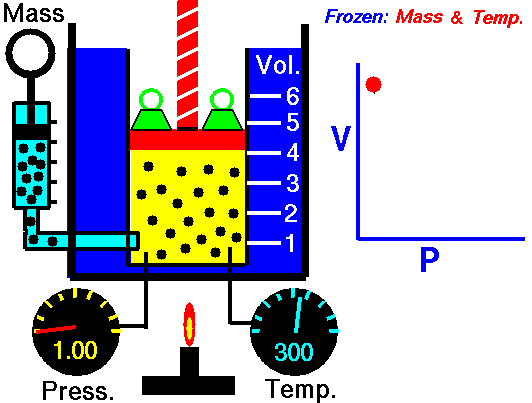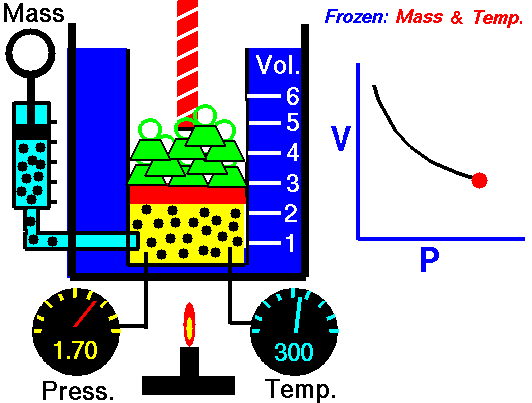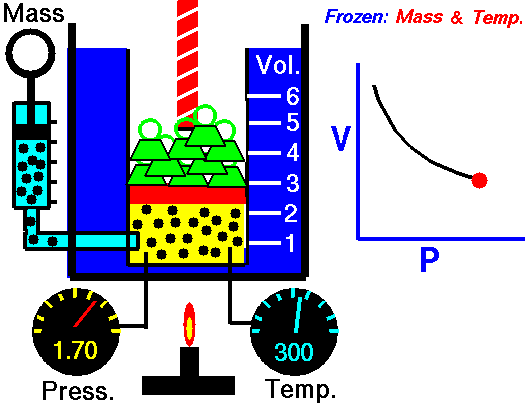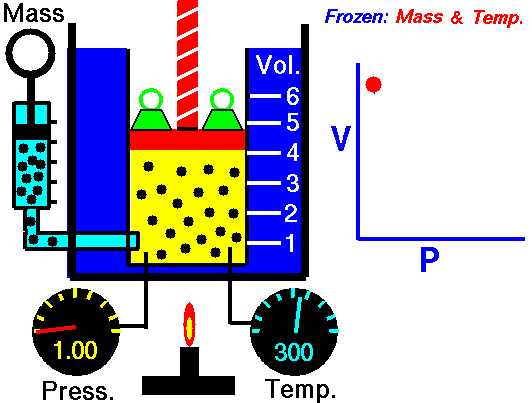
قانون بویل
هر روزه، تعداد بسیاری از بالنهای هواشناسی برای پیشبینی هوا و کمک به تحلیل دادهها در مدلهای هواشناسی به جو زمین فرستاده میشوند. این بالنهای هلیومی با افزایش ارتفاع، کاهش فشار اتمسفریک را تجربه میکنند که سبب انبساط بالن خواهد شد. در نقطهای مشخص، این بالن در اثر انبساط میترکد و دستگاههای متصل به آن توسط چتر به زمین بازمیگردند. این انبساط در اثر کاهش فشار، اساس قانون بویل در بررسی رفتار گازها به شمار میآید.
شیمیدان انگلیسی، «رابرت بویل» (Robert Boyle) را به عنوان یکی از بنیانگذاران دانش شیمی آزمایشگاهی میشناسند. او کشف کرد که افزایش دو برابری فشار یک محفظه گازی در دمای ثابت سبب کاهش حجم گاز به میزان نصف حالت قبل میشود. قانون بویل بیان میکند که حجم گازی با جرم مشخص و در دمای ثابت، با فشار آن رابطهای معکوس دارد یعنی با افزایش یک متغیر، متغیر دیگر کاهش مییابد.
به طور فیزیکی، مولکولهای گاز در حال حرکت هستند و فاصله مشخصی از یکدیگر دارند. افزایش فشار، مولکولها را به یکدیگر نزدیکتر میکند و سبب کاهش حجم میشود. اگر فشار کاهش پیدا کند، ذرات گاز میتوانند در فضای بیشتری حرکت داشته باشند.

به صورت ریاضی، قانون بویل را میتوان به شکل زیر بیان کرد.
$$P \times V = k$$
رابطه بالا بیان میکند که حاصلضرب فشار در حجم، عددی ثابت است. این عدد ثابت تنها به جرم و دمای گاز بستگی دارد. جدول زیر، دادههای حجم و فشار را برای مقدار مشخصی از گاز در دمای ثابت نشان میدهد. ستون سوم در این جدول، حاصلضرب این دو مقدار را نشان میدهد و عددی ثابت است. با تغییر یک متغیر، دیگری به گونهای تغییر میکند تا این حاصلضرب، عدد ثابتی را بدست دهد.
| فشار (اتمسفر) | حجم (میلیلیتر) | حاصلضرب فشار در حجم |
| 0/5 | 1000 | 500 |
| 0/625 | 800 | 500 |
| 1 | 500 | 500 |
| 2 | 250 | 500 |
| 5 | 100 | 500 |
| 8 | 62/5 | 500 |
| 10 | 50 | 500 |
در تصویر زیر میتوانید رابطه معکوس فشار و حجم را در قانون بویل مشاهده کنید. این نمودار نشان میدهد که با کاهش حجم، فشار افزایش پیدا میکند. از قانون بویل میتوان جهت مقایسه شرایط مختلف یک گاز استفاده کرد. به همین منظور، از زیروند «۱» برای بیان شرایط اولیه فشار و دما و زیروندن «2» برای بیان شرایط بعد از تغییر بهره میگیریم. بنابراین، رابطه ریاضی قانون بویل به شکل زیر تغییر پیدا خواهد کرد
مثال قانون بویل
مقدار مشخصی از یک گاز، حجمی برابر با ۱ لیتر را اشغال کرده است که فشاری برابر با ۴۰۰ کیلوپاسکال دارد. اگر گاز را به محفظهای با حجم ۳ لیتر منتقل کنیم، با فرض اینکه دما و مقدار گاز ثابت باشند، فشار در محفظه جدید چقدر خواهد بود.
برای حل این سوال میتوان از قانون بویل کمک گرفت. بر اساس این قانون خواهیم داشت:
$$\begin{equation}
\mathrm{P}_{1} \mathrm{~V}_{1}=\mathrm{P}_{2} \mathrm{~V}_{2} \Rightarrow \mathrm{P}_{2}=\left(\mathrm{P}_{1} \mathrm{~V}_{1}\right) / \mathrm{V}_{2}
\end{equation}$$
قانون شارل
زمانی که گاز داخل یک سیستم سلیندر و پیستون را حرارت میدهیم، انرژی جنبشی مولکولهای گاز افزایش مییابد و پیستون را به طرف بالا (یا عقب) جابجا میکنند و سبب افزایش حجم میشوند.
فیزیکدان فرانسوی «ژاک شارل» (Jacques Charles) اثر دما بر حجم یک گاز در فشار ثابت را مورد مطالعه قرار داد تا به قانونی موسوم به قانون شارل دست پیدا کند. قانون شارل بیان میکند که در فشار ثابت، حجم گازی با جرم مشخص، با دمای مطلق آن رابطهای مستقیم دارد. همانطور که در تعریف این قانون نیز بیان شد، باید از دمای مطلق در رابطه مربوط به قانون شارل بهره گرفت. به طور ریاضی، این رابطه به صورت زیر تعریف میشود. در این رابطه نیز عدد k برای نمونهای مشخص از یک گاز، عدد ثابتی است.
$$\frac{V}{T} = k$$
همانند قانون بویل، از قانون شارل نیز برای مقایسه حالتهای مختلف یک گاز استفاده میشود که رابطه آن به صورت زیر خواهد بود:
$$\begin{equation}
\frac{V_{1}}{T_{1}}=\frac{V_{2}}{T_{2}}
\end{equation}$$
مثال قانون شارل
گازی، حجمی برابر با ۴۰۰ سانتیمتر مکعب را در دمای صفر درجه سلسیوس اشغال میکند و در این شرایط، فشاری برابر با ۷۸۰ میلیمتر جیوه دارد. این گاز در فشار ثابت و دمای ۸۰ درجه سانتیگراد، چه حجمی خواهد داشت.
برای حل این سوال، ابتدا باید دما را به کلوین تبدیل کنیم:
$$T _ 1 = 0+273 = 273 \ K $$
$$T _ 2 = 80+273 = 353 \ K $$
حال به کمک رابطه قانون شارل میتوانیم $$V_2$$ را محاسبه کنیم.
$$\begin{equation}
\frac{400}{273}= \frac{\mathrm{V} 2}{353 }\\
\mathrm{~V} 2= (400\times 353) / 273 \\
\mathrm{~V} 2=517.21 \ \mathrm{cm}^ 3
\end{equation}$$
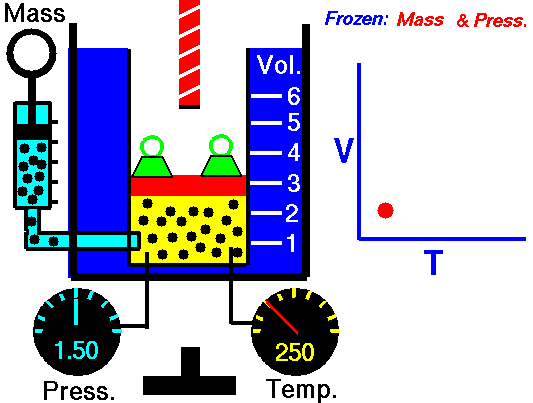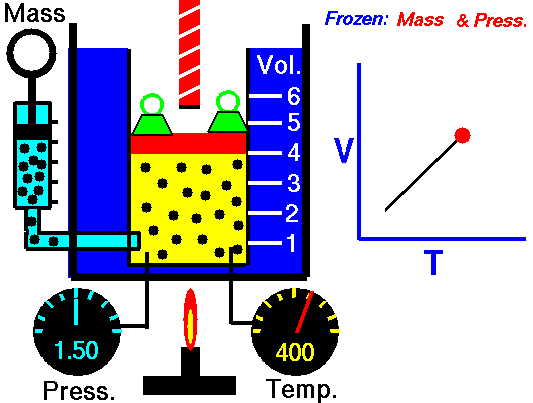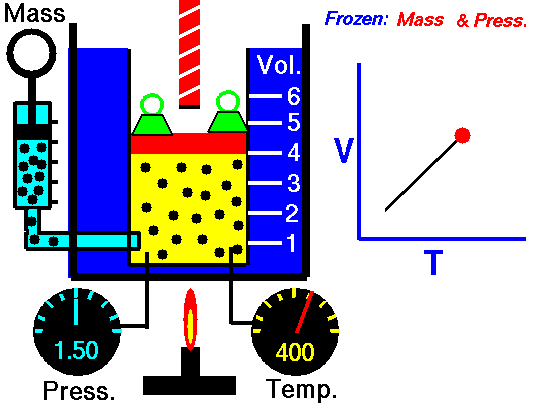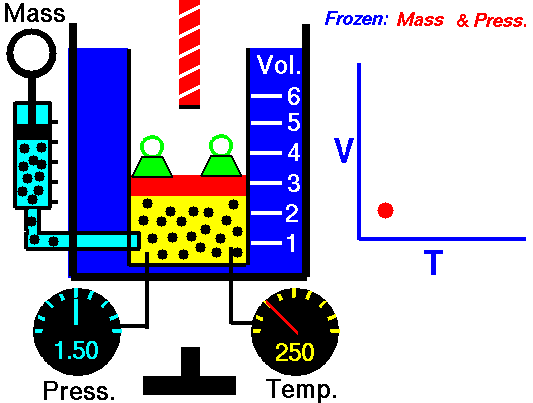
قانون گیلوساک
از گاز پروپان به طور گسترده برای اجاقهای خوراکپزی استفاده میشود. اگر از یک فشارسنج در این کپسولها کمک بگیریم، متوجه خواهیم شد که در روزهای گرم، فشار بیشتر و در روزهای سرد، فشار کمتری توسط این فشارسنج برای کپسول ثبت میشود.

زمانی که دمای نمونهای از یک گاز در کپسولی افزایش پیدا میکند، فشار آن نیز افزایش خواهد یافت. در حقیقت، افزایش انرژی جنبشی گاز باعث برخورد مولکولها به دیواره ظرف با نیروی بیشتری خواهد شد و این امر، فشار بیشتری را بوجود میآورد. شیمیدان فرانسوی «ژوزف گیلوساک» (Joseph Gay-Lussac)، رابطه بین فشار یک گاز و دمای مطلق آن را کشف کرد. این قانون در بررسی رفتار گازها بیان میکند که فشار یک گاز با جرم مشخص در حجم ثابت، رابطهای مستقیم با دمای مطلق آن دارد.
قانون گیلوساک به قانون شارل شباهت بسیاری دارد و تفاوت آن تنها در نوع محفظه نگهداری است. کپسول گاز در قانون شارل، دارای حجمی متغیر است اما در قانون گیلوساک، کپسول باید حجم ثابتی داشته باشد. به همین دلیل، رابطه ریاضی قانون گیلوساک نیز مشابه با قانون شارل خواهد بود.
$$\begin{equation}
\frac{P}{T}=k
\end{equation}$$
$$\begin{equation}
\frac{P_{1}}{T_{1}}=\frac{P_{2}}{T_{2}}
\end{equation}$$
قانون ترکیبی گازها
تا اینجا رابطه بین دو متغیر از سه متغیر فشار، حجم و دما را جهت بررسی رفتار گازها مرور کردهایم و متغیر سوم، مقداری ثابت داشته است. با این وجود، زمانی که هر سه متغیر تغییر کنند، شرایط متفاوتی خواهیم داشت. «قانون ترکیبی گازها» (Combined Gas Law)، رابطهای بین فشار، حجم و دمای مطلق گاز برقرار میکند. در این قانون، تنها مقدار ثابت، مقدار گاز خواهد بود که رابطه آن به شکل زیر است.
$$\begin{equation}
\frac{P \times V}{T}=k \quad \\ \quad \frac{P_{1} \times V_{1}}{T_{1}}=\frac{P_{2} \times V_{2}}{T_{2}}
\end{equation}$$
مثال قانون ترکیبی گازها
حجم اولیه یک گاز برابر با ۵ لیتر و حجم نهایی آن ۳ لیتر است. اگر دمای اولیه در فشار ۲۵ کیلوپاسکال برابر با ۲۷۳ کلوین و دمای نهایی۲۰۰ کلوین باشد، فشار نهایی را محاسبه کنید.
برای حل این سوال، با توجه به رابطه قانون ترکیبی گازها و ثابت بودن مقدار گاز، تنها فشار اولیه مجهول است که با جایگذاری در رابطه، محاسبه میشود.
$$\begin{equation}
\quad \frac{P_{1} \times V_{1}}{T_{1}}=\frac{P_{2} \times V_{2}}{T_{2}}
\end{equation}$$
$$\frac{25 \times 5}{273} = \frac{P_2 \times 3 }{200} \\
P_ 2 = 30.525 \ kPa$$
قانون آووگادرو
قانون بعدی که در بررسی رفتار گازها با آن مواجه میشویم، قانون آووگادرو است که بیان میکند حجم یک گاز در دما و فشار ثابت به طور مستقیم با تعداد مولهای آن برابر است. رابطه ریاضی قانون آووگادرو به صورت زیر بیان میشود که در این رابطه، «n» تعداد مولهای گاز است.
$$\begin{equation}
V=k \times n \\ \frac{V_{1}}{n_{1}}=\frac{V_{2}}{n_{2}}
\end{equation}$$
قانون گازهای ایده آل
قانون ترکیبی گازها نشان داد که فشار یک گاز با حجم رابطه معکوس و با دما رابطه مستقیم دارد. قانون آووگادرو نیز نشان داد که حجم یا فشار، رابطهای مستقیم با تعداد مولهای گاز دارند. با کنار هم قراردادن این روابط، به رابطه زیر میرسیم.
$$\begin{equation}
\frac{P_{1} \times V_{1}}{T_{1} \times n_{1}}=\frac{P_{2} \times V_{2}}{T_{2} \times n_{2}}
\end{equation}$$
قانون گازهای ایدهآل رابطهای است که فشار، حجم، دما و تعداد مولهای یک گاز ایدهآل را به یکدیگر مرتبط میکند. رابطه ریاضی این قانون به صورت زیر بیان میشود. در این رابطه، $$R$$ ثابت گازهای ایدهآل یا ثابت جهانی گازها خواهد بود.
$$\begin{equation}
P V=n R T
\end{equation}$$
معرفی فیلم آموزش علوم تجربی پایه نهم - بخش شیمی
از جمله دروسی که به بررسی اتمها و مواد میپردازد، درس علوم تجربی پایه نهم است که به دلیل اهمیت این موضوع، «فرادرس» آموزشی ویدیویی را با مدت زمان ۲ ساعت و در قالب ۳ درس منتشر کرده است که در ادامه به توضیح آن میپردازیم.
درس یکم به ماده و نقش آن در زندگی اختصاص دارد و در این درس، پس از آشنایی با عنصر، با جدول تناوبی عناصر آشنا میشویم و طبقهبندی انواع پلیمرها نیز بررسی میشود.
درس دوم به بررسی رفتار اتم اختصاص دارد و عنصر و ترکیب و اجزای سازنده ترکیبات مرور میشوند. در انتهای درس نیز به نقش یونها در بدن انسان پرداخته میشود. درس سوم به طور ویژه به محیط زیست و شیمی سبز اختصاص دارد و انواع چرخههایی طبیعی همچون چرخه آب و کربن در این درس مورد بررسی قرار میگیرند. نفت خام، هیدروکربنها و ترکیبهای نفت خام نیز از جمله دروس مهم این آموزش به شمار میآیند.
گازهای حقیقی و ایده آل
گاز ایدهآل به گازی میگویند که در تمامی شرایط دمایی و فشاری، از قانون گازهای ایدهآل و به طور کامل از نظریه جنبشی گازها پیروی کند. بنابراین، ذرات گاز نباید حجمی را اشغال کنند و نیروی جاذبهای داشته باشند. با توجه به اینکه در حقیقت چنین گازی وجود ندارد، نمیتوان تمامی گازها را به عنوان گاز ایدهآل در نظر گرفت که در بررسی رفتار گازها لزوم بیان مفهوم گاز حقیقی نیز مشخص میشود.
گاز حقیقی به گازی میگویند که از نظریه جنبشی گازها پیروی نمیکند. البته در شرایط دما و فشار معمول در آزمایشگاههای شیمی، گازهای حقیقی رفتاری بسیار شبیه به گازهای ایدهآل دارند.
بنابراین، این سوال پیش میآید که تحت چه شرایطی، گازها رفتاری غیرایدهآل از خود نشان میدهند. در حقیقت، زمانیکه گازها تحت فشار زیادی قرار بگیرند، مولکولها به قدری به یکدیگر نزدیک میشوند که فضای خالی بین آنها از بین میرود. زمانی که گازی سرد شود، کاهش انرژی جنبشی آنها سبب کاهش سرعت حرکت ذرات گاز خواهد شد. زمانیکه ذرات در سرعتهای پایینی حرکت میکنند، دیگر نمیتوان از نیروهای جاذبه بین آنها صرف نظر کرد. به طور خلاصه، یک گاز حقیقی در دماهای پایین و فشارهای بالا، از رفتار ایدهآل فاصله میگیرد. به این ترتیب، گازها در دمای بالا و فشار پایین، رفتاری ایدهآل خواهند داشت.











